Многофункциональные и поливалентные ингибиторы ангиогенеза
Иллюстрации
Показать всеИзобретение относится к биотехнологии. Получены многофункциональные и поливалентные ингибиторы на основе слитых белков, содержащих полипептид, который распознает и блокирует функционально активный участок молекулы, вовлеченной в процесс ангиогенеза, и полипептид, содержащий домен олигомеризации и функционально активный модулирующий или ингибирующий процесс ангиогенеза участок, отделенный чувствительным к протеиназам участком. Эти ингибиторы пригодны для лечения и профилактики патологий, возникающих посредством процесса ангиогенеза, например злокачественной опухоли, ревматоидного артрита или псориаза. 8 н. и 17 з.п. ф-лы, 6 ил., 1 табл.
Реферат
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к слитым белкам, пригодным в качестве многофункциональных и поливалентных ингибиторов ангиогенеза, содержащим полипептид, который распознает и блокирует функционально активный участок молекулы, вовлеченной в процесс ангиогенеза, и полипептид, содержащий домен олигомеризации и функционально активный ингибирующий или модулирующий процесс ангиогенеза участок, разделенные чувствительным к протеиназам участком. Настоящее изобретение также относится к генным конструкциям и конструкциям векторов, пригодным для получения указанных слитых белков.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Ангиогенез представляет собой биологический процесс, приводящий к формированию новых кровеносных сосудов из ранее существующих сосудов в органе или ткани. Ангиогенез начинается с разрушения базальной мембраны вследствие действия протеиназ, секретируемых эндотелиальными клетками, продолжается миграцией и пролиферацией указанных эндотелиальных клеток, завершаясь формированием просвета, базальной мембраны и окружения из периферических клеток.
Ангиогенез не происходит в нормальных физиологических условиях у здоровых взрослых, за исключением процессов, связанных с менструальным циклом у женщин и заживлением ран. Однако дисбаланс в процессе ангиогенеза приводит к развитию патологических нарушений, например, таких как ревматоидный артрит, псориаз, бартонеллез, отторжение трансплантированного органа, геморрагия и неоваскуляризация глаза (один из наиболее частых случаев слепоты), диабетическая ретинопатия, ретролентальная фиброплазия, дегенерация желтого пятна, неоваскулярная глаукома, окклюзия вен сетчатки, окклюзия артерий сетчатки, птеригий, покраснение радужки, вновь образованные сосуды, солидные опухоли, гемангиома и пролиферация и метастазы опухоли.
Кроме того, ангиогенез играет важную роль в прогрессирующем росте и метастатическом распространении опухолей. Для того чтобы иметь возможность роста, опухоль должна постоянно стимулировать развитие новых капилляров. Новые сосуды, образованные в опухоли, обеспечивают путь для злокачественных клеток, с помощью которого они могут проникать в кровообращение и формировать метастазы в отдаленных областях. Если ангиогенную активность подавить или устранить, тогда, несмотря на существование опухоли, она не может развиваться.
По этой причине различные исследовательские группы проводят работу для выявления соединений, выполняющих ингибирующее воздействие на ангиогенез (ингибиторы ангиогенеза или антиангиогенные средства), пригодных в качестве лекарственных средств для лечения или профилактики патологий, возникающих при развитии ангиогенеза.
В отношении опухолей полагают, что опухоли не могут расти или образовывать метастазы в другом органе без образования новых кровеносных сосудов, таким образом, в качестве раннего события при прогрессировании опухоли происходит ангиогенное переключение. Было описано несколько антиангиогенных стратегий, вмешивающихся на различных уровнях ангиогенного каскада: блокирование активности фактора роста; ингибирование протеиназ внеклеточного матрикса (ECM); направление непосредственно на эндотелиальные клетки (EC); повышенное регулирование эндогенных ингибиторов и т.д. Эндогенные ингибиторы ангиогенеза получили особое внимание в отношении лечения злокачественных опухолей, поскольку оказалось, что они являются нетоксичными и неиммуногенными средствами. Было выявлено по меньшей мере 10 эндогенных ингибиторов ангиогенеза [O'Reilly, M.S. et al., Cell, 88: 277-285, 1997], среди которых наиболее хорошо известными являются ангиостатин и эндостатин.
Эндостатины (ES) представляют собой ингибиторы миграции эндотелиальных клеток и ангиогенеза, и в моделях на животных было показано, что они снижают рост опухоли. Механизмы, вовлеченные в указанные действия, не ясны, хотя было предположено, что в них участвуют связывание рецепторов клеточной поверхности (интегрины и гепарансульфаты, VEGFR-2), металлопротеиназы и компоненты ECM. Источником ES является домен NCI коллагенов XV и XVIII, откуда они протеолитически высвобождаются в форме тримера, и далее они превращаются в мономерные эндостатины массой приблизительно 20 кДа. На N-конце NC1 находится домен тримеризации приблизительно из 60 остатков, соединенный с элементом ES из приблизительно 180 остатков посредством гибкой шарнирной области, содержащей различные чувствительные к протеиназам участки, посредством которых после протеолитического расщепления высвобождается эндостатин.
Boehm et al. [Nature, 390:404 (1997)] описывают использование в качестве экспериментальной модели мышей, которым трансплантировали несколько опухолей (карцинома легких Льюиса, фибросаркома и меланома). У мышей, которым не вводили ES, указанные опухоли росли быстро, приводя к смерти животных. Напротив, у мышей, которым вводили ES после развития опухоли, наблюдалось уменьшение объема опухоли вплоть до достижения почти микроскопического размера. Циклическое введение ES мышам с опухолью приводило к полной регрессии опухолей в моделях на животных. Однако клинические испытания, проведенные для ES, не подтвердили существенного ингибирования роста опухоли, и регрессия опухоли наблюдалась редко. К сожалению, это не является единичным примером, и другие клинические испытания, включающие различные антиангиогенные молекулы, также не оправдали надежд, несмотря на значительные противоопухолевые эффекты в моделях на животных. В связи с указанным кажется логичным сочетать несколько ингибиторов ангиогенеза для лечения злокачественных опухолей у человека. Альтернативно повышенная биологическая активность (ES + ангиостатин) и направленное против опухоли действие [ES + RGD (аргинин-глицин-аспарагиновая кислота)] потенциально могут улучшить ингибирование роста опухоли.
С другой стороны, был продемонстрирован терапевтический потенциал одноцепочечного фрагмента Fv (scFv) антитела против ламинина (L36) с антиангиогенной активностью как in vivo, так и in vitro. Результаты показали, что изменение морфогенетического потенциала матриксов, ассоциированных с клетками, является эффективным способом предотвращения формирования ассоциированных с опухолью кровеносных сосудов in vivo.
Несмотря на проведенные к настоящему времени попытки, все еще является необходимой разработка соединений ингибиторов ангиогенеза, пригодных в качестве лекарственных средств для лечения или профилактики патологий, возникающих вследствие развития ангиогенеза.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Задачей настоящего изобретения является предоставление соединений с антиангиогенной активностью, потенциально пригодных в качестве лекарственных средств для профилактики и/или лечения патологий, возникающих вследствие ангиогенеза, например псориаза, ревматоидного артрита, ретинопатий, злокачественной опухоли и т.д.
Решение проблемы в соответствии с настоящим изобретением основано на слитых белках, потенциально пригодных в качестве многофункциональных и поливалентных ингибиторов ангиогенеза, содержащих (a) полипептид, содержащий участок, который распознает и блокирует функционально активный участок молекулы, вовлеченной в процесс ангиогенеза, и (b) полипептид, содержащий домен олигомеризации и функционально активный ингибирующий или модулирующий процесс ангиогенеза участок, разделенные чувствительным к протеиназе участком.
Иллюстрацией настоящего изобретения являются конструкции нескольких белковых химер. Один из слитых белков (смотрите пример) содержит одноцепочечный фрагмент Fv (scFv) моноклонального антитела против ламинина L36 и домен NC1 коллагена XVIII, содержащий домен тримеризации и домен эндостатина (ES), связанные шарнирным пептидом, содержащим чувствительные к протеиназам участки, посредством которых после протеолитического расщепления высвобождаются мономерные ES. Уровни протеиназ повышаются в микроокружении опухоли, таким образом, из указанного слитого белка высвобождаются in situ как мономеры ES, так и тримеры scFv. Секреция указанного слитого белка осуществлялась посредством генетически модифицированных клеток человека в функционально активной форме. Полная форма обладала молекулярной массой приблизительно 210 кДа, что указывает на то, что в физиологических условиях отдельные субъединицы являются не ковалентно связанными с образованием тримерной структуры. Указанный тримерный слитый белок значительно ингибировал способность эндотелиальных клеток мигрировать в ответ на факторы роста и образовывать сосуды капиллярного типа при выращивании на субстрате матригель. Более того, указанный слитый белок обрабатывали несколькими различными протеиназами. Данные показали, что катепсин L, панкреатическая эластаза и некоторые матриксные металлопротеиназы (MMP) образуют как мономеры типа ES, так и тримерные фрагменты антитела (scFv). Кроме того, слитые белки преобразовывались правильно, когда они продуцировались генетически модифицированными продуцирующими MMP клетками опухоли, но не тогда, когда они продуцировались генетически модифицированными клетками, которые не продуцировали MMP. Эти результаты открывают путь для новой стратегии генной терапии против злокачественной опухоли с использованием указанного типа слитых белков, которые составляют часть нового поколения ингибиторов ангиогенеза, пригодных в качестве лекарственных средств для лечения заболеваний, обусловленных дисбалансом в указанном ангиогенезе.
Таким образом, в одном аспекте настоящее изобретение относится к генной конструкции, содержащий функционально связанные по меньшей мере одну последовательность нуклеиновой кислоты (A), содержащую нуклеотидную последовательность, кодирующую полипептид, который распознает и блокирует функционально активный участок молекулы, вовлеченной в процесс ангиогенеза; и последовательность нуклеиновой кислоты (B), содержащую нуклеотидную последовательность, кодирующую полипептид, содержащий (i) домен олигомеризации, (ii) функционально активный в процессе ангиогенеза участок и (iii) чувствительный к протеиназам участок между указанным доменом олигомеризации и указанным функционально активным в процессе ангиогенеза участком, где 3'-конец указанной первой последовательности нуклеиновой кислоты (A) связан с 5'-концом указанной второй последовательности нуклеиновой кислоты (B).
В другом аспекте настоящее изобретение относится к экспрессирующей кассете, содержащей указанную генную конструкцию, функционально связанную с контролирующей экспрессию последовательностью.
В другом аспекте настоящее изобретение относится к рекомбинантному вектору, содержащему указанную генную конструкцию или указанную экспрессирующую кассету. В другом аспекте настоящее изобретение относится к клетке-хозяину, содержащей указанную генную конструкцию, или указанную экспрессирующую кассету, или указанный рекомбинантный вектор.
В другом аспекте настоящее изобретение относится к слитому белку, получаемому посредством экспрессии последовательности нуклеиновой кислоты, находящейся в указанной генной конструкции. Указанный слитый белок, как правило, содержит полипептид (A'), содержащий участок, который распознает и блокирует функционально активный участок молекулы, вовлеченной в процесс ангиогенеза; и полипептид (B'), содержащий (i) домен олигомеризации, (ii) функционально активный в процессе ангиогенеза участок и (iii) чувствительный к протеиназам участок между указанным доменом олигомеризации и указанным функционально активным в процессе ангиогенеза участком.
В другом аспекте настоящее изобретение относится к фармацевтической композиции, содержащей либо указанный слитый белок совместно с по меньшей мере одним фармацевтически приемлемым эксципиентом, либо вектор, содержащий генную конструкцию по настоящему изобретению или экспрессирующую кассету по настоящему изобретению, и необязательно по меньшей мере один фармацевтически приемлемый эксципиент.
В другом аспекте настоящее изобретение относится к применению указанного слитого белка или указанной генной конструкции, или указанной экспрессирующей кассеты, или указанного рекомбинантного вектора для изготовления фармацевтической композиции для предотвращения, лечения, торможения или минимизации развития ангиогенеза.
В другом аспекте настоящее изобретение относится к применению указанного слитого белка или указанной генной конструкции, или указанной экспрессирующей кассеты, или указанного рекомбинантного вектора для изготовления фармацевтической композиции для лечения и/или профилактики патологий, возникающих вследствие ангиогенеза.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
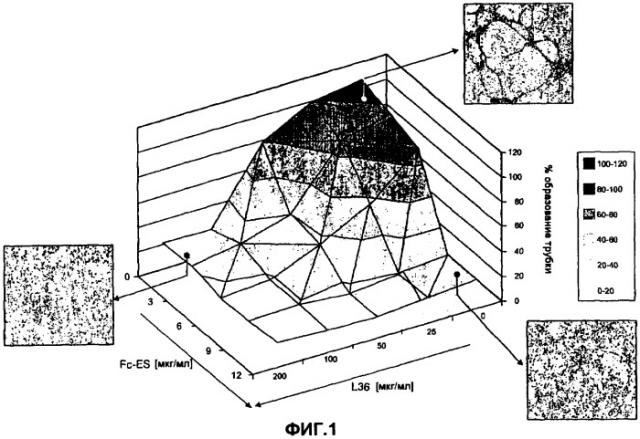
На фиг.1 представлено картографическое изображение, на котором показано действие на морфогенез капилляров отдельного лечения и сочетанного лечения различными концентрациями рекомбинантного моноклонального антитела (L36) в форме scFv [одноцепочечный фрагмент Fv моноклонального антитела L36 против ламинина] и димерного слитого белка Fc-ES (слитый белок домена ES и фрагмента Fc иммуноглобулина).
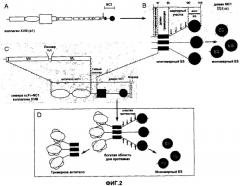
На фиг.2 представлена иллюстрация продукции слитого белка в соответствии с настоящим изобретением и его протеолитической обработки. На фиг.2A схематично представлена последовательность, кодирующая ген α1 (коллаген XVIII) и домен NC1. На фиг.2B схематично представлен указанный домен NC1, содержащий соединительный пептид, домен тримеризации, шарнирный пептид и домен ES. На фиг.2C схематично представлен слитый белок, или химера, образованный рекомбинантным моноклональным антителом против ламинина (L36) в форме scFv и доменом NC1 коллагена XVIII. На фиг.2D представлен результат протеолитической обработки указанного слитого белка, где наблюдалось формирование тримерного и мономерного антитела против ES.
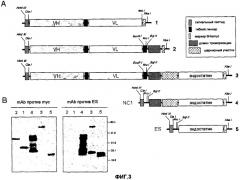
На фиг.3A схематично представлена структура гена антитела в форме scFv и несколько генных конструкций, содержащих (или не содержащих) кодирующую последовательность домена ES. На фиг.3B представлены результаты вестерн-блот анализа очищенных слитых белков; иммуноблотинг проводили с моноклональным антителом против myc (mAb) и/или с mAb против ES [дорожка 1: scFv L36; дорожка 2: scFv L36-NC1ES-; дорожка 3: scFv L36-NC1ES+; дорожка 4: NC1; и дорожка 5: ES].
На фиг.4A представлен градиент седиментационного равновесия для доменА scFv NC1ES- (1 мг/мл в фосфатно-солевом буфере (PBS)) при 11000 об/мин и 20°C. Светлыми кружками показаны данные, тремя сплошными линиями представлены теоретические градиенты мономера scFv (37148 Да), димера (74296 Да) и тримера (111444 Да). В верхнем квадрате указанной фиг.4A представлено распределение скорости седиментации слитого белка scFv L36-NC1ES- (1 мг/мл в буфере PBS) при 42000 об/мин и 20°C. На фиг.4B представлен график, показывающий аффинность связывания ламинина, иммобилизованного на пластмассовой подложке [в большей степени в случае слитого белка scFv L36-NC1ES- (тримерный), чем в случае scFv L36 (мономерный)]. На фиг.4C представлен график, на котором показано зависимое от дозы модулирование дифференцировки клеток эндотелия (в ответ на различные концентрации scFv или концентрации scFv L36-NC1ES-) в стандартном анализе с матригелем. Каждая точка отображает среднее значение для двух лунок +/- стандартное отклонение. На фиг.4D представлены результаты воздействия на слитый белок scFv L36-NC1ES- различных протеиназ (MMP, панкреатической эластазы свиньи и катепсина L).
На фиг.5 представлено распределение скорости седиментации scFv L36-NC1ES+ (фиг.5A) и NC1 (фиг.5B). На фиг.5C представлены кривые насыщения, полученные с указанными концентрациями scFv L36-NC1ES+ и NC1. На фиг.5D представлен график, отображающий зависимое от дозы модулирование дифференцировки клеток эндотелия (в ответ на различные концентрации scFv L36, scFv L36-NC1ES+, NC1 или Fc-ES) в стандартном анализе с матригелем. Каждая точка отображает среднее значение для двух лунок +/- стандартное отклонение. На фиг.5E представлена гистограмма, на которой показано модулирование в анализе эндотелиальных клеток HUVEC посредством scFv L36 (L36), NC1, scFv L36-NC1ES+ или Fc-ES (ES) [PBS использовали в качестве контроля].
На фиг.6A представлен результат обработки scFv L36-NC1ES+ различными протеиназами (MMP, панкреатической эластазой свиньи и катепсином L), а на фиг.6B представлены результаты указанной обработки для NC1. Очищенные белки инкубировали в течение указанных периодов времени с различными протеиназами, как указано в примере (смотрите раздел "Материалы и способы"), и реакционные смеси анализировали посредством SDS-PAGE (фиг.6C) или посредством вестерн-блота с mAb против эндостатина. Расстояния пробега маркеров молекулярной массы и NC1 показаны слева от указанных фигур. Указателями в виде пустых стрелок на фиг.6A и 6B показаны протеолитические продукты.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В одном аспекте настоящее изобретение относится к генной конструкции, в дальнейшем в настоящем описании генной конструкции по настоящему изобретению, содержащей функционально связанные по меньшей мере:
a) первую последовательность нуклеиновой кислоты (A), содержащую нуклеотидную последовательность, кодирующую полипептид, который распознает и блокирует функционально активный участок молекулы, вовлеченной в процесс ангиогенеза; и
b) вторую последовательность нуклеиновой кислоты (B), содержащую нуклеотидную последовательность, кодирующую полипептид, содержащий (i) домен олигомеризации, (ii) функционально активный в процессе ангиогенеза участок и (iii) чувствительный к протеиназам участок между указанным доменом олигомеризации и указанным функционально активным в процессе ангиогенеза участком;
где 3'-конец указанной первой последовательности нуклеиновой кислоты (A) связан с 5'-концом указанной второй последовательности нуклеиновой кислоты (B).
Последовательность нуклеиновой кислоты (A) содержит нуклеотидную последовательность, кодирующую полипептид, который распознает и блокирует функционально активный участок молекулы, вовлеченной в процесс ангиогенеза. Иллюстративные примеры молекул, вовлеченных в процесс ангиогенеза, включают белки внеклеточного матрикса (ECM), ангиогенные факторы, рецепторы клеточной мембраны и т.д. Белки ECM включают коллаген, протеогликаны, фибронектин, ламинин, тенасцин, энтактин и тромбоспондин. В конкретном варианте осуществления указанная молекула, вовлеченная в процесс ангиогенеза, представляет собой ламинин, такой как ламинин млекопитающих, например ламинин крысы, мыши или человека. Ангиогенные факторы включают семейство сосудисто-эндотелиальных факторов роста (VEGF) и т.д. Рецепторы указанных ангиогенных факторов, например рецептор 2 VEGF (VEGFR-2), интегрины и т.д., также можно упомянуть в качестве рецепторов клеточной мембраны, вовлеченных в ангиогенез.
В соответствии с настоящим изобретением можно использовать практически любой полипептид, содержащий участок, который распознает и блокирует функционально активный участок молекулы, вовлеченной в процесс ангиогенеза, такой как антитело, например моноклональное или поликлональное антитело, которое распознает молекулу, вовлеченную в процесс ангиогенеза, или ее рекомбинантный фрагмент, содержащий участок, который распознает указанную молекулу, вовлеченную в процесс ангиогенеза, например, в его рекомбинантной одноцепочечной форме (одноцепочечный фрагмент Fv или scFv), бифункциональной форме (димер), полной форме (Fab + Fc) и т.д.; кроме того, в конкретном варианте осуществления последовательность нуклеиновой кислоты (A) кодирует рекомбинантное одноцепочечное антитело (scFv), полученное из mAb, против ламинина L36 (пример 1), содержащее вариабельный участок тяжелой цепи (VH) моноклонального антитела L36, слитое посредством линкера, такого как пептид, содержащий последовательность G4S, с вариабельным участком легкой цепи (VL) mAb L36 (фиг.2C), последовательность которого описана Sanz L. et al. [Cancer Immunology and Immunotherapy, 2001 Dec; 50(10)557-65], где 3'-конец последовательности, кодирующей VL, связан с 5'-концом последовательности, кодирующей указанный линкер, и 3'-конец нуклеотидной последовательности, кодирующей указанный линкер, связан с 5'-концом последовательности, кодирующей VL.
mAb L36 распознает ламинины различных видов животных, например мыши, крысы, человека и т.д., поскольку оно взаимодействует с участком, который является высоко консервативным среди различных видов животных [Sanz L. et al., EMBO J 2003, Vol. 22(7):1508-1517].
Благодаря своим свойствам, указанный полипептид, который распознает и блокирует функционально активный участок молекулы, вовлеченной в процесс ангиогенеза, такой как антитело в любой его форме (scFv, бифункциональной или полной), может распознавать и блокировать функционально активный участок молекулы, вовлеченной в процесс ангиогенеза, и может направлять антиангиогенный полипептид, слитый с указанным полипептидом, к молекулам, вовлеченным в процесс ангиогенеза, например белкам ECM, ангиогенным факторам, рецепторам клеточной мембраны и т.д., и блокировать функционально активные участки указанных молекул.
Последовательность нуклеиновой кислоты (B) содержит нуклеотидную последовательность, кодирующую полипептид, содержащий (i) домен олигомеризации, (ii) функционально активный в процессе ангиогенеза участок и (iii) чувствительный к протеиназам участок между указанным доменом олигомеризации (i) и указанным функционально активным в процессе ангиогенеза участком (ii).
Домен олигомеризации представляет собой домен, который обеспечивает образование олигомеров (например, димеров, тримеров, тетрамеров и т.д., пептидов или белков). Для осуществления настоящего изобретения на практике можно использовать практически любой домен олигомеризации, например домен димеризации, тримеризации или тетрамеризации и т.д., представленный в различных белках как эукариотического, так и прокариотического происхождения, способных рекомбинантно экспрессироваться и формировать белковый олигомер белка, который его содержит. В конкретном варианте осуществления указанный домен олигомеризации представляет собой домен тримеризации, такой как домен тримеризации домена NC1 коллагена XVIII или коллагена XV.
Функционально активный в процессе ангиогенеза участок включает любой функционально активный в процессе ангиогенеза пептид или белок, такой как ингибитор процесса ангиогенеза или модулирующий пептид или белок. В соответствии с настоящим изобретением можно использовать практически любой функционально активный в процессе ангиогенеза пептид или белок; хотя в конкретном варианте осуществления указанный функционально активный в процессе ангиогенеза участок включает эндостатин (ES) млекопитающих, такой как ES, находящийся в домене NC1 коллагена XV или коллагена XVIII.
Чувствительный к протеиназам участок расположен между указанным доменом олигомеризации (i) и указанным функционально активным в процессе ангиогенеза участком (ii) и содержит полипептидную последовательность, чувствительную к действию протеиназ. Несмотря на то что в соответствии с настоящим изобретением можно использовать любую пептидную последовательность, чувствительную к любой протеиназе, на практике предпочтительной для указанной протеиназы является протеиназа, экспрессируемая только в области опухоли, чтобы слитый белок по настоящему изобретению "преобразовывался" с образованием функционально активных в процессе ангиогенеза пептидных или белковых мономеров и тримерных полипептидных молекул, способных распознавать и блокировать функционально активный участок молекулы, вовлеченной в процесс ангиогенеза. Таким образом, в конкретном варианте осуществления указанный чувствительный к протеиназам участок содержит шарнирный участок, находящийся в домене NC1 коллагена XV или XVIII млекопитающих между доменом тримеризации и доменом ES или участком указанного домена NC1, поскольку указанный участок является чувствительным к действию протеиназ, экспрессируемых только в области опухоли.
Таким образом, в особенно предпочтительном варианте осуществления последовательность нуклеиновой кислоты (B) содержит нуклеотидную последовательность, кодирующую домен NC1 коллагена XVIII млекопитающих или домен NC1 коллагена XV млекопитающих. Как известно, указанный домен NC1 коллагена XVIII (и коллагена XV) содержит домен тримеризации и домен ES, связанные шарнирным пептидом (фиг.2B). Последовательности указанных доменов NC1 коллагена XV и XVIII известны; в качестве иллюстрации, последовательность домена NC1 коллагена XVIII описана ранее Sasaki et al. [Sasaki et al., Structure, function and tissue forms of the C-terminal globular domain of collagen XVIII containing the angiogenesis inhibitor endostatin. EMBO J. 1998 Aug 3; 17(15):4249-56]. В примере 1 описано получение нуклеотидной последовательности, содержащей участок, кодирующий домен NC1 коллагена XVIII мыши.
Для осуществления настоящего изобретения на практике можно использовать любой другой домен, сходный с доменом NC1 коллагена XVIII, содержащий (i) домен олигомеризации, (ii) функционально активный в процессе ангиогенеза участок и (iii) чувствительный к протеиназам участок между указанным доменом олигомеризации и указанным функционально активным в процессе ангиогенеза участком, предпочтительно участок, чувствительный к протеиназам, экспрессируемым в области опухоли.
Как правило, последовательность нуклеиновой кислоты (A) не является непосредственно слитой с последовательностью нуклеиновой кислоты (B), а предпочтительным является введение гибкого связующего пептида (или спейсерного пептида) между полипептидами, кодируемыми указанными последовательностями нуклеиновых кислот (A) и (B). Таким образом, если необходимо, генная конструкция по настоящему изобретению также может дополнительно содержать третью последовательность нуклеиновой кислоты (C), содержащую нуклеотидную последовательность, кодирующую подвижный связывающий пептид, расположенный между указанными последовательностями нуклеиновой кислоты (A) и (B), где 5'-конец указанной последовательности нуклеиновой кислоты (C) связан с 3'-концом указанной последовательности нуклеиновой кислоты (A) и 3'-конец указанной последовательности нуклеиновой кислоты (C) связан с 5'-концом указанной последовательности нуклеиновой кислоты (B). Предпочтительно указанный спейсерный пептид (C) представляет собой пептид со структурной гибкостью. Можно использовать практически любой пептид со структурной гибкостью. В качестве иллюстрации, указанный гибкий пептид может содержать повторы аминокислотных остатков, в частности остатков Gly и Ser, или любой другой пригодный повтор аминокислотных остатков. В соответствии с настоящим изобретением можно использовать практически любую пептидную последовательность, определяющую гибкий связующий пептид. Иллюстративные примеры гибких связующих белков включают последовательности, такие как Gly-Ser-Pro-Gly (GSPG), или последовательность (Gly-Ser)4. Тем не менее, в конкретном варианте осуществления указанный гибкий связующий белок содержит последовательность Leu-Glu-Gly-Ala-Gly-Gly-Ser-Gly-Gly-Ser-Ser-Gly-Ser-Asp-Gly-Ala-Ser-Gly-Ser. Таким образом, в конкретном варианте осуществления генная конструкция по настоящему изобретению в дополнение к указанным последовательностям нуклеиновых кислот (A) и (B) содержит третью последовательность нуклеиновой кислоты (C), содержащую нуклеотидную последовательность, кодирующую пептид Leu-Glu-Gly-Ala-Gly-Gly-Ser-Gly-Gly-Ser-Ser-Gly-Ser-Asp-Gly-Ala-Ser-Gly-Ser.
Также в целях упрощения выделения и очистки слитого белка, полученного с помощью настоящего изобретения, генная конструкция по настоящему изобретению может содержать, если это необходимо, последовательность нуклеиновой кислоты, кодирующую пептид, который можно использовать в целях выделения и очистки слитого белка. Таким образом, в конкретном варианте осуществления генная конструкция по настоящему изобретению включает, если это необходимо, последовательность нуклеиновой кислоты (D), содержащую нуклеотидную последовательность, кодирующую пептид, который можно использовать в целях выделения или очистки, известный как маркерный пептид. Указанная последовательность нуклеиновой кислоты (D) может быть расположена в любом положении, которое не изменяет функциональности любого из полипептидов, экспрессируемых указанными последовательностями нуклеиновых кислот (A) и (B). В качестве иллюстрации, указанная последовательность нуклеиновой кислоты (D) может быть расположена в направлении 5'→3' от 3'-конца указанной последовательности нуклеиновой кислоты (B). Можно использовать практически любой пептид, или пептидную последовательность, который обеспечивает выделение и очистку слитого белка, например полигистидиновые последовательности, пептидные последовательности, которые могут распознавать антитела, которые могут использоваться для очистки полученного слитого белка посредством иммуноаффинной хроматографии, такие как маркерные пептиды и т.д., например эпитопы, полученные из гемагглютинина вируса лихорадки, или эпитоп C-myc и т.д.
Генную конструкцию по настоящему изобретению можно получать посредством применения хорошо известных в данной области способов [Sambrook et al., "Molecular cloning, a Laboratory Manual", 2nd; ed., Cold Spring Harbor Laboratory Press, N.Y., 1989. Vol 1-3]. Указанная генная конструкция по настоящему изобретению может включать функционально связанную регуляторную последовательность экспрессии последовательностей нуклеиновых кислот, кодирующих полипептиды, кодируемые последовательностями нуклеиновых кислот (A) и (B), таким образом, составляя экспрессирующую кассету. Как используют в настоящем описании, выражение "функционально связанный" означает, что полипептиды, кодируемые последовательностями нуклеиновых кислот (A) и (B), и, когда это целесообразно, (C), экспрессируются в правильной открытой рамке считывания под контролем последовательностей контроля экспрессии и регуляторных последовательностей.
Таким образом, в другом аспекте настоящее изобретение относится к экспрессирующей кассете, содержащей генную конструкцию по настоящему изобретению, функционально связанную с последовательностью контроля экспрессии нуклеотидной последовательности, кодирующей слитый белок в соответствии с настоящим изобретением, содержащий (a) полипептид, который распознает и блокирует функционально активный участок молекулы, вовлеченной в процесс ангиогенеза, и (b) полипептид, содержащий (i) домен олигомеризации, (ii) функционально активный в процессе ангиогенеза участок и (iii) чувствительный к протеиназам участок между указанным доменом олигомеризации и указанным функционально активным в процессе ангиогенеза участком. Контролирующие последовательности представляют собой последовательности, которые контролируют и регулируют транскрипцию, и, когда это целесообразно, трансляцию указанного слитого белка, и включают промоторные последовательности, последовательности, кодирующие регуляторы транскрипции, связывающие рибосомы последовательности (RBS) и/или последовательности терминатора транскрипции. В конкретном варианте осуществления указанная последовательность контроля экспрессии является функциональной в прокариотических клетках и организмах, например бактериях и т.д., в то время как в другом конкретном варианте осуществления указанная последовательность контроля экспрессии является функциональной в эукариотических клетках и организмах, например в клетках насекомых, клетках растений, клетках млекопитающих и т.д. Иллюстративные примеры промоторов, которые могут быть представлены в экспрессирующей кассете в соответствии с настоящим изобретением, включают промотор цитомегаловируса человека (hCMV) и т.д.
Предпочтительно указанная экспрессирующая кассета дополнительно содержит маркер или ген, кодирующий мотив или фенотип, которые позволяют проводить селекцию клетки-хозяина, трансформированной указанной экспрессирующей кассетой. Иллюстративные примеры указанных маркеров, которые могут находиться в экспрессирующей кассете по настоящему изобретению, включают гены устойчивости к антибиотикам, гены устойчивости к токсичным соединениям, и, главным образом, все гены, которые обеспечивают селекцию генетически трансформированных растений.
Генная конструкция по настоящему изобретению или экспрессирующая кассета в соответствии с настоящим изобретением могут быть встроены в пригодный вектор. Таким образом, в другом аспекте настоящее изобретение относится к вектору, такому как экспрессирующий вектор, содержащему указанную генную конструкцию по настоящему изобретению или указанную экспрессирующую кассету. Выбор вектора зависит от клетки-хозяина, в которую его затем вводят. В качестве иллюстрации, вектор, в который встраивают последовательность нуклеиновой кислоты, может представлять собой плазмиду или вектор, которые при введении в клетку-хозяина либо встраиваются, либо не встраиваются в геном указанной клетки. Указанный вектор можно получать общепринятыми способами, известными специалистам в данной области [Sambrook et al., 1989, смотрите выше]. В конкретном варианте осуществления указанный рекомбинантный вектор представляет собой вектор, который пригоден для трансформации в клетки животных.
Указанный вектор можно использовать для трансформации, трансфекции или инфицирования клеток, способных быть трансформированными, трансфицированными или инфицированными указанным вектором. Указанные клетки могут представлять собой прокариотические или эукариотические клетки. Таким образом, в другом аспекте настоящее изобретение относится к клетке-хозяину, которая трансформирована, трансфицирована или инфицирована вектором в соответствии с настоящим изобретением. Указанная трансформированная, трансфицированная или инфицированная клетка содержит, таким образом, генную конструкцию по настоящему изобретению или указанную экспрессирующую кассету или вектор в соответствии с настоящим изобретением. Трансформированные, трансфицированные или инфицированные клетки можно получать общепринятыми способами, известными специалистам в данной области [Sambrook et al., 1989, смотрите выше]. В конкретном варианте осуществления указанная клетка-хозяин представляет собой клетку животных, которая трансформирована, трансфицирована или инфицирована пригодным вектором, где указанная трансформированная, трансфицированная или инфицированная клетка животных способна экспрессировать слитый белок в соответствии с настоящим изобретением, таким образом, указанные векторы можно использовать для экспрессии в клетках животных слитого белка в соответствии с настоящим изобретением.
Генную конструкцию по настоящему изобретению можно использовать для получения слитых белков, содержащих (a) полипептид (A'), содержащий участок, который распознает и блокирует функционально активный участок молекулы, вовлеченной в процесс ангиогенеза; и (b) полипептид (B'), содержащий (i) домен олигомеризации, (ii) функционально активный в процессе ангиогенеза участок и (iii) чувствительный к протеиназам участок между указанным доменом олигомеризации и указанным функционально активным в процессе ангиогенеза участком.
Таким образом, в другом аспекте настоящее изобретение относится к способу получения указанного слитого белка в соответствии с настоящим изобретением, который включает выращивание клетки или организма в соответствии с настоящим изобретением в условиях, которые обеспечивают продукцию указанного слитого белка. Условия для оптимизации культуры указанной клетки или организма зависят от используемой клетки или организма. Если это необходимо, способ получения представляющего интерес продукта в соответствии с настоящим изобретением дополнительно включает выделение и очистку указанного слитого белка. В другом аспекте настоящее изобретение относится к слитому белку, получаемому посредством экспрессии последовательности нуклеиновой кислоты, содержащейся в генной конструкции по настоящему изобретению. Более конкретно, настоящее изобретение относится к слитому белку, содержащему:
(a) полипептид (A'), содержащий участок, который распознает и блокирует функционально активный участок молекулы, вовлеченной в процесс ангиогенеза; и
(b) полипептид (B'), содержащий (i) домен олигомеризации, (ii) функционально активный в процессе ангиогенеза участок и (iii) чувствительный к протеиназам участок между ук