Способ выделения гибридных растений сои с использованием микросателлитных (ssr) локусов днк
Иллюстрации
Показать всеИз каждого проростка в группе семян сои родительских форм и полученных от скрещивания последних выделяют ДНК. Выделенную ДНК амплифицируют с помощью полимеразной цепной реакции. Амплификацию осуществляют по микросателлитным локусам SATT1, SATT9 и SOYPR 1 с использованием праймеров, фланкирующих эти локусы. Продукты апмплификации разделяют электрофорезом в окрашенном агарозном геле. Сравнение электрофоретических спектров каждого проростка со спектрами его родительских форм в ультрафиолетовых лучах позволяет выделить гибридные проростки по наличию на электрофореграмме двух фракций, соответствующих фракциям родительских форм. 1 з.п. ф-лы, 3 ил.
Реферат
Изобретение относится к сельскому хозяйству и может быть использовано в селекции сои.
Соя - это основная белково-масличная культура в России. В селекции сои при искусственной гибридизации необходимо контролировать образование гибридов. В настоящее время селекционеры могут вовлекать в скрещивания только родительские формы, различающиеся по морфологическим маркерам, которые хорошо определяются визуально и их проявление не зависит от условий окружающей среды. Как правило, это маркеры, определяющие качественные признаки: окраску различных частей растений, размер побегов, устойчивость к вредителям и болезням и так далее. При этом контроль за гибридностью в F1 можно осуществлять при условии, если в гибридной комбинации материнская форма обладает рецессивным признаком, а отцовская - доминантным.
Микросателлитные маркеры, если они имеют кодоминантное наследование, позволяют легко выявить гибридность в скрещиваниях, когда родительские формы не отличаются по морфологическим признакам. Из литературных источников известно, что SSR-локусы имеют, как правило, кодоминантный тип наследования.
Известен «Способ идентификации проростков сои по признаку окраски гипокотиля» (Патент РФ №2220562 по заявке №2002102172/12 от 22.01.2002 г., А01Н 1/04, публ. 10.01.2004 г., Бюл. №1), заключающийся в выделении гибридных растений сои по цвету гипокотиля проростков. Согласно этому способу на основе визуальной оценки выделяют гибридные растения по фиолетовой окраске гипокотиля проростка.
Недостатком известного способа является то, что при этом способе оценки должно соблюдаться основное условие - родительские формы должны отличаться по цвету гипокотиля проростка и контроль за гибридностью в F1 можно осуществлять при условии, если в гибридной комбинации материнская форма обладает рецессивным признаком (проростки имеют зеленый гипокотиль), а отцовская - доминантным (проростки имеют фиолетовый гипокотиль). То есть не всегда можно применить данный способ.
Наиболее близким к заявляемому изобретению является «Способ оценки типичности инбредных линий и уровня гибридности семян F1 подсолнечника» (Патент РФ №2294965 по заявке 2005120935/13 от 04.07.2005 г., C12Q 1/68, C12N 15/09, G01N 33/48, публ. 10.03.2007 г., Бюл. №7. Авторы: Антонова Т.С., Челюстникова Т.А., Гучетль С.З., Рамазанова С.А.), взятый нами за прототип.
В соответствии с известным способом отбирают пробу, состоящую из 100 штук семян исследуемой партии, проращивают их в течение 3-х суток, выделяют ДНК из каждого проростка, проводят амплификацию ДНК по выбранным микросателлитным локусам НА 432, НА 514, НА 1442, ORS 5 с использованием соответствующих им фланкирующих последовательностей прямого и обратного праймеров при помощи полимеразной цепной реакции, разделяют продукты амплификации на фракции методом электрофореза в 2% агарозном геле, окрашенном бромистым этидием. Уровень гибридности партии семян F1 определяют путем подсчета количества растений со спектром материнской и отцовской формы.
Недостатком данного способа является невозможность применения заявленных последовательностей праймеров, фланкирующих микросателлитные локусы ДНК, для выявления гибридов сои.
Задача, решаемая заявленным изобретением, состоит в повышении уровня идентификации генотипов и выделения гибридов сои за счет применения используемых микросателлитных локусов, полиморфных для сортов сои и обладающих кодоминантным типом наследования.
Цель изобретения - подбор локусов, рекомендуемых для выявления гибридов сои F1.
Технический результат достигается тем, что в известном способе оценки типичности инбредных линий и уровня гибридности семян F1 подсолнечника, включающем проращивание семян и получение проростков, выделение ДНК из каждого проростка, проведение амплификации ДНК по выбранным микросателлитным локусам с использованием фланкирующих их последовательностей праймеров при помощи полимеразной цепной реакции (ПЦР), разделение продуктов амплификации на фракции методом электрофореза в окрашенном агарозном геле, визуальное сравнение электрофоретических спектров каждого проростка со спектрами его родительских форм в лучах ультрафиолетового света, выделение гибридных проростков по наличию на электрофореграмме двух фракций, соответствующих фракциям родительских форм, согласно изобретению амплификацию ДНК проводят по следующему набору микросателлитных локусов с использованием фланкирующих их праймеров:
| Микросателлитный локус | Последовательность прямого (п) и обратного (о) праймеров | |
| SATT1 | п | AGT АСА TAG АТА ТТА AAG ТСТ |
| о | ААА TGA TGA ACG TGA АТТ АТТ | |
| SATT9 | п | АТТ ACT AGA GAA АТТ AGT ТТА |
| о | СТТ ACT AGG GTA ТТА АСС СТТ | |
| SOYPR1 | п | CGA AGA GCT ACG TGC САА АТТ |
| о | GTT AGA ААА СТС CGC ССА САС |
при этом при проведении ПЦР праймеры отжигают при разной температуре для разных локусов, причем отжиг праймеров, фланкирующих микросателлитные локусы SATT1 и SOYPR1, осуществляют при температуре 60°С, а праймеров, фланкирующих микросателлитный локус SATT9, - при температуре 45°С.
Сопоставительный анализ заявляемого технического решения с прототипом позволяет сделать вывод, что заявляемый способ выделения гибридных растений сои с использованием микросателлитных (SSR) локусов ДНК отличается от известного условиями осуществления действий, а именно используемыми веществами. Так, в известном способе при проведении ПЦР используют следующие микросателлитные локусы: НА 432, НА 514, НА 1442, ORS 5, а также «свои» фланкирующие их (локусов) праймеры. В заявляемом же способе при проведении ПЦР используют другие микросателлитные локусы, а именно SATT1, SATT9, SOYPR1, а также другие последовательности прямого и обратного праймеров, фланкирующих эти заявляемые локусы. Таким образом, заявляемый способ соответствует критерию патентоспособности НОВИЗНА.
Исследуя уровень техники в процессе проведения патентного поиска по всем видам сведений, общедоступных в печати, мы не выявили отличительного от прототипа признака, касающегося набора микросателлитных локусов и фланкирующих их праймеров при проведении амплификации ДНК. Заявляемый способ, включающий заявленную совокупность признаков, для специалиста в области селекции сои явным образом не следует из известного на сегодня существующего уровня техники. Нашими исследованиями было выявлено, что заявляемые последовательности праймеров фланкируют соответствующие им микросателлитные локусы, полиморфные для сортов сои и обладающие кодоминантным типом наследования. На основании этого можно сделать вывод о соответствии заявляемого изобретения критерию патентоспособности ИЗОБРЕТАТЕЛЬСКИЙ УРОВЕНЬ.
Заявляемое техническое решение соответствует и критерию патентоспособности ПРОМЫШЛЕННАЯ ПРИМЕНИМОСТЬ, т.к. оно может быть использование в сельском хозяйстве. И, кроме того, ниже в описании изобретения представлены средства и методы, с помощью которых возможно осуществление технического решения в том виде, как оно охарактеризовано в независимом пункте формулы изобретения.
Способ осуществляют следующим образом. Для выделения гибридных растений сои с использованием микросателлитных (SSR) локусов ДНК проращивают семена родительских форм сои, участвовавших в скрещивании, и семена гибридов F1, полученных в результате скрещивания, любым стандартным методом (в рулонах фильтровальной бумаги, в камере искусственного климата или в поле) и получают проростки, из каждого проростка выделяют ДНК любым известным методом, по известной методике проводят амплификацию ДНК проростков по заявленным микросателлитным локусам с использованием фланкирующих их последовательностей праймеров при помощи ПЦР.
Полученные продукты амплификации разделяют на фракции методом электрофореза в окрашенном агарозном геле. Полученные электрофоретические спектры каждого проростка визуально сравнивают со спектрами его родительских форм в лучах ультрафиолетового света, выделяют гибридные проростки по наличию на электрофореграмме двух фракций, соответствующих фракциям родительских форм.
ПРИМЕР осуществления способа
Проращивали семена гибридов F1 и их родительских форм (Дуар × Ника; Ника × Sepideh; Офелия × РВБ) в рулонах фильтровальной бумаги в термостате при температуре +24°С. Из каждого полученного проростка проводили выделение ДНК стандартным методом, для чего брали фрагменты примордиальных листьев массой 0,2 г родительских форм и гибридов F1 (с каждого растения отдельно) и гомогенизировали в фарфоровой ступке с добавлением 0,9 мл лизирующего буфера (20 мМ Na EDTA; 0,1М трис-HCl рН 8,5, 1,4М NaCl, 20% СТАВ). Полученную массу переносили в чистую пластиковую пробирку, инкубировали при температуре 65°С в течение 60 мин, периодически перемешивая. Далее добавляли 0,45 мл смеси хлороформа и изоамилового спирта (в соотношении 24:1 по объему) и полученную смесь перемешивали в течение 10 мин легким покачиванием, чтобы не нарушить целостность молекулы ДНК. Затем пробирки центрифугировали 5 мин при 10000 об/мин в микроцентрифуге MiniSpin plus (Германия). Верхнюю фракцию переносили в чистую пробирку. Процедуру повторяли дважды. Затем к полученному субнатанту добавляли 7 мкл раствора РНК (10 мг/мл), перемешивали и инкубировали при 37°С в течение 60 мин. ДНК осаждали добавлением равного объема охлажденного до -20°С изопропилового спирта с последующим центрифугированием в течение 5 мин при 10000 об/мин. Осадок промывали дважды 80% этанолом, подсушивали при комнатной температуре 20 мин. Полученную ДНК растворяли в 100 мкл воды. Таким образом выделяли ДНК у всех анализируемых образцов сои. Затем проводили реакции амплификации ДНК по заявленному набору микросателлитных локусов с использованием фланкирующих их последовательностей праймеров (прямого и обратного) при помощи ПЦР.
Полимеразную цепную реакцию (ПЦР) проводили на приборе "Терцик" (ДНК-технология, Россия) в 25 мкл реакционной смеси, содержащей: 67 мМ трис-HCl, рН 8,8; 16,6 мМ сульфата аммония; 2 мМ MgCl2; 0,01% Tween 20; по 0,2 мМ дезоксирибонуклеозидфосфатов; по 10 пМ праймеров; 10 нг анализируемой ДНК и 1 ед. рекомбинантной термостабильной ДНК полимеразы. Термально-временной режим реакций: начальна денатурация при 96°С в течение 2 мин, затем 30 циклов: денатурация при 94°С 30 сек, отжиг при 45 или 60°С (в зависимости от праймера: праймеры для локусов SATT1 и SOYPR1 отжигали при 60°С, а для локуса SATT9 - при 45°С) в течение 40 сек, элонгация при 70°С в течение 1 мин, финальная элонгация - 2 мин.
Продукты амплификации разделяли на фракции методом электрофореза в окрашенном агарозном геле. Для этого использовали 2% агарозный гель на однократном ТАЕ-буфере, содержащем 0,004М трис-ацетата и 0,002М ЭДТА. В качестве электродного буфера использовали такой же однократный ТАЕ-буфер. Для приготовления геля к 50 мл однократного ТАЕ-буфера добавляли 1 г агарозы, доводили смесь до кипения. Затем охлаждали колбу с горячим гелем под проточной водой до температуры 70°С, после этого добавляли 2 мкл 1% раствора бромистого этидия. Электрофорез проводили в камере для горизонтального электрофореза в течение 1,5 часа, при силе тока 50 мА.
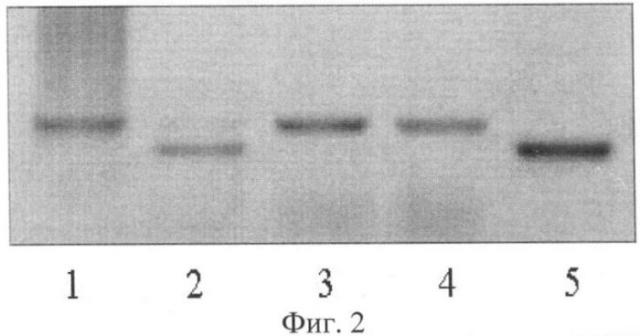
Визуальное сравнение спектров анализируемых сортов проводили в лучах ультрафиолетового света. Для визуализации продуктов амплификации использовали трансиллюминатор и видиосистему с программным обеспечением Gel Imager (ДНК-технология, Россия). Связанные с бромистым этидием фрагменты ДНК образцов сои четко видны в лучах ультрафиолетового света. Спектры ДНК гибридов F1 отличались по количеству фракций от фрагментов ДНК родительских форм. У гибридов присутствуют материнская и отцовская фракции (фиг.1, 2, 3). У ложных гибридов на фореграмме выявляется только материнская фракция. Так, на фиг.1 представлены электрофоретические спектры продуктов амплификации ДНК родительских форм Дуар и Ника (дорожки 1 и 4) и гибридов F1 Дуар × Ника (дорожки 2 и 3) по локусу SATT1, на фиг.2 - родительских форм Ника и Sepideh (дорожки 1 и 5) и гибридов F1 Ника × Sepideh (дорожки 2, 3, 4) по локусу SATT9 и на фиг.3 - родительских форм Офелия и РВБ (дорожки 1 и 3) и гибрида F1 Офелия × РВБ (дорожка 2) по локусу SOYPR1.
Итак, заявленный набор микросателлитных локусов с использованием фланкирующих их праймеров позволяет выявлять гибриды сои F1, т.е. обеспечивает достижение поставленной цели изобретения. Заявляемый способ позволяет решить поставленную задачу, состоящую в повышении уровня идентификации генотипов и выделения гибридов сои за счет применения используемых микросателлитных локусов, полиморфных для сортов сои и обладающих кодоминантным типом наследования.
1. Способ выделения гибридных растений сои с использованием микросателлитных (SSR) локусов ДНК, включающий проращивание семян и получение проростков, выделение ДНК из каждого проростка, проведение амплификации ДНК по выбранным микросателлитным локусам с использованием фланкирующих их праймеров при помощи полимеразной цепной реакции (ПЦР), разделение продуктов амплификации на фракции методом электрофореза в окрашенном агарозном геле, визуальное сравнение электрофоретических спектров каждого проростка со спектрами его родительских форм в лучах ультрафиолетового света, выделение гибридных проростков по наличию на электрофореграмме двух фракций, соответствующих фракциям родительских форм, отличающийся тем, что амплификацию ДНК проводят по следующему набору микросателлитных локусов с использованием фланкирующих их праймеров:
| Микросателлитный локус | Последовательность прямого и обратного праймеров | |
| SATT1 | п | AGT АСА TAG АТА ТТА AAG ТСТ |
| 0 | ААА TGA TGA ACG TGA АТТ АТТ | |
| SATT9 | п | АТТ ACT AGA GAA АТТ AGT ТТА |
| 0 | СТТ ACT AGG GTA ТТА ACC CTT | |
| SOYPR1 | п | CGA AGA GCT ACG TGC CAA АТТ |
| 0 | GTT AGA ААА CTC CGC CCA CAC |
2. Способ по п.1, отличающийся тем, что при проведении полимеразной цепной реакции отжиг праймеров, фланкирующих микросателлитные локусы SATT1 и SOYPR 1, осуществляют при температуре 60°С, а праймеров, фланкирующих микросателлитный локус SATT9 - при температуре 45°С.