Способ нивелирования ранних проявлений вазопатии у новорожденных поросят с анемией
Иллюстрации
Показать всеИзобретение относится к ветеринарии и биологии, а именно к гематологии и ангиологии. Способ включает введение ферроглюкина по 150 мг (2 мл) внутримышечно двукратно с интервалом 10 дней. Также вводят полизон 3 мг/кг и крезацин 5 мг/кг, которые включают в схему выпаивания соответственно на 5 суток и на 7 суток. Способ позволяет избежать нарушений трофики тканей за счет сосудистых осложнений у новорожденных поросят с анемией, уменьшить их падеж, оздоровить стадо, увеличить количество и качество получаемой мясной продукции. 1 ил., 1 табл.
Реферат
Изобретение относится к ветеринарии и биологии, а именно к гематологии и ангиологии.
Аналогов предлагаемого способа коррекции субклинической вазопатии у новорожденных поросят с анемией не существует.
В литературе имеются сведения о применении при анемии у поросят ферроглюкина (Внутренние незаразные болезни сельскохозяйственных животных. Под ред. В.М.Данилевского. М.: «Агропромиздат», 1991. - 576 с.).
В качестве эффективных стимуляторов жизнедеятельности растущего организма в современной ветеринарии применяются полизон - фосфорнокислая соль 2-амино-4-метилтио-(S-оксо-S-амино)-масляной кислоты, представляет собой слаборастворимый в воде порошок от белого до кремового цвета (Овчинников А. и др. Полизон - стимулятор роста // Птицеводство, 2006. - №12. - с.14-15.), и крезацин - производное ароксиалкилкарбоновых кислот. Он представляет собой белый кристаллический порошок, хорошо растворимый в воде, со слабым специфическим запахом, сладковато-горьковатого вкуса. Он проявляет эффективное стимулирующее действие на живые организмы, повышая выживаемость человека и животных в неблагоприятных и экстремальных условиях, стимулируя или нормализуя жизненные процессы (Байматов В.Н., Латыпов М.М. Влияние крезацина на состояние птицы. Ветеринария, 2006, №11, с.49-51).
Однако никогда ранее лечебный комплекс, состоящий из ферроглюкина, полизона и крезацина, не применялся у новорожденных поросят с анемией с целью коррекции у них ранних проявлений вазопатии.
Целью изобретения является коррекция ранних проявлений вазопатии у новорожденных поросят с анемией.
Сущность заявляемого способа заключается в том, что для коррекции субклинической вазопатии новорожденным поросятам с анемией в зависимости от степени начальных нарушений назначается ферроглюкин по 150 мг (2 мл) внутримышечно, двукратно с интервалом 10 дней, полизон 3 мг/кг на 5 суток и крезацин 5 мг/кг на 7 суток, включенных в схему выпаивания.
Способ позволяет корректировать ранние проявления вазопатии у новорожденных поросят с анемией к концу курса лечения. При соблюдении рекомендаций заявляемого способа возможно поддержание в последующем на нормальном уровне состояния функций сосудистой стенки, что позволит существенно оздоровить стадо, сократить падеж, увеличить привесы и получать от этих животных здоровое потомство.
Заявляемый способ осуществляется следующим образом.
Для диагностики субклинической вазопатии новорожденным поросятам проводится следующее обследование.
Антиагрегационная активность сосудистой стенки определяется по методу (Балуда В.П., Лукьянова Т.И., Балуда М.В. Метод определения антиагрегационной активности стенки сосудов человека. // Лабор. Дело, 1983. - №6. - с.17-20). В основе этого метода лежит вычисление степени торможения агрегации тромбоцитов в плазме, полученной из крови после временной венозной окклюзии.
На сосуд, из которого еще не производился забор крови, накладывается манжетка сфигмоманометра и создается давление на 10 мм рт.ст. выше систолического. Через 3 минуты производится взятие 9 мл крови в 1 мл 3,8% раствора цитрата натрия. Ее немедленно центрифугируют 5 минут при 1000 об/мин для получения богатой тромбоцитами плазмы (БТП). Плазму отсасывают пипеткой и сразу же помещают в тающий лед, где хранят до начала исследований. Повторно пробу центрифугируют 20 минут при 3000 об/мин для получения бестромбоцитной плазмы. После подсчета количества тромбоцитов в богатой тромбоцитами плазме, полученной до венозного застоя (подробно описано ниже), ее разводят бедной тромбоцитами плазмой (БеТП), взятой до (1 проба) и после (2 проба) венозного застоя до концентрации 200 000 тромбоцитов/мкл. Полученную смесь встряхивают и инкубируют 10 минут при 20-22°C. Затем проводят агрегацию тромбоцитов (AT) с коллагеном (разведение 1:2 основной суспензии) на стекле следующим способом (Шитикова А.С. В кн.: Гемостаз. Физиологические механизмы, принципы диагностики основных форм геморрагических заболеваний. Под ред. Н.Н.Петрищева, Л.П.Папаян. СПб.: 1999. С.49-52).
Кровь забирают с цитратом натрия 3,8% в соотношении 9:1, центрифугируют 5 мин при 1000 об/мин для получения богатой тромбоцитами плазмы. Часть плазмы отбирают, а оставшуюся центрифугируют при 3000 об/мин в течение 20 мин, получая БеТП. БТП стандартизируют по числу тромбоцитов путем разбавления исходной БТП аутологичным образцом БеТП (полученной до венозного застоя - 1-я проба или после него - 2-я проба) до 200·109/л. Концентрация кровяных пластинок в исходной БТП подсчитывается в камере Горяева (в 50 больших квадратах). Объемы смешиваемых БТП и БеТП определяют по формуле:
VБеТП=VБТП·(N/200000)-1],
VБеТП - объем бедной тромбоцитами плазмы,
VБТП - объем богатой тромбоцитами плазмы,
N - счетная концентрация тромбоцитов в исходной БТП (клеток/мкл).
Из отобранного объема стандартизированной плазмы на предметное стекло наносят 0,02 мл плазмы и другой пипеткой 0,02 мл р-ра индуктора коллагена в стандартной концентрации (разведение 1:2 основной суспензии).Стеклянной палочкой смешивают плазму с индукторами и включают секундомер. Смесь перемешивают так, чтобы жидкость занимала окружность диаметром около 2 см.
Покачивая стекло круговыми движениями в проходящем свете осветителя на черном фоне следят через лупу за возникновением агрегатов. При появлении отчетливых агрегатов, просветлении раствора и прилипании части агрегатов к стеклу секундомер отключают, фиксируя время агрегации тромбоцитов.
Реакцию повторяют по 2-3 раза в 1-й и 2-й пробе, находя для каждой из них среднее арифметическое значение.
По степени торможения агрегации тромбоцитов после венозного застоя судят об антиагрегационной активности плазмы крови, обусловленной поступлением в кровоток простациклина из сосудистой стенки. Индекс антиагрегационной активности сосудистой стенки (ИААСС) при исследовании AT на стекле рассчитывали по формуле:
Нормальными значениями для коллагена можно считать ИААСС 1,45-1,50.
Определение антитромбогенных свойств сосудистой стенки, зависящих от продукции веществ, активирующих антитромбин III, оценивая его базальный уровнь до и после временной дозированной ишемии стенки вены, приведены ниже (Баркаган З.С., Момот А.П. Основы диагностики нарушений гемостаза. М., 1999 - 214 с.).
Принцип метода основан на выявлении снижения активности (в отсутствие гепарина) в плазме антитромбина III (AT III), которую определяют по способности исследуемой плазмы инактивировать тромбин, для чего ее предварительно обрабатывают сорбентом гепарина, затем подвергают тепловой дефибринации и смешивают со стандартным количеством тромбина. После инкубации смеси в ней определяют остаточную коагуляционную активность тромбина. По уровню снижения активности тромбина в процентах от нормы оценивают активность AT III в исследуемой плазме.
Используются следующие реактивы. 1. Трис-HCl буфер 0,05 М, pH 7,4. 2. Раствор тромбина в буфере: 0,2 мл раствора должны свертывать 0,3 мл 0,4% раствора фибриногена за 15-16 сек. Рабочий раствор тромбина готовят в пластиковой или силиконированной пробирке, хранят при комнатной температуре и используют в тесте в день исследования. 3. Сорбент гепарина Гепасорб-1 (фирма "Технология-Стандарт"). 4. Свежеприготовленный раствор фибриногена в концентрации 3,5-4,0 г/л, который применяют для тестирования остаточной активности тромбина. Допускается замена раствора фибриногена нормальной бедной тромбоцитами цитратной плазмой, разведенной буфером в 2 раза. 5. Свежая цитратная бедная тромбоцитами плазма, полученная от 6-8 здоровых поросят, или лиофилизированная фирменная, с известной активностью AT III, которую используют для построения калибровочного графика.
Материалом для исследования служит цитратная бедная тромбоцитами плазма.
Для приготовления сорбированной и дефибринированной плазмы в пробирке смешивают 10 мг сорбента гепарина с 1,0 мл исследуемой плазмы. Постоянно встряхивая пробирку, перемешивают ее содержимое при комнатной температуре в течение 8 мин, исключая образование пены и осадка на ее дне. После этого, смесь центрифугируют в течение 2 мин при 1000-1500 об/мин. Плазму в надосадке переносят в чистую пробирку и дефибринируют на водяной бане при +56°C в течение 6 мин, после чего вновь центрифугируют при 3000 об/мин в течение 10 мин, снимают надосадочную часть и исследуют в течение первых 2 ч.
Ход определения. В пробирку вносят 0,4 мл рабочего раствора тромбина и прогревают его на водяной бане при +37°C в течение 2 мин. Затем добавляют 0,1 мл исследуемой адсорбированной и дефибринированной плазмы, включают секундомер. Через 2 мин (точно!) 0,2 мл смеси переносят в пробирку с 0,3 мл раствора фибриногена (или разведенной нормальной плазмы), предварительно подогретой до +37°C. Немедленно включают секундомер и регистрируют время свертывания.
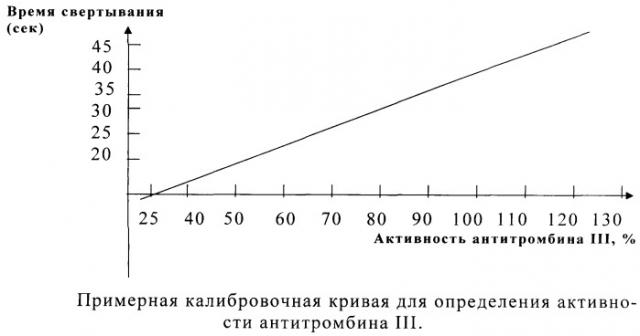
По калибровочной кривой находят активность AT III в процентах.
Построение калибровочной кривой проводят следующим образом. Плазму здоровых людей подвергают дефибринированию, как указано выше. Затем из нее готовят разведения для построения калибровочной кривой в соответствии с табл.1.
| Таблица 1 | ||
| Схема приготовления разведений плазмы для построения калибровочной кривой при определении активности AT III | ||
| Номер разведения | Плазма + буфер | Активность AT III, % |
| 1 | Плазма без буфера | 100 |
| 2 | 0,2 мл + 0,2 мл | 50 |
| 3 | 0,1 мл + 0,3 мл | 25 |
С каждым из разведений определяют время свертывания по указанной выше методике. Все измерения проводят трижды, рассчитывают средний результат. При построении калибровочной кривой по логарифмической оси ординат откладывают время свертывания в секундах, по оси абсцисс - активность AT III в % в соответствии с указанными выше разведениями. Примерная калибровочная кривая приведена на чертеже.
Калибровочную кривую для одного типа и одной серии тромбина и буфера строят однократно. Периодически контролируют лишь активность рабочего раствора тромбина.
В норме без венозной окклюзии активность AT III составляет 85-115%. При взятии крови после временной венозной окклюзии, как описано в методе по оценке антиагрегационной активности сосудов, и определении в ней AT III возможно косвенно оценить уровень синтеза в стенке сосуда тканевых активаторов AT III. На фоне временной венозной окклюзии активность AT III повышается и находится в границах 120-143%. Рассчитывается индекс синтеза активаторов AT III в сосудах (ИСААС) путем деления величины активности AT III на фоне венозной окклюзии на величину AT III без нее. В норме он равен 1,20-1,40.
Активность синтеза тканевых активаторов плазминогена по времени лизиса эуглобулинового сгустка до и после временной венозной окклюзии оценивали следующим образом.
Принцип метода заключается в осаждении эуглобулиновой фракции плазмы, при этом основные ингибиторы фибринолиза, в частоности α2-антиплазмином, остаются в надосадочной части и удаляются. Поэтому эуглобулиновый лизис отражает активность фибринолиза в условиях исключения ингибирующего действия антиплазминов. Его скорость отражает, в основном, количество плазминогена в плазме и степень его активации. Определяют время спонтанного лизиса сгустка, получаемого из эуглобулиновой фракции плазмы при добавлении к ней раствора хлорида кальция.
Используются следующие реактивы. 1. 1% раствор уксусной кислоты. 2. 0,277% раствор хлорида кальция. 3. Буфер Михаэлиса или трис-НС буфер, 0.05М, pH 7,3-7,4.
Материалом для исследования служит цитратная бедная тромбоцитами плазма до и после временной венозной окклюзии.
Ход определения
Для получения эуглобулиновой фракции к 8,0 мл дистиллированной воды добавляют 0,15 мл 1% уксусной кислоты и 0,5 мл исследуемой плазмы. После 30-минутного охлаждения смеси в холодильнике при +2-8°C эуглобулины осаждают центрифугированием при 1500 об/мин в течение 7 мин. Надосадочную жидкость сливают, пробирку осушают опрокидыванием на фильтровальную бумагу. Осадок эуглобулинов разводят в 0,5 мл буфера и помещают на водяную баню (+37°C). Затем, не вынимая пробирку из бани, добавляют 0,5 мл раствора хлорида кальция, осторожно перемешивают покачиванием пробирки (не встряхивая!) включают секундомер и инкубируют на водяной бане при +37°C. Регистрируют время с момента добавления хлорида кальция до полного растворения сгустка.
Результат выражают в минутах. В норме время спонтанного лизиса эуглобулинового сгустка составляет 175-230 мин. После временной венозной окклюзии время лизиса снижается, находясь в границах 126-170 мин. При делении величины длительности спонтанного лизиса эуглобулинового сгустка до окклюзии на величину после рассчитан индекс фибринолитической активности сосудистой стенки (ИФАСС), в норме равный 1,35-1,45.
Для каждой лаборатории необходимо обследование группы здоровых новорожденных поросят, чтобы найти средние нормативные значения с расчетом S2 по всем трем методикам для последующих расчетов.
По каждой методике у каждого больного поросенка для большей точности диагностики проводят тест 3-4 раза с вычислением среднеарифметических значений, которые используют в последующих расчетах и вычислениях S2.
Для определения весомости отдельных исследуемых параметров у сосудистых больных поросят и вычисления у них общего антитромботического потенциала сосудов применялся системный многофакторный анализ, позволяющий переводить многомерные количественные характеристики исследуемого процесса с несопоставимыми абсолютными значениями в сопоставимые относительные величины (Применение методов морфометрии и статистического анализа в морфологических исследованиях. Сост. М.В.Углова, Б.А.Углов, В.В.Архипов и др. Куйбышев, 1982. - 47 с.). Расчет производился по формулам:
Xi - исследуемый параметр, X0 - нормативный параметр, Xj - относительная разность.
Pi - весовой коэффициент (коэффициент влияния), a - постоянный множитель (в наших исследованиях a=0,1), σj - среднеквадратическое отклонение значения Xj в относительных единицах
- дисперсия исследуемого параметра Xi, ni - количество наблюдений при определении Xi, - дисперсия нормативного параметра X0, n0 - количество наблюдений при определении X0.
- величина, интегрально характеризующая исследуемый процесс в заданный срок (в относительных единицах), является общим антитромботическим потенциалом сосудов (ОАПС).
Сочетанное применение описанных методов с последующей обработкой полученных значений ИААСС, ИСААС и ИФАСС системным многофакторным анализом с определением общего антитромботического потенциала сосудов () - норма 0,180 и выше - позволяет выявлять у животных риск развития ослабления антитромботической активности сосудов ( от 0,179 до 0,060), что является, по сути дела, ранними проявлениями вазопатии и требует проведения соответствующих мероприятий, нормализующих функции стенки сосуда и не позволяющих развиться клинически проявляющейся тромбофилии ( от 0,059 и ниже), требующей немедленного проведения серьезных лечебных мероприятий.
Ранние проявления вазопатии могут корректироваться лечебным комплексом из ферроглюкина по 150 мг (2 мл) внутримышечно, двукратно с интервалом 10 дней, полизона 3 мг/кг на 5 суток и крезацина 5 мг/кг на 7 суток, включенных в схему выпаивания.
Внедрение данного способа коррекции субклинического ослабления антитромботической активности сосудов у новорожденных поросят с анемией в практику ветеринарных учреждений позволит решить ряд насущных биологических, ветеринарных и экономических проблем современного свиноводства. Эффективная коррекция у новорожденных поросят с анемией позволит оздоровить стадо, получать высокие привесы, а в последующем здоровое потомство.
Пример. У новорожденного поросенка №22 с анемией было выявлено нарушение эритропоэза и признаки снижения уровня содержания железа в его организме (сывороточное железо 11,7 мкмоль/л, сидероциты 1,0%, при количестве гемоглобина у него 82,0 г/л, эритроцитов - 3,92×1012/л).
Поросенок обследован в условиях свинарника по поводу клиники анемии. У поросенка была взята кровь и исследована троекратно по изложенной выше схеме с оценкой ИААСС, ИСААС и ИФАСС и вычислением общего антитромботического потенциала сосудов.
У поросенка были выявлены выраженные признаки угнетения антитромботической функции сосудистой стенки. ИААСС составлял 1,45, ИСААС 1,22 и ИФАСС 1,37. Общий антитромботический потенциал сосудов у него составил =0,121.
Поросенку было назначено лечение: ферроглюкин по 150 мг (2 мл) внутримышечно, двукратно с интервалом 10 дней, полизон 3 мг/кг на 5 суток и крезацин 5 мг/кг на 7 суток, включенных в схему выпаивания.
После завершения лечения признаки анемии купировались - сывороточное железо 19,6 мкмоль/л, сидероциты 7,9%, при количестве гемоглобина у него 119,2 г/л, эритроцитов - 4,98×1012/л), ИААСС составлял - 1,49, ИСААС 1,35 и ИФАСС 1,39, отмечена нормализация значения общего антитромботического потенциала сосудов (=0,182). Дальнейшее наблюдение за данным поросенком не выявило в последующем нарушений параметров антитромботической активности сосудов.
Использование предлагаемого способа коррекции субклинической вазопатии в ветеринарии поможет избежать нарушений трофики тканей за счет сосудистых осложнений у новорожденных поросят с анемией, уменьшить их падеж, оздоровить стадо, увеличить количество и качество получаемой мясной продукции и здоровое потомство.
Способ нивелирования ранних проявлений вазопатии у новорожденных поросят с анемией, включающий применение ферроглюкина по 150 мг (2 мл) внутримышечно, двоекратно с интервалом 10 дней, полизона 3 мг/кг на 5 суток и крезацина 5 мг/кг на 7 суток, включенных в схему выпаивания.