Применение бычьего лактоферрина для создания лекарственного средства, предназначенного для ингибирования роста бактерий
Иллюстрации
Показать всеНастоящее изобретение относится к новому применению бычьего лактоферрина для создания лекарственного средства, предназначенного для ингибирования роста бактерий. Заявлено применение бычьего лактоферрина, выделенного из цельного молока с низким числом соматических клеток в количестве, эффективном для ингибирования роста бактериальных патогенов, экспрессирующих секреторную систему III типа, у субъекта, для изготовления молочной смеси, причем бактериальный патоген, экспрессирующих секреторную систему III типа, выбран и группы, включающей Salmonella, Shigella, Yersinia, Pseudomonas и Escherichia. Заявленное изобретение обеспечивает ингибирование роста бактериальных патогенов, экспрессирующих секреторную систему III типа. 2 н. и 8 з.п. ф-лы, 18 ил., 1 табл.
Реферат
Уровень техники
Настоящее изобретение в целом относится к применению бычьего лактоферрина для создания лекарственного средства, предназначенного для ингибирования роста бактерий.
Описание релевантного уровня техники
Колонизация желудочно-кишечного тракта (GI, от англ. Gastrointestinal) новорожденного ребенка бактериями начинается через несколько часов после рождения. Бактерии могут попадать в организм ребенка с пищей или водой либо непосредственно из организма человека, ухаживающего за новорожденным. Одно из бактериальных семейств, которое часто присутствует в желудочно-кишечном тракте человека, является семейство Enterobacteriaceae, которое включает грамотрицательные факультативно анаэробные бактерии. Многие виды бактерий данного семейства считаются кишечными патогенами, включая бактерии рода Escherichia, Salmonella, Shigella и Yersinia.
Escherichia coli (Е.coli) является одним из основных видов бактерий, обитающих в толстом кишечнике теплокровных животных. Являясь частью нормальной микрофлоры желудочно-кишечного тракта человека, Е.coli принимает важное участие в переваривании пищи, поскольку обладает способностью выделять витамин К из непереваренного материала в толстом кишечнике. Однажды попав в организм, штамм Е.coli может порепетировать в желудочно-кишечном тракте долгие месяцы или даже годы. Поскольку данный вид бактерий не приобретает генетических элементов, кодирующих факторы вирулентности, он остается комменсалом.
Однако существует несколько подвидов Е.coli, которые могут вызывать инфекционные и другие заболевания различной степени тяжести. Например, классы Е.coli, известные как уропатогенные Е.coli (UPEC), могут вызывать инфекционные заболевания мочеполовых путей наиболее распространенную внекишечную инфекцию, вызываемую Е.coli. Е.coli является причиной более 80 процентов всех неосложненных инфекций мочеполовых путей, которые являются причиной более 7 000 000 обращений пациентов ко врачам в Соединенных Штатах Америки. Аналогично, ассоциированный с менингитом штамм Е.coli (MNEC) является наиболее распространенным патогеном, приводящим к развитию менингита, в особенности в неонатальном периоде. Неонатальный менингит встречается у одного из 2-4 тысяч новорожденных.
Штаммы Е.coli могут вызывать и другие заболевания. Например, если Е.coli попадает в брюшную полость через перфоративное отверстие или разрыв толстой кишки, он приводит к развитию перитонита, потенциально летального инфекционного осложнения. Е.coli также может вызывать сепсис, инфекцию, которая является результатом попадания бактерий в кровоток. Чаще всего бактерии попадают в кровоток из отдаленных очагов инфекции, локализующихся, например, в почках, коже или легких. В Соединенных Штатах Америки регистрируется приблизительно 500 000 случаев септицемии в год, а показатель смертности от данного осложнения составляет 20-50%, несмотря на постоянные попытки найти лечение указанной патологии. Приблизительно 45% случаев септицемии обусловлены грамотрицательными бактериями, такими как Е.coli.
Определенные вирулентные штаммы Е.coli также могут являться причиной различных серьезных заболеваний, сопровождающихся расстройством кишечника. Тяжесть таких диарейных заболеваний может быть различной, вплоть до летального исхода. Даже не являясь фатальными, указанные заболевания являются одной из самых распространенных патологий у новорожденных и детей раннего возраста в развитых странах, несмотря на продолжающиеся попытки понять причины и патогенез данных заболеваний.
Диарея является наиболее опасным патологическим состоянием для детей и новорожденных. Она занимает первое место по причине смертности у детей до 5 лет и приводит к смерти 3-4 миллионов новорожденных ежегодно по всему миру. Частые эпизоды острой или персистирующей диареи также могут серьезно повлиять на пищевой статус, рост и развитие ребенка. Steiner, T.S., et al. Enteroaggregative Esherichia Coli Prjduce Intestinal Inflammation and Growth Impairment and Cause Interleukin-8 Release from Intestinal Epithelial Cells, J. Infect. Dis. 117:88-96 (1998).
Диареегенные штаммы Е.coli были классифицированы, по крайней мере, на шесть базовых категорий на основании их эпидемиологических и клинических характеристик, специфических детерминант вирулентности и ассоциации с определенными серотипами: энтеротоксигенные Е.coli (ETEC), энтероинвазивные Е.coli (EIEC), диффузно-адгезивные Е.coli (DAEC), энтеропатогенные Е.coli (ЕРЕС), энтерогеморрагические Е.coli (EHEC) и энтероадгезивные Е.coli (EAEC). Nataro et al., Diarrheagenic Esherichia coli, et al. Detection and Characterization of Diarrhcagenic Е.coli, Clin. Microbio. Rev. 11:142-201 (Jan. 1998); Trung Vu Hguyen, et al., Detection and Characterization of Diarrheagenic Escherichia coli from Young Children in Hanoi, Vietnam, J. Clin. Microbio. 43:755-760, 755 (Feb. 2005).
ETEC представляют собой специфический штамм Е.coli, продуцирующий энтеротоксины. Некоторые энтеротоксины являются цитотоксичными и способны повреждать клетки слизистой оболочки желудочно-кишечного тракта, в то время как другие оказывают лишь цитотоническое действие, индуцируя секрецию воды и электролитов. ETEC считаются основным возбудителем диареи путешественников. Альтернативно, ЕIЕС представляют собой штамм, продуцирующий факторы инвазии и обладающий способностью колонизировать ткани и вызывать их воспаление и разрушение. ЕIЕС по механизму своего действия близки бактериям р.Shigella и вызывают развитие инвазивной, дизентериеподобной формы диареи у людей. DAEC штаммы идентифицируют на основании их способности диффузно прикрепляться к поверхности клеток. ЕРЕС представляют собой самый первый классифицированный штамм диареегенных Е.coli, часто вызывающий профузную водянистую диарею. ЕРЕС являются основной причиной диареи детского возраста в развивающихся странах. В отличие от ETEC или ЕIЕС, ЕРЕС не продуцируют распознаваемых токсинов или факторов инвазии. Другой отдельной группой Е.coli являются ЕНЕС, также известные как Е.coli, продуцирующие Шига-токсин (STEC). ЕНЕС экскретируют сильные веротоксины, или Шига-токсины, вызывающие геморрагические колиты, или кровавую диарею. Наконец, ЕАЕС, известные благодаря их способности прикрепляться к тканевой культуре клеток при помощи адгезии, ассоциированы с персистирующей диареей, в особенности в развивающихся странах.
Род Shigella, который также относится к семейству Enterobacteriaceae, близок по своим свойствам к роду Escherichia, однако бактерии являются анаэрогенными и не способны ферментировать лактозу. Следовательно, всегда можно отличить их от Е.coli. Данное семейство включает четыре рода: S.dysenteriae, S.flexneri, S.boydii и S.sonnei. Среди вида S.flexneri выделяют много штаммов, включая М90Т, Е22383 и Е23507.
Инфекция, вызываемая бактериями вида Shigella flexneri, общеизвестная как шигеллез, или бактериальная дизентерия, является основной причиной детской смертности в развивающихся странах. Каждый год регистрируется приблизительно 165 миллионов случаев шигеллеза, что является причиной около 1.5 миллиона смертельных исходов. Шигеллез характеризуется диарей, лихорадкой, тошнотой и кишечными спазмами. В редких случаях у детей, страдающих дизентерией, наблюдаются судороги. Шигеллез является очень распространенным заболеванием и является серьезной проблемой в тех местах, где гигиенические условия являются неблагоприятными. Заражение происходит, главным образом, при употреблении воды, загрязненной фекалиями инфицированных людей. Инфекция является высококонтагиозной, менее чем 10 бактериальных клеток достаточно для развития заболевания. Дети, в особенности ясельного возраста от 2 до 4-х лет, наиболее часто болеют шигеллезом.
ЕРЕС, ЕНЕС и Shigtlla используют одинаковый механизм для инвазии и повреждения эукариотических клеток и вызывают диарею. Указанный механизм известен как секреторная система III типа (TTSS). Патогены, используя указанный механизм, индуцируют характерное гистопатологическое повреждение, обозначаемое термином повреждение адгезия/разрушение (А/Е), характеризующееся интимным прикреплением бактерий к эпителиальным клеткам с последующим разрушением клеточных микроворсинок. Sekiya, et al., Supermolecular Structure of the Enteropathogenic Esherichia coli Type III Secretion System and its Direct Interaction with the EspA-Sheath-like Structure, PNAS, 98:11, 638-11, 643 (2001). TTSS дает позволяет патогенам инъецировать вирулентные белки непосредственно в цитоплазму эукариотических клеток. Yip, Clavin, et al., Structural Characterization of a Type-III Secretion System Filament Protein in Complex with its Chaperone, Nat. Structural & Mol. Biol. 12:75-81 (2005).
TTSS аппарат состоит из двух отдельных частей: (1) удлиненной, полой внеклеточной структуры, обычно называемой иглой, и (2) цилиндрического основания, аналогичного флагеллярному базальному тельцу, которое пересекает две бактериальные мембраны и обеспечивает стабилизацию целой структуры на клеточной оболочке. Считается, что игла физически связана с базальным тельцем. Tampakaki, A., et al., Conserved Features of Type III Secretion. Cell. Microbiol. 6:805-816 (2004).
TTSS механизм запускается, когда патоген вступает в тесный контакт с клеткой-хозяином. Поскольку механизм, описанный выше, является специфическим механизмом для ЕРЕС, считается, что аналогичный механизм существует у всех патогенов, экспрессирующих TTSS. Sekiya, PNAS 98:11, 638; Ebel, F., et al., Temperature-and Medium-Dependent Secretion of Proteins by Shiga Toxin-Producing Esherichia coli, Infect. Imm. 64:4472-4479 (Nov. 1996).
Считается, что TTSS представляет собой многоэтапный механизм, приводящий к развитию инфекции. На первом этапе происходит сборка пары кольцевидных структур, расположенных на внутренней и внешней мембране бактериальной клетки. Затем бактерия образует инъецирующий порт, состоящий из секреторного компонента F Е.coli (EscF), который закреплен на внутренней и внешней мембранах бактериальной клетки. После этого секреторный белок А Е.coli (EspA) прикрепляется к кончику EspF. EspA последовательно инициирует полимеризацию от кончика EspF и способствует сборке трубчатой структуры, известной как игла. Игла является растяжимой, и ее удлинение контролируется количеством секретируемого EspA. Игла структурирует физический мостик между бактерией и мембраной клетки-хозяина.
На конце иглы два секреторных белка Е.coli: В (EspB) и D (EspD) гетероолигомеризуются в комплексы, которые формируют поры в мембране эукариотической клетки-мишени. Эти поры позволяют бактерии инъецировать белки в цитоплазматический компартмент эпителиальных клеток. EspB и EspD так же, как и транслоцируемый рецептор интимина (Tir), затем транслоцируются в инфицированные клетки. Известно, что правильное функционирование EspB очень важно для успешного использования секреторной системы третьего типа патогенными бактериями. Путем введения бактериальных белков в клетку-хозяина бактерии вынуждают клетку содействовать существующей в ней инфекции. Кроме того, происходит транслокация Tir, который переносится за пределы поверхности клеток кишечника и связывается непосредственно с молекулой адгезии бактерий - интимином. Связывание Tir с интимином запускает полимеризацию актина и других компонентов цитоскелета в месте прикрепления, что затем приводит к разрушению нормальных микроворсинок энтероцитов и формированию своеобразного "пьедестала". Описанные изменения обычно и обозначаются термином А/Е повреждение. После того как множество бактерий адгезируется на поверхности клеток кишечника указанным образом, появляются симптомы инфекции, такие как диарея. На фиг.16 представлена схема типичной TTSS.
В отличие от ЕРЕС, ЕНЕС и Shigella, ЕАЕС являются классом Е.coli, который не экспрессирует секреторную систему III типа. Отличительной чертой ЕАЕС штаммов является их способность прикрепляться к тканевой культуре клеток путем адгезии. Бактерии выстраиваются в ряды, параллельные клеткам культуры. Данный тип адгезии известен как "расположение по типу кирпичной кладки".
Патогенез ЕАЕС имеет три этапа: (1) прикрепление к слизистой оболочке кишечника при помощи фимбрий агрегации-адгезии (AAF) или других факторов адгезии; (2) увеличение продукции слизи бактериальными клетками и клетками-хозяевами, которая формирует слизистую биопленку на поверхности энтероцитов; (3) воспалительный ответ с выбросом цитокинов, слизистой токсичностью и кишечной секрецией. Huang, D.B. et al., Enteroaggregative Escherichia Coli: An Emerging Enteric Pathogen, Am. J. Gastroenterol. 99(2):383-389 (2004). К ЕАЕС относятся многие штаммы E.coli, включая Е.Coli O42, O4, O:Н10 и O44:Н18.
Штаммы ЕАЕС, ассоциированные с персистирующей диареей у детей разного возраста, являются причиной приблизительно 10% случаев диареи у детей. В развивающихся странах штаммы ЕАЕС вызывают острую диарею у детей приблизительно в 8-32% случаев и ассоциированы с персистирующей диареей в 20-30% случаев. Эти штаммы также ассоциированы с диарей путешественников и диареей, ассоциированной с приобретенным синдромом иммунодефицита (AIDS). Продолжительность ЕАЕС-ассоциированной диареи у детей менее 3-х лет в среднем составляет 17 дней, что намного дольше, чем при любом другом патогене.
Было доказано, что самым эффективным способом профилактики диареи у детей менее 5 лет является грудное вскармливание. Многие исследования показали, что исключительно грудное вскармливание, и в меньшей степени частичное грудное вскармливание, может защищать от острой и персистирующей диареи. Victoria, C.G., et al., Risk Factors for Deaths Due to Respiratory Infections Among Brazilian Infants, Int.J. Epidemiol. 18:918-25 (1989). Эффективность грудного вскармливания как защитного воздействия обусловлена множеством анти-инфекционных, антивоспалительных и иммунорегуляторных факторов, поступающих в организм ребенка с грудным молоком. Newburg, D.S. Human Milk Glycoconjugaes that Inhibit Pathogens, Curr. Med. Chem. 6:117-127(1999).
Лактоферрин, железо-связывающий гликопротеин, представляет собой один из основных полифункциональных агентов, присутствующий в грудном молоке. Он также присутствует в секретах экзокринных желез, таких как слезы, слюна и секреты специфических типов клеток, таких как нейтрофилы. Было показано, что человеческий лактоферрин оказывает протективное действие в отношении грамотрицательных бактерий при помощи различных механизмов.
Не ограничиваясь какой-либо одной теорией, считается, что человеческий лактоферрин оказывает бактериостатическое действие, лишая бактерии железа, которое необходимо для их роста. Таким образом, связывая железо окружающей среды, так необходимое для роста патогенных микроорганизмов, человеческий лактоферрин эффективно ингибирует рост указанных микроорганизмов.
Считается, что человеческий лактоферрин также может подавлять бактериальную активность за счет непосредственного связывания с микробной мембраной. Человеческий лактоферрин связывается с липидом А липополисахарида (LPS) на поверхности бактериальных клеток, что приводит к нарушению целостности мембраны бактериальной клетки и разрушает ее. Существует предположение, что связывание человеческого лактоферрина с LPS может нарушать функционирование секреторной системы III типа, вызывая сначала секрецию белков, а затем их разрушение. Oshoa, Т. J., et al., Lactoferrin Impairs Type III Secretory System Function in Enteropathogenic Escherichia coli, Infect. Immun. 71:5149-5155 (2003).
В нескольких исследованиях было изучено влияние человеческого лактоферрина на различные виды бактерий. Например, исследование 2003 года было направлено на изучение влияния рекомбинантного человеческого лактоферрина на TTSS. Известно, что аминокислотная последовательность рекомбинантного человеческого лактоферрина практически аналогична последовательности нативного человеческого лактоферрина, однако имеет другой характер гликозилирования. В исследовании было показано, что рекомбинантный человеческий лактоферрин может нарушать функцию секреторной системы III типа у Е.coli. Id. В исследовании также было показано, что человеческий лактоферрин не препятствует росту ЕРЕС.Id.
В исследовании 2001 года было показано, что человеческий лактоферрин может ингибировать адгезию ЕРЕС к HeLa клеткам. Nascimento de Araujo, А., et al., Lactoferrin and Free Secretory Component of Human Milf Inhibit the Adhesion of Enteropathogenic Escherichia coli to HeLa Cells, ВМС Microbiol. 1:25 (2001). Однако данное исследование не было направлено на изучение способности человеческого лактоферрина ингибировать рост микроорганизмов.
В то время как лактоферрин оказывает положительный эффект на симптомы диареи, многие женщины не способны или не хотят кормить грудью. Поэтому было бы полезно создать альтернативу женскому молоку, которая будет эффективной в отношении профилактики и лечения диарейных инфекций. Такая альтернатива также должна быть эффективной в отношении ингибирования роста бактериальных патогенов, которые вызывают диарейные инфекции.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЕ
Таким образом, вкратце, настоящее изобретение относится к новому способу использования бычьего лактоферрина для создания лекарственного средства, предназначенного для ингибирования роста бактериального патогена, экспрессирующего секреторную систему III типа.
Настоящее изобретение также относится к новому способу использования бычьего лактоферрина для создания лекарственного средства, предназначенного для ингибирования роста бактериальных патогенов, экспрессирующих секреторную систему III типа, у пациента и/или профилактики или лечения инфекции, вызыванной бактериальными патогенами, экспрессирующими секреторную систему Ш типа. Согласно определенным вариантам осуществления настоящего изобретения, указанные бактериальные патогены выбраны из группы, включающей бактерии рода Salmonella, Shigella, Yersinia, Pseudomonas и Escherichia.
Кроме того, настоящее изобретение относится к новому способу использования бычьего лактоферрина для создания лекарственного средства, предназначенного для ингибирования адгезии бактериальных патогенов, экспрессирующих секреторную систему III типа, к поверхности клеток кишечника человека.
Дополнительно настоящее изобретение относится к новому способу использования бычьего лактоферрина для создания лекарственного средства, вызывающего преждевременный выброс EspB бактериальными патогенами, экспрессирующими секреторную систему III типа, а также вызывающего разрушение EspB бактериальных патогенов, экспрессирующих секреторную систему III типа.
Кроме того, настоящее изобретение относится к новому способу использования бычьего лактоферрина для создания лекарственного средства для ингибирования роста энтероадгезивных Е.coli в организме пациента, а также для профилактики или лечения инфекций, вызванных энтероадгезивными Е.coli.
Настоящее изобретение также относится к новому способу использования бычьего лактоферрина для создания лекарственного средства, предназначенного для ингибирования адгезии энтероадгезивных Е.coli к клеткам кишечника.
Кроме того, настоящее изобретение относится к новой энтеральной композиции или молочной смеси, содержащей бычьей лактоферрин, выделенный из цельного молока с низким числом соматических клеток. Согласно определенным вариантам осуществления настоящего изобретения, энтеральная композиция также содержит гликомакропептид казеина.
К преимуществам настоящего изобретения относится то, что заявленное соединение может быть легко введено в энтеральную композицию или молочную смесь для профилактики или лечения указанных заболеваний. Альтернативно, лекарственное средство, заявленное в соответствии с настоящим изобретением, может быть нанесено на поверхность пищевых продуктов, либо смешано с пищевыми продуктами для ингибирования роста бактериальных патогенов.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Для более полного понимания сущности настоящего изобретения ниже представлено более детальное его описание с ссылками на сопроводительные чертежи.
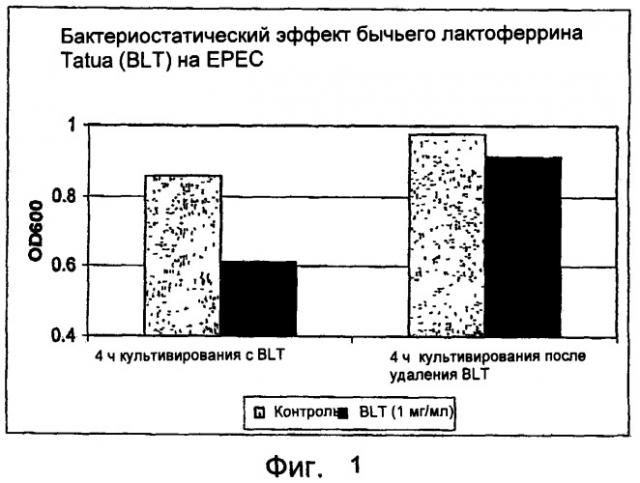
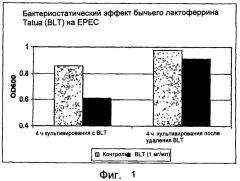
На фиг.1 показан бактериостатический эффект bLF на рост ЕРЕС.
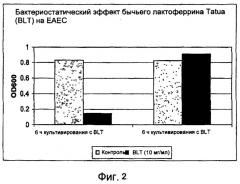
На фиг.2 показан бактериостатический эффект bLF на рост ЕАЕС.
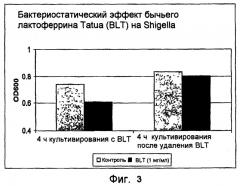
На фиг.3 показан бактериостатический эффект bLF на рост бактерий рода ShigeHa.
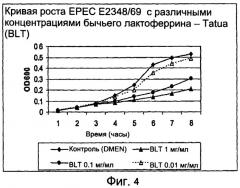
На фиг.4 показано влияние различных концентраций bLF на ингибирование роста ЕРЕС.
На фиг.5 показано влияние различных концентраций bLF на ингибирование роста ЕАЕС.
На фиг.6 показано влияние различных концентраций bLF на ингибирование роста бактерий рода Shigella.
На фиг.7 показано влияние насыщающих концентраций железа на способность bLF ингибировать рост ЕРЕС.
На фиг.8 показано влияние насыщающих концентраций железа на способность bLF ингибировать рост ЕАЕС.
На фиг.9 показано влияние насыщающих концентраций железа на способность bLF ингибировать рост бактерий рода Shigella.
На фиг.10 показан эффект различных композиций bLF на ингибирование роста ЕРЕС.
На фиг.11 показан эффект различных композиций bLF на ингибирование роста ЕАЕС.
На фиг.12 показан эффект различных композиций bLF на ингибирование роста бактерий рода Shigella.
На фиг.13 показана адгезия ЕАЕС к НЕр-2 клеткам в отсутствии bLF.
На фиг.14 показан эффект bLF на адгезию ЕАЕС к НЕр-2 клеткам.
На фиг.15 показан эффект насыщающих концентраций железа на способность bLF ингибировать адгезию ЕАЕС к НЕр-2 клеткам.
На фиг.16 представлена схема секреторной системы III типа.
На фиг.17 представлен вестерн-блот STEC HW 1 и STEC 306-7, отдельно и в присутствии бычьего и человеческого лактоферрина.
На фиг.18 представлен вестерн-блот STEC TWO 8023 и С600, отдельно и в присутствии бычьего и человеческого лактоферрина.
ДЕТАЛЬНОЕ ОПИСАНИЕ ПРЕДПОЧТИТЕЛЬНЫХ ВАРИАНТОВ ОСУЩЕСТВЛЕНИЯ НАСТОЯЩЕГО ИЗОБРЕТЕНИЯ
Далее представлено подробное описание наиболее предпочтительных вариантов осуществления настоящего изобретения, которые проиллюстрированы одним или несколькими примерами. Каждый из указанных примеров представлен с целью объяснения вариантов осуществления настоящего изобретения и ни в коем случае не ограничивает его сущность. В действительности, любому специалисту в данной области очевидно, что могут быть внесены различные изменения и модификации заявленного изобретения в пределах представленной ниже формулы изобретения. В частности, свойства и особенности одного варианта осуществления настоящего изобретения могут использоваться для описания или иллюстрации другого варианта осуществления настоящего изобретения.
Следовательно, подразумевается, что настоящее изобретение включает такие свои варианты и модификации, которые попадают под представленную ниже формулу изобретения. Другие объекты, характерные особенности и аспекты настоящего изобретения рассматриваются далее либо являются очевидными из представленного ниже детального описания. Любому специалисту в данной области очевидно, что настоящее обсуждение представляет собой лишь описание примерных вариантов осуществления настоящего изобретения без ограничения всей широты его сущности.
Термин "пробиотик" относится к микроорганизму, который оказывает благоприятный эффект на здоровье хозяина.
Термин "пребиотик" обозначает неперевариваемый пищевой ингредиент, который стимулирует рост и/или активность пробиотиков.
Термин "субъект" обозначает любое млекопитающее, предпочтительно человека. Согласно определенным вариантам осуществления настоящего изобретения субъект нуждается в профилактики или лечении инфекции, вызванной бактериями из семейства Enterobacteriaceae или бактериальными патогснами, экспрессирующими TTSS. Согласно другим вариантам осуществления настоящего изобретения субъект нуждается в ингибировании роста бактериальных патогенов, экспрессирующих TTSS. Согласно определенным вариантам осуществления настоящего изобретения субъект нуждается в ингибировании роста ЕАЕС или в профилактики или лечении инфекции, вызванной ЕАЕС. Согласно специфическим вариантам осуществления настоящего изобретения субъект является ребенком или новорожденным. Согласно некоторым вариантам осуществления настоящего изобретения субъектом является новорожденный ребенок, который не получает грудного вскармливания.
Термин "ингибирование" обозначает уменьшение, ограничение или блокирование роста или активности одного или более организма.
Используемый здесь термин "лечение" обозначает улучшение течения заболевания, патологического состояния или подавление симптома заболевания или патологического состояния.
Термин "профилактика" обозначает прекращение или предотвращение развития заболевания, патологического состояния или симптома заболевания или патологического состояния путем какого-либо действия.
Термин "эффективное количество" относится к количеству, при введении которого происходит ингибирование роста патогенных организмов или улучшение течения заболевания или патологического состояния или подавление симптомов заболевания или патологического состояния.
Термин "инфекция" обозначает инвазию и размножение патогенных микроорганизмов в организме субъекта, что приводит к существенному повреждению тканей и последующему развитию заболевания посредством различных клеточных или токсических механизмов.
Термин "число соматических клеток" обозначает измеренное число белых кровяных клеток (лейкоцитов) в молоке.
Термин "энтеральная композиция" обозначает композицию для энтерального введения субъекту, предпочтительно путем приема внутрь.
Используемый здесь термин "молочная смесь" относится к композиции, которая полностью удовлетворяет питательные потребности ребенка и представляет собой заменитель женского молока. В США состав молочных смесей регламентируется постановлениями федерального агентства 21 C.F.R., Разделы 100, 106 и 107. Указанные постановления регулируют макронутриентный, витаминный, минеральный состав молочной смеси, а также уровни других компонентов для того, чтобы наилучшим образом воспроизвести свойства женского грудного молока.
В соответствии с настоящим изобретением заявлен новый способ использования бычьего лактоферрина (bLF) для создания лекарственного средства, предназначенного для ингибирования роста бактерий семейства Enterobacteriaceae. Бычий лактоферрин представляет собой гликопротеин, который относится к семейству белков транспортеров железа или трансферринов. Его выделяют из бычьего молока, в котором он является компонентом сыворотки.
Существуют значительные различия аминокислотной последовательности, характера гликозилирования и железосвязывающей способности бычьего и человеческого лактоферрина. Кроме того, выделение бычьего лактоферрина из цельного кровьего молока имеет множество последовательных этапов, которые, в идеале, должны приводить к приобретению композицией бычьего лактоферрина определенных физико-химических свойств. Бычий и человеческий лактоферрин также отличаются по их способности связываться с рецептором лактоферрина, обнаруживаемым в кишечнике человека. Специфически, известно, что бычий лактоферрин обладает слабой способностью связываться с рецептором лактоферрина в кишечнике человека. Поскольку человеческий и бычий лактоферрин обладают такими разными свойствами, результаты, достигнутые в настоящем изобретении, оказались неожиданными и впечатляющими.
Как обсуждалось выше, считается, что основной механизм бактериостатического действия человеческого и, по-видимому, бычьего лактоферрина заключается в депонировании железа, необходимого для роста патогенов. Однако в настоящем изобретении было доказано, что бактериостатический эффект бычьего лактоферрина не зависит от насыщения железом. Таким образом, бактериостатический эффект бычьего лактоферрина обусловлен, по-видимому, другим механизмом, чем эффект человеческого лактоферрина.
Существует несколько исследований, направленных на изучение бактериостатических эффектов bLF. Например, в одном исследовании было показано, что bLF оказывает бактериостатичеекое действие на пролиферацию различных видов Clostridium у мышей. Teraguchi, S., et al., Bacteriostatic Effect of Orally Administered Bovine Lactoferrin on Proliferation of Clostridium Species in the Gut of Mice Fed Bovine Milk, Appl. Environ. Microbiol. 61:501-506 (1995). Также было показано, что bLF оказывает бактериостатичеекое действие на кишечные бактерии семейства Enterobacteriacea у мышей. Teraguchi, S., et al., The Bacteriostatic Effect of Orally Administered Bovine Lactoferrin on Intestinal Enterobacteriacea of SPP Mice Fed Bovine Milk, Biosci. Biotech. Biochem. 58:482-487 (1994). Несмотря на то, что основными бактериями семейства Enterobacteriacea, выделенными во время указанного исследования, были Е.coli, настоящее исследование не предоставляет доказательств того, что ингибирующий эффект bLF на рост бактериальных патогенов, экспрессирующих секреторную систему III типа, распространяется на специфические классы Е.coli, в частности на ЕАЕС.
В противоположность результатам описанных выше исследований, аналогичное исследование показало, что bLF не оказывает ингибирующего эффекта на рост энтеротоксигенных E.coli. Sarelli, L., et al., Lactoferrin to Prevent Experimental Escherichia Coli Diarrhea in Weaned Pigs, Intl. J. Appl. Res., статья доступна на сайте http://www.iarvm.com/articles/Vol1Iss4/Heinonen.htm. Исследование также показало, что не происходит существенного уменьшения случаев экспериментально-индуцированной диареи или количества клеток гемолитических Е.coli в фекалиях, Id.
Некоторые патенты также касаются эффектов bLF на различные бактерии и/или заболевания. Например, заявка на патент США No. 20030203839 Kuzel., et al. относится к использованию bLF для лечения прогрессирующего синдрома системного воспалительного ответа (SIRS) и препятствия его развития в сепсис, тяжелый сепсис, септический шок и полиорганную недостаточность.
Заявки на патент США No. 20040043922 от Naidu и 20030229011 от Braun относятся к способу уменьшения микробной контаминации пищевых продуктов. Указанный способ заключается в обработке пищевых продуктов иммобилизованным лактоферрином. Поскольку настоящее изобретение полезно для лечения инфекций, вызванных ЕРЕС и Shigella spp., для его реализации необходимо, чтобы иммобилизованный лактоферрин был эффективным.
Заявка на патент США No. 20040152624 от Varadhachary et al., относится к способу лечения бактериемии, заключающемуся во введении эффективного количества bLF пациенту. Согласно данной ссылке, заявленный способ также приводит к уменьшению уровня циркулирующих бактерий. Однако ни в одной из указанных ссылок не раскрываются преимущества bLF для воздействия на бактериальные патогены, экспрессирующие секреторную систему III типа. Аналогично, ни в одной из указанных заявок не отражены преимущества bLF в отношении ЕАЕС. Таким образом, настоящее изобретение имеет ряд преимуществ перед указанными выше заявками.
Согласно определенным вариантам осуществления настоящего изобретения бактерии семейства Enterobacteriaceae относятся бактерии вида Е.coli и рода Shigella. Согласно другому варианту осуществления настоящего изобретения семейство Enterobacteriacea включает энтеропатогенные Е.coli, энтероадгезивные Е.coli и бактерии рода Shigella. Согласно еще одному варианту осуществления настоящего изобретения семейство Enterobacteriaceae может включать E.coli Е2348/69, E.coli O42 и Shigella flexneri M90T. Штаммы E.coli E2348/69, Е.coli O42 и Shigella flexneri M90T являются особенно патогенными, поскольку вызывают многие опасные инфекции у новорожденных и детей раннего возраста.
Согласно другим вариантам осуществления настоящего изобретения рост бактериальных патогенов, экспрессирующих секреторную систему III типа, ингибируется эффективным количеством bLF. Согласно определенным вариантам осуществления настоящего изобретения к бактериальным патогенам, экспрессирующим секреторную систему III типа, относятся Salmonella, Shigella, Yersinia, Pseudomonas и Escherichia. Согласно определенному варианту осуществления настоящего изобретения к патогенам рода Escherichia относятся энтеропатогенныс Е.coli или энтерогеморрагические Е.coli. К ЕРЕС относятся многие штаммы Е.coli, включая Е.coli Е2348/69, O26, O55, O157, O111, O114:Н2, O119:Н6, O126, O127:Н6, O128:Н2 и O142:Н6. Аналогично, к ЕНЕС относятся штаммы STEC TWO 8023, STEC HW1, STEC 306-7, O157:H7, O111:H8, O104:Н21, O111, O26 или O26:Н11.
Согласно специфическому варианту своего осуществления изобретение направлено на профилактику или лечение инфекций, вызванных бактериями семейства Enterobacteriacea у пациента. К указанным инфекциям относятся все инфекции, известные специалистам в данной области, которые вызываются бактериями семейства Enterobacteriacea. Более специфично, к указанным инфекциям относятся все инфекции, известные специалистам в данной области, которые вызываются энтеропатогенными Е.coli, энтероадгезивными Е.coli или Shigella flexneri. К указанным инфекциям также относятся инфекции, известные специалистам в данной области, вызванные бактериальными патогенами, экспрсссирующими секреторную систему III типа. Согласно одному варианту осуществления настоящего изобретения к указанным инфекциям относятся инфекции мочеполового тракта, неонатальный менингит, перитонит, шигеллез или любая инфекции или заболевания желудочно-кишечного тракта.
Согласно другому варианту осуществления настоящего изобретения рост патогенных бактерий ингибируется без сопутствующего увеличения уровней токсинов, продуцируемых бактериями. Известно, что ингибирование роста является триггерным механизмом для индукции бактериофагов, которые несут Stx гены. Известно также, что многие антибиотики увеличивают продукцию токсинов путем индукции фаголитического цикла. Приятной неожиданностью оказалось, что настоящее изобретение не индуцирует усиленную продукцию токсинов при одновременном ингибировании роста бактерий. Таким образом, настоящее изобретение может ингибировать рост патогенных бактерий без сопутствующего увеличения продукции токсинов. Это неожиданное преимущество обсуждается ниже в Примере 4.
Согласно определенным вариантам осуществления настоящего изобретения bLF выделяют из цельного молока. Согласно другим определенным вариантам осуществления настоящего изобретения bLF имеет низкое число соматических клеток. Согласно некоторым вариантам осуществления настоящего изобретения bLF выделяют из коровьего молока и он имеет низкое число соматических клеток.
Не ограничиваясь какой-либо одной теорией, считается, что bLF, выделенный из цельного молока, имеет меньшее количество первично связанного липополисахарида (LPS), чем bLF, выделенный из сухого молока. Кроме того, считается, что bLF с низким числом соматических клеток имеет меньше первично-связанного LPS. Поскольку описанная форма bLF имеет меньше первично-связанного LPS, на его поверхности доступно больше сайтов связывания. Считается, что это способствует связыванию bLF с нужными сайгами и прерывает инфекционный процесс.
bLF, который используется согласно определенным вариантам осуществления настоящего изобретения, может представлять собой любой bLF, выделенный из цельного молока и/или имеющий низкое число соматических клеток. Например, указанный bLF доступен из Tatua Co-operative Dairy, Co., Ltd., in Morrinsville, New Zealand.
Согласно одному варианту осуществления настоящего изобретения ингибирующий эффект bLF на рост бактерий является дозозависимым. При увеличении дозы bLF ингибирующий эффект bLF также возрастает.
Согласно другому варианту осуществления настоящего изобретения ингибирующий эффект bLF на рост бактерий зависит от концентрации железа, которое присутствует в кишечнике пациента. bLF, заявленный в соответствии с настоящим изобретением, теряет свой бактериостатический эффект после насыщения железом.
Согласно другому варианту осуществления настоящего изобретения bLF оказывает ингибирующий эффект на рост бактериальных патогенов, имеющих секреторную систему III типа, а также на ЕАЕС, у которых нет секреторной системы III типа. Настоящее изобретение наглядно демонстрирует, что, несмотря на то что bLF является эффективным в отношении бактериальных патогенов, экспрессирующих секреторную систему III типа, он не является специфичным именно для этой системы. bLF также эффективно ингибирует рост патогенов, не имеющих TTSS. Не ограничиваясь какой-либо теорией, считается, что заякоренные в мембране вирулентные белки ЕАЕС, отвечающие за адгезию, могут повреждаться при взаимодействии bLF с бактериальной поверхностью. Выявлено несколько белков адгезии, которые могут обусловливать влияние bLF на адгезию ЕАЕС, включая AAF/I и AAF/II. Таким образом, bLF может защищать новорожденных от развития инфекций желудочно-кишечного тракта, препятствуя прикреплению ЕАЕС к кишечному эпителию и, таким образом, защищая его от колонизации патогенов.
Согласно определенному варианту осуществления настоящего изобретения bLF может ингибировать адгезию ЕАЕС к клеткам кишечника. Согласно данному варианту осуществления настоящего изобретения на указанный антиадгезивный эффект не влияет концентрация железа в кишечнике пациента.
Эффективное количество bLF, заявленное в соответствии с настоящим изобретением, может находиться от 0.001 мг до приблизительно 100 г в день. Согласно одному варианту осуществления настоящего изобретения эффективное количество bLF может составлять от 0.1 мг до 10 г в день. Согласно еще одному варианту осуществления настоящего изобретения эффективное количество bLF может составлять от 10 мг до прибл