Питательная среда для культивирования бактерий
Иллюстрации
Показать всеИзобретение относится к биотехнологии и может быть использовано в научно-исследовательской и практической работе для бактериологической диагностики ряда условно патогенных микроорганизмов. Питательная среда содержит отвар из молок лососевых рыб, хлорид натрия, дрожжевой экстракт, глюкозу, микробиологический агар и дистиллированную воду. Изобретение позволяет расширить ассортимент питательных сред и упростить способ получения питательной среды. 2 н.п. ф-лы, 3 табл.
Реферат
Изобретение относится к общей и медицинской микробиологии и может быть использовано как в научно-исследовательской, так и в практической работе для культивирования широкого круга микроорганизмов (бактерий рода Listeria, рода Yersinia - Y. pseudotuberculosis, Y. enterocolitica, Escherihia coli, Shigella flexneri, Salmonella typhimureum, Staphylococcus aureus и т.д.).
В настоящее время существует достаточное количество плотных питательных сред для культивирования микроорганизмов. Как правило, питательная среда состоит из белковой и углеводной основы, а также дополнительных компонентов, которые усиливают рост микроорганизмов: витамины, аминокислоты, минеральные компоненты.
Питательные свойства плотной питательной среды в основном зависят от состава белковой основы. Для их приготовления используются, как правило, белки животного происхождения - мясо (преимущественно говяжье), рыба, мясо-костная мука, казеин, заменители полноценного мяса - плацента, кровь домашних животных, дрожжи, белки растительного происхождения (соевые бобы, горох, ячмень).
Известны питательные среды для культивирования микроорганизмов, в том числе и условно патогенных бактерий рода Listeria, в составе которых в качестве белковой основы используют как бульоны, так и различные гидролизаты:
1) питательная среда для культивирования бактерий рода Listeria, состоящая из белкового компонента, в качестве которого используются мясопептонный бульон, хлорид натрия и вода (патент Франции №2671516, кл C12Q 1/04);
2) питательная среда для культивирования бактерий рода Listeria, состоящая из белкового компонента, в качестве которого используются ферментативный гидролизат крови, натрия хлорид, глюкоза, агар микробиологический, мясная вода (патент РФ №2118363, МПК 6 C12N 1/04).
Недостатком этих питательных сред является недостаточный аминокислотный состав, который приводит к неравномерному росту на них микроорганизмов, в том числе и бактерий, относящихся к роду Listeria.
Наиболее близкими к заявляемому решению являются:
1) ГРМ-АГАР (Питательный агар для культивирования микроорганизмов, г.Оболенск, патент №2089609), состоящий из белковой основы, в качестве которой используют (г/л): панкреатический гидролизат рыбной муки (24,0), панкреатический гидролизат казеина (10,0), натрий хлористый (4,0), агар (12,0±2,0), вода - остальное.
2) Среда №1 ГРМ (Питательная среда для культивирования и подсчета широкого спектра аэробных бактерий, в том числе и бактерий рода Listeria, которым для более эффективного размножения необходима глюкоза, состоящая из белковой основы, в качестве которой используют (г/л): панкреатический гидролизат рыбной муки (15,0), панкреатический гидролизат казеина (10,0), натрий хлористый (3,5), дрожжевой экстракт (2,0), глюкоза (1,0), агар (10,0±2,0), вода остальное (Каталог «Бактериологические среды для санитарной и клинической микробиологии, биотехнологии и контроля лекарственных средств. Оболенск, 1999. 4-е издание, 56 с.).
Недостатком этих питательных сред является их многокомпонентность. В качестве белковой основы используются белковые гидролизаты, приготовление которых достаточно трудоемко, кроме того, данные питательные среды имеют недостаточный аминокислотный состав, который приводит к неравномерному росту на них микроорганизмов, в том числе и бактерий, относящиеся к роду Listeria.
Задача, решаемая изобретением, - создание универсальной питательной среды для широкого спектра бактерий, в том числе и бактерий рода Listeria, за счет содержания в питательной среде постоянного аминокислотного состава, расширение сырьевой базы для приготовления белковой основы питательной среды, удешевление ее за счет использования отходов рыбного производства, доступность в применении практическим лабораториям.
Поставленная задача решается следующим образом.
Питательная среда для культивирования бактерий, содержащая белковую основу, микробиологический агар, хлорид натрия, дистиллированную воду, согласно изобретению дополнительно содержит дрожжевой экстракт, а в качестве белковой основы отвар молок лососевых рыб при следующем соотношении, г/л:
- отвар из молок лососевых рыб - 6,0
- микробиологический агар 10,0±2,0
- хлорид натрия - 5,0
- дрожжевой экстракт - 4,0-10,0
- дистиллированная вода - остальное
- рН среды - 7,2-7,4,
при этом при культивировании бактерий рода Listeria питательная среда дополнительно содержит глюкозу в количестве 1 г/л.
Приготовление питательной среды для культивирования широкого спектра бактерий как условно-патогенных, так и патогенных на основе отвара из молок лососевых рыб осуществляют следующим образом.
Сначала готовят отвар из молок лососевых. К 500 г предварительно измельченных молок лососевых рыб добавляют водопроводную воду в соотношении 1:2 и кипятят 1 час. Полученный отвар фильтруют, стерилизуют давлением 1 атм 30 мин.
Отвар можно готовить впрок, хранить в бытовом холодильнике при температуре +4-8°С от 30 дней и более или высушить («сухой» отвар), а затем использовать по мере необходимости.
«Сухой» отвар из молок рыб можно хранить в течение длительного времени в бытовом холодильнике (+4-8°С) или при комнатной температуре, его можно транспортировать в другие регионы, при этом его качество сохраняется.
Для приготовления заявляемой питательной среды берут 4,0-10,0 г дрожжевого экстракта, 5,0 г хлорида натрия, 10,0-12,0 г микробиологического агара, 6,0 г «сухого» отвара из молок лососевых рыб или 600,0-750,0 мл жидкого отвара из молок лососевых и добавляют до 1 л дистиллированной воды. Смесь перемешивают, общеизвестным способом доводят рН среды до 7,2-7,4 при помощи 20% NaOH. Полученную питательную среду стерилизуют при 1 атм в течение 30 минут.
Готовая стерильная среда, разлитая в чашки Петри, имеет желтоватый цвет, прозрачная или слегка опалесцирует.
Использование в предлагаемой питательной среде в качестве белковой основы - отвара из молок лососевых рыб обуславливает не уступающий прототипу рост микроорганизмов за счет содержания в нем достаточного количества аминокислот и микроэлементов. Молоки рыб - доступный, недорогой источник сырья. Они содержат нуклеопротеиды, состоящие из нуклеиновых кислот и простейших белков - протаминов и гистонов. Протамины и гистоны построены из аминокислот, среди которых преобладают аргинин, лизин и гистидин; в состав протаминов входят тирозин, триптофан, серин, валин и пролин, а в состав гистонов - серин, валин, аланин, фенилаланин и тирозин. В молоках ряда рыб присутствуют такие водорастворимые витамины: В12 в количествах от 7 до 50 мкг %; B1 (тиамин) - 50-185 мкг %; В2 (рибофлавин) - 40-600 мкг %; Вс (фолиевая кислота) - 125-1300 мкг %; РР (никотиновая кислота) - 1,1-5,7 мг % и др. (В.П.Зайцев, И.В.Кизеветтер, Л.Л.Лагунов и др. «Технология рыбных продуктов. М.: Изд-во «Пищевая промышленность», 1965, с.73-74). Химический состав молок кеты 6-й стадии зрелости отражен в табл.№1 (Ю.И.Касьяненко, Т.Н.Пивненко. «Сравнительные физико-химические характеристики низкомолекулярной дезоксирибонуклеиновой кислоты (ДНК) из морских гидробионтов» - «Известия ТИНРО», 1999, т.125, с.152-158).
| Таблица 1 | |
| Химический состав молок кеты 6-й стадии зрелости, % | |
| Наименование вещества. | Содержание |
| Дезоксирибонуклеиновая кислота (ДНК) | 12,0 |
| Рибонуклеиновая кислота (РНК) | 0,3 |
| Кислоторастворимые продукты | 0,1 |
| Белок | 8,7 |
| Вода | 78,5 |
| Другие | 0,4 |
Указанный технический результат при осуществлении изобретения достигается за счет того, что питательная среда для культивирования различного спектра бактерий согласно изобретению содержит:
1) в качестве белковой основы и минеральных веществ - отвар (жидкий или сухой) из молок лососевых рыб,
2) в качестве источника витаминов группы В - дрожжевой экстракт,
3) для обеспечения изотоничности среды - хлорид натрия.
Для культивирования бактерий, относящихся к роду Listeria, дополнительно в качестве углеводной основы используется глюкоза в количестве 1,0 г.
Приготовление плотной питательной среды на основе сухого отвара молок лососевых рыб осуществляют следующим образом.
К 4,0-10,0 г дрожжевого экстракта, 1,0 г глюкозы, 5,0 г хлорида натрия, 10,0±2,0 г микробиологического агара вносим 6,0 г «сухого» или 600,0-750,0 мл жидкого отвара из молок лососевых рыб и добавляют до 1 л дистиллированную воду. Смесь перемешивают, общеизвестным способом доводят рН среды до 7,2-7,4 при помощи 20% NaOH. Полученную питательную среду стерилизуют при 0,5 атм в течение 20 минут.
Готовая стерильная среда, разлитая в чашки Петри, имеет желтоватый цвет, прозрачная или слегка опалесцирует.
Масса «сухого» отвара или жидкого из молок лососевых рыб была определена экспериментально исходя из необходимого количества аминокислот в питательной среде. При этом существенными признаками предлагаемой плотной питательной среды следует считать ее качественный и количественный состав, т.к. величины содержания компонентов в заявляемой питательной среде являются оптимальными и обусловливают относительную сбалансированность стоимости среды с ее ростовыми характеристиками. Выход за пределы заявленных значений компонентов приводит либо к перерасходу сырья, либо к снижению ее ростовых свойств.
Для определения ростовых свойств заявляемой среды использовали тест-штаммы бактерий из коллекции ГУ НИИ эпидемиологии и микробиологии СО РАМН (г.Владивосток): 1) бактерии рода Listeria - L. monocytogenes NCTC 10527 (4b серовариант); L. ivanovii NCTC 11846; L. innocua SLCC 3379; L. seeligeri SLCC 5921; L. welschimeri; L. grayi 17; 2) бактерии рода Yersinia - Y. pseudotuberculosis 2781; Y. enterocolitica 164; 3) Escherihia coli; 4) Staphylococcus aureus; 4) Shigella flexneri 73.
Для определения показателей чувствительности и скорости роста заявляемой питательной среды суточные культуры тест-штаммов, выращенные на скошенном агаре, смывали физиологическим раствором NaCl, доводили под оптический стандарт ГИСК им. Тарасовича, соответствующий разведению 10 ед. мутности. Из исходной стандартной взвеси каждого тест-штамма готовили 10-кратные разведения путем последовательного переноса не менее 0,5 мл культуры в 8 пробирок с 4,5 мл физиологическим раствором и из разведений 103 КОЕ/мл и 102 КОЕ/мл по 0,1 мл взвеси каждого тест-штамма вносили в 3 чашки с экспериментальной средой. Взвесь культуры распределяли шпателем по поверхности агара. Чашки с посевами помещали на 24-48 ч в термостат при 37°С. Учет результатов проводили ежедневно.
Одновременно определяли биологические свойства культур, выросших на чашках с заявляемой средой (определение формы, характера роста колоний, их диаметр, морфологию культур, подвижность, биохимические свойства, гемолитическую и лецитиназную активность, определение каталазы) с изучением не менее 3 колоний с каждой чашки (согласно Методическим рекомендациям к контролю питательных сред по биологическим показателям. Москва, 1980).
В качестве контрольных сред использовали ГРМ-АГАР (Питательный агар для культивирования микроорганизмов, г.Оболенск, патент №2089609) и Среда №1 ГРМ (Питательная среда для культивирования и подсчета широкого спектра аэробных бактерий», г.Оболенск).
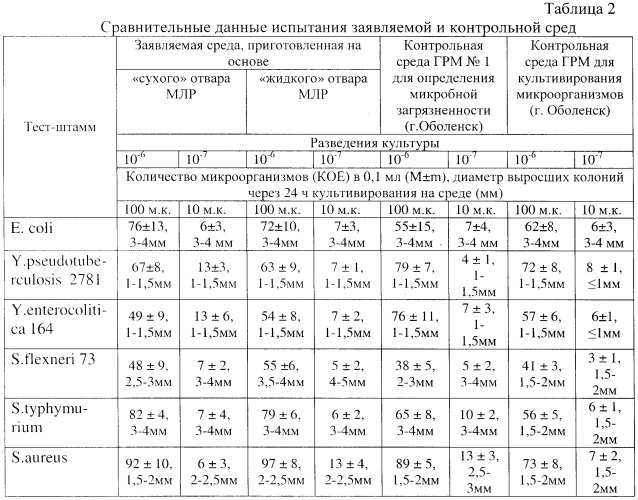
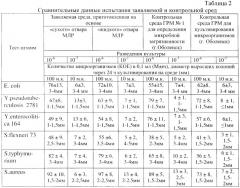
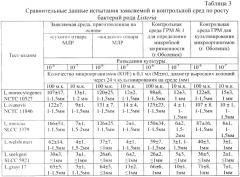
Результаты по количеству выросших колоний тест-штаммов на заявляемой среде представлены в табл.2, 3.
Как видно из данных табл.2, 3, заявляемая плотная питательная среда, приготовленная на основе жидкого или «сухого» отвара молок лососевых рыб, не уступала контрольным по количеству колоний, выросших на чашке через 24±2 ч инкубации посевов, а также обладала высокой чувствительностью (10-7), поскольку позволяла обнаружить рост колоний при посеве единичных микробных клеток. Изучались биологические свойства выросших колоний тест-штаммов на заявляемой среде (разных основах) после их культивирования на ней 24 и 48 ч, которые не отличались от контролей.
В табл.2 показано, что заявляемая питательная среда универсальна и на ней могут расти бактерии как патогенные Escherihia coli; Staphylococcus aureus; Shigella flexneri 73, так и условно-патогенные Yersinia - Y. pseudotuberculosis 2781; Y. enterocolitica 164.
Изучение показателя эффективности заявляемой питательной среды для культивирования листерий проводили на расширенном наборе штаммов, принадлежащих к разным видам Listeria. Как видно из данных таблицы 3, количество листерий, выросших на заявляемой среде, составило в среднем 100 м.к./мл (для видов L.monocytogenes, Livanovii, L.innocua). Отдельные виды листерий росли лучше (L.monocytogenes, L.ivanovii, L.innocua), другие хуже (L.welschimeri, L.grayi, L.seeligeri). На заявляемой питательной среде из молок лососевых рыб (МЛР) листерии формировали прозрачные с перламутровым оттенком, круглые с ровными краями колонии диаметром 2-4 мм.
При определении морфологии листерий в мазках отмечались типичные мелкие грамположительные палочки или овоидной формы клетки, идентичные с контрольным тест-штаммом листерий.
Как видно из таблицы 2, ростовые свойства тест-штаммов бактерий в заявляемой питательной среде, приготовленной на основе как жидкого, так и «сухого» отвара из молок рыб, идентичны.
Заявленное техническое решение соответствует критерию «изобретательский уровень» в виду того, что для приготовления плотной питательной среды для культивирования бактерий в качестве белковой основы используется жидкий или «сухой» отвар, приготовленный из молок лососевых рыб.
Существенным отличием предлагаемого технического решения является:
- возможность использования предлагаемой среды для культивирования широкого спектра бактерий как условно-патогенных, так и патогенных;
- замена дорогостоящей питательной среды дешевой легкодоступной питательной средой, приготовленной на основе отвара из молок лососевых рыб.
В результате этого достигается:
- удешевление питательной среды;
- расширение сырьевой базы для ее приготовления.
Заявляемое техническое решение соответствует критерию «промышленная применимость», так как среда проста в изготовлении и ее можно готовить как в любой микробиологической лаборатории, так и в промышленном масштабе.
Примеры конкретного получения питательной среды.
Пример 1
Для культивирования бактерий рода Yersinia берут питательную среду следующего состава, г/л:
«сухой» отвар из молок рыб - 6,0
микробиологический агар - 10,0
дрожжевой экстракт - 5,0
хлорид натрия - 5,0
дистиллированная вода - до 1 л
рН среды 7,2-7,4
Смесь перемешивают. Полученную питательную среду разливают по емкостям, общеизвестным методом при помощи 20% NaOH в каждой емкости питательной среды доводят рН до 7,2-7,4, а затем стерилизуют при 1 атм в течение 30 минут.
Готовая стерильная среда, разлитая в чашки Петри, имеет желтоватый цвет, прозрачная или слегка опалесцирует.
Культивирование бактерий рода Yersinia проводили по вышеуказанной методике. Полученные результаты отражены в табл.2.
Пример 2
Для культивирования бактерий рода Listeria берут питательную среду следующего состава, г/л:
«сухой» отвар из молок лососевых рыб - 6,0
микробиологический агар - 11,0
дрожжевой экстракт - 5,0
глюкоза - 1,0
хлорид натрия - 5,0
дистиллированная вода до 1 л
рН среды 7,2-7,4
Смесь перемешивают. Полученную питательную среду разливают по емкостям, общеизвестным методом при помощи 20% NaOH в каждой емкости питательной среды доводят рН до 7,2-7,4, а затем стерилизуют при 0,5 атм в течение 20 минут.
Готовая стерильная среда, разлитая в чашки Петри, имеет желтоватый цвет, прозрачная или слегка опалесцирует.
Культивирование бактерий, относящихся к роду Listeria, проводили по вышеуказанной методике. Полученные результаты отражены в табл.3.
Пример 3
Питательную среду готовят аналогично примеру 1, однако среду готовили на основе жидкого отвара из молок рыб, г/л:
Микробиологический агар - 12,0
хлорид натрия - 5,0
глюкоза - 1,0
Дрожжевой экстракт - 10,0
Жидкий отвар из молок лососевых рыб - 600,0
Дистиллированная вода - остальное
рН - 7,2-7,3
Культивирование бактерий, относящихся к роду Listeria, проводили по вышеуказанной методике. Полученные результаты отражены в табл.3.
Пример 4
Питательную среду готовят аналогично примеру 1, однако среду готовили на основе жидкого отвара из молок рыб, г/л:
Микробиологический агар - 10,0 NaCl - 5,0
Глюкоза - 1,0
Дрожжевой экстракт - 7,0
Жидкий отвар из молок лососевых рыб - 750,0
Дистиллированная вода - остальное
рН 7,2-7,3
Культивирование бактерий, относящихся к роду Escherihia coli, проводили по вышеуказанной методике. Полученные результаты отражены в табл.2.
Питательная среда разработана на основе дешевого отечественного сырья, проста в изготовлении, значительно дешевле среды прототипа. Для ее приготовления можно использовать некондиционные молоки рыб 5-6 степени зрелости, т.е. текучие, которые нельзя использовать для приготовления пищевых продуктов. При этом ее ростовые свойства не уступают контрольным средам, а технология приготовления значительно проще, что позволяет расширить сырьевую базу и удешевить питательную среду для культивирования бактерий.
1. Питательная среда для культивирования бактерий, содержащая белковую основу, микробиологический агар, хлорид натрия, дистиллированную воду, отличающаяся тем, что питательная среда дополнительно содержит дрожжевой экстракт, а в качестве белковой основы отвар из молок лососевых рыб при следующем соотношении, г/л:
| отвар из молок лососевых рыб | 6,0 |
| микробиологический агар | 10,0±2,0 |
| хлорид натрия | 5,0 |
| дрожжевой экстракт | 4,0-10,0 |
| дистиллированная вода | остальное |
| рН среды | 7,2-7,4. |
2. Питательная среда по п.1, отличающаяся тем, что питательная среда дополнительно содержит глюкозу в количестве 1,0 г/л.