Способ пластики обширных дефектов диафрагмы
Иллюстрации
Показать всеИзобретение относится к области медицины, а именно к торакальной хирургии, и может быть использовано при реконструктивно-восстановительных операциях на диафрагме, в частности при пластическом замещении дефектов после обширной резекции диафрагмы. Сущность способа состоит в закрытии дефекта диафрагмы имплантатом, который фиксируют к диафрагме и/или грудной стенке по всему периметру. При этом дефект диафрагмы закрывают сетчатым имплантатом, выступающим за края дефекта диафрагмы не менее чем на 20 мм, с размерами ячейки 100-250 мкм, сплетенным по текстильной технологии из сверхэластичной никелидотитановой нити диаметром 50-60 мкм, и фиксируют без натяжения к диафрагме и/или грудной стенке узловыми швами сверхэластичной никелидотитановой нитью диаметром 50-60 мкм. Имплантат фиксируют по всему периметру П-образными узловыми швами, швы завязывают поверх диафрагмы. Причем к грудной стенке фиксируют П-образными узловыми швами перикостально с формированием узла на коже, а внутренний и наружный края имплантата формируют в виде дупликатуры. Использование данного изобретения позволяет уменьшить количество послеоперационных осложнений, повысить надежность пластического закрытия дефекта диафрагмы. 6 ил.
Реферат
Изобретение относится к медицине, а именно к торакальной хирургии, и может быть использовано при реконструктивно-восстановительных операциях на диафрагме, в частности при пластическом замещении дефектов после обширной резекции диафрагмы.
Известен способ пластики дефекта диафрагмы путем сопоставления и сшивания краев дефекта узловыми швами в различных вариантах [1]. Недостатки способа связаны с неизбежным натяжением швов после сведения краев диафрагмы и риском их прорезывания с развитием несостоятельности шва и диафрагмальной грыжи. Область применения его ограничена. Способ невыполним при обширных дефектах, когда невозможно сопоставить края диафрагмы.
Известен способ замещения дефекта диафрагмы путем перемещения и тампонады области дефекта прилежащими внутренними органами (легкое, печень, селезенка, сальник) [2, 3]. Недостатки связаны с транспозицией внутренних органов, что приводит к нарушению их функции. Способ не всегда выполним после комбинированных онкологических вмешательств, сопровождающихся удалением и резекцией этих органов. Кроме того, известный способ травматичен, увеличивает продолжительность операции, при повышении внутрибрюшного давления не предупреждает пролабирование и ущемление внутренних органов с развитием ранних и поздних послеоперационных осложнений.
Известны способы пластики обширного дефекта диафрагмы за счет выкраивания и перемещения аутотрансплантата: свободного лоскута широкой фасции бедра, кожного и мышечно-плеврального лоскутов, лоскута широчайшей мышцы спины, прямой, поперечной и наружной косой мышц живота на питающей ножке [4, 5, 6]. Однако свободные лоскуты лишены кровоснабжения, лизируются, теряют прочностные свойства в ближайшие сроки после операции. Способы, связанные с мышечными и комбинированными из различных анатомических структур (мышечно-плевральный, фасциально-мышечно-апоневротический и т.п.) лоскутами на питающей ножке, имеют существенные недостатки: технически сложны в исполнении, травматичны, оперативные вмешательства продолжительны. Также возможен тромбоз сосудистой ножки с развитием нарушения питания аутотрансплантата и последующей его резорбцией, инфицированием области вмешательства. В отдаленные сроки после операции мышечные лоскуты атрофируются, что может привести к рецидиву диафрагмального дефекта. Кроме того, создается анатомо-функциональный или косметический дефект в донорской зоне, пластическое восстановление их также может быть необходимо.
Известны способы пластики дефекта диафрагмы консервированными гомо- и ксенотрансплантатами: лиофилизированным бычьим перикардом, твердой мозговой оболочкой [6]. К недостаткам относят низкую устойчивость к инфекции и недостаточную биосовместимость трансплантата и, как следствие, лизирование и потерю его прочностных свойств в отдаленные сроки после операции.
Известны способы пластики обширного дефекта диафрагмы аллотрансплантатами: сетками из тефлона, терилена, ивалона, поликапромида (Ампоксен), полипропилена (Prolene), мерсилена (Dacron), лавсана (Marlex) [7, 8]. Недостатком способов является недостаточная биохимическая и биомеханическая совместимость имплантатов. Вследствие этого после врастания соединительной ткани и ее созревания они становятся ригидными, деформируются и сокращаются, что затрудняет экскурсию диафрагмы, нарушает биомеханику внешнего дыхания и может привести к рецидиву диафрагмальной грыжи. Кроме того, эти аллотрансплантаты неустойчивы к инфекции, нередко способствуют длительному существованию экссудативного плеврита, а в случае развития гнойных послеоперационных осложнений поддерживают воспаление.
Наиболее широко распространенным и взятым за прототип является способ пластики обширного дефекта диафрагмы политетрафторэтиленом (Gore-tex) [9]. Недостатком способа является недостаточная биохимическая и биомеханическая совместимость имплантата. Политетрафторэтилен инкапсулируется толстой капсулой без фиксации и прорастания его соединительной тканью, что не исключает миграцию имплантата, неустойчив к инфекции, а при развитии гнойных осложнений поддерживает и затрудняет санацию гнойного очага.
Новая техническая задача - снижение послеоперационных осложнений, повышение надежности пластического закрытия дефекта диафрагмы и расширение области применения.
Для решения поставленной задачи в способе пластики обширного дефекта диафрагмы, включающем закрытие образующегося дефекта диафрагмы имплантатом, который фиксируют к диафрагме и/или грудной стенке по всему периметру, образующийся дефект диафрагмы закрывают сетчатым имплантатом, выступающим за края дефекта диафрагмы не менее чем на 20 мм, с размерами ячейки 100-250 мкм, сплетенным по текстильной технологии из сверхэластичной никелидотитановой нити диаметром 50-60 мкм, и фиксируют без натяжения к диафрагме и/или грудной стенке узловыми швами сверхэластичной никелидотитановой нитью диаметром 50-60 мкм, при этом имплантат фиксируют по всему периметру П-образными узловыми швами с длиной стежка 8-10 мм и расстоянием между швами 10-15 мм, причем к грудной стенке фиксируют П-образными узловыми швами перикостально с формированием узла на коже, а внутренний и наружный края имплантата формируют в виде дупликатуры.
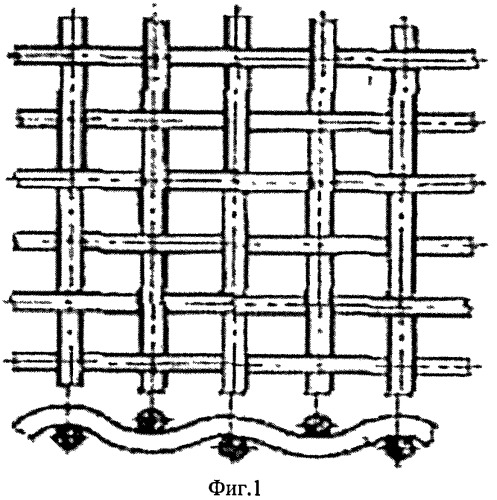
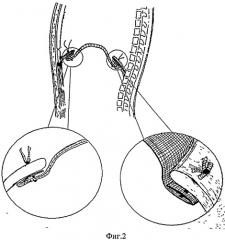
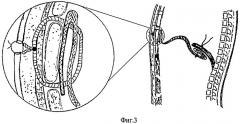
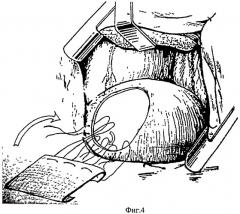
Способ осуществляют следующим образом. После выполнения оперативного вмешательства с обширной резекцией диафрагмы либо в случае диафрагмальной грыжи осуществляют доступ к диафрагме, вскрывая грудную полость в VII-VIII межреберье или используют комбинированный торакоабдоминальный доступ, проводят ревизию, внутренние органы освобождают (резецируют) и вправляют в брюшную полость, мобилизуют грыжевые ворота. Выкроенный сетчатый имплантат (фиг.1), выступающий за края дефекта диафрагмы не менее чем на 20 мм, с размерами ячейки 100-250 мкм, сплетенный по текстильной технологии из сверхэластичной никелидотитановой нити диаметром 50-60 мкм, помещают на дефект и фиксируют без натяжения узловыми швами по краю дефекта диафрагмы (фиг.2), а в местах ее отсутствия к грудной стенке сверхэластичной никелидотитановой нитью диаметром 50-60 мкм (фиг.3), при этом из торакотомного доступа через диафрагмальный дефект размещают имплантат на нижней поверхности диафрагмы, фиксируют по всему периметру П-образными узловыми швами сверхэластичной никелидотитановой нитью диаметром 50-60 мкм, завязывают узлы на верхней поверхности диафрагмы, причем внутренний и наружный края имплантата формируют в виде дупликатуры. Для этого прошивают дупликатуру наружного края имплантата П-образными узловыми швами с длиной стежка 8-10 мм и расстоянием между швами 10-15 мм, отступая от свободного края имплантата 8-10 мм, затем прошивают снизу вверх через всю толщу диафрагму, отступая от края дефекта не менее чем 10-12 мм (фиг.4), при отсутствии реберной части диафрагмы прошивают перикостально через все слои грудную стенку, лигатуры не затягивают. П-образными узловыми швами подтягивают наружный край имплантата на нижнюю поверхность диафрагмы или к внутренней поверхности грудной стенки, узлы завязывают на верхней поверхности диафрагмы или на коже, погружая узел шва через кожный разрез до 0,8 см длиной под кожу. Подобным образом на нижней поверхности диафрагмы размешают и фиксируют без натяжения внутренний край имплантата (фиг.5). Для этого прошивают дупликатуру внутреннего края имплантата П-образными узловыми швами с длиной стежка 8-10 мм и расстоянием между швами 10-15 мм, отступая от свободного края имплантата 8-10 мм, затем прошивают снизу вверх через всю толщу диафрагму, отступая от края дефекта не менее чем 10-12 мм, а при отсутствии мышечной части диафрагмы прошивают сухожильный центр, лигатуры не затягивают. П-образными узловыми швами подтягивают внутренний край имплантата на нижнюю поверхность диафрагмы или к сухожильному центру, узлы завязывают на верхней поверхности диафрагмы. Затем подобно П-образными узловыми швами фиксируют передний и задний края имплантата, по необходимости дополнительно фиксируют имплантат отдельными узловыми швами к краю дефекта диафрагмы. После завершения пластики диафрагмы (фиг.6) плевральную полость и поддиафрагмальное пространство дренируют дренажами с активной аспирацией. Операционную рану послойно ушивают.
Новым является то, что пластическое замещение дефекта диафрагмы осуществляют сетчатым тканевым имплантатом на основе никелида титана и фиксируют сверхэластичной никелидотитановой нитью. Размер ячейки 100-250 мкм и толщина нити 50-60 мкм подобраны экспериментальным путем и являются оптимальными для замещения этой анатомической структуры. Поведение имплантата определяется явлениями смачиваемости и капиллярности. Поры нити и ячейки имплантата заполняются тканевой жидкостью, которая после пропитывания структуры имплантата удерживается в виде пленки в просвете ячеек под действием силы поверхностного натяжения, за счет чего создается герметичность и разграничение плевральной полости от брюшной. Со временем в области соприкосновения поверхностей сетчатого имплантата с диафрагмой, грудной стенкой идет активное развитие соединительной ткани с прорастанием сетчатой структуры имплантата фибробластами, капиллярами и новообразованными сосудами.
Создание дупликатуры внутреннего и наружного края имплантата, размещение его на нижней поверхности диафрагмы и использование П-образных узловых швов позволяет оптимально разместить и надежно фиксировать его по краю дефекта диафрагмы. Вследствие биомеханической и биохимической совместимости имплантата с окружающими тканями происходит прорастание соединительной ткани сквозь сетчатую структуру имплантата с образованием единого с имплантационным материалом тканевого регенерата, что также гарантирует надежное удержание в тканях, предотвращает смещение имплантата относительно дефекта диафрагмы, исключает рецидивы. Эластичные свойства сетчатого никелида титана и диафрагмы сходны, поэтому при растяжении деформация образованного комплекса диафрагма-имплантат получается согласованной. Это снижает риск послеоперационных осложнений, повышает прочность соединения и обеспечивает анатомо-физиологическое восстановление данной области.
Отсутствие в мировой литературе и в патентно-информационных источниках решений со сходной совокупностью существенных признаков свидетельствует о соответствии предложения авторами критериям «новизна» и «изобретательский уровень». Изобретение иллюстрируется схемами выполнения конкретных приемов и примерами отдельных операций в эксперименте.
На чертежах представлено:
Фиг.1. Фрагмент сетчатого имплантата, сплетенного по текстильной технологии.
Фиг.2. Вариант фиксации имплантата по краю дефекта диафрагмы.
Фиг.3. Вариант фиксации имплантата к грудной стенке.
Фиг.4. Этап операции. Наружные края дупликатуры имплантата и дефекта диафрагмы прошиты П-образными узловыми швами.
Фиг.5. Этап операции. Внутренние края дупликатуры имплантата и дефекта диафрагмы прошиты П-образными узловыми швами.
Фиг.6. Внешний вид после пластики дефекта диафрагмы.
Проверочным тестом достижимости технического результата является экспериментальная апробация предлагаемого способа пластики обширных дефектов диафрагмы, смоделированных в анатомическом эксперименте и на 10 беспородных собаках массой тела 10-16 кг. Эксперименты на животных выполнены в отделе экспериментальной хирургии Центральной научно-исследовательской лаборатории СибГМУ. Исследование проводили согласно этическим принципам, изложенным в "Европейской конвенции по защите позвоночных животных, используемых для экспериментальных и других научных целей", все манипуляции и выведение животных из опытов проводили под общей анестезией.
Пример 1 (беспородная собака массой тела 16 кг). После обработки операционного поля йодом и спиртом под общей анестезией с управляемым дыханием выполнили в VII межреберье торакотомию справа, осуществили доступ к диафрагме, пересечением легочной связки мобилизовали диафрагмальную долю легкого и сместили правое легкое кнутри и кверху. С помощью хирургических ножниц и диатермоэлектрокоагуляции иссекли фрагмент диафрагмы и сформировали дефект размером ~ 10×10 см с оставлением по всему периметру мышечных пучков поясничной, реберной и грудинной частей диафрагмы. Затем осуществили главное действие способа, пластику обширного дефекта диафрагмы. Сетчатый имплантат, выступающий за края дефекта диафрагмы не менее чем на 20 мм, с размерами ячейки 220 мкм, сплетенный по текстильной технологии из сверхэластичной никелидотитановой нити диаметром 60 мкм, разместили на нижней поверхности диафрагмы, фиксировали без натяжения по всему периметру дефекта диафрагмы П-образными узловыми швами с длиной стежка 8-10 мм и расстоянием между швами 10-15 мм сверхэластичной никелидотитановой нитью диаметром 60 мкм, отступая от края дефекта диафрагмы не менее чем 10-12 мм и от свободного края имплантата 8-10 мм, завязывали узлы на верхней поверхности диафрагмы, причем внутренний и наружный края имплантата сформировали в виде дубликатуры. Плевральную полость дренировали. Операционную рану послойно ушили. При максимальном раздувании легких (на высоте «вдоха») дренаж удален. В раннем и отдаленном послеоперационном периодах осуществляли клиническое наблюдение, лучевой и эндоскопический контроль, проводили гистологическое исследование препаратов.
Пример 2 (беспородная собака массой тела 14 кг). После обработки операционного поля йодом и спиртом под общей анестезией с управляемым дыханием выполнили в VI межреберье боковую торакотомию слева, пневмонэктомию с раздельной обработкой элементов корня легкого. С помощью хирургических ножниц и диатермоэлектрокоагуляции иссекли фрагмент диафрагмы и сформировали дефект размером ~ 10×8 см с удалением мышечных пучков реберной части диафрагмы. Затем осуществили главное действие способа, пластику обширного дефекта диафрагмы. Сетчатый имплантат, выступающий за края дефекта диафрагмы не менее чем на 20 мм, с размерами ячейки 180 мкм, сплетенный по текстильной технологии из сверхэластичной никелидотитановой нити диаметром 50 мкм, разместили на нижней поверхности диафрагмы, фиксировали без натяжения по всему периметру дефекта диафрагмы П-образными узловыми швами с длиной стежка 8-10 мм и расстоянием между швами 10-15 мм сверхэластичной никелидотитановой нитью диаметром 50 мкм, отступая от края дефекта диафрагмы не менее чем 10-12 мм и от свободного края имплантата 8-10 мм, завязывали узлы на верхней поверхности диафрагмы, при этом к боковой поверхности грудной стенки имплантат фиксировали перикостально, прошивая через все слои грудную стенку, причем внутренний и наружный края имплантата сформировали в виде дубликатуры. Плевральную полость дренировали. Операционную рану послойно ушили. При максимальном раздувании правого легкого (на высоте «вдоха») дренаж удален. В раннем и отдаленном послеоперационном периодах осуществляли клиническое наблюдение, лучевой и эндоскопический контроль, проводили гистологическое исследование препаратов.
Результаты экспериментальной апробации подтверждают работоспособность предлагаемого способа и достижимость технического результата. Готовность операции к клиническому применению свидетельствует о соответствии предложения критерию «промышленно применимо».
Способ целесообразно применять для пластики дефекта диафрагмы после значительного повреждения (размозжения), оперативного вмешательства с обширной резекцией диафрагмы (комбинированная резекция легкого или пневмонэктомия при местно-распространенном раке легкого или злокачественной мезотелиоме плевры, удаление злокачественной опухоли диафрагмы и т.п.), при диафрагмальной грыже, заборе лоскута диафрагмы в качестве пластического материала для реконструкции грудной стенки и других анатомических структур. Также можно использовать сетчатый имплантат из никелида титана для укрепления линии швов на диафрагме в случае риска их прорезывания с развитием несостоятельности.
Источники информации
1. Бисенков Л.Н. Торакальная хирургия. М., 2002. С.883-889.
2. Петровский Б.В., Каншин Н.Н., Николаев Н.О. Хирургия диафрагмы. - Л.: Медицина, 1966. - С.335.
3. Пат. 2063707, МПК6 А61В 17/00. Способ формирования левой грудобрюшной преграды по М.И.Давыдову / М.И.Давыдов. №93029424; заявлено 06.10.1993; опубл. 20.07.1996. Приоритет 06.10.1993 (Россия).
4. Bedini A., Andreani S., Muscolino G. Latissimus dorsi reverse flap to substitute the diaphragm after extrapleural pneumonectomy // Ann. Thorac. Surg. 2000; 69: 986-988.
5. Пат. 2251983, МПК7 А61В 17/00. Способ лечения грыж диафрагмы / В.К.Татьянченко, Черкасов М.Ф., Е.И.Потемкин, Е.В.Андреев, К.В.Шурыгин, А.Ш.Гаербеков. №200133027; заявлено 11.11.2003; опубл. 20.05.2005, Бюл. №14. Приоритет 11.11.2003 (Россия). 8 с.
6. Suzuki К., Takahashi К., Itou Y. et al. Reconstruction of diaphragm using autologous fascia lata // Ann. Thorac. Surg. 2002; 74: 209-212.
7. Оперативная хирургия / Под ред. И.Литтманна. Будапешт, 1985. С.285-293.
8. Хирургия далеко зашедших и осложненных форм рака легкого / Под ред. Л.Н.Бисенкова. СПб.: ДЕАН, 2006. - С.270-271.
9. Rocco G., Rendina E.A, Meroni A. et al. Prognostic factors after surgical treatment of lung cancer invading the diaphragm // Ann. Thorac. Surg. 1999; 68(6): 2065-2068.
Способ пластики обширного дефекта диафрагмы, включающий закрытие образующегося дефекта диафрагмы имплантатом, который фиксируют к диафрагме и/или грудной стенке по всему периметру, отличающийся тем, что образующийся дефект диафрагмы закрывают сетчатым имплантатом, выступающим за края дефекта диафрагмы не менее чем на 20 мм, с размерами ячейки 100-250 мкм, сплетенным по текстильной технологии из сверхэластичной никелидотитановой нити диаметром 50-60 мкм и фиксируют без натяжения к диафрагме и/или грудной стенке узловыми швами сверхэластичной никелидотитановой нитью диаметром 50-60 мкм, при этом имплантат фиксируют по всему периметру П-образными узловыми швами с длиной стежка 8-10 мм и расстоянием между швами 10-15 мм, швы завязывают поверх диафрагмы, причем к грудной стенке фиксируют П-образными узловыми швами перикостально с формированием узла на коже, а внутренний и наружный края имплантата формируют в виде дупликатуры.