Пэг-илированные наночастицы
Иллюстрации
Показать всеИзобретение относится к медицине и касается наночастиц, включающих сополимер простого винилметилового эфира и малеинового ангидрида (PVM/MA) или его производные. Настоящее изобретение обеспечивает увеличенную биоадгезию и, как следствие, пролонгированное время удерживания при тесном контакте со слизистыми. 5 н. и 21 з.п. ф-лы, 13 ил., 10 табл.
Реферат
Область изобретения
Изобретение относится к ПЭГ-илированным (покрытым полиэтиленгликолем) наночастицам на основе биологически разлагаемого полимера и полиэтиленгликоля, к способу их изготовления, препаративным формам, содержащим их, и к их применению в качестве систем для введения лекарственных средств.
Описание предшествующего уровня техники
В последние годы были предложены биологически разлагаемые наночастицы в качестве новых систем для введения лекарственных средств. Один из самых важных признаков, который они обеспечивают, представляет собой контролируемое высвобождение включенного лекарственного средства. Это ведет к большей терапевтической эффективности, обеспечивает более удобное для пациента введение и позволяет предотвратить передозировку. Кроме того, могут быть включены лекарственные средства с различными физико-химическими признаками, позволяя улучшить их устойчивость в биологических жидкостях. Это обстоятельство очень важно в случае антигенов, белков и макромолекул в целом. Кроме того, наночастицы ввиду их маленького размера подходят для введения лекарственных средств различными путями, например орально, парентерально и в виде глазных лекарственных форм (Kreuter, Adv. Drug Del. Rev., 7 (1991) 71-86; Gref et al., Science, 263 (1994) 1600-1603; Zimmer and Kreuter, Adv. Drug Del. Rev., 16 (1995) 61-73).
Оральное введение представляет собой самый удобный и популярный путь введения лекарственных средств. Однако биологическая доступность определенной активной молекулы зависит от (i) характеристик молекулы лекарственного средства и от фармацевтической формы и (ii) от физиологических условий, имеющихся в желудочно-кишечном тракте, таких как присутствие протеолитических ферментов, перистальтические движения и пресистемный метаболизм. Были предложены коллоидные системы, такие как наночастицы, для преодоления некоторых из этих препятствий. Эти носители по существу имеют большую удельную площадь поверхности, посредством чего облегчается их взаимодействие с биологической подложкой (слизистой оболочкой желудочно-кишечного тракта). Регулирование высвобождения лекарственного средства также позволяет продлить время эффекта молекул с низким биологическим периодом полувыведения. С другой стороны, наночастицы могут захватываться клетками пейеровых бляшек и фолликулами лимфоидной ткани (Hodges et al., J. Drug Target., 3 (1995) 57-60; Florence, Pharm. Res., 14 (1997) 259-266). Этот феномен позволяет направить лекарственное средство в лимфатические пути и в случае вакцин содействовать представлению их антигена. Однако обычные наночастицы имеют несколько значительных недостатков в отношении их применения путем орального введения: (i) определенная неустойчивость в жидкостях желудочно-кишечного тракта, (ii) низкая степень кишечного всасывания и (iii) неспецифический тропизм или адгезия в слизистой оболочке желудочно-кишечного тракта.
Парентеральное введение наночастиц обеспечивает регулируемое системное высвобождение, которое подходит для лекарственных средств с (i) низкой оральной биологической доступностью, (ii) коротким биологическим периодом полувыведения из плазмы и (iii) ограниченной устойчивостью. Другим существенным преимуществом парентерально введенных наночастиц является возможность концентрации лекарственного средства в определенном органе. Однако наночастицы быстро распознаются, захватываются и выводятся из циркуляции крови макрофагами мононуклеарной фагоцитарной системы (MPS) после их внутривенного введения. Этот феномен ограничивает их функцию в регулируемом высвобождении, а также возможность концентрации лекарственного средства в тканях, отличных от MPS.
Введение систем контролируемого высвобождения в виде глазных лекарственных форм имеет значительные преимущества для лечения глазных заболеваний, хотя можно также получить системный эффект. Однако введение в виде глазных лекарственных форм связано с быстрым выведением препаративной формы из прероговичной области ввиду дренирования в носослезный проток и разбавления слезной жидкости. Эти процессы приводят к тому, что очень низкая процентная доля введенного лекарственного средства (менее чем 5%) может проникнуть через роговицу и достичь внутриглазных тканей. Это дренирование ответственно за возникновение системных эффектов после введения препаративной формы этим путем. Ряд исследований продемонстрировал, что применение наночастиц позволяет увеличить количество лекарственных средств в конъюнктиве и увеличить их биологическую доступность по сравнению с обычными офтальмологическими формами, такими как растворы и мази (Gurny et al., J. Controlled Rel., 6 (1987) 367-373; Deshpande et al., Crit. Rev. Ther. Drug Carrier Syst., 15 (1998) 381-420). Коллоидные системы можно вводить в виде простых капель, избегая проблем, связанных со зрением, ввиду их низкой вязкости. Частоту применения можно снизить ввиду пролонгированного высвобождения лекарственного средства из матрицы наночастиц. Однако наночастицы также проявляют быстрое выведение из участка всасывания.
Поэтому, даже хотя наночастицы потенциально можно использовать для различных ранее указанных способов введения, еще существуют проблемы, которые затрудняют их применение. Модификация характеристик полимерной матрицы, а также их поверхности может обеспечить решение некоторых из описанных выше проблем.
С этой точки зрения, ассоциация или покрытие наночастиц подходящими полимерами может модифицировать их физико-химические характеристики, и это может косвенно модифицировать их распределение и взаимодействие с биологической средой. Возможная стратегия представляет собой связывание полиэтиленгликоля (ПЭГ) с наночастицами, известное как пэгиляция или получение скрытых наночастиц.
В отношении применения оральным введением ассоциация полиэтиленгликолей с обычными наночастицами позволяет защитить их против ферментной атаки в жидкостях пищеварительного тракта. Это связано с возможностью отторжения белков пропиленгликолями (Gref et al., Science, 263 (1994) 1600-1603). Эта стратегия также позволила бы минимизировать их взаимодействие с муцином и другими белками, присутствующими в просвете. Аналогичная стратегия применялась при разработке наночастиц для глазного применения. Fresta et al. наблюдали значительное увеличение глазного всасывания ацикловира после его введения в наносферах поли(алкилцианоакрилата), покрытых полиэтиленгликолем (Fresta et al., J. Pharm. Sci., 90 (2001) 288-297). Этот феномен объясняется большим взаимодействием покрытых наночастиц с роговичным эпителием.
Различные наночастицы, покрытые полиэтиленгликолем, после внутривенного введения демонстрировали длительное присутствие в циркуляции (Gref et al., Science, 263 (1994) 1600-1603; Stolnik et al., Pharm. Res., 11 (1994) 1800-1808; Bazile et al., J. Pharm. Sci., 84 (1995) 493-498). Наночастицы поли(молочной) кислоты (PLA), покрытые полиэтиленгликолем, имеют гораздо более длительный период полувыведения из плазмы (t1/2=6 ч), чем когда они покрыты альбумином или полоксамером (t1/2=2-3 мин) (Verrecchia et al., J. Controlled Rel., 36 (1995) 49-61). Присутствие гидрофильных полиэтиленгликолевых цепей на поверхности наночастиц значительно снижает их взаимодействие с белками крови (известными как опсонины). Эти белки содействуют фагоцитозу, формируя «мостик» между частицами и фагоцитами (Frank & Fries, Immunol. Today, 12 (1991) 322-326). Однако гидрофильные свойства полиэтиленгликолей являются не единственным важным фактором, обеспечивающим эффективное сопротивление опсонизации. Другие гидрофильные полимеры, такие как поливиниловый спирт, продемонстрировали низкую защитную способность против опсонизации наночастиц (Leroux et al., Life Sci., 57 (1995) 695-703). Поэтому стерическая стабилизация, обеспечиваемая ПЭГ-илированием, была бы также вызвана другими физико-химическими свойствами, такими как высокая гибкость цепей ПЭГ и специфическая структурная формация (Mosquiera et al., Biomaterials, 22 (2001) 2967-2979).
Основным недостатком, связанным с этой новой стратегией, является устойчивость ассоциации полиэтиленгликолей с поверхностью наночастиц (Peracchia et al., Life Sci., 61 (1997) 749-761). Известно, что способность полиэтиленгликоля отторгать белки зависит от конфигурации, заряда, длины и гибкости цепей (Torchillin, J. Microencaps., 15 (1998) 1-19). Способ модификации поверхности наночастиц главным образом осуществляется физической адсорбцией (Stolnik et al., Adv. Drug Del. Rev., 16 (1995) 195-214) или ковалентным связыванием (De Jaeghere et al., J. Drug Target., 8 (2000) 143-153). Однако недостатком простой адсорбции является быстрая потеря покрытия вследствие неустойчивости взаимодействия. Учитывая то, что ковалентное связывание предпочтительно, большинство ПЭГ-илированных наночастиц были получены с использованием сополимеров полиэтиленгликоля с молочной или гликолевой кислотой. Однако процесс сополимеризации требует использования нескольких катализаторов и определенных химических условий (Beletsi et al., Int. J. Pharm., 182 (1999) 187-197). Кроме того, могут быть проблематичными остатки токсичных органических растворителей, используемых при органическом синтезе (метиленхлорид, толуол и т.д.).
Поэтому еще необходимо получить наночастицы, которые устойчивы при оральном введении, которые сохраняют гидрофильное покрытие и которые имеют хорошие биоадгезивные характеристики и специфичность в желудочно-кишечном тракте. Для того чтобы быть эффективными, они должны быть нетоксичными, биологически разлагаемыми и легко получаемыми.
Краткое изложение сущности изобретения
Целью настоящего изобретения является предоставление наночастиц, которые устраняют указанные выше недостатки, т.е. обладают устойчивостью и специфичностью при оральном введении, имеют хорошие биоадгезивные характеристики для взаимодействия со слизистыми оболочками, способны нести широкий диапазон активных молекул, высвобождают активные молекулы регулируемым образом и предотвращают их выведение из системы крови, особенно когда они вводятся парентерально.
Наблюдалось, что наночастицы, сформированные биологически разлагаемым полимером и полиэтиленгликолем, разрешают эти проблемы. В частности, было обнаружено, что наночастицы, сформированные простым поливинилметиловым эфиром и сополимером малеинового ангидирида и полиэтиленгликоля, легко получить, и они обеспечивают превосходные характеристики биоадгезии, размера и зета потенциала, делая их подходящими для введения активных молекул. Кроме того, было обнаружено, что выбор типа полиэтиленгликоля, используемого для их получения, позволяет подходящим образом модулировать признаки этих наночастиц, которые можно преимущественно использовать в соответствии с типом препарата, который предстоит использовать, и/или способом введения фармацевтической препаративной формы.
Поэтому в первом аспекте изобретение относится к ПЭГ-илированным наночастицам для переноса биологически активных молекул, включающих биологически разлагаемый полимер и полиэтиленгликоль или его производные. В одном варианте биологически разлагаемый полимер представляет собой сополимер простого винилметилового эфира и малеинового ангидрида (PVM/MA).
Полиэтиленгликоль предпочтительно имеет молекулярную массу в диапазоне от 400 до 35000 Да. Полиалкиленгликоль обеспечивает хорошие результаты, когда он выбран из группы полиэтиленгликолей, полипропиленгликолей, блок- или статистических сополимеров, включая 2 типа блоков, их смеси или их производные. По меньшей мере, одна концевая гидроксильная группа полиэтиленгликоля необязательно замещена, предпочтительно, алкокси, акрилатной, метакрилатной, алкильной, амино, фосфатной, изотиоцианатной, сульфгидрильной, меркапто- или сульфатной группой.
В одном варианте изобретения отношение массы полиэтиленгликоля к биологически разлагаемому полимеру составляет 1:2-6, предпочтительно 1:2-4, предпочтительнее примерно 1:4.
ПЭГ-илированные наночастицы по изобретению могут включать активную молекулу, такую как белки, пептиды, ДНК, РНК, нуклеозиды, нуклеотиды, олигонуклеотиды или полинуклеотиды. С точки зрения ее активности, она может представлять собой, среди других, противоопухолевое средство или антиген для опухолей, или защитное средство центральной нервной системы или глюкокортикоид, или антиген для вакцинации или аллерген для иммунотерапии.
В другом аспекте изобретение относится к фармацевтической композиции, включающей ПЭГ-илированные наночастицы, как описано выше. В одном варианте препаративная форма предназначена для орального введения. В другом варианте она предназначена для парентерального введения или для введения через слизистую оболочку (например, глазную слизистую оболочку).
Поэтому ПЭГ-илированные наночастицы по изобретению можно использовать при изготовлении лекарственного средства. Оно может необязательно быть в лиофилизированной форме.
В другом аспекте изобретение относится к способу получения описанных ПЭГ-илированных наночастиц, включающему стадию одновременной инкубации полимера и полиэтиленгликоля в органическом растворителе перед десольватацией полимера водно-спиртовым раствором. В одном варианте концентрация биологически разлагаемого полимера составляет от 0,001 до 10% мас./об., а концентрация полиэтиленгликоля - от 0,001 до 5% мас./об. Отношение органической фазы к фазе водно-спиртового раствора составляет от 1/1 до 1/10.
Способ может, кроме того, включать дополнительные стадии для удаления органических растворителей и/или очистки, а также стадии стабилизации ПЭГ-илированных наночастиц посредством использования поперечно-сшивающих веществ. Биологически активная молекула может быть включена на стадии одновременной инкубации полимера и полиэтиленгликоля в органическом растворителе, или она может быть в последующем включена в водную суспензию уже сформированных наночастиц, с тем чтобы могла произойти их ассоциация.
Описание чертежей
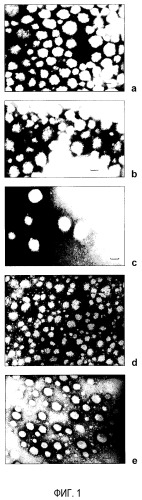
На фиг. 1 показаны фотографии трансмиссионной электронной микроскопии (ТЕМ) различных типов наночастиц (NP) - (а) NP; (b) PEG NP; (c) mPEG NP; (d) DAE-PEG NP; (e) DAP-PEG NP. Шкала представляет 150 нм.
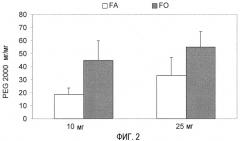
На фиг. 2 показана ассоциация PEG 2000 (мг/мг) в соответствии с используемым способом: одновременной инкубацией PEG и PVM/MA в органической фазе (ОР) или инкубацией наночастиц с водным раствором (АР) PEG.
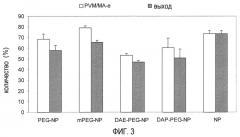
На фиг. 3 показано воздействие полиэтиленгликоля на процентную долю PVM/MA, превращенного в наночастицы (PVM/MA-e), и на производительность способа.
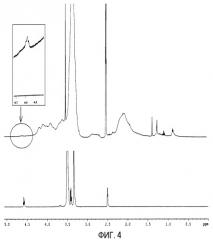
Фиг. 4 показывает спектры ядерного магнитного резонанса ПЭГ-илированных наночастиц с PEG 2000 (верхние) и свободного PEG 2000 (нижние). Увеличенное изображение пика при 4,58 м.д. (протоны гидроксильной группы) показано в прямоугольнике.
На фиг. 5 показаны детали спектров ядерного магнитного резонанса (а) ПЭГ-илированных наночастиц с PEG 2000 и (b) свободного PEG 2000, растворенных в DMSO (диметилсульфоксиде) (5 мг в 0,5 мл).
На фиг. 6 показаны детали спектров ядерного магнитного резонанса (а) ПЭГ-илированных наночастиц с DAP-PEG 2000 и (b) свободного DAP-PEG 2000, растворенных в DMSO (5 мг в 0,5 мл).
На фиг. 7 показаны детали спектров ядерного магнитного резонанса (а) ПЭГ-илированных наночастиц с DAE-PEG 2000 и (b) свободного DAE-PEG 2000, растворенных в DMSO (5 мг в 0,5 мл).
На фиг. 8 показаны структуры, предложенные для различных ПЭГ-илированных наночастиц, по данным ядерного магнитного резонанса и величинам зета потенциала - а) PEG-NP; b) mPEG-NP; c) DAE-PEG-NP; d) DAP-PEG-NP.
На фиг. 9 показано распределение ПЭГ-илированных наночастиц в желудочно-кишечном тракте после их орального введения у крыс: а) PEG-NP; b) mPEG-NP; c) DAE-PEG-NP; d) DAP-PEG-NP. Ось x представляет количество сцепленных наночастиц (NP) (мг); ось у показывает различные части тракта (St: желудок; I1, I2, I3, I4: части кишечника; Ce: слепая кишка; ось z представляет время после введения (ч).
На фиг. 10 показаны кривые биоадгезии (NP, мг) различных ПЭГ-илированных наночастиц во всем желудочно-кишечном тракте после орального введения одной дозы 10 мг. T: время в ч.
На фиг. 11 показаны полученные флуоресцентной микроскопией изображения части подвздошной кишки через 2 ч после орального введения 10 мг ПЭГ-илированных наночастиц с PEG 2000 (PEG-NP): а) ворсинки подвздошной кишки: стрелками показан верхушечный компартмент эпителия; b) эпителиальные клетки: клетками показана флуоресценция между энтероцитами. Шкала представляет 20 мкм.
На фиг. 12 показаны микроскопические изображения сегмента подвздошной кишки через 2 ч после орального введения 10 мг ПЭГ-илированных наночастиц с PEG 2000 (PEG-NP): а) общий вид (увеличение в 135 раз) и b) увеличенная деталь (увеличение в 530 раз). L: просвет; Е: энтероциты; GC: клетки, генерирующие слизь; темные стрелки: ядра энтероцитов; белые стрелки: кровяные капилляры в подслизистой.
На фиг. 13 показано положение PEG-NP в пейеровых бляшках подвздошной кишки после орального введения 10 мг наночастиц: а) общий вид пейеровой бляшки (увеличение в 135 раз); b) увеличенная деталь (увеличение в 530 раз); РР - пейерова бляшка; FAE - связанный с фолликулом эпителий; темные стрелки: куполовидные клетки пейеровой бляшки, в которые должны быть включены наночастицы.
Подробное описание изобретения
К удивлению, было обнаружено, что модификация и покрытие наночастиц биологически разлагаемого полимера, такого как сополимер простого винилметилового эфира и малеинового ангидрида (PVM/MA) с различными полиэтиленгликолями, позволяет получить наночастицы с характеристиками физико-химических свойств, биоадгезии и специфичности при оральном введении, превращающими их в очень интересные системы в качестве особых носителей лекарственных средств. Признаки этих наночастиц можно преимущественно модифицировать в соответствии с типом используемого полиэтиленгликоля и способом получения. ПЭГ-илированные наночастицы по изобретению могут пролонгировать время нахождения в слизистых оболочках после их орального или глазного введения. Эти наночастицы представляют интерес для введения лекарственных средств с узкими окнами всасывания и, таким образом, улучшают их биологическую доступность. Эти наночастицы также представляют собой подходящие носители для лекарственных средств с повышенной токсичностью (например, цитотоксических препаратов), поскольку они позволяют увеличить время циркуляции системы в плазме, в течение которого препарат постепенно высвобождается регулируемым образом. С другой стороны, ПЭГ-илированные наночастицы могут предотвратить распознавание и выведение посредством клеток системы мононуклеарных фагоцитов (MPS), обеспечивая длительную циркуляцию лекарственных средств после их внутривенного введения.
Термин «наночастицы» используется для обозначения сфер или аналогичных форм с размером менее чем 1,0 мкм, предпочтительно, в диапазоне от 10 до 900 нм.
Как указано выше, в одном аспекте изобретение относится к ПЭГ-илированным наночастицам, образованным из биологически разлагаемого полимера. Можно использовать известные в данной области биологически разлагаемые полимеры, которые вызывают образование наночастиц. Эти полимеры включают, среди других, полигидроксикислоты, такие как полимолочная и полигликолевая кислота, и их сополимеры (например, PLGA), полиангидриды, сложные полиэфиры и полисахариды, например хитозан. Термин «биологически разлагаемые» в настоящем описании относится к полимерам, которые растворяются или разрушаются через период времени, который приемлем для желательного применения, в данном случае терапии in vivo, после их контакта с физиологическим раствором с рН 6-9 и при температуре в диапазоне от 25°С до 40°С.
В одном варианте изобретения сополимер простого винилметилового эфира и малеинового ангидрида в форме ангидирда (PVM/MA или Gantrez AN) используется в качестве биологически разлагаемого полимера. Он предпочтительно имеет молекулярную массу в диапазоне от 100 до 2400 кДа, предпочтительнее от 200 до 2000 кДа. В одном варианте изобретения предпочтителен сополимер PVM/MA с молекулярной массой от 180 до 250 кДа.
Этот сополимер предпочтителен, потому что он широко используется в фармацевтической технологии ввиду его низкой токсичности (LD 50=8-9 г/кг при оральном введении) и превосходной биологической совместимости. Его также легко получить с точки зрения количества и его стоимости. Этот полимер ввиду его ангидридных групп может взаимодействовать с различными гидрофильными веществами без необходимости применения обычных органических реагентов (глютаральдегид и производные карбодиимида), имеющих значительную токсичность (Arbos et al., J. Controlled Rel., 83 (2002) 321-330). Полимер нерастворим в водной среде, но ангидридная группа Gantrez AN гидролизуется, давая начало получению карбоксильных групп. Растворение происходит медленно и зависит от условий, в которых оно происходит. Ввиду биологической доступности функциональных групп в PVM/MA ковалентное связывание молекул с нуклеофильными группами, такими как гидроксилы (-ОН) или амины (NH2), происходит простой инкубацией в водной среде.
Не ПЭГ-илированные наночастицы этого сополимера и их получение описаны в WO 02/069938, принадлежащей тому же заявителю, и содержание этой заявки полностью включено сюда в качестве ссылки. Наночастицы сополимера простого винилметилового эфира и малеинового ангидрида легко получить десольватированием полимера посредством добавления к его органическому раствору первого полярного растворителя (смешиваемого с раствором полимера) и последующего добавления второй жидкости, не являющейся растворителем, в данном случае, водно-спиртового раствора. Необязательно можно добавить поперечно-сшивающее вещество. Получение ПЭГ-илированных наночастиц этого полимера описано ниже, и было обнаружено, что их можно очень легко получить.
В настоящем описании под термином «полиэтиленгликоль» подразумевается любой гидрофильный полимер, растворимый в воде, содержащей группы простого эфира, связанные 2 или 3 атомами углерода, необязательно, разветвленные алкиленовые группы. Поэтому это определение включает разветвленные или неразветвленные полиэтиленгликоли, полипропиленгликоли, а также блок- или статистические сополимеры, включающие эти 2 типа блоков. Этот термин также включает производные концевых гидроксильных групп, которые могут быть модифицированы (1 или оба конца) с тем, чтобы ввести алкокси-, акрилатную, метакрилатную, алкильную, амино-, фосфатную, изотиоционатную, сульфгидрильную, меркапто- и сульфатную группы. Полиэтиленгликоль или полипропиленгликоль может иметь заместители в алкиленовых группах. Если заместители присутствуют, то они предпочтительно представляют собой алкильные группы.
Полиэтиленгликоли представляют собой растворимые в воде полимеры, которые были утверждены для орального, парентерального и местного применения лекарственных средств (FDA, Администрация пищевых продуктов и лекарственных средств США). Полиэтиленгликоли получают посредством полимеризации этиленоксида (ЕО) или пропиленоксида (РО) в присутствии воды, моноэтиленгликоля или диэтиленгликоля как инициаторов взаимодействия в щелочной среде (1,2-Epoxide Polymers: Ethylene Oxide Polymers and Copolymers" in Encyclopedia of Polymer Science and Engineering; Mark, H.F. (Ed.), John Wiley and Sons Inc., 1986, pp. 225-273). Когда достигается желательная молекулярная масса (в целом регулируемая посредством измерений вязкости в ходе осуществления способа), реакция полимеризации заканчивается нейтрализацией катализатора кислотой (молочной кислотой, уксусной кислотой или им подобными). В результате получается линейный полимер, имеющий очень простую структуру:
HO-(CH2-CH2-O)n-H,
где (n) представляет собой количество мономеров или единиц ЕО. Единицы альтернативно содержат пропиленовые группы.
Хотя технически все эти продукты следует называть поли(оксиалкиленами), продукты со средними величинами молекулярного веса (или молекулярной массой) от 200 до 35000 известны как полиэтиленгликоли (ПЭГ, PEG). Этот термин «полиэтиленгликоль» обычно используется для указания на существенное влияние гидроксильных концевых групп на физико-химические свойства этих молекул. Термин PEG обычно используется в комбинации с цифровой величиной. В фармацевтической промышленности цифра указывает на среднюю молекулярную массу, тогда как в химической промышленности цифра, сопровождающая буквы PEG, относится к полимеризованным единицам ЕО, образующим молекулу (Hand book of Pharmaceutical Excipients, Rowev R.C., Sheskey P. J., 5 Weller P.J. (Eds.), 4th Edition, Pharmaceutical Press and American Pharmaceutical Association, London, UK, 2003). PEG включены в различные фармакопеи, хотя номенклатура отличается (International Harmonisation: Polyethylene glycol (PEG): Pharmeuropa 1999, 11, 612-614). В соответствии с руководством Handbook of Pharmaceutical Excipients (Fourth Edition), 2003 Edited by R.C. Rowe, P.J. Sheskey и P.J. Weller Published by the Pharmaceutical Press (London, UK) и American Pharmaceutical Association (Washington, USA) полиоксиэтиленгликоли также именуются полиэтиленгликолями, макроголами, макроголом или PEG. В Британской Фармакопее используются полиэтиленгликоли и макроголы, в Европейской Фармакопее полиэтиленгликоли и макрогол, тогда как в Фармакопее США (USP) используется полиэтиленгликоль(и).
PEG с молекулярной массой менее чем 400 представляют собой нелетучие жидкости при комнатной температуре. PEG 600 проявляет точку плавления в диапазоне от 17 до 22°С, тогда как PEG со средними молекулярными массами в диапазоне от 800 до 2000 представляют собой пастообразные материалы с низкими точками плавления. PEG с молекулярной массой, превышающей 3000, представляют собой твердое вещество, и PEG с молекулярной массой до 35000 имеется в продаже. С другой стороны, хотя точка плавления PEG увеличивается с увеличением молекулярной массы, точка кипения увеличивается до максимальной величины 60°С. Аналогичным образом, когда молекулярная масса увеличивается, уменьшается его растворимость в воде. В любом случае, для PEG 35000 количество, близкое к 50% мас./мас., может раствориться в воде.
С токсикологической точки зрения, PEG считаются скорее нетоксичными и не иммуногенными (Hermansky S.J et al., Food Chem. Toxic., 1995, 33, 139-140; Final Report on the Safety Assessment of PEGs: J.A. С.Т., 1993, 12, 429-457; Polyethylene glycol, 21 CFR 172.820, FDA). Допустимое суточное потребление, определенное ВОЗ, составляет 10 мг/кг массы (Polyethylene glycols; Twenty-third report of the Joint FАО/WHO Expert Committee on Food Additives; World Health Organisation, Geneva; Technical Report Series 1980, 648, 17-18).
Производные полиэтиленгликоля имеют преимущества, аналогичные традиционным PEG, такие как их растворимость в воде, отсутствие физиологической активности, низкая токсичность и устойчивость в очень разных условиях. Эти производные включают очень разные продукты и характеризуются функциональной группой, замещающей гидроксил, такой как -NH2 (среди самых реактивных групп), фенол, альдегид, изотиоцианат, -SH группы и т.д. Среди производных полиэтиленгликоля можно указать следующие соединения, которые можно использовать в изобретении:
- сложные эфиры полиоксиэтилена: сложный эфир моносукцинимидилсукцинат простого монометилового эфира PEG; простой монокарбоксиметиловый эфир монометилового эфира PEG; адипинат PEG; дистеарат PEG, моностеарат PEG; гидроксистеарат PEG; дилаурат PEG; диолеат PEG, моноолеат PEG, монорицинолеат PEG; сложные эфиры кокосового масла PEG;
- простые алкиловые эфиры полиоксиэтилена: простой монометиловый эфир PEG или метокси PEG (mPEG); простой диметиловый эфир PEG;
- другие: поли(этиленгликольтерефталат); производные полиоксиэтилена и сложные эфиры сорбитана и жирные кислоты; сополимеры этиленоксида и пропиленоксида; сополимеры этиленоксида с акриламидом;
- производные PEG: O,O'-бис-(2-аминоэтил)полиэтиленгликоль (DAE-PEG 2000); O,O'-бис-(2-аминопропил)полипропиленгликоль-полиэтиленгликоль-полипропиленгликоль.
В одном варианте изобретения полиэтиленгликоль является неразветвленным и не имеет замещенных гидроксильных групп. В этом варианте используемые полиэтиленгликоли имеют молекулярную массу от 400 до 35000 Да. Когда молекулярная масса менее чем 400 Да, то было обнаружено, что эффективное ПЭГ-илирование не происходит. Поэтому в одном предпочтительном варианте изобретения полиэтиленгликоль, используемый при изготовлении ПЭГ-илированных наночастиц, имеет молекулярную массу, равную или больше чем 400, предпочтительнее, равную или больше чем 1000, особенно предпочтительны величины от 1500 до 10000, предпочтительно, от 2000 до 5000 кДа.
Поэтому в одном варианте используется полиэтиленгликоль 2000 (PEG 2000). Количество PEG 2000 в отношении полимера составляет предпочтительно от 1:2 до 1:6; величины, близкие к отношению 1:4, обеспечивают хорошие результаты. Например, примерно 0,25 мг PEG 2000/мг полимера обеспечивает эффективное ПЭГ-илирование. В этом случае количество, ассоциированное с наночастицами, составляет примерно 55,0 мкм/мг наночастиц. Эти наночастицы характеризуются наличием сферической формы и размера, близкого к 300 нм.
В другом варианте изобретения полиэтиленгликоль, используемый при изготовлении ПЭГ-илированных наночастиц, имеет блокированную концевую гидроксильную группу, например, посредством производного простого метилового эфира. Это снижает его гидрофильность и может даже изменить структуру наночастицы. В этом случае большая процентная доля цепей полиэтиленгликоля была бы включена внутрь них, и только небольшая их часть располагалась бы на поверхности наночастиц. Эта особенность позволяет заявителям модулировать признаки наночастиц посредством блокирования гидроксильных групп или путем введения других функциональных групп, как описано ниже. В случае m-PEG, который находится внутри наночастиц, его функцией была бы модификация высвобождения лекарственного средства путем модификации пористости полимерной матрицы.
Простой метиловый эфир полиэтиленгликоля 2000 (m-PEG 2000) используется в предпочтительном варианте. Количество m-PEG 2000 в отношении полимера составляет предпочтительно 1:2-6; величины, близкие к отношению 1:4, обеспечивают хорошие результаты, например, примерно 0,25 мг m-PEG 2000/мг полимера. В этом случае количество, ассоциированное с наночастицами, составляет 35,5 мкг/мг наночастиц. Эти наночастицы характеризуются наличием сферической формы и размера, близкого к 300 нм.
В другом варианте изобретения используемый полиэтиленгликоль имеет концевые функциональные группы, отличные от гидроксильной группы, такие как аминогруппы. Эти аминогруппы, в свою очередь, могут быть замещены и иметь функциональные группы. В предпочтительном варианте аминогруппы представляют собой -NH2. Наблюдалось, что с этими группами наночастицы после орального введения накапливаются в определенных сегментах кишечного тракта, что обеспечивает возможность определенного введения.
Поэтому в одном варианте полиэтиленгликоль, используемый при изготовлении ПЭГ-илированных наночастиц, представляет собой О,О-бис-(2-аминоэтил)полиэтиленгликоль 2000 (DAE-PEG 2000). В этом случае считается, что структура ПЭГ-илированных наночастиц не представляет собой структуру «щеточного» типа, потому что цепи соединялись бы на двух концах, вызывая образование формы «петельного» типа. Количество DAE-PEG в отношении полимера составляет предпочтительно менее чем 1:4. В предпочтительном варианте оно равно или меньше чем 0,25 мг DAE-PEG 2000/мг полимера. В этом случае количество, ассоциированное с наночастицами, составляет примерно 90,6 мкг/мг наночастиц. Эти наночастицы характеризуются наличием сферической формы и размера, близкого к 500 нм.
В другом варианте полиэтиленгликоль, используемый при получении ПЭГ-илированных наночастиц, имеет аминогруппы и ответвления в алкильной группе. Было обнаружено, что с этими заместителями имеется тенденция к формированию структуры щеточного типа при одном из концов внутри наночастицы и другом конце снаружи.
Поэтому, если используемый полиэтиленгликоль представляет собой O,O'-бис-(2-аминопропил)полипропиленгликоль-полиэтиленгликоль-полипропиленгликоль 2000 (DAP-PEG 2000), наночастицы характеризуются наличием сферической формы и размера, близкого к 360 нм. В этом случае количество DAP-PEG в отношении полимера предпочтительно равно или меньше чем 0,25 мг DAP-PEG 2000/мг полимера, а количество, ассоциированное с наночастицами, составляет 67,6 мкг/мг наночастиц.
Химические структуры некоторых полиалкиленгликолей, соответствующих ранее указанным группам с различными типами функциональных групп, иллюстративно представлены ниже:
а) H(OCH2CH2)nOH
b) H3C(OCH2CH2)nOH
c) H2N(CH2CH2O)nCH2CH2NH2
d) H2NCHCH3CH2(OCHCH3CH2) (OCH2CH2)n(OCH2CHCH3)NH2
Определенными примерами были бы:
а) полиэтиленгликоль 400, 1000 или 2000 (PEG 400, PEG 1000 или PEG 2000);
b) простой метиловый эфир полиэтиленгликоля 2000 (mPEG 2000);
c) O,O'-бис-(2-аминоэтил)полиэтиленгликоль (DAE-PEG 2000);
d) O,O'-бис-(2-аминопропил)полипропиленгликоль-полиэтиленгликоль-полипропиленгликоль (DAP-PEG 2000).
Как видно из описанного выше, что подтверждено примерами, выбор типа полиэтиленгликоля позволяет модулировать по желанию признаки системы, которая генерирована. Использование смесей различных типов полиэтиленгликолей добавляет дополнительный фактор вариабельности. С практической точки зрения, это важно для адаптации и выбора самой подходящей системы для каждой активной молекулы и для каждого способа введения.
Способ получения биологически разлагаемого полимера и наночастиц полиэтиленгликоля, предпочтительно сополимера простого винилметилового эфира и малеинового ангидрида (PVM/MA) и полиэтиленгиколя, основан на способе смещения растворителя, описанном, например, в WO 02/069 938.
В одном варианте изобретения ПЭГ-илированные наночастицы получают двумя различными способами: (i) одновременной инкубацией двух полимеров (например, PVM/MA и PEG) в органической фазе и (ii) инкубацией наночастиц биологически разлагаемого полимера с водным раствором полиэтиленгликоля. Эти способы обоснованы для получения наночастиц PVM/MA с ассоциацией PEG на их поверхности. Первый вариант (одновременная инкубация полимеров) предпочтителен, потому что он обеспечивает хорошую степень ассоциации PEG.
Первый способ включает одновременное растворение биологически разлагаемого полимера и полиэтиленгликоля в органическом растворителе, таком как, например, ацетон. Инкубация смеси проводится при перемешивании при комнатной температуре в течение определенного периода времени. Концентрация биологически разлагаемого полимера составляет от 0,001 до 10% мас./об., а концентрация полиэтиленгликоля или его производного - от 0,001 до 5% мас./об.
К этому раствору необязательно добавляется определенный объем полярного растворителя, смешиваемого с раствором полимеров, такого как, например, этанол.
Можно также необязательно использовать поперечно сшивающий агент для улучшения устойчивости наночастиц, как описано в WO 02/069938. Среди поперечно сшивающих агентов, которые можно использовать, находятся диаминированные молекулы (например, 1,3 диаминопропан), полисахариды или одиночные сахариды, белки и, в целом, любая молекула, имеющая функциональные группы, которые способны взаимодействовать с группами ангидрида Gantrez. В способе по изобретению поперечная сшивка не обязательна, когда добавляются PEG, потому что это происходит одновременно. Должно добавляться очень небольшое количество указанных продуктов, если желательна их поперечная сшивка.
Наконец, добавляется аналогичный объем второй жидкости, не являющейся растворителем, предпочтительно, водно-спиртовой раствор. В одном варианте используется вода фармацевтического сорта (очищенная вода WFI в соответствии с заявкой). Отношение органической фазы к водно-спиртовому раствору находится предпочтительно в диапазоне от 1/1 до 1/10. Наночастицы формируются сразу в среде, имея вид молочной суспензии.
Органические растворители удаляются любым подходящим способом, таким как выпаривание под пониженным давлением, причем наночастицы остаются в устойчивой водной суспензии.
Наночастицы очищаются обычными средствами, такими как центрифугирование, ультрацентрифугирование, тангенциальная фильтрация или выпаривание, включая использование вакуума.
Наконец, их, при желании, можно лиофилизировать для их длительного хранения и консервации. Можно использовать обычные криопротективные агенты, такие как сахароза или маннит, для содействия лиофилизации, предпочтительно в концентрации в диапазоне от 0,1 до 10 мас.%.
Второй способ включает растворение биологически разлагаемого полимера в органическом растворителе, таком как ацетон. В последующем к этому раствору добавляются определенный объем водно-спиртового раствора, такого как этанол, и, наконец, аналогичный объем воды. Наночастицы сразу формируются в среде, и они имеют вид молочной суспензии. Органическ