Гликопэгилированный гранулоцитарный колониестимулирующий фактор
Иллюстрации
Показать всеНастоящее изобретение относится к конъюгатам пептида гранулоцитарного колониестимулирующего фактора, образованного присоединением через интактную гликозильную линкерную группу фрагментов ПЭГ. Указанные конъюгаты получают из гликозилированных и негликозилированных пептидов под действием гликозилтрансферазы. Гликозилтрансфераза присоединяет фрагмент модифицированного сахара к аминокислотному или гликозильному остатку пептида. Настоящее изобретение также относится к фармацевтическим композициям, содержащим указанные конъюгаты, и способам получения этих конъюгатов. 4 н. и 31 з.п. ф-лы, 11 ил., 3 табл.
Реферат
Перекрестные ссылки на родственные заявки
В настоящей заявке испрашивается приоритет по предварительной заявке на патент США № 60/526796, поданной 3 декабря 2003; предварительной заявке на патент США № 60/555813, поданной 23 марта 2004; предварительной заявке на патент США № 60/570282, поданной 11 мая 2004; предварительной заявке на патент США № 60/539387, поданной 26 января 2004; предварительной заявке на патент США № 60/592744, поданной 29 июля 2004; предварительной заявке на патент США № 60/614518, поданной 29 сентября 2004, и предварительной заявке на патент США № 60/623387, поданной 29 октября 2004, каждая из которых во всей своей полноте и для всех целей осуществления изобретения вводится в настоящее описание посредством ссылки.
Уровень техники
Гранулоцитарный колониестимулирующий фактор (G-CSF) представляет собой гликопротеин, который стимулирует выживание, пролиферацию, дифференцировку и осуществление функций клеток-предшественников нейтрофилов-гранулоцитов и зрелых нейтрофилов. В клинических целях используются две формы рекомбинантного человеческого G-CSF, которые являются сильными стимуляторами гранулопоэза нейтрофилов и имеют продемонстрированную эффективность в предупреждении инфекционных осложнений при некоторых нейтропениях. Они могут быть использованы для ускорения восстановления нейтрофилов после лечения миелодепрессантами.
G-CSF способствует снижению тяжести осложнений, вызываемых противораковой химиотерапией, благодаря уменьшению случаев развития фебрильной нейтропении и тяжести осложнений, вызываемых высокодозовой химиотерапией, проводимой в сочетании с трансплантацией костного мозга, а также способствует уменьшению случаев возникновения и продолжительности инфекционных заболеваний у пациентов с тяжелой хронической нейтропенией. Недавно было продемонстрировано, что G-CSF обладает терапевтическим действием при его введении после начала инфаркта миокарда.
Человеческая форма G-CSF была клонирована исследователями Японии и США в 1986 (см., например, Nagata et al., Nature 319:415-418, 1986). Природный человеческий гликопротеин присутствует в двух формах: одна из них состоит из 175 аминокислот, а другая - из 178 аминокислот. Превалирующая и более активная форма, состоящая из 175 аминокислот, была использована в продуцировании фармацевтических продуктов методом рекомбинантных ДНК.
Рекомбинантный человеческий G-CSF, синтезированный в экспрессионной системе E.coli, был назван филграстимом. Структура филграстима несколько отличается от структуры природного гликопротеина. Другая форма рекомбинантного человеческого G-CSF называется ленограстимом и была синтезирована в клетках яичника китайского хомячка (СНО).
hG-CSF представляет собой мономерный белок, который димеризует рецептор G-CSF посредством образования комплекса 2:2 из 2 молекул G-CSF и двух рецепторов (Horan et al., Biochemistry 35(15):4886-96 (1996)). В исследованиях, проводимых с помощью рентгеновской кристаллографии, нижеследующие остатки hG-CSF были идентифицированы как часть контактных областей, связывающихся с рецептором, а именно такие остатки, как G4, P5, A6, S7, S8, L9, P10, Q11, S12, L15, K16, E19, Q20, L108, D109, D112, T115, T116, Q119, E122, E123 и L124 (см., например, Aritomi et al. (1999) Nature 401:713).
Коммерчески доступные формы rhG-CSF имеют кратковременный фармакологический эффект, и в большинстве случаев они должны быть введены более одного раза в день на протяжении всего курса лечения лейкопении. Использование молекулы с более длительным временем полужизни в кровотоке позволяет уменьшить число введений, необходимых для ослабления лейкопении и предупреждения последующих возможных инфекций. Другой проблемой, связанной с использованием существующих в настоящее время продуктов rG-CSF, является возникновение дозозависимой боли в костях. Поскольку боль в костях, возникающая у пациентов, является серьезным побочным эффектом, вызываемым лечением с применением rG-CSF, то было бы желательно получить такой продукт rG-CSF, который не вызывал бы боли в костях, либо использовать такой продукт, который по своей природе не обладает таким эффектом или является эффективным в достаточно малых дозах, не вызывающих боли в костях. Таким образом, необходимость в улучшении свойств рекомбинантных молекул G-CSF является совершенно очевидной.
В литературе сообщалось о получении сконструированных на основе белка вариантов hG-CSF (патенты США № 5581476, 5214132, 5362853, 4904584 и Riedhaar-Olson et al., Biochemistry 35:9034-9041, 1996). Была также описана модификация hG-CSF и других полипептидов, которая заключается во введении, по меньшей мере, одной дополнительной углеводной цепи по сравнению с природным полипептидом (патент США № 5218092). Кроме того, были описаны и исследованы полимерные модификации природного hG-CSF, включая присоединение групп ПЭГ (см., например, Satake-Ishikawa et al. (1992) Cell Structure and Function 17:157; Bowen et al. (1999) Experimental Hematology 27:425; патент США № 5824778; патент США № 5824784, WO 96/11953, WO 95/21629 и WO 94/20069).
Присоединение синтетических полимеров к пептидному остову в целях улучшения фармакокинетических свойств терапевтического гликопротеина известно специалистам. Репрезентативным полимером, который был конъюгирован с пептидами, является полиэтиленгликоль (“ПЭГ”). Было продемонстрировано использование ПЭГ в целях дериватизации терапевтических пептидов для снижения иммуногенности данных пептидов. Так, например, в патенте США № 4179337 (Davis et al.) описаны неиммуногенные полипептиды, такие как ферменты и пептидные гормоны, присоединенные к полиэтиленгликолю (ПЭГ) или к полипропиленгликолю. Увеличение размера ПЭГ-конъюгата рассматриваемых полипептидов, помимо снижения иммуногенности, также приводит к увеличению времени выведения из кровотока.
Основным способом присоединения ПЭГ и его производных к пептидам является неспецифическое связывание посредством аминокислотного остатка пептида (см., например, патент США № 4088538, патент США № 4496689, патент США № 4414147, патент США № 4055635 и РСТ WO 87/00056). Другим способом присоединения ПЭГ к пептидам является неспецифическое окисление гликозильных остатков на гликопептиде (см., например, WO 94/05332).
Эти неспецифические методы предусматривают рандомизированное неспецифическое присоединение полиэтиленгликоля к реакционноспособным остаткам на пептидном остове. Очевидно, что рандомизированное присоединение молекул ПЭГ имеет свои недостатки, включая отсутствие гомогенности конечного продукта и возможное снижение биологической или ферментативной активности такого пептида. Поэтому, для продуцирования терапевтических пептидов, наилучшей стратегией является дериватизация, которая приводит к образованию специфически меченного легко характеризуемого и, по существу, гомогенного продукта. И такие методы были разработаны.
Специфически меченные гомогенные пептиды с терапевтическими свойствами могут быть продуцированы in vitro под действием ферментов. В отличие от стандартных неспецифических методов присоединения синтетического полимера или другой метки к пептиду, ферментативный синтез имеет те преимущества, что он является региоселективным и стереоселективным. Двумя основными классами ферментов, используемых в синтезе меченых пептидов, являются гликозилтрансферазы (например, сиалилтрансферазы, олигосахарилтрансферазы, N-ацетилглюкозаминилтрансферазы) и гликозидазы. Эти ферменты могут быть использованы для специфического присоединения сахаров, которые могут быть затем модифицированы так, чтобы они содержали терапевтический фрагмент. Альтернативно, гликозилтрансферазы и модифицированные гликозидазы могут быть использованы для прямого переноса модифицированных сахаров на пептидный остов (см., например, патент США № 6399336 и публикации заявок на патенты США 20030040037, 20040132640, 20040137557, 20040126838 и 20040142856, каждая из которых вводится в настоящее описание посредством ссылки). Методы комбинирования элементов, полученных химическим и ферментативным синтезом, также известны специалистам (см., например, работу Yamamoto et al. Carbohydr. Res. 305:415-422 (1998) и публикацию заявки на патент США 20040137557, которые вводятся в настоящее описание посредством ссылки).
Для решения проблемы, связанной с необходимостью создания более эффективного терапевтического G-CSF, настоящее изобретение было направлено на получение гликопэгилированного G-CSF, который является терапевтически активным и обладает улучшенными фармакокинетическими параметрами и свойствами по сравнению с идентичными или близкородственными аналогами негликопэгилированного пептида G-CSF. Кроме того, настоящее изобретение относится к способу высокоэффективного и промышленного синтеза пептидов G-CSF с улучшенными свойствами.
Сущность изобретения
Было обнаружено, что регулируемая модификация гранулоцитарного колониестимулирующего фактора (G-CSF) одной или несколькими полиэтиленгликолевыми группами позволяет получить новые производные G-CSF с улучшенными фармакокинетическими свойствами по сравнению с соответствующим природным (непэгилированным) G-CSF (фиг.3). Кроме того, фармакологическая активность гликопэгилированного G-CSF является примерно такой же, как активность коммерчески доступного монопэгилированного филграстима (фиг.4).
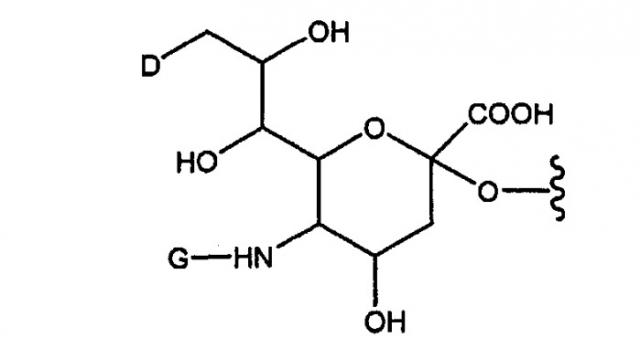
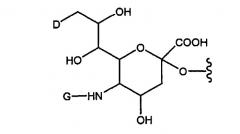
В репрезентативном варианте изобретения “гликопэгилированные” молекулы G-CSF согласно изобретению получают путем опосредуемого ферментом образования конъюгата, содержащего гликозилированный или негликозилированный пептид G-CSF и ферментативно переносимый сахарный фрагмент, в структуру которой входит остаток полиэтиленгликоля. Остаток ПЭГ присоединен к сахарному фрагменту непосредственно (т.е. посредством одной группы, образованной в результате взаимодействия двух реакционноспособных групп) или посредством линкера, например замещенного или незамещенного алкила, замещенного или незамещенного гетероалкила и т.п. Пример переносимой ПЭГ-сахарной структуры приводится на фиг.5.
Таким образом, в одном из своих аспектов настоящее изобретение относится к конъюгату, содержащему остаток ПЭГ, например ПЭГ и пептид, который обладает in vivo активностью, аналогичной или почти аналогичной активности известного G-CSF. В конъюгате согласно изобретению остаток ПЭГ ковалентно присоединен к пептиду посредством интактной гликозильной линкерной группы. Репрезентативными интактными гликозильными линкерными группами являются молекулы сиаловой кислоты, дериватизированные полиэтиленгликолем (ПЭГ).
В одном из своих репрезентативных аспектов настоящее изобретение относится к пептиду G-CSF, который включает фрагмент:
В вышеуказанной формуле, D представляет собой -ОН или R1-L-НN-. Символ G означает R1-L или С(О)(С1-С6)алкил. R1 представляет собой группу, содержащую линейный или разветвленный остаток полиэтиленглиголя, а L означает линкер, который выбран из связи, замещенного или незамещенного алкила и замещенного или незамещенного гетероалкила. В общих чертах, если D представляет собой ОН, то G представляет собой R1-L, а если G представляет собой -С(О)(С1-С6)алкил, то D представляет собой R1-L-NН-. В модифицированных структурах сиаловой кислоты, описанных в настоящей заявке, СООН также представляет собой СОO- и/или его соль.
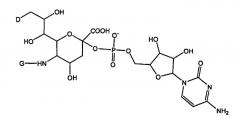
В другом своем аспекте настоящее изобретение относится к способу получения ПЭГилированного G-CSF, содержащего фрагмент, описанный выше. Способ согласно изобретению включает (а) контактирование субстрата пептида G-CSF с донорным фрагментом “ПЭГ-сиаловая кислота” и с ферментом, переносящим ПЭГ-сиаловую кислоту на аминокислотный или гликозильный остаток G-CSF в условиях, подходящих для такого переноса. Репрезентативный донорный фрагмент “ПЭГ-сиаловая кислота” имеет формулу:
В одном из вариантов изобретения указанным хозяином является клетка млекопитающего. В других вариантах осуществления изобретения клеткой-хозяином является клетка насекомого, растения, бактерий или грибов.
Фармакокинетические свойства соединений согласно изобретению могут быть легко изменены путем изменения структуры, числа или положения сайта(ов) гликозилирования пептида. Таким образом, объем настоящего изобретения включает способ добавления одной или нескольких мутаций, которые вводят сайт О- или N-связанного гликозилирования в пептид G-CSF и которые отсутствуют в молекуле дикого типа. Антитела против этих мутантов и их гликозилированных конечных продуктов и промежуточных соединений также входят в объем настоящего изобретения.
В другом своем аспекте настоящее изобретение относится к G-CSF-конъюгату, содержащему набор остатков ПЭГ, например ПЭГ, ковалентно связанного с G-CSF посредством интактной гликозильной линкерной группы. В конъюгате согласно изобретению, по существу, каждый член данного набора связан посредством гликозильной линкерной группы с гликозильным остатком пептида и каждый гликозильный остаток имеет идентичную структуру.
В своем репрезентативном варианте настоящее изобретение относится к G-CSF-конъюгату, содержащему набор остатков ПЭГ, например ПЭГ, ковалентно связанного с G-CSF посредством интактной гликозильной линкерной группы. В конъюгате согласно изобретению, по существу, каждый член данного набора связан с аминокислотным остатком пептида и каждый аминокислотный остаток, к которому присоединен данный полимер, имеет идентичную структуру. Так, например, если один из пептидов включает связанный с Thr гликозильный остаток, то, по меньшей мере, примерно 70%, 80%, 90%, 95%, 97%, 99%, 99,2%, 99,4%, 99,6% или, более предпочтительно, 99,8% пептидов в данном наборе будут иметь одинаковое число гликозильных остатков, ковалентно связанных с одним и тем же остатком Thr. Представленное выше обсуждение в равной степени относится к сайтам О-гликозилирования и N-гликозилирования.
Настоящее изобретение также относится к фармацевтической композиции. Такая композиция включает фармацевтически приемлемый носитель и ковалентный конъюгат, содержащий неприродный остаток ПЭГ и гликозилированный или негликозилированный пептид G-CSF.
Другие цели и преимущества настоящего изобретения будут очевидны из нижеследующего подробного описания изобретения.
Описание графического материала
На фиг.1 представлена структура G-CSF, которая иллюстрирует наличие и локализацию потенциального гликозилирования у остатка Thr 133 (Thr 134, если присутствует метионин).
На фиг.2 представлена схема, иллюстрирующая репрезентативный вариант настоящего изобретения, в котором углеводный остаток на пептиде СGS ремоделирован путем ферментативного присоединения группы GаlNac к гликозильному остатку у Thr 133 (Thr 134, если присутствует метионин) с последующим присоединением ПЭГ-дериватизированного сахарного фрагмента.
На фиг.3 представлены графики, иллюстрирующие сравнение времени пребывания in vivo негликозилированного G-CSF, NeulastaТМ и ферментативно гликопэгилированного G-CSF.
На фиг.4 представлены графики, иллюстрирующие сравнение активностей различных молекул, указанных на фиг.3.
На фиг.5 представлена схема синтеза для продуцирования репрезентативного предшественника “ПЭГ-гликозилированная линкерная группа” (модифицированного сахара) согласно изобретению в целях получения конъюгатов согласно изобретению.
На фиг.6 представлены репрезентативные аминокислотные последовательности G-CSF. SEQ ID NO:1 представляет собой вариант, состоящий из 175 аминокислот, где первой аминокислотой является метионин и где треониновый остаток присутствует в положении 134. SEQ ID NO:2 представляет собой вариант, который содержит 174 аминокислоты и имеет такую же последовательность, как и последовательность, состоящая из 175 аминокислот, за исключением того, что в ней отсутствует инициирующий метионин, а поэтому эта последовательность начинается с Т, а треониновый остаток находится в положении 133.
На фиг.7 проиллюстрированы некоторые репрезентативные содержащие модифицированный сахар нуклеотиды, используемые для осуществления настоящего изобретения.
На фиг.8 проиллюстрированы другие репрезентативные, содержащие модифицированный сахар нуклеотиды, используемые для осуществления настоящего изобретения.
На фиг.9 продемонстрировано продуцирование рекомбинантного G-CSF в бактериях, выращенных в различных средах и индуцированных IPTG.
На фиг.10 проиллюстрирован Вестерн-блот-анализ подвергнутого рефолдингу G-CSF после хроматографии на SР-сефарозе.
На фиг.11 представлена таблица сиалилтрансфераз, которые используются для переноса описанных здесь модифицированной молекулы сиаловой кислоты и немодифицированной сиаловой кислоты на акцептор.
Подробное описание настоящего изобретения и его предпочтительных вариантов
Сокращения
ПЭГ - полиэтиленгликоль; PPG (ППГ) - полипропиленгликоль; Ara - арабинозил; Fru - фруктозил; Fuc - фукозил; Gal - галактозил; GalNac - N-ацетилгалактозаминил; Glc - глюкозил; GlcNAc - N-ацетилглюкозаминил; Man - маннозил; ManAc - маннозаминилацетат; Xyl - ксилозил; NeuAc - сиалил(N-ацетилнейраминил); М6Р - маннозо-6-фосфат; Sia - сиаловая кислота, N-ацетилнейраминил и их производные и аналоги.
Определения
Если это не определено особо, то все используемые здесь технические и научные термины имеют общепринятое значение, известное специалистам в области, к которой относится настоящее изобретение. В общих чертах, используемая здесь номенклатура и лабораторные процедуры, применяемые в культивировании клеток, молекулярной генетике, органической химии и химии синтеза нуклеиновых кислот, а также в методе гибридизации, являются хорошо известными и подробно описаны в литературе. Для синтеза нуклеиновых кислот и пептидов применяются стандартные методы. Такие методы и процедуры обычно осуществляют стандартными способами, описанными в литературе и в различных общих руководствах (в общих чертах, см. руководство Sambrook et al., Molecular Cloning: A Laboratory Manual, 2d ed. (1989) Cold Spring Harbor Laboratory Press, Cold Spring Harbor, NY, которое вводится в настоящее описание посредством ссылки), и эти способы также описаны в данном документе. Используемая здесь номенклатура и лабораторные процедуры, применяемые в аналитической химии и в химии органического синтеза и описанные ниже, хорошо известны и подробно описаны в литературе. Для химического синтеза и химических анализов применяются стандартные методы или их модификации.
Все описанные здесь олигосахариды имеют названия или сокращения, принятые для невосстанавливающего сахарида (т.е. Gаl) и соответствующие конфигурации гликозидной связи (α или β), связи в кольце (1 или 2) и положению восстанавливающего сахарида в кольце, участвующего в образовании связи (2, 3, 4, 6 или 8), а также названия или сокращения, принятые для восстанавливающего сахарида (т.е. GlcNAc). Каждый из сахаридов предпочтительно является пиранозой. Описание стандартной номенклатуры, используемой в биологии гликозилирования, можно найти в руководстве Essentials of Glycobiology Varki et al., eds. CSHL Press (1999).
Считается, что олигосахариды должны иметь восстанавливающий конец и невосстанавливающий конец, независимо от того, является ли сахарид, находящийся у восстанавливающего конца, действительно восстанавливающим сахаром или нет. В соответствии с общепринятой номенклатурой описанные здесь олигосахариды слева имеют невосстанавливающий конец, а справа - восстанавливающий конец.
Термин “сиаловая кислота” означает любой член семейства карбоксилированных сахаров из девяти атомов углерода. Наиболее распространенным членом семейства сиаловых кислот является N-ацетил-нейраминовая кислота (2-кето-5-ацетамидо-3,5-дидезокси-D-глицеро-D-галактононулопирано-1-оновая кислота (часто сокращенно называемая Neu5Ac, NeuAc или NANA)). Вторым членом такого семейства является N-гликолил-нейраминовая кислота (Neu5Gc или NeuGc), в которой N-ацетильная группа NeuAc является гидроксилированной. Третьим членом семейства сиаловых кислот является 2-кето-3-дезокси-нонулозоновая кислота (KDN) (Nadano et al., (1986) J. Biol. Chem. 261:11550-11557; Kanamori et al. J. Biol. Chem. 265:21811-21819 (1990)). В объем настоящего изобретения также входят 9-замещенные сиаловые кислоты, такие как 9-О-С1-С6ацил-Neu5Ac, например 9-О-лактил-Neu5Ac или 9-О-ацетил-Neu5Ac, 9-дезокси-9-фтор-Neu5Ac и 9-азидо-9-дезокси-Neu5Ac. Описание семейства сиаловых кислот можно найти, например, в публикации Varki, Glycobiology 2:25-40 (1992) Sialic Acids: Chemistry, Methabolism and Function, R. Schauer Ed. (Springer-Verlag, New York (1992)). Синтез и использование соединений сиаловой кислоты в процедуре сиалилирования описаны в Международной заявке WO 92/16640, опубликованной 1 октября 1992.
Термин “гранулоцитарный колониестимулирующий фактор”, или “пептид гранулоцитарного колониестимулирующего фактора”, или “G-CSF”, или “пептид G-CSF” относится к любому пептиду дикого типа или к мутированному пептиду, к рекомбинантному или нативному G-CSF или любому его фрагменту, обладающему активностью, аналогичной активности нативного G-CSF или имитирующей эту активность. Обычно, этот термин также охватывает непептидные миметики G-CSF. В репрезентативном варианте изобретения пептид G-CSF имеет аминокислотную последовательность, представленную в SEQ ID NO:1. В других репрезентативных вариантах изобретения пептид G-CSF имеет последовательность, выбранную из SEQ ID NO:3-11.
Термин “активность гранулоцитарного колониестимулирующего фактора” означает любую активность, включая, но не ограничиваясь ими, связывание с рецептором и активацию рецептора, ингибирование связывания с рецептором или любую биохимическую или физиологическую реакцию, которая обычно происходит под действием гранулоцитарного колониестимулирующего фактора дикого типа. Активность гранулоцитарного колониестимулирующего фактора может быть индуцирована под действием любого пептида гранулоцитарного колониестимулирующего фактора, определенного выше.
Термин “пептид” означает полимер, в котором мономеры представляют собой аминокислоты и соединены друг с другом амидными связями и который, альтернативно, называется полипептидом. Кроме того, этот термин также охватывает неприродные аминокислоты, например β-аланин, фенилглицин и гомоаргинин. В настоящем изобретении могут быть также использованы аминокислоты, которые не кодируются генами. Кроме того, в настоящем изобретении могут быть также использованы аминокислоты, которые были модифицированы путем включения реакционноспособных групп, сайтов гликозилирования, полимеров, терапевтических молекул, биомолекул и т.п. Все аминокислоты, используемые в настоящем изобретении, могут быть либо D-изомерами, либо L-изомерами. Обычно, предпочтительным является L-изомер. Кроме того, в настоящем изобретении могут быть также использованы другие пептидомиметики. Используемый здесь термин “пептид” означает гликозилированные и негликозилированные пептиды. Могут быть также использованы пептиды, которые являются неполностью гликозилированными в системе, экспрессирующей данный пептид. Общий обзор можно найти у Spatola A.F. Chemistry and Biochemistry of Amino Acids, Peptides and Proteins, B. Weinstein, eds., Marcel Dekker, New York, p.267 (1983).
Термин “пептидный конъюгат” означает молекулу согласно изобретению, в которой пептид конъюгирован с описанным здесь модифицированным сахаром.
Термин “аминокислота” означает природные и синтетические аминокислоты, а также аналоги и миметики аминокислот, которые имеют такие же функции, как и природные аминокислоты. Природными аминокислотами являются аминокислоты, кодируемые генетическим кодом, а также аминокислоты, которые были затем модифицированы, например гидроксипролин, γ-карбоксиглутамин и О-фосфосерин. “Аминокислотные аналоги” означают соединения, которые имеют такую же основную химическую структуру, как и природные аминокислоты, то есть содержат α-углерод, связанный с водородом, карбоксильной группой, аминогруппой и R-группой, например гомосерин, норлейцин, метионинсульфоксид, метионинметилсульфоний. Эти аналоги имеют модифицированные R-группы (например, норлейцин) или модифицированные пептидные остовы, но, при этом, сохраняют основную химическую структуру, присущую природной аминокислоте. Термин “аминокислотные миметики” означает химические соединения, которые имеют структуру, отличающуюся от общей химической структуры аминокислот, но обладающую функцией, аналогичной функции природной аминокислоты. Используемый здесь термин “аминокислота”, независимо от того, присутствует ли она в линкере или в компоненте пептидной последовательности, означает D- и L-изомер аминокислоты, а также смеси этих двух изомеров.
Используемый здесь термин “модифицированный сахар” означает природный или неприродный углевод, который ферментативно присоединен к аминокислоте или к гликозильному остатку пептида способом согласно изобретению. Модифицированный сахар выбирают из ряда субстратов фермента, включая, но не ограничиваясь ими, сахарсодержащие нуклеотиды (моно-, ди- и трифосфаты), активированные сахара (например, гликозилгалогениды, гликозилмезилаты) и сахара, которые не являются активированными и не содержатся в нуклеотидах. “Модифицированный сахар” ковалентно связан с функциональной “модифицирующей” группой. Подходящими модифицирующими группами являются, но не ограничиваются ими, молекулы ПЭГ, терапевтические молекулы, диагностические молекулы, биомолекулы и т.п. Модифицирующая группа, предпочтительно, не является природным или немодифицированным углеводом. Положение функциональной модифицирующей группы выбирают так, чтобы эта группа не препятствовала образованию “модифицированного сахара” в результате ферментативного присоединения этой группы к пептиду.
Термин “водорастворимый” относится к молекулам, которые обладают определенной детектируемой степенью растворимости в воде. Методы детекции и/или оценки растворимости в воде хорошо известны специалистам. Репрезентативными ПЭГ-частями являются пептиды, сахариды, полиэфиры, полиамины, поликарбоновые кислоты и т.п. Пептиды могут иметь смешанные последовательности или могут состоять из одной аминокислоты, например полилизина. Аналогичным образом, сахариды могут иметь смешанные последовательности или могут состоять из одной сахаридной субъединицы, например декстрана, амилозы, хитозана и полисиаловой кислоты. Примером полиэфира является полиэтиленгликоль. Примером полиамина является полиэтиленимин, а репрезентативной поликарбоновой кислотой является полиакриловая кислота.
Используемый здесь термин “гликозильная линкерная группа” означает гликозильный остаток, к которому ковалентно присоединен агент (например, остаток ПЭГ, терапевтическая молекула, биомолекула). В способах согласно изобретению “гликозильная линкерная группа” ковалентно присоединяется к гликозилированному или к негликозилированному пептиду и тем самым связывает данный агент с аминокислотой и/или гликозильным остатком пептида. “Гликозильная линкерная группа” обычно образуется из “модифицированного сахара” в результате ферментативного присоединения “модифицированного сахара” к аминокислоте и/или к гликозильному остатку данного пептида. Термин “интактная гликозильная линкерная группа” означает линкерную группу, образующуюся из гликозильной части, в которой отдельные сахаридные мономеры, связывающие элементы конъюгата, не разлагаются, например не окисляются, например, под действием метапериодата натрия. “Интактные гликозильные линкерные группы” согласно изобретению могут образовываться из природного олигосахарида путем присоединения гликозильной(ых) единицы(единиц) или удаления одной или нескольких гликозильных единиц из исходной сахаридной структуры.
Используемый здесь термин “нацеливающая молекула” означает молекулу, которая может селективно локализоваться в конкретной ткани или области организма. Такая локализация опосредуется специфическим распознаванием молекулярных детерминант, размером молекулы указанного нацеливающего агента или конъюгата, ионными взаимодействиями, гидрофобными взаимодействиями и т.п. Другие механизмы доставки агента в конкретную ткань или область известны специалистам. Примерами нацеливающих молекул являются антитела, фрагменты антител, трансферрин, НS-гликопротеин, факторы свертывания крови, сывороточные белки, β-гликопротеин, G-CSF, GM-CSF, M-CSF, ЕРО и т.п.
Используемый здесь термин “фармацевтически приемлемый носитель” включает любой материал, который, при его объединении с конъюгатом, сохраняет активность данного конъюгата и не реагирует с иммунной системой пациента. Примерами таких носителей являются, но не ограничиваются ими, любой стандартный фармацевтический носитель, такой как забуференный фосфатом физиологический раствор, вода, эмульсии, такие как эмульсии типа “масло в воде”, и смачивающие агенты различных типов. Другими носителями могут быть также стерильные растворы, таблетки, включая таблетки с покрытиями и капсулы. Обычно, такие носители содержат наполнители, такие как крахмал, молоко, сахар, глины некоторых типов, желатин, стеариновую кислоту или ее соли, стеарат магния или кальция, тальк, растительные жиры или масла, смолы, гликоли или другие известные наполнители. Такими носителями могут быть также ароматизаторы, красители или другие ингредиенты. Композиции, содержащие такие носители, приготавливают хорошо известными стандартными методами.
Используемый здесь термин “введение” означает пероральное введение, введение в виде суппозиториев, введение путем местного контакта, внутривенное введение, внутрибрюшинное введение, внутримышечное введение, введение в пораженный участок, интраназальное введение или подкожное введение либо имплантацию индивидууму устройства пролонгированного высвобождения, например миниосмотического насоса. Введение может быть осуществлено любым способом, включая парентеральное и трансмукозальное введение (например, пероральное, интраназальное, вагинальное, ректальное или трансдермальное введение). Парентеральное введение включает, например, внутривенное, внутримышечное, интраартериолярное, внутрикожное, подкожное, внутрибрюшинное, интравентрикулярное и внутричерепное введение. Кроме того, если инъекцию вводят в целях уничтожения опухоли, например в целях индуцирования апоптоза, то такое введение может быть осуществлено непосредственно в опухоль и/или в ткани, окружающие опухоль. Другими способами введения являются, но не ограничиваются ими, использование липосомных препаратов, внутривенное вливание, использование чрезкожных пластырей и т.п.
Термин “облегчение” или “облегчать” означает любой признак положительной динамики в лечении патологии или состояния, включая объективные или субъективные параметры, такие как ослабление, ремиссия или уменьшение симптомов заболевания, или улучшение физического или психического состояния пациента. Облегчение симптомов может быть основано на объективных или субъективных параметрах, включая результаты обследования физического и/или психического состояния пациента.
Термин “терапия” означает “лечение” или “устранение” заболевания или состояния, включая предупреждение данного заболевания или состояния у животного, которое может иметь предрасположенность в развитию данного заболевания, но у которого еще отсутствуют или пока не обнаружены симптомы заболевания (профилактическое лечение), подавление развития заболевания (замедление или прекращение его развития), ослабление симптомов или побочных эффектов заболевания (включая паллиативное лечение) и улучшение динамики заболевания (приводящей к регрессии, т.е. к обратному развитию заболевания).
Термин “эффективное количество”, или “количество, эффективное для...”, или “терапевтически эффективное количество”, или любой грамматически эквивалентный термин означает количество, которое, при его введении животному для лечения заболевания, является достаточным для эффективного лечения такого заболевания.
Термин “выделенный” относится к материалу, который, по существу или в основном, не содержит компонентов, используемых для получения такого материала. Что касается пептидных конъюгатов согласно изобретению, то термин “выделенный” относится к материалу, который, по существу или в основном, не содержит компонентов, которые обычно присутствуют вместе с этим материалом в смеси, используемой для получения пептидного конъюгата. Термины “выделенный” и “чистый” являются взаимозаменяемыми. Выделенные пептидные конъюгаты согласно изобретению обычно имеют уровень чистоты, выражаемый, предпочтительно, в виде интервала значений. Нижняя граница интервала значений чистоты для пептидных конъюгатов составляет примерно 60%, примерно 79% или примерно 80%, а верхняя граница интервала значений чистоты для пептидных конъюгатов составляет примерно 70%, примерно 80%, примерно 90% или более чем примерно 90%.
Если пептидные конъюгаты имеют чистоту более чем примерно 90%, то их чистота также, предпочтительно, выражена в виде интервала значений. Нижняя граница этого интервала значений чистоты для пептидных конъюгатов составляет примерно 90%, примерно 92%, примерно 94%, примерно 96% или примерно 98%. Верхняя граница интервала значений чистоты для пептидных конъюгатов составляет примерно 92%, примерно 94%, примерно 96%, примерно 98% или примерно 100%.
Чистоту определяют хорошо известными аналитическими методами (например, по интенсивности полосы на окрашенном серебром геле, с помощью электрофореза в полиакриламидном геле, с помощью ВЭЖХ или аналогичными методами).
Используемый здесь термин “в основном, каждый член популяции” описывает свойства популяции пептидных конъюгатов согласно изобретению, в которых множество идентичных акцепторных сайтов на пептиде содержит выбранный процент модифицированных сахаров, присоединенных к пептиду. Термин “в основном, каждый член популяции”, упоминаемый в связи с “гомогенностью” этих сайтов на пептиде, конъюгированном с модифицированным сахаром, относится к конъюгатам согласно изобретению, которые являются гомогенными, по меньшей мере, примерно на 80%, предпочтительно, примерно, по меньшей мере, на 90%, а более предпочтительно, примерно, по меньшей мере, на 95%.
Термин “гомогенность” относится к структурному составу всей популяции акцепторных фрагментов, с которыми конъюгированы модифицированные сахара. Так, например, говорят, что пептидный конъюгат согласно изобретению, в котором каждый фрагмент модифицированного сахара конъюгирован с акцепторным сайтом, имеющим такую же структуру, как и акцепторный сайт, с которым конъюгирован любой другой модифицированный сахар, является гомогенным примерно на 100%. Гомогенность обычно выражена в виде интервала значений. Нижняя граница интервала гомогенности для пептидных конъюгатов составляет примерно 60%, примерно 70% или примерно 80%, а верхняя граница интервала частоты для пептидных конъюгатов составляет примерно 70%, примерно 80%, примерно 90% или более чем примерно 90%.
Если пептидные конъюгаты имеют гомогенность, равную или составляющую примерно более 90%, то их гомогенность также, предпочтительно, выражена в виде интервала значений. Нижняя граница интервала гомогенности для пептидных конъюгатов составляет примерно 90%, примерно 92%, примерно 94%, примерно 96% или примерно 98%. Верхняя граница интервала гомогенности для пептидных конъюгатов составляет примерно 92%, примерно 94%, примерно 96%, примерно 98% или примерно 100%. Чистоту пептидных конъюгатов обычно определяют одним или несколькими методами, известными специалистам, например, с помощью жидкостной хроматографии-масс-спектрометрии (ЖХ-МС), лазерной десорбционной времяпролетной масс-спектрометрии (MALDITOF), капиллярного электрофореза и т.п.
Термины “по существу, однородная гликозилированная форма” или “по существу, однородная картина гликозилирования”, если они относятся к гликопептидам, означают процент акцепторных фрагментов, гликозилированных под действием представляющей интерес гликозилтрансферазы (например, фукозилтрансферазы). Так, например, в случае α-1,2-фукозилтрансферазы, по существу, однородная картина фукозилирования наблюдается в том случае, когда в пептидном конъюгате согласно изобретению фукозилированы почти все (как определено ниже) фрагменты Gаlβ1,4-GlcNac-R и их сиалилированные аналоги. Для специалистов в этой области очевидно, что исходный материал может содержать гликозилированные акцепторные фрагменты (например