Система для спектроскопии пропускания для использования при определении анализируемых веществ в жидкости организма
Иллюстрации
Показать всеИзобретение относится к спектроскопии полного пропускания для определения концентрации анализируемого вещества в пробе жидкости. Система включает область размещения пробы, источник света, коллимирующую линзу, первую линзу, вторую линзу и датчик. Область размещения пробы выполнена из оптически прозрачного материала с возможностью помещения в нее анализируемой пробы. Коллимирующая линза принимает свет от источника света и направляет на область размещения пробы. Первая линза принимает обычный и рассеянный свет, прошедший через пробу, с первым углом расхождения. На первую линзу попадает свет с первым углом приема. Из первой линзы выходит свет со вторым углом расхождения, меньшим первого. Вторая линза принимает свет от первой линзы, и из нее выходит по существу коллимированный луч света. Изобретение позволяет повысить точность измерения концентрации анализируемого вещества. 5 н. и 40 з.п. ф-лы, 14 ил.
Реферат
Область техники, к которой относится изобретение
Настоящее изобретение относится к спектроскопии в целом и к использованию спектроскопии полного пропускания для определения концентрации анализируемого вещества в жидкости организма, в частности.
Уровень техники
Спектроскопия пропускания применяется для проведения количественного анализа пробы на основе прохождения светового луча через пробу, содержащуюся в кювете. Компоненты пробы поглощают различные частотные составляющие светового луча, поэтому спектральный анализ прошедшего через пробу луча позволяет проводить анализ самой пробы. Сухие химические реагенты растворяются в пробе, они взаимодействуют с анализируемым веществом с образованием хроматического отклика на некоторых длинах волн в диапазоне от 450 нанометров (нм) до приблизительно 950 нм.
Спектроскопия пропускания является одним из методов измерения концентрации анализируемого вещества (например, глюкозы, лактата, фруктозамина, гемоглобина A1c и холестерина) в жидкости организма (например, крови, плазме или сыворотке, слюне, моче и тканевой жидкости). Система индикаторных реагентов и анализируемое вещество в пробе жидкости организма вступают в хроматическую реакцию, т.е. реакцию между реагентом и анализируемым веществом, которая приводит к изменению цвета пробы. Степень изменения цвета указывает на концентрацию анализируемого вещества в жидкости организма. Изменение цвета пробы оценивают, например, с помощью спектроскопии, измеряя поглощение прошедшего света. Обычная спектроскопия пропускания подробно описана в патенте США №5866349. Диффузное отражение и флуоресцентная спектроскопия подробно описаны в патентах США №№5518689 "Diffuse Light Reflectance Readhead" ("Считывающая головка в системе с отражением диффузного света"); 5611999 "Diffuse Light Reflectance Readhead" ("Считывающая головка в системе с отражением диффузного света") и 5194393 "Optical Biosensor and Method of Use" ("Оптический биодатчик и способ его применения").
В простейшем случае анализ с помощью спектроскопии пропускания предусматривает применение источника света, который создает луч света, освещающий образец, и датчика для приема прошедшего через пробу света. Затем принятый прошедший свет сравнивают с эталонным образцом (например, светом, непосредственно принятым датчиком без прохождения через пробу). При обычной спектроскопии пропускания принимают и анализируют свет, выходящий из пробы под малыми углами (например, от приблизительно 0° до приблизительно 15°) относительно нормальной оптической оси, а не рассеянный свет, прошедший через пробу. Нормальная оптическая ось - это ось, перпендикулярная оптическим входному и выходному окошку кюветы с пробой. При спектроскопии полного пропускания принимают по существу весь свет (в т.ч. и рассеянный), выходящий из пробы под большими углами (например, от приблизительно 0° до приблизительно 90°) относительно нормальной оптической оси. В существующих системах для проведения анализа с помощью спектроскопии полного пропускания используется фотометрический шар для приема всего света, прошедшего через пробу, и фотоэлектронный умножитель, необходимый для приема отраженного света с малой части внутренней поверхности фотометрического шара.
Как сообщалось в статье "Data Preprocessing and Partial Least Squares Analysis for Reagentless Determination of Hemoglobin Concentration Using Conventional and Total Transmission Spectroscopy" ("Предварительная обработка данных и частичный анализ методом наименьших квадратов при безреагентном определении концентрации гемоглобина с применением обычной и полной спектроскопии пропускания"), опубликованной в апреле 2001 г. в Journal of Biomedical Optics (Журнале биомедицинской оптики) (том 6, №2), обычные уровни пропускания (без рассеянных составляющих) для цельной крови с содержанием гемоглобина от приблизительно 6,6 до 17,2 г/дл составляют от 15,8 до 0,1%Т по всему видимому и ближнему инфракрасному диапазону (например, от приблизительно 500 нм до приблизительно 800 нм) при длине пути всего лишь 100 мкм; однако уровни полного пропускания (с учетом рассеянного света) для цельной крови с содержанием гемоглобина в том же диапазоне составляют от 79 до 2%Т. Полное пропускание света с длиной волны от приблизительно 600 нм до приблизительно 800 нм составляет около 100%Т, и между разными уровнями гемоглобина существует очень малое различие. Таким образом, уровень концентрации гемоглобина оказывает малое влияние на пропускание света с длиной волны в диапазоне от приблизительно 600 нм до приблизительно 800 нм.
Недостатком существующих систем для проведения анализа с помощью спектроскопии полного пропускания является низкий уровень сигнала фотометрического шара, вследствие которого необходимо использовать фотоэлектронный умножитель для приема отраженного света с малой части внутренней поверхности фотометрического шара. Другим недостатком систем, использующих обычную и полную спектроскопию пропускания, является стоимость фотометрического шара и фотоэлектронного умножителя. Стоимость этих устройств исключает применение систем спектроскопии полного пропускания в устройствах, используемых пациентами для самопроверки, например определения уровня глюкозы в крови. В результате этого исследования в области применения спектроскопических систем для определения концентрации анализируемого вещества в пробе жидкости организма сосредоточились на измерении обычного пропускания света.
Однако существующие системы обычной спектроскопии пропускания имеют ряд недостатков. Как отмечалось выше, они принимают только свет, выходящий из образца под малыми углами, используя для этого традиционные измерения, в результате чего часто теряется свет, выходящий из образца под большими углами. Значительная часть света, рассеянного красными кровяными тельцами, не собирается существующими системами с использованием обычных измерений пропускания. Это приводит к значительным потерям света и, следовательно, очень низким уровням пропускания через цельную кровь.
Для снижения потерь при пропускании в обычных системах пропускания обычно в пробу крови добавляют реагент или детергент, чтобы лизировать красные кровяные тельца. Разрушение стенок красных кровяных телец путем лизирования снижает рассеянную составляющую и повышает обычное прохождение света через пробу. Добавление лизирующего реагента и последующий лизис красных кровяных телец занимает время, являющееся достаточно продолжительным по сравнению с общей длительностью процесса измерения. Эта проблема отсутствует в существующих способах спектроскопии полного пропускания, поскольку оптические средства собирают и рассеянный, и обычный прошедший свет. Уровни полного пропускания обычно достаточно высоки, чтобы устранить необходимость в лизисе красных кровяных телец, что значительно сокращает общее время химического анализа.
Другим недостатком, связанным с существующими системами обычной спектроскопии пропускания, является смещение пропускания при длинах волн света, соответствующих области протекания хроматической реакции. Индикаторный реагент может вступать в реакцию с внутриклеточными компонентами (например, гемоглобином, лактатдегидрогеназой и др.), высвобождаемыми при лизисе красных кровяных телец, вызывая дополнительный цветовой отклик. Смещение пропускания, вызванное реакцией реагента с некоторыми внутриклеточными компонентами, такими как гемоглобин, не соответствует уровню глюкозы в крови. Такое смещение пропускания вызывает неточности в определении концентрации анализируемого вещества (например, глюкозы). Величина смещения связана с концентрацией некоторых клеточных компонентов в клетках крови.
Поскольку в способах спектроскопии полного пропускания не требуется лизис крови, количество внутриклеточных компонентов, которые могут повлиять на измерения глюкозы, значительно уменьшается. Однако смещение продолжает существовать для таких веществ, как гемоглобин, которые поглощают свет в видимом диапазоне при длинах волн менее чем приблизительно 600 нм. Из указанной выше статьи в журнале Journal of Biomedical Optics известно, что, например, спектр полного пропускания оксигемоглобина имеет пики поглощения при длинах волн приблизительно 542 нм и приблизительно 577 нм. Известно, что уровень поглощения при длинах волн приблизительно 542 нм или приблизительно 577 нм может использоваться для определения концентрации гемоглобина в пробе цельной крови. Остающуюся ошибку взаимодействия, вызываемую гемоглобином, при определении концентрации глюкозы можно исправить путем измерения полного пропускания при 542 нм или 577 нм и коррелирования поглощения с известной концентрацией гемоглобина.
Гематокрит цельной крови также может вызывать смещение пропускания ввиду различия составляющей рассеянного света при разных значениях гематокрита. Потери пропускания, вызванные различными значениями гематокрита, не отображают уровень глюкозы в крови. Существующие системы обычной или полной спектроскопии пропускания не способны определять различие значений гематокрита ввиду низкого уровня пропускания и малого разделения уровней гематокрита при определенных длинах волн света.
Другим недостатком существующих систем обычной спектроскопии пропускания является недостаточная точность, связанная с длиной пути в пробе. 10% изменение длины пути в пробе приводит к 10% ошибке в измерении концентрации как в способах обычной спектроскопии пропускания, так и в способах спектроскопии полного пропускания. Механические допуски, обуславливающие различие в длине пути, являются, по существу, одинаковыми независимо от длины пути. Однако в существующих системах, в которых используются обычные способы пропускания, нужны более короткие длины пути, чтобы компенсировать потери пропускания, вызванные рассеянием света красными кровяными тельцами. Таким образом, механический допуск при меньшей длине пути приводит к большим ошибкам при определении концентрации. Большая длина пути (применение которой возможно в системах спектроскопии полного пропускания, собирающих рассеянный свет от красных кровяных телец) снижает ошибку.
Таким образом, было бы желательным уменьшить или устранить описанные выше проблемы, связанные с существующими системами обычной и полной спектроскопии пропускания, при определении концентрации анализируемого вещества в жидкости организма.
Раскрытие изобретения
В соответствии с одним вариантом осуществления система для спектроскопии полного пропускания для применения при определении концентрации анализируемого вещества в пробе жидкости содержит область размещения пробы, источник света, коллимирующую линзу, первую линзу, вторую линзу и датчик. Область размещения пробы выполнена с возможностью помещения в нее анализируемой пробы. Область размещения пробы выполнена из по существу оптически прозрачного материала. Коллимирующая линза выполнена с возможностью принимать свет от источника света и освещать область размещения пробы по существу коллимированным лучом света. Первая линза принимает обычный и рассеянный свет, прошедший через пробу, с первым углом расхождения. На первую линзу попадает свет с первым углом приема. Из первой линзы выходит свет со вторым углом расхождения. Второй угол расхождения меньше первого угла расхождения. Вторая линза принимает свет от первой линзы, и из нее выходит по существу коллимированный луч света. Датчик измеряет свет, поступающий из второй линзы.
В соответствии с одним способом концентрацию анализируемого вещества в пробе жидкости определяют с помощью системы для спектроскопии полного пропускания. Анализируемую пробу помещают в область размещения пробы системы для спектроскопии полного пропускания. Луч света выходит из источника света. Выходящий из источника света луч является по существу коллимированным. Проба освещается по существу коллимированным лучом света от источника света. Первая линза принимает обычный и рассеянный свет, прошедший через пробу. Угол расхождения прошедшего света уменьшается первой линзой. Свет с меньшим углом расхождения попадает на вторую линзу. Поступающий во вторую линзу свет по существу коллимируется там. Датчик измеряет по существу коллимированный свет, выходящий из второй линзы.
В соответствии с одним способом свет, прошедший через пробу жидкости, измеряют с помощью системы для спектроскопии полного пропускания. Проба освещается по существу коллимированным лучом света. Первая линза принимает обычный и рассеянный свет, прошедший через пробу. Угол расхождения прошедшего света уменьшается первой линзой. Прошедший свет по существу коллимируется второй линзой после уменьшения угла расхождения. Датчик измеряет по существу коллимированный, прошедший через пробу свет.
В соответствии с другим способом концентрацию анализируемого вещества в пробе жидкости измеряют с помощью системы для спектроскопии полного пропускания. Эта система включает источник коллимированного света, область размещения пробы, первую линзу, в которую поступает обычный и рассеянный свет, прошедший через пробу, вторую линзу, в которую поступает свет из первой линзы и из которой выходит по существу коллимированный луч света, и датчик. Проба взаимодействует с реагентом, обеспечивающим получение хроматической реакции в области размещения пробы. Пробу освещают по существу коллимированным лучом ближней инфракрасной части спектра, выходящим из источника света в системе. Свет ближней инфракрасной части спектра, прошедший через пробу, измеряют с помощью датчика системы. Пробу освещают по существу коллимированным лучом видимой части спектра, выходящим из источника света в системе. Свет видимой части спектра, прошедший через пробу, измеряют с помощью датчика. Определяют отношение измерений прошедшего через пробу видимого света к свету ближней инфракрасной части спектра.
В соответствии с еще одним способом концентрацию глюкозы в пробе крови определяют с помощью системы для спектроскопии полного пропускания. Эта система включает первую линзу, в которую поступает обычный и рассеянный свет, прошедший через пробу, вторую линзу, в которую поступает свет от первой линзы и из которой выходит по существу коллимированный луч света. Способ включает взаимодействие пробы крови с высушенным реагентом в области размещения пробы для получения хроматической реакции. Пробу освещают по существу коллимированным лучом видимой части спектра, выходящим из источника света в системе. Свет видимой части спектра, прошедший через пробу, измеряют с помощью датчика системы. Пробу освещают по существу коллимированным лучом ближней инфракрасной части спектра, выходящим из источника света. Свет ближней инфракрасной части спектра, прошедший через пробу, измеряют с помощью датчика. Вносят коррекцию на смещение пропускания, вызванное гематокритом пробы крови. Определяют концентрацию глюкозы в пробе крови.
Краткое описание чертежей
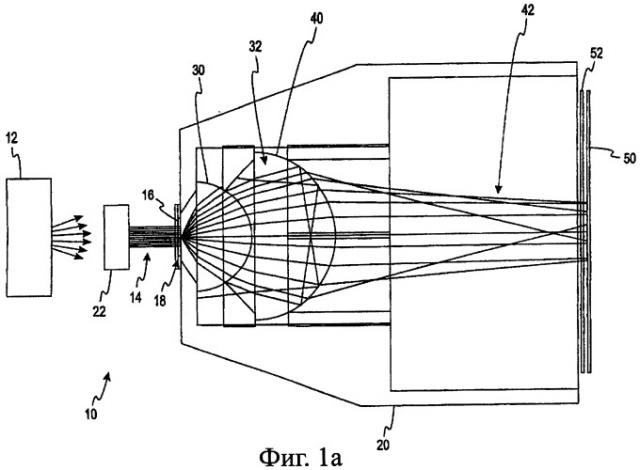
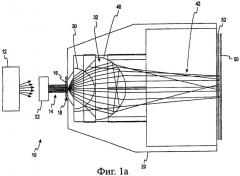
На Фиг.1а приведен вид сбоку системы для спектроскопии полного пропускания, используемой при определении концентрации анализируемого вещества в пробе жидкости в соответствии с первым вариантом осуществления настоящего изобретения.
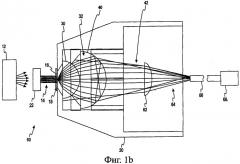
На Фиг.1b приведен вид сбоку системы для спектроскопии полного пропускания, используемой при определении концентрации анализируемого вещества в пробе жидкости в соответствии с другим вариантом осуществления настоящего изобретения.
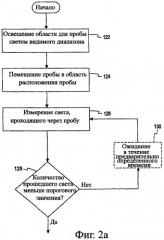
На Фиг.2а приведен алгоритм, описывающий работу системы согласно Фиг.1а в соответствии с первым вариантом осуществления настоящего изобретения, включающим датчик недостаточного наполнения для определения достаточности объема пробы.
На Фиг.2b приведен алгоритм, описывающий работу системы согласно Фиг.1а в соответствии с другим вариантом осуществления настоящего изобретения, способный вносить корректировку из-за смещения пропускания, вызванного гематокритом пробы крови.
На Фиг.2с приведен алгоритм, описывающий работу системы согласно Фиг.1а в соответствии с другим вариантом осуществления настоящего изобретения, способный вносить корректировку из-за смещения пропускания, вызванного гемоглобином в пробе крови.
На Фиг.3а приведены спектры полного пропускания, полученные в тестах цельной крови с гематокритом 20% при уровнях глюкозы 54, 105, 210 и 422 мг/дл в видимой и ближней инфракрасной части от 500 нм до 940 нм.
На Фиг.3b приведены спектры полного пропускания, полученные в тетах цельной крови с гематокритом 60% при уровнях глюкозы 59, 117, 239 и 475 мг/дл от видимой до ближней инфракрасной части спектра при длине волны от 500 нм до 940 нм.
На Фиг.4а приведены спектры полного пропускания согласно Фиг.3а с коррекцией на рассеяние путем отнесения всех значений пропускания к пропусканию при 940 нм.
На Фиг.4b приведены спектры полного пропускания согласно Фиг.3b с коррекцией на рассеяние путем отнесения всех значений пропускания к пропусканию при 940 нм.
На Фиг.5 приведен график ответного сигнала концентрации глюкозы в цельной крови при значениях гематокрита 20%, 40% и 60%, измеренного методом полного пропускания (в единицах поглощения) при 680 нм с помощью считывающей головки, изображенной на Фиг.1а.
На Фиг.6 приведен график ответного сигнала согласно Фиг.5 с коррекцией на смещение пропускания (в единицах поглощения), вызванное различными значениями гематокрита в пробах крови.
На Фиг.7 приведены спектры полного пропускания (в единицах поглощения) реагента и цельной крови при уровнях глюкозы 0, 100 и 400 мг/дл, а также воды и реагента в видимой и ближней инфракрасной части спектра от 500 нм до 940 нм.
На Фиг.8 приведена линейная зависимость между полным пропусканием (в единицах поглощения) при 680 нм реагента, прореагировавшего с цельной кровью, при концентрациях глюкозы 0, 50, 100, 200 и 450 мг/дл.
На Фиг.9 приведены спектры обычного и полного пропускания в диапазоне от 500 нм до 940 нм для цельной крови со значениями гематокрита 20%, 40% и 60%.
Хотя в изобретение могут быть внесены различные модификации или использованы альтернативные формы, на чертежах в качестве примера изображены конкретные варианты осуществления изобретения, которые подробно здесь описаны. Однако следует понимать, что изобретение не должно ограничиваться конкретными описанными вариантами. Изобретение охватывает все модификации, эквиваленты и альтернативы, которые включены в объем настоящего изобретения.
Осуществление изобретения
Рассмотрим теперь чертежи и вначале обратимся к Фиг.1а, где изображена система 10 для спектроскопии пропускания методом полного пропускания для использования при определении концентрации анализируемого вещества в биологической пробе, такой как проба жидкости организма. Неограничивающие примеры анализируемых веществ, концентрация которых может определяться, включают: глюкозу, лактат, фруктозамин, холестерин и гемоглобин A1c. Эти анализируемые вещества могут содержаться в жидкостях организма, таких как кровь (включая плазму и сыворотку крови), слюна, моча и тканевая жидкость.
Система 10 включает источник света 12. В соответствии с одним вариантом осуществления источник света является галогенной лампой, излучающей белый свет с длиной волны от приблизительно 300 нм до приблизительно 3200 нм. В соответствии с другим вариантом осуществления источник света 12 излучает два или более лучей монохроматического света благодаря светодиодам (СИД) с центральной длиной волны в диапазоне от приблизительно 400 нм до приблизительно 1000 нм. Свет от источника 12 поступает на коллимационную линзу 22, создающую по существу коллимированный луч света 14. Коллимированный луч света 14 освещает пробу 16, расположенную в области 18 размещения пробы считывающей головки 20.
В соответствии с одним вариантом осуществления проба содержит кровь и глюкозу, которая прореагировала с сухой реагентной системой, содержащей индикатор. В соответствии с одним вариантом осуществления индикаторный реагент глюкозы, который может использоваться, содержит глюкозодегидрогеназу, NAD (никотинамидадениндинуклеотид), диафоразу, тетразолиевый индикатор (WST-4)(2-бензотиазоил-3-(4-карбокси-2-метоксифенил)-5-[4-(2-сульфоэтилкарбамоил)фенил]-2Н-тетразолий) и полимеры. Следует понимать, что специалист в данной области техники сможет использовать различные ферменты (такие как PQQ-глюкозодегидрогсназа, глюкозооксидаза или лактатдегидрогеназа и т.д.), индикаторы и медиаторы, а также анализируемые вещества (такие как глюкоза, лактат и т.п.). Нет необходимости в том, чтобы в состав композиции реагента входил гемолизирующий агент, разрушающий красные кровяные тельца. Благодаря отсутствию необходимости в разрушении красных кровяных телец общее время исследования сокращается.
По существу коллимированный луч света 14 освещает пробу 16, и часть света проходит через пробу 16. Прошедший через пробу свет, включающий обычный и диффузно рассеянный свет, собирает первая линза 30 и вторая линза 40. В изображенных на чертежах вариантах осуществления первая и вторая линзы являются полусферическими. Следует понимать, что для приема пропущенного света могут использоваться и других типы линз, в т.ч. сферические и асферические.
В соответствии с альтернативным вариантом осуществления первая линза 30 собирает свет с углом приема приблизительно 72° или числовой апертурой (NA) приблизительно 0,951, однако угол приема имеет диапазон от 0° до 90° для сбора рассеянной части прошедшего света. Свет 32, выходящий из первой линзы 30, расходится под углом в диапазоне от приблизительно 15° до приблизительно 40°, а конкретнее приблизительно 20°. Вторая линза 40 уменьшает расхождение света 32, выходящего из первой линзы 30, до угла расхождения света 42 в диапазоне от 0° до приблизительно 10°, а конкретнее коллимирует от 0° приблизительно до 5°. Обычный и рассеянный свет, прошедший через пробу, не отклоняется или рассеивается первой и второй линзами 30, 40. Таким образом, пара линз 30, 40 собирает по существу весь свет, прошедший через пробу 16. Пара линз 30, 40 по существу коллимирует собранный свет и освещает датчик 50 почти с прямым углом падения. Расходящийся свет 42 имеет угол расхождения менее чем приблизительно 5°.
В соответствии с одним вариантом осуществления системы 10 для спектроскопии перед датчиком 50 может устанавливаться полосовой фильтр 52 или множество полосовых фильтров. Полосовой фильтр(ы) 52 обычно имеет центральную длину волны от приблизительно 400 до приблизительно 1000 нм и узкую полосу пропускания от приблизительно 5 до приблизительно 50 нм. Полосовой фильтр(ы) 52 обычно используется в случае, когда в качестве источника света 12 применяется источник белого света, такой как галогенная лампа. В альтернативном варианте полосовой фильтр может использоваться для изменения спектральной полосы светодиодного источника 12 или удаления составляющей окружающего света, которая не вносит вклад в прохождение света через пробу. Расходящийся свет 42 на полосовом фильтре(ах) 52 по существу коллимируется, потому что свет, проходящий через фильтр вне установленного для фильтра угла падения, окажется вне установленной полосы пропускания фильтра.
Первая и вторая линзы 30, 40 вместе повышают уровень светового сигнала, поступающего в датчик 50, потому что линзы 30, 40 собирают и направляют большую часть света, прошедшего через пробу 16 в датчик 50. Кроме того, уровень сигнала повышается путем направления в датчик 50 коллимированного луча света, который является по существу перпендикулярным поверхности датчика. Обычно угол расхождения коллимированного луча света меньше, чем приблизительно 5°. Нормальный угол падения к поверхности датчика 50 уменьшает потерю сигнала, вызванную френелевским отражением от поверхности датчика 50. Френелевское отражение является причиной значительных потерь света при углах падения более чем приблизительно 20°.
Собранный датчиком 50 свет 42 затем сравнивают с эталонным измерением, представляющим собой значение при отсутствии пробы (наличии только воздуха) в оптическом пути, для определения процента пропускания пробы и концентрации анализируемого вещества в пробе.
В соответствии с изображенным на чертеже вариантом осуществления системы 10 для спектроскопии датчик 50 и полосовой фильтр(ы) 52 по существу линейно совмещены со второй линзой 40. В соответствии с одним вариантом осуществления настоящего изобретения датчик 50 является кремниевым детектором. Однако следует понимать, что для приема пропущенного света могут использоваться и другие оптические датчики, в т.ч. другие типы фотодатчиков, такие как, например, датчики на сульфиде свинца или приборы с зарядовой связью (CCD). В других альтернативных вариантах осуществления датчик 50 и полосовой фильтр(ы) 52 не являются линейно совмещенными со второй линзой 40. Вместо этого световод или оптоволокно(а) (не изображены) имеет вход, по существу линейно совмещенный со второй линзой 40, и передает свет в датчик/фильтр, расположенный в другом месте, или в спектрограф. Спектроскопическая система 10 значительно улучшает уровень получаемого сигнала по сравнению с существующими системами для спектроскопии по методу полного пропускания, поскольку первая и вторая линзы 30, 40 передают свет непосредственно в датчик.
В соответствии с одним вариантом осуществления настоящего изобретения длина пути через пробу 16 составляет от приблизительно 40 мкм до приблизительно 200 мкм, а проба имеет диаметр, приблизительно равный 1 мм. В соответствии с одним вариантом осуществления первая линза 30 представляет собой пластиковую микрополусферическую линзу диаметром около 4 мм. Вторая собирающая линза 40 представляет собой пластиковую микрополусферическую линзу диаметром около 8 мм. Соотношение диаметров первой и второй линз, как правило, составляет приблизительно 1:2. В соответствии с одним вариантом осуществления первая и вторая полусферические линзы 30, 40 изготовлены из акрила.
Датчик 50 вырабатывает выходной сигнал, соответствующий поступающему в него свету. В соответствии с одним вариантом осуществления настоящего изобретения этот выходной сигнал отслеживается системой управления (не изображена) системы 10 для спектроскопии пропускания, которая содержит считывающую головку 20, для определения момента поступления пробы и заполнения области 18 размещения пробы в считывающей головке 20. В некоторых вариантах осуществления настоящего изобретения область 18 размещения пробы может быть частью капиллярного канала или является связанной с капиллярным каналом для заполнения области 18 размещения кюветы для пробы. В соответствии с одним вариантом осуществления область 18 размещения пробы выполнена из по существу оптически прозрачного материала.
Теперь рассмотрим Фиг.1b, где изображена система 60 для спектроскопии пропускания, используемая для определения концентрации анализируемого вещества в пробе жидкости согласно другому варианту осуществления. Система 60 для спектроскопии пропускания содержит множество таких же компонентов, как и система, описанная выше со ссылкой на Фиг.1а. Кроме того, система 60 для спектроскопии пропускания включает линзу связи 62, собирающую расходящийся свет 42. Линза связи 62 дополнительно уменьшает расхождение света 42 с получением расходящегося света 64 перед поступлением его в оптический кабель 66. Как показано на Фиг.1b, оптический кабель 66 передает расходящийся свет в спектрограф 68. В другом варианте осуществления спектрограф может быть заменен на датчик (например, датчик 50) на Фиг.1а. В таком варианте осуществления может быть добавлен фильтр, такой как (например, фильтр(ы) 52) описанный выше со ссылкой на Фиг.1а.
Для предотвращения или уменьшения ошибок, связанных с (а) недостаточным заполнением области 18 размещения пробы или (b) несогласованностью по времени, система управления отслеживает выходной сигнал датчика, который изменяется по мере заполнения области 18 для размещения пробы жидкостью организма (например, кровью). Временная последовательность, вариант осуществления которой описан со ссылкой на Фиг.2а, предусматривает достаточное время для протекания реакции между реагентом и содержащимся в пробе анализируемым веществом. Это улучшает общие результаты исследования, т.к. по существу точное согласование по времени может обеспечить более быстрое и надежное определение содержания анализируемого вещества.
Недостаточное заполнение имеет место, например, в случае получения слишком малой пробы для реакции с предварительно заданным количеством реагента, находящегося в области 18 размещения пробы. После приема прошедшего через пробу света, указывающего на заполнение области 18 размещения пробы, система управления "знает", что последующий выходной сигнал датчика 50 может использоваться для определения концентрации анализируемого вещества в пробе жидкости организма (например, пробе крови).
Кроме того, в соответствии с одним способом согласно настоящему изобретению после того, как датчик 50 обнаружит пробу или определенное количество пробы, система 10 инициирует временную последовательность, по окончании которой датчик 50 начинает принимать прошедший через пробу свет для проведения анализа. В соответствии с этим способом система 10 для спектроскопии пропускания, описанная со ссылкой на Фиг.2а, начинает работу с контроля области пробы с целью определения правильного момента времени, когда датчик 50 должен начать принимать прошедший через пробу свет. На этапе 122 пустая область 18 для размещения пробы (Фиг.1а) освещается светом от источника света 12. При отсутствии пробы в области размещения пробы уровень пропускания через систему 10 будет очень высоким (например, почти 100%). На этапе 124 проба поступает в область 18 размещения пробы. В соответствии с одним вариантом осуществления настоящего изобретения реагент, предназначенный для смешивания с пробой, в сухом виде заранее помещен в область 18 размещения пробы. В альтернативном варианте реагент может поступать вместе с пробой или после того, как проба поступит в область 18 размещения пробы.
На этапе 126 система 10 контролирует область 18 размещения пробы путем измерения света, прошедшего через пробу. На этапе 128 система 10 сравнивает количество прошедшего света, измеренное датчиком 50, с пороговым значением, хранящимся в памяти системы 10. Если измеренное количество превышает пороговое значение, система "приходит к выводу" о том, что на этапе 128 в область размещения пробы не поступило достаточное количество пробы, и на этапе 126 производится повторное измерение количества света, проходящего через область 18 размещения пробы. Система 10 может ожидать в течение предварительно заданного времени (например, 5 или 10 секунд) на этапе 130, прежде чем выполнит следующее измерение. Если измеренное количество света меньше порогового значения, которое хранится в памяти, система может начать выполнение анализа на этапе 150 (Фиг.2b) или этапе 102 (Фиг.2с).
Хотя измерение прошедшего через пробу света на этапе 126 показано после поступления пробы в область размещения пробы, этот этап может выполняться непрерывно. Например, датчик может непрерывно детектировать свет, прошедший через область 18 размещения пробы, чтобы определить момент, когда следует начать анализ, описанный на Фиг.2с, с момента начала работы системы 10 до получения положительного результата на этапе 128. Кроме того, система 10 может генерировать сигнал ошибки, если после помещения пробы в предназначенную для нее область на этапе 124 не получен положительный результат (например, поступил слишком малый объем пробы после включения системы 10) согласно альтернативному варианту осуществления. Кроме того, желательно точно знать момент начала реакции, чтобы правильно определить время протекания реакции при проведении анализа. Точное время начала реакции может быть определено с помощью способа контроля согласно Фиг.2а.
Система для спектроскопии полного пропускания собирает по существу большее количество пропущенного через пробу света в видимом диапазоне (например, от приблизительно 400 до приблизительно 700 нм) и в ближней инфракрасной части спектра (например, от приблизительно 700 до приблизительно 1100 нм) по сравнению с системами для обычного пропускания для определения концентрации анализируемого вещества в пробе. Система 10 для спектроскопии пропускания обеспечивает лучшие характеристики по сравнению с существующими системами пропускания, поскольку большая часть собранного прошедшего через пробу света попадает в датчик. Такая улучшенная собирающая способность позволяет системе 10 собирать свет в обеих частях спектра, что используется для корректировки смещения или помех, вызванных рассеянием при разных значениях гематокрита (Фиг.2b) или наличием гемоглобина (Фиг.2с) и гематокрита (Фиг.2с) в жидкости организма, такой как проба цельной крови.
На Фиг.2b проиллюстрирован один способ применения системы 10 для спектроскопии пропускания для определения концентрации анализируемого вещества в жидкости организма (например, пробе цельной крови) и внесения корректировки на смещение пропускания, вызванное различными значениями гематокрита. Степень смещения является функцией гематокрита в пробе цельной крови. В соответствии с одним вариантом осуществления настоящего изобретения индикаторные реагенты подбираются таким образом, чтобы обеспечить хроматическую реакцию, указывающую на концентрацию анализируемого вещества в пробе крови в видимом диапазоне спектра при длине волны менее чем приблизительно 750 нм.
В экспериментах с системой 10 для полного пропускания согласно Фиг.1а предполагали, что общий прошедший через пробу свет изменяется в зависимости от значения гематокрита при измерении в видимой и ближней ИК части спектра при длинах волн от приблизительно 400 до приблизительно 1100 нм. До сделанного авторами изобретения открытия считалось, что различие между значениями гематокрита не может быть обнаружено по общему прошедшему через пробу свету, имеющему длину волны от приблизительно 600 до приблизительно 1000 нм. Например, в статье в журнале Journal of Biomedical Optics, на которую приводилась ссылка в части "Уровень техники", указано на отсутствие различия между разными значениями гематокрита при длинах волн от приблизительно 600 до приблизительно 800 нм.
Однако гематокрит цельной крови влияет на спектральный отклик в видимом и ближнем ИК (инфракрасном) диапазоне (например, 400-1100 нм). Пропускание света зависит и является пропорциональным гематокриту ввиду различия в количестве рассеянного света, обусловленного числом красных кровяных телец. Смещение пропускания для того или иного уровня гематокрита в ближнем ИК диапазоне пропорционально значению гематокрита крови. Сравнение между Фиг.3а и 3b также показывает, что пропускание через кровь с гематокритом 20% на 30%Т выше, чем через кровь с гематокритом 60% в исследованном диапазоне от приблизительно 500 до приблизительно 940 нм. Однако пропускание света, измеренное в ближнем ИК диапазоне, не зависит от концентрации глюкозы, поскольку индикатор предназначен для обеспечения хроматической реакции в видимом диапазоне (например, при длине волны приблизительно 680 нм).
В способе согласно Фиг.2b пробу цельной крови, вступившую в реакцию с реагентом, освещали светом с первой длиной волны (например, от приблизительно 750 до приблизительно 1100 нм) на этапе 150 для определения рассеянной части измеряемого света, зависящей от значения гематокрита пробы цельной крови. Свет (нормальную и рассеянную части) измеряли датчиком 50 на этапе 152, как описано выше со ссыпкой на Фиг.1а. Далее пробу освещали светом со второй диной волны (например, от приблизительно 600 до приблизительно 750 нм) на этапе 154 и нормальную и рассеянную части прошедшего света измеряли датчиком 50 на этапе 156 для определения рассеянной части света, зависящей от гематокрита, и хроматического отклика, зависящего от концентрации анализируемого вещества. На этапе 158 вносили коррекцию из-за зависящего от гематокрита рассеянного света путем расчета отношения данных измерений, полученных на этапах 156 и 152. Концентрацию анализируемого вещества в пробе цельной крови рассчитывали на этапе 160, используя скорректированное значение пропускания, определенное на этапе 158.
В альтернативном варианте осуществления настоящего изобретения могут использоваться дополнительные алгоритмы корректировки, такие ка