Способ диагностики lawsonia intracellularis
Иллюстрации
Показать всеИзобретение относится к области ветеринарии и касается способа диагностики инфекции, вызываемой Lawsonia intracellularis. Сущность изобретения включает контактирование жидкого образца, взятого из организма млекопитающего, с одним или несколькими моноклональными антителами к антигену Lawsonia intracellularis, секретируемыми линиями клеток гибридом ЕСАСС, имеющими регистрационные номера. Изобретение также включает диагностический тест-набо, содержащий специфические для Lawsonia intracellularis антитела. Преимущество изобретения заключается в повышении специфичности выявления антигена. 8 н. и 3 з.п. ф-лы, 5 ил., 1 табл.
Реферат
Область техники, к которой относится изобретение
Настоящее изобретение относится к области ветеринарии и прежде всего касается Lawsonia intracellularis. В частности, изобретение относится к способу диагностики инфекции, вызываемой Lawsonia intracellularis, и диагностическому тест-набору, содержащему специфические для Lawsonia intracellularis антитела. Изобретение относится также к применению способа или тест-набора для диагностики инфекций, вызываемых Lawsonia intracellularis.
Предпосылки создания изобретения
L. intracellularis, возбудитель пролиферативной энтеропатии свиней («ПЭС»), поражает практически всех животных, включая человека, кроликов, хорьков, хомяков, лис, лошадей и различных представителей других классов животных, таких как страусы и эму. L. intracellularis является наиболее распространенной причиной потерь поголовья свиней в Европе, а также в Соединенных Штатах.
Характерной особенностью ПЭС является присутствие интрацитоплазматических несвязанных с мембраной изогнутых бацилл внутри энтероцитов в инфицированных областях кишечника. Бактерии, связанные с ПЭС, были названы «Campylobacter-подобными организмами» (S. McOrist и др., Vet. Pathol., том 26, 1989, с.260-264). Затем бактерии-возбудители были охарактеризованы в качестве нового таксономического рода и видов под общеупотребительным названием Ileal symbiont (IS) intracellularis (C. Gebhart и др., Int'l. J. of Systemic Bacteriology, том. 43(3), 1993, с.533-538). В последние годы эти новым бактериям было дано таксономическое название Lawsonia (L.) intracellularis (S. McOrist и др., Int'l. J. of Systemic Bacteriology, том 45 (4), 1995, с.820-825). Эти три названия можно использовать взаимозаменяемо для обозначения одного и того же организма, как он идентифицирован и описан далее в настоящем описании.
L. intracellularis является облигатной внутриклеточной бактерией, которую нельзя культивировать с помощью обычных бактериологических методов на стандартных бесклеточных средах, и предполагается, что для своего роста они должны прикрепляться к эпителиальным клеткам. У S. McOrist и др., Infection and Immunity, том 61 (19), 1993, c.4286-4292 и G. Lawson и др., J. of Clinical Microbiology, том 31 (5), 1993, c.1136-1142 описано культивирование L. intracellularis с использованием монослоев эпителиальных клеток кишечника крыс линии IEC-18 в стандартных колбах для культуры ткани. Кроме того, у Н. Stills, Infection and Immunity, том 59 (9), 1991, c.3227-3236 описано применение монослоев человеческих эмбриональных клеток кишечника линии Intestine 407 и монослоев клеток аденокарциномы ободочной кишки линии GPC-16 морских свинок для культивирования в стандартных колбах для культуры ткани.
В частности, L. intracellularis можно культивировать известными в данной области методами, предпочтительно описанными в US 5714375 и 5885823. Можно, например, сначала инокулировать культуру клеток с помощью инокулята, содержащего бактерии L. intracellularis, таким образом, чтобы инфицировать клетки бактериями. Для воплощения изобретения на практике можно применять многие линии клеток, включая (но не ограничиваясь ими) крысиные эпителиальные клетки кишечника линии IEC-18 (АТСС 1589), клетки человеческой эпидермоидной карциномы линии Нер-2 (АТСС 23), мышиные (неспецифические) клетки линии McCoys (АТСС 1696), клетки почки зеленой обезьяны буффало линии BGMK (Biowhittaker №71-176) и эпителиальные клетки кишечника свиньи. Предпочтительными культурами клеток являются клетки линии Нер-2, McCoys или IEC-18.
Если применяют культуру клеток, то перед инокуляцией клетки могут находиться в форме монослоя. Для формирования монослоя клетки можно высевать в обычные колбы. В каждую колбу, как правило, высевают от примерно 1×105 до примерно 10×105 клеток на колбу площадью 25, 75, 150, 850 см2 или роллерный флакон в смеси со средой для роста. Среды для роста могут представлять собой любые среды для культивирования клеток, которые содержат источник азота, необходимые факторы роста для рассматриваемых клеточных культур и источник углерода, такой как глюкоза или лактоза. Предпочтительной средой является среда DMEM, дополненная средой Хэма F12 и 1-5% фетальной телячьей сыворотки, хотя можно использовать также другие поступающие в продажу среды, получая при этом хорошие результаты.
Улучшение культивирования L. intracellularis достигают путем поддерживания культуры клеток на стадии постоянного роста. Поэтому конфлюэнтность монослоя культуры клеток в момент инокуляции должна составлять от примерно 20 до примерно 50%. Предпочтительно конфлюэнтность клеток в момент инокуляции должна составлять от примерно 30 до примерно 40%, наиболее предпочтительно примерно 30%.
В альтернативном варианте клетки перед осуществлением инокуляции можно выращивать в суспензии, как это описано ниже. Предпочтительно клетки сначала выращивают до достижения 100%-ной конфлюэнтности в форме монослоя в системе адгезионного типа, например в системе с использованием роллерных флаконов, а затем переносят и выращивают в суспензии объемом 3-3000 л.
В качестве инокулята можно применять культуру L. intracellularis, полученную от инфицированных свиней или других животных.
Инокулят может представлять собой кишечный гомогенат, полученный путем соскабливания слизистой оболочки подвздошной кишки свиньи или другого животного, зараженного ПЭС. Когда приготавливают кишечный гомогенат, срезы подвздошной кишки, выбранные для получения культуры, должны иметь серьезные повреждения, характеризующиеся значительным утолщением кишки. Вследствие недолговечности бактерий образцы после осуществления аутопсии предпочтительно следует как можно быстрее помещать на хранение при -70°С. К инокуляту добавляют антибиотик, к которому L. intracellularis обладает устойчивостью, такой как ванкомицин, амфотерицин В или представитель антибиотиков, несущих аминогликозидную группу, включая указанные в качестве примера гентамицин и неомицин, для подавления загрязняющих бактерий при сохранении роста L. intracellularis. Независимо от того, является ли инокулят чистой культурой или кишечным гомогенатом, инокуляцию клеточных культур можно осуществлять различными методами, известными в данной области, с использованием указаний, приведенных в настоящем описании.
Затем бактерии и/или инокулированные клеточные культуры инкубируют при пониженной концентрации растворенного О2. При концентрации растворенного кислорода выше 10% рост L. intracellularis происходит с меньшей скоростью по сравнению с оптимальной, причем в конце концов прекращается, когда концентрация кислорода выходит из указанного диапазона. Предпочтительно бактерии и/или инокулированные клеточные культуры инкубируют при концентрации растворенного кислорода, составляющей от примерно 0 до примерно 10%. Более предпочтительно бактерии и/или клетки инкубируют при концентрации кислорода, составляющей от примерно 0 до примерно 8%, причем наиболее предпочтительной является концентрация кислорода от примерно 0 до примерно 3,0%.
Оптимальная концентрация диоксида углерода также является важной для оптимального роста L. intracellularis. При концентрации диоксида углерода выше 0 и ниже 4% происходит рост, не соответствующий оптимальному, причем рост в конце концов прекращается, когда концентрация диоксида углерода выходит из указанного диапазона. Предпочтительно концентрация диоксида углерода составляет от примерно 6 до примерно 10%, причем наиболее предпочтительной является концентрация диоксида углерода примерно 8,8%.
Кроме того, клетки предпочтительно инкубируют при концентрации водорода, составляющей от примерно 73 до примерно 96%. Можно применять азот для замены части или всего присутствующего водорода. Наиболее предпочтительно клетки инкубируют при концентрации O2 от примерно 0 до примерно 8,0%, концентрации СО2 примерно 8,8% и концентрации Н2 примерно 83,2%.
Инокулированные клетки можно инкубировать в двойном газовом инкубаторе или иных газовых камерах, которые содержат необходимые концентрации водорода, кислорода и диоксида углерода и которые позволяют поддерживать клетки в суспендированном состоянии в процессе инкубации. Камера должна иметь устройства для поддержания инокулированных клеток в суспензии и газовый монитор и источник питания для подачи и поддержания необходимых концентраций газа. Температура инкубации должна составлять от 30 до примерно 45°С и более предпочтительно от примерно 36 до примерно 38°С. Наиболее предпочтительно температура составляет примерно 37°С. Необходимое оборудование для культивирования и ослабления вирулентности микроорганизмов хорошо известно и доступно специалистам в данной области, и оно указано в настоящем описании. Одним из примеров оборудования, пригодного для осуществления настоящего изобретения, является двойной газовый инкубатор, например модель 480 (Lab-Line, Мелрозе Парк, шт. Иллинойс) в сочетании с вращающимися колбами для поддержания клеток в суспензии. Предпочтительное согласно настоящему изобретению оборудование включает содержащие среды ферментер, биореактор, шейкер с перемешивающей пластиной или роторный шейкер и способные поддерживать клеточную культуру в суспензии посредством продувки газом соответствующей концентрации или с помощью иных средств механического перемешивания и позволяющие осуществлять непрерывный мониторинг уровней растворенного O2 в средах. Фирма New Brunswick, Braun и другие компании изготавливают пригодные для этой цели ферментеры и биореакторы.
Максимального роста клеток и, следовательно, L. intracellularis достигают путем поддержания инокулированных клеток в суспендированном состоянии в процессе инкубации за счет увеличения контакта отдельных клеток с питательными средами и присутствия необходимой смеси водорода, кислорода и диоксида углерода. Клеточные культуры можно перемешивать и поддерживать в суспензии разнообразными методами, известными в данной области, с использованием, например, колб для культур, роллер-флаконов, мембранных культур, биоконтейнеров, биореакторных систем WAVE™ и вращающихся колб. Клетки можно поддерживать в суспензии в процессе инкубации путем инкубации клеток во вращающейся колбе внутри двойного газового инкубатора или аналогичного устройства. Понятие «вращающаяся колба» в контексте настоящего изобретения обозначает колбу или иной контейнер, в котором для перемешивания культуры и поддержания ее в суспензии используется лопастная мешалка, пропеллерная мешалка или иные средства.
В альтернативном варианте осуществления изобретения инокулированные клетки инкубируют до достижения конфлюэнтности клеток и затем клетки помещают во вращающуюся колбу, содержащую питательные среды, и инкубируют в двойном газовом инкубаторе при вращении колбы. Предпочтительно инокулированные клетки соскабливают или трипсинизируют и пересевают во вращающуюся колбу. Это можно осуществлять различными методами, известными в данной области, например с использованием скребка для клеток для отделения клеток. После внесения клеток во вращающуюся колбу лопасть вращающейся колбы, как правило, вращается со скоростью от примерно 30 до примерно 60 об/мин на магнитной перемешивающей пластине для поддержания инфицированных клеток в суспензии.
Затем часть культивированных L. intracellularis пересевают на свежую культуру для увеличения производства бактерий L. intracellularis. Понятие «пересев» или его варианты в контексте настоящего описания обозначает процесс переноса части культивируемых L. intracellularis на свежие клеточные культуры для осуществления заражения свежих клеток бактерией. Понятие «свежий», в контексте настоящего описания обозначает клетки, которые еще не были заражены L. intracellularis. Предпочтительно возраст таких клеток в среднем составляет не более примерно одного дня.
Пересев L. intracellularis в суспензионных культурах можно осуществлять путем изъятия части исходной культуры и внесения ее в новую колбу, содержащую свежую культуру клеток. Если исходная культура имеет большое количество бактерий/мл, например более примерно 104 бактерий/мл, ее предпочтительно добавляют из зараженной колбы в количестве от примерно 1 до 10 об.% культуры по отношению к культуре свежих клеток, находящихся в новой колбе. Это предпочтительно осуществляют, когда заражено 50-100% клеток. Если заражено менее 50% клеток, то пересев предпочтительно осуществляют путем разделения культуры в соотношении 1:2 в новой колбе и увеличения объема с помощью добавления свежих сред. В любом случае в отличие от пересева монослойных культур, известного из существующего уровня техники, не требуется осуществлять лизис клеток и другие стадии.
После достижения достаточного увеличения культуры клеток и последующего заражения L. intracellularis, что определяют с помощью окрашивания согласно методу непрямой иммунофлуоресценции (антител) (ИФА), оценки значения TCID50 или с помощью любого сопоставимого метода, собирают по меньшей мере часть культивируемых бактерий L. intracellularis. Стадию сбора можно осуществлять путем отделения бактерий от суспензии с помощью различных методов, известных обычным специалистам в данной области, с использованием указаний, приведенных в настоящем описании. Предпочтительно бактерии L. intracellularis собирают путем центрифугирования всего содержимого или части суспензии с образованием дебриса клеточной культуры, ресуспендирования образовавшихся дебрисов и лизиса инфицированных клеток. Как правило, по меньшей мере часть содержимого центрифугируют примерно при 3000×g в течение примерно 20 мин для того, чтобы получить дебрис клеток и бактерий. Затем дебрис можно ресуспендировать, например, в сахарозо-фосфат-глутаматном (СФГ) растворе и пропускать примерно 20 раз через иглу 25-го размера для осуществления лизиса клеток. Если требуется дополнительная очистка, то образцы можно центрифугировать примерно при 145×g в течение примерно пяти минут для удаления клеточных ядер и дебриса. Затем супернатант можно центрифугировать примерно при 3000xg в течение примерно двадцати минут и образовавшийся дебрис ресуспендировать в соответствующем разбавителе, таком как СФГ, дополненный фетальной бычьей сывороткой (чтобы сделать собранные бактерии пригодными для лиофилизации, замораживания или использования в качестве инокулята), или в питательных средах (чтобы сделать собранные бактерии более пригодными для пересева на свежие клетки).
Как указывалось ранее, эффективный рост L. intracellularis для полупромышленного производства усиливают путем поддержания активного роста тканевых клеток. Использование суспензионных культур значительно облегчает поддержание активного роста клеток и позволяет осуществлять непрерывное увеличение объема культуры и повышение масштаба производства. При использовании ферментера и концентрации растворенного O2 примерно от 0 до 3%, как это указано выше, оказывается возможным достигать концентрации вплоть до 108 бактерий/мл.
Когда используют клетки линии McCoys или IEC-18, то наряду с питательными средами предпочтительно добавляют желатин, агарозу, коллаген, акриламид или кремниевые гранулы, такие как пористые микроносители типа Cultisphere-G (фирма HyClone Laboratories, Логан, шт. Юта). Однако для клеток линии НЕр-2 и других линий клеток не требуются микроносители при использовании способов, предлагаемых в изобретении.
При использовании культур клеток линии НЕр-2 для поддержания культуры предпочтительно 25-50% культуры с недельными интервалами удаляют и заменяют свежими средами. Для клеточных культур с микроносителями или гранулами предпочтительно удаляют 25-50% культуры и заменяют свежими средами 1-2 раза в неделю. Для повышения масштаба производства к культуре можно дополнительно добавлять 25-50% сред или сред с микроносителями.
В зависимости от скорости, с которой происходит заражение культуры клеток, пересев на свежие клетки, как правило, осуществляют с интервалом времени от примерно 2 до примерно 7 дней. Принимая во внимание, что культура клеток становится зараженной по меньшей мере на 70% в течение 2-7 дней, пересев предпочтительно осуществляют примерно через каждые 5-7 дней.
Диагностику антигена L. intracellularis осуществляют в настоящее время с помощью прямого метода иммунофлуоресценции и ПЦР. Диагностику антител, специфических в отношении L. intracellularis, в настоящее время осуществляют с использованием иммунофлуоресценции. Эти методы являются трудоемкими и требующими больших затрат времени, и они не пригодны для крупномасштабного скрининга.
Эффективная диагностика ПЭС затрудняется также вследствие значительного времени, которое требуется для культивирования бактерий-возбудителей. В настоящее время на основе результатов настоящего изобретения можно разрабатывать диагностические средства, позволяющие осуществлять быстрые и точные анализы присутствия L. intracellularis в биологических образцах, взятых из организма свиньи или других животных, чувствительных к ПЭС.
Таким образом, в основу настоящего изобретения была положена задача разработать усовершенствованные способы диагностики заболевания, вызываемого L. intracellularis.
Краткое изложение сущности изобретения
Настоящее изобретение относится к области ветеринарии и прежде всего касается Lawsonia intracellularis. В частности, изобретение относится к способу диагностики инфекции, вызываемой Lawsonia intracellularis, и диагностическому тест-набору с использованием специфических для Lawsonia intracellularis антител. Изобретение относится также к применению способа или диагностического тест-набора для диагностики инфекций, вызываемых Lawsonia intracellularis.
Краткое описание чертежей
На чертежах показано:
на фиг.1 - результаты, полученные с помощью блокирующего ELISA, предлагаемого в изобретении;
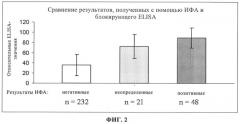
на фиг.2 - сравнение результатов, полученных методом ИФА и ELISA для 301 образца сыворотки, полученной в полевых условиях;
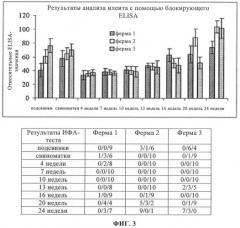
на фиг.3 - результаты кросс-секционных скринингов (скринингов с использованием данных, полученных для разных объектов) с использованием блокирующего ELISA, полученные на 3 фермах, зараженных илеитом;
на фиг.4 - результаты, полученные с помощью ELISA, на 22 зараженных илеитом немецких фермах;
на фиг.5 - корреляция результатов, полученных с помощью ELISA, с клиническими симптомами.
Подробное описание изобретения
Определение понятий, используемых в описании
Перед изложением вариантов осуществления настоящего изобретения необходимо отметить, что в контексте настоящего описания и прилагаемой формуле изобретения понятия, употребляемые в единственном числе, включают также и множественное число, если в контексте ясно не указано иное. Так, например, понятие «бактерия» включает множество таких бактерий, понятие «клетка» включает одну или большее количество клеток и их эквивалентов, известных специалистам в данной области, и т.д. Если не указано иное, все технические и научные термины, используемые в настоящем описании, имеют значения, общепринятые в области техники, к которой относится изобретение. Хотя при воплощении на практике или при тестировании настоящего изобретения можно применять любые методы и материалы, аналогичные или эквивалентные указанным в настоящем описании, в настоящем описании представлены предпочтительные методы, устройства и материалы. Все указанные в описании публикации включены в настоящее описание в качестве ссылки для цели описания и раскрытия клеточных линий, векторов и методологий, представленных в публикациях, которые можно применять согласно изобретению. В данном описании ничто не следует истолковывать как признание того, что в изобретении не указаны такие документы, полученные задним числом, в качестве прототипов изобретения.
В контексте настоящего описания понятие «L. intracellularis» обозначает внутриклеточные изогнутые грамотрицательные бактерии, подробно описанные у Gebhart и др., Int'l. J. of Systemic Bacteriology, том. 43 (3), 1993, c.533-538 и S. McOrist и др., Int'l. J. of Systemic Bacteriology, том 45 (4), 1995, с.820-825, каждая публикация включена в настоящее описание в качестве ссылки во всей полноте; бактерии-возбудители, которые можно получать из зараженной ПЭС свиньи или других животных, обитающих во всем мире, на основе знаний в данной области и указаний, приведенных в настоящем описании; и варианты или мутанты любых из указанных выше бактерий, полученные спонтанно или искусственным путем, и ДНК, РНК и бактериальные белки, специфические для L. intracellularis, включая белки, экспрессируемые в векторах или после введения in vivo, а также фрагменты или антигенные производные L. intracellularis. Это понятие включает также адаптированные изоляты и ослабленные изоляты, которые описаны ниже.
В контексте настоящего описания понятие «адаптированный изолят» обозначает любой изолят L. intracellularis, полученный с помощью методов культивирования и пересева в культуре клеток или любых других методов, приведенных в настоящем описании, для репликации L. intracellularis с целью получения антигена.
В контексте настоящего описания понятие «ослабленный изолят» обозначает любой изолят L. intracellularis, полученный с помощью методов культивирования и пересева, приведенных в настоящем описании, для достижения авирулентности при сохранении иммуногенных свойств при введении животному-хозяину.
В контексте настоящего изобретения понятие «полупромышленное культивирование» обозначает уровень культивирования L. intracellularis, превышающий примерно 2,0-3,0 л, и включает производство в масштабе 100 л или более. «Культивирование» в контексте настоящего описания обозначает процесс стимуляции роста, репродукции и/или пролиферации L. intracellularis.
Описание изобретения
Решение указанных выше технических задач достигается с помощью настоящего описания и вариантов осуществления, представленных в формуле изобретения.
Задачей настоящего изобретения является разработать способ диагностики преклинического или клинического заражения L. intracellularis. Кроме того, задачей являлось разработать способы обнаружения иммунного ответа на L. intracellularis и средство для выявления эпидемиологии L. intracellularis.
Эта задача решается согласно настоящему изобретению с помощью способа диагностики преклинического или клинического заболевания, вызываемого L. intracellularis, представленного в описании и формуле изобретения.
Изобретение относится также к обнаружению антител к L. intracellularis и к обнаружению самой L. intracellularis. К таким антителам относятся антитела любого типа, известные специалисту в данной области, в частности иммуноглобулины, включающие подтипы IgA, растворимый IgA, IgM, IgG (IgG1, IgG2a, IgG2b, IgG3), а также IgD, IgE.
Для обнаружения антител, специфических в отношении L. intracellularis, способ, предлагаемый в изобретении, заключается в том, что:
а) берут жидкий образец (образец жидкости) из организма млекопитающего,
б) выявляют специфическое связывание этого жидкого образца с антигеном L. intracellularis,
в) сравнивают полученный результат с контролем.
Как указано выше, понятие L. intracellularis относится также к фрагментам или антигенным производным L. intracellularis, которые можно применять согласно описанному выше способу.
Аналогично этому для обнаружения L. intracellularis способ, предлагаемый в изобретении, заключается в том, что:
а) берут жидкий образец из организма млекопитающего,
б) выявляют специфическое связывание этого жидкого образца с антителами к L. intracellularis,
в) сравнивают полученный результат с контролем.
Жидкий образец может представлять собой любую жидкость, содержащуюся в организме, включая слюну, пот, мочу, кровь, секреты, выделения или образцы других жидкостей, содержащихся в организме, которые известны эксперту в данной области. В предпочтительном варианте осуществления изобретения жидкий образец собирают с использованием либо контейнера для сбора (для мочи или другой жидкости), шприца/пробирки для сбора (для крови), либо определенного типа тампона для сбора (для слюны, пота и т.д.). Предпочтительно, если образец, указанный на стадии а), представляет собой кровь, то из этого образца выделяют сыворотку или плазму и стадию б) осуществляют с использованием сыворотки или плазмы вместо жидкого образца. Затем осуществляют стадию в), как описано выше.
В предпочтительном варианте осуществления изобретения способ заключается в проведении иммунного анализа. В иммунном анализе используют моноклональные антитела или поликлональную антисыворотку, специфическую для L. intracellularis. В иммунных анализах, предлагаемых в изобретении, применяют методы обнаружения, известные в данной области, такие как ELISA (твердофазный иммуноферментный анализ) или так называемый сэндвич-ELISA, дот-блоттинги, иммуноблоттинги, радиоиммунные тесты (радиоиммунные анализы (РИА)), основанный на оценке диффузии анализ по методу Оухтерлони или реактивные иммунофлуоресцентные анализы. Другими иммунными анализами являются тест на основе непрямого или прямого иммунофлюоресцентного метода (с использованием антител) (ИФА). Еще одним иммунным анализом является так называемый Вестерн-блот (также называемый методом Вестерн-переноса или Вестерн-блоттингом). Вестерн-блот позволяет переносить белки или полипептиды, разделенные с помощью гель-электрофореза в полиакриламидном геле, на нитроцеллюлозный фильтр или другой пригодный носитель и в то же время сохранять относительные положения белков или полипептидов, полученных с помощью гель-электрофореза. Затем Вестерн-блот инкубируют с антителом, которое специфически связывается с рассматриваемым белком или полипептидом. Эти методы обнаружения обычные специалисты могут применять для осуществления на практике описанного изобретения. Ниже даны литературные ссылки, в которых специалист может найти описания указанных выше методов и других методов обнаружения: An Introduction to Radioimmunoassay and related techniques, изд-во Elsevier Science Publishers, Amsterdam, The Netherland, 1986; Bullock и др., Techniques in Immunocytochemistry, изд-во Academic Press, Orlando, Fl том 1 (1982), том 2, 1983, том 3 (1985); Tijssen, Practice and Theory of Enzyme Immunoassays: Laboratory Techniques in Biochemistry and Molecular Biology, изд-во Elsevier Science Publishers, Amsterdam, The Netherland, 1985. В качестве других иммунных анализов, применяемых согласно изобретению, можно использовать технологии на основе твердых и жидких белковых чипов или технологии на основе микроматриц с применением меченых или немеченых реагентов. Такие анализы описаны, например, у Kozak К. R. и др. Identification ofbiomarkers for ovarian cancer using strong anion-exchange ProteinChips: potential use in diagnosis and prognosis, Proc. Natl. Acad. Sci. USA, 14, 100(21), октябрь 2003, с. 12343-12348, или у Fulton R. J. и др., Advanced multiplexed analysis with the FlowMetrix™ system, Clinical Chemistry, 43(9), 1997, с.1749-1756.
Изобретение относится также к диагностическому тест-набору для обнаружения инфекции, вызываемой L. intracellularis, который содержит все элементы, необходимые для осуществления на практике описанного выше способа диагностики преклинического или клинического заболевания, вызываемого L. intracellularis.
Кроме того, изобретение относится, в частности, к диагностическому тест-набору, который содержит антитела, специфические для L. intracellularis.
Кроме того, изобретение относится, в частности, к диагностическому тест-набору, который отличается тем, что антитела, предлагаемые в изобретении, являются поликлональными.
Кроме того, изобретение относится, в частности, к диагностическому тест-набору, который отличается тем, что антитела, предлагаемые в изобретении, являются моноклональными.
Диагностический тест-набор представляет собой набор всех компонентов, необходимых для осуществления способа диагностики, предлагаемого в изобретении. Конкретными примерами (перечень не является исчерпывающим) других компонентов, необходимых для осуществления способа диагностики, предлагаемого в изобретении, являются контейнеры, такие как 96-луночные планшеты или титрационные микропланшеты, лабораторные пробирки, другие пригодные контейнеры, поверхности и субстраты, мембраны, такие как нитроцеллюлозный фильтр, реагенты для отмывки и буферы. Диагностический тест-набор может содержать также реагенты, которые позволяют обнаруживать связанные антитела, такие, например, как меченые «вторичные» антитела, хромофоры, ферменты (например, конъюгированные с антителами) и их субстраты или другие субстанции, которые обладают способностью связываться с антителами.
Представленные в настоящем описании или известные в данной области бактерии L. intracellularis или компоненты, полученные из таких бактерий, можно применять в качестве антигена при проведении ELISA или другого иммунного анализа, такого как иммунофлуоресцентный метод («ИФА»), для обнаружения антител к L. intracellularis в сыворотке или другой общей воде организма животных, в отношении которых имеется предположение, что они заражены бактериями. В настоящее время предпочтительным методом анализа является ИФА, описанный ниже в примере. В альтернативном варианте бактерии, предлагаемые в настоящем изобретении, можно анализировать с помощью Вестерн-блоттинга.
Предпочтительным протоколом Вестерн-блоттинга является следующий протокол:
1. Осуществляют электрофорез антигена на ДСН-ПААГ, предпочтительно 12% ДСН-ПААГ, и переносят на нитроцеллюлозную мембрану.
2. Помещают мембрану в блокирующий буфер на 2 ч.
3. Удаляют блокирующий буфер и промывают ЗФР в течение 1 мин.
4. Разводят сыворотку блокирующим буфером и наносят на мембрану. Инкубируют в течение 2 ч при комнатной температуре.
5. Отмывают 3 раза буфером для отмывки (5 мин для каждой отмывки).
6. Разводят конъюгированное специфическое для L. intracellularis антитело, предпочтительно моноклональное антитело, блокирующим буфером и наносят на мембрану. Инкубируют в течение 1 ч при комнатной температуре.
7. Отмывают 3 раза буфером для отмывки.
8. Добавляют субстрат на 10 мин или до тех пор, пока не возникает выраженный бэндинг.
9. Отмывают с помощью ЗФР.
10. Сушат на воздухе и помещают на хранение в темноту.
Конъюгат, сшитый с антителом, может представлять собой, например, фермент, такой как пероксидаза из хрена (HRP) или щелочная фосфатаза (АР). В альтернативном варианте в качестве конъюгата можно применять хромофор или любую другую обнаруживаемую субстанцию, которую можно количественно оценивать в присутствии субстрата.
Согласно изобретению наиболее предпочтительным иммунным анализом является ELISA. Наиболее предпочтительно такой ELISA представляет собой сэндвич-ELISA (т.е. ELISA с использованием захвата). Такой ELISA обладает большей специфичностью, поскольку с его помощью обнаруживают два антитела, специфические для двух различных эпитопов на одном антигене. При использовании сэндвич-ELISA титрационные микропланшеты сенсибилизируют немечеными антителами. Затем добавляют в качестве антигена L. intracellularis. После стадии отмывки связанный антиген L. intracellularis обнаруживают с помощью второго меченого специфического для L. intracellularis антитела, распознающего другой эпитоп L. intracellularis.
Примером процедуры сенсибилизации может служить следующая процедура.
Планшеты сенсибилизируют с помощью немеченого антитела, например, в смеси 10% сахарозы/10% нормальной лошадиной сыворотки в ddH2O и инкубируют с антигеном L. intracellularis. Затем планшеты сушат и запечатывают и хранят при 37°С. В альтернативном варианте сенсибилизированные антителом планшеты помещают на хранение, а антиген добавляют при проведении ELISA.
Предпочтительным протоколом ELISA, предлагаемым в изобретении, является следующий протокол (при использовании сенсибилизированных антителом планшетов):
1. Добавляют антиген в количестве 0,1 мл/лунку, разведенный в буфере для сенсибилизации. Инкубируют в течение 18 ч при 4°С.
2. Промывают 3 раза ЗФР.
3. В каждую лунку планшета добавляют 0,25 мл блокирующего буфера. Инкубируют в течение 1-2 ч при 37°С.
4. Отмывают 3 раза буфером для отмывки.
5. Разводят сыворотку блокирующим буфером и добавляют по 0,1 мл в первые лунки планшета. Осуществляют серийные разведения в соотношении 1:2 в следующих лунках планшета. Инкубируют в течение 1 ч при 37°С.
6. Отмывают 3-5 раз буфером для отмывки.
7. Разводят конъюгированное специфическое для L. intracellularis антитело блокирующим буфером и добавляют по 0,1 мл в лунки планшета и инкубируют в течение 1 ч при 37°С.
8. Отмывают 3-5 раз буфером для отмывки.
9. Добавляют субстрат.
10. Измеряют абсорбцию света с помощью спектрофотометра.
11. Лунки, в которые не добавляли антиген, используют в качестве контролей.
12. В каждом тесте следует использовать также свиную сыворотку в качестве положительного и отрицательного контроля.
Предпочтительно ELISA осуществляют следующим образом.
Планшеты сенсибилизируют с помощью немеченого антитела, например, в смеси 10% сахарозы/10% нормальной лошадиной сыворотки в ddH2O и инкубируют с антигеном Lawsonia intracellularis. Затем планшеты сушат и запечатывают и хранят при 37°С.
1. Добавляют по 90 мкл буфера во все лунки.
2. Добавляют по 10 мкл сыворотки в выбранные лунки.
3. Инкубируют планшет в течение 1 ч при 37°С.
4. Отмывают планшет 3 раза ЗФРТ (ЗФР-Твин).
5. Добавляют конъюгированное с HRP специфическое антитело к L. intracellularis, предпочтительно моноклональное антитело, разведенное в CDS-C (стандартный буфер для лиофилизации конъюгатов) + 0,5М NaCl, 100 мкл/лунку.
6. Инкубируют в течение 1 ч при 37°С.
7. Отмывают планшет 3 раза ЗФРТ.
8. Добавляют субстрат из расчета 100 мкл/лунку и инкубируют при комнатной температуре в течение 10 мин.
9. Добавляют по 50 мкл/лунку стоп-раствора для прекращения реакции.
10. Считывают планшет при 450 нм в спектрофотометре.
Наиболее предпочтительным протоколом сэндвич-ELISA, предлагаемым в изобретении, является следующий протокол:
1. Добавляют по 0,1 мл/лунку МАт, разведенного в буфере для сенсибилизации. Инкубируют в течение 18 ч при 4°С.
2. Отмывают 3 раза ЗФР.
3. Добавляют по 0,1 мл/лунку антигена, разведенного в буфере, в каждую лунку планшета. Инкубируют в течение 1-2 ч при 37°С.
4. Отмывают 3 раза буфером для отмывки и/или непосредственно добавляют в каждую лунку планшета по 0,25 мл блокирующего буфера. Инкубируют в течение 1-2 ч при 37°С.
5. Отмывают 3 раза буфером для отмывки.
6. Разводят сыворотку блокирующим буфером и добавляют по 0,1 мл в первые лунки планшета. Осуществляют серийные разведения в соотношении 1:2 в следующих лунках планшета. Инкубируют в течение 1 ч при 37°С.
7. Отмывают 3-5 раз буфером для отмывки.
8. Разводят конъюгированное специфическое антитело к L. intracellularis, предпочтительно моноклональное антитело, блокирующим буфером и добавляют по 0,1 мл в лунки планшета и инкубируют в течение 1 ч при 37°С.
9. Отмывают 3-5 раз буфером для отмывки.
10. Добавляют субстрат.
11. Измеряют абсорбцию света с помощью спектрофотометра.
12. Лунки, в которые не добавляли антиген, используют в качестве контролей.
13. В каждом тесте следует использовать также свиную сыворотку в качестве положительного и отрицательного контроля.
Применяемый согласно настоящему описанию антиген представляет собой L. intracellularis, как указано выше. МАт представляет собой моноклональное антитело, специфическое для L. intracellularis. Предпочтительно такое антитело представляет собой описанное ниже антитело.
При создании изобретения неожиданно были созданы обладающие высокой активностью антитела, которые можно применять в ELISA согласно изобретению. Антителам для удобства осуществления ссылок присвоили следующие номера: 301:39, 287:6, 268:29, 110:9, 113:2 и 268:18. Все антитела обладают специфичностью в отношении антигенов бактерий L. intracellularis. В качестве иммобилизованных антител в сэндвич-ELISA применяют 110:9, 113:2 или 268:18, а в качестве конъюгированных антител применяют 268:18, 268:29 или 287:6. Наиболее предпочтительным иммобилизованным антителом является антитело 110:9, а конъюгированным антителом является антитело 268:29. Предпочтительными являются также антитела, обладающие всеми характеристиками указанных выше антител, что означает, что они обладают практически такими же характеристиками связывания, которые присущи указанным выше антителам, и/или которые направлены на те же самые антигены L. intracellularis, которые указаны выше, и/или направлены или распознают те же самые эпитопы, что и указанные выше антитела.
Антитела, предлагаемые в изобретении, продуцируются клетками гибридомы. Клетки гибридом, предлагаемых в изобретении, депонированы с целью патентования в соответствии с Будапештским договором в Научно-производственном центре микробиологии (CAMR) и Европейской коллекции клеточных культур (ЕСАСС), Солсбери, Уилтшир SP4 OJG, Великобритания. Дата депонирования - 11 мая 2004. Линия клеток гибридомы 110:9 успешно депонирована под регистрационным номером ЕСАСС 04092204. Линия клеток гибридомы 113:2 успешно депонирована под регистрационным номером ЕСАСС 04092201. Линия клеток гибридомы 268:18 успешно депонирована под регистрационным номеро