Способ моделирования сахарного диабета i типа у крыс
Иллюстрации
Показать всеИзобретение относится к медицине, а именно к экспериментальной эндокринологии, и может быть использовано для моделирования сахарного диабета I типа у крыс. Для этого выбирают в качестве экспериментального животного крысу породы Wistar, генетически не предрасположенной к развитию аутоиммунных заболеваний. Экспериментальному животному вводят трехкратно стрептозотоцин с интервалом в 7 суток. При этом во время первого введения количество вводимого препарата определяют из расчета 25 мг/кг массы тела экспериментального животного. Во время второго введения количество вводимого препарата определяют из расчета 20 мг/кг массы тела экспериментального животного. Во время третьего введения количество вводимого препарата определяют из расчета 25 мг/кг массы тела экспериментального животного. Причем каждое введение стрептозотоцина осуществляют животному после 12 часов голодания. При этом за сутки перед каждым введением стрептозотоцина животному внутрибрюшинно вводят 1 мл неполного адъюванта Фрейнда. Способ обеспечивает адекватное воспроизведение модели. 2 ил.
Реферат
Изобретение относится к медицине, в частности к экспериментальной патофизиологии и эндокринологии.
Известно, что сахарный диабет (СД) I типа относится к аутоиммунным заболеваниям. Широкая распространенность этого заболевания и отсутствие точных корреляций с генетическими отклонениями в организме позволяют предполагать, что СД I типа заболевают и люди, генетически не предрасположенные к данному заболеванию. Так показано, что 85-90% случаев СД I типа наблюдается в семьях без первичной истории СД I типа среди родственников 1-й линии родства [Dahlquist G. et al., 1985]. В области экспериментальной медицины, однако, отсутствует адекватная аутоиммунная модель СД I типа у животных, генетически не предрасположенных к развитию данного заболевания.
На сегодняшний день широкое распространение получили аутоиммунные модели СД I типа у генетически предрасположенных животных: у крыс линии ВВ (BioBreeding), у мышей линии NOD (Non-Obese Diabetic). У данных линий животных имеет место предрасположенность к мутациям генов HLA (Human Leucocyte Antigens), при этом инсулиновая недостаточность развивается спонтанно и становится отчетливо выраженной спустя 1-2 месяца [Green E.A., Flavell R.A., 1999; Toyoda H., Formby В., 1998]. К преимуществам исследований на данных линиях относятся возможность блокады отдельных цитокинов специфическими антисыворотками и изучение последующих изменений в развитии и течении заболевания [Rabinovitch А. et al., 1995; Brown G.R. et al., 1998].
Недостатком этих моделей является то, что они созданы у животных, генетически предрасположенных к СД I типа, что искажает развитие и реализацию компенсаторных механизмов и регенерацию островковой ткани поджелудочной железы (ПЖ) вследствие измененного реагирования адаптивных систем организма; в результате модель не позволяет изучить и подобрать адекватную терапию для данного заболевания у животных без генетических дефектов развития иммунной системы.
Данные модели являются аналогами заявляемой аутоиммунной модели СД I типа.
На генетически не предрасположенных животных в эксперименте используются модели химически индуцированного СД с помощью введения стрептозотоцина (STZ) (однократно в дозе 65 мг/кг) или аллоксана (однократно в дозе 80-100 мг/кг), которые, как полагают, избирательно повреждают β-клетки поджелудочной железы. Однако при использовании аллоксана в указанной дозе развивается также нейро- и нефротоксическое действие, а развивающийся СД характеризуется высокой частотой реверсии [Arai Т. et al., 1996; Babaya N. et al., 2005; Hosokawa M. et al., 2001].
При использовании STZ в указанной дозе наступает глубокое повреждение β-клеток ПЖ, которые становятся не способными к восстановлению своей функции; помимо этого STZ повреждает регионарные стволовые клетки ПЖ и костного мозга, что предотвращает индукцию процессов регенерации β-клеток и приводит к ингибированию иммунных реакций [Nir Т. et al., 2007]. В результате под влиянием стрептозотоцина прогрессирует фиброзирующая регенерация, которая не способствует развитию аутоиммунного повреждения.
Данная модель является прототипом заявляемой модели СД I типа.
Таким образом, на сегодняшний день адекватная аутоиммунная модель СД I типа на генетически не предрасположенных животных отсутствует.
Задачей заявляемого патента является создание аутоиммунной модели СД I типа у животных, генетически не предрасположенных к развитию СД I типа и других аутоиммунных заболеваний.
Техническим результатом является создание адекватной устойчивой аутоиммунной модели сахарного диабета I типа у генетически не предрасположенных к развитию аутоиммунных заболеваний животных, исключение при этом необратимого повреждения островковых клеток ПЖ, токсического воздействия на регионарные стволовые клетки и ингибирования регенераторных процессов в поджелудочной железе с сохранением возможности терапевтического регулирования повреждения ПЖ.
Сущность изобретения заключается в следующем. Выбирают в качестве экспериментального животного крысу породы Wistar, генетически не предрасположенную к развитию аутоиммунных заболеваний, и внутрибрюшинно вводят экспериментальному животному стрептозотоцин трехкратно с интервалом в 7 суток. При этом во время первого введения количество вводимого препарата определяют из расчета 25 мг/кг массы тела экспериментального животного. Во время второго введения количество вводимого препарата определяют из расчета 20 мг/кг массы тела экспериментального животного. Во время третьего введения количество вводимого препарата определяют из расчета 25 мг/кг массы тела экспериментального животного. Причем каждое введение стрептозотоцина осуществляют животному после 12 часов голодания. При этом за сутки перед каждым введением стрептозотоцина животному внутрибрюшинно вводят 1 мл неполного адъюванта Фрейнда.
Способ осуществляется следующим образом.
1. Подготовка к иммунизации животного. После профилактического осмотра животного с целью исключения различных заболеваний под эфирным наркозом обрабатывают поверхность передней брюшной стенки животного по Филончикову-Гроссиху.
2. Введение неполного адъюванта Фрейнда осуществляют внутрибрюшинно в объеме 1 мл в месте предварительно обработанной области. После внутрибрюшинного введения в течение 30 секунд место инъекции умеренно прижимают асептическим спиртовым шариком с целью исключения обратного тока жидкости, после чего обрабатывают раствором повидон-йод.
3. После 12 часов голодания животному осуществляют введение разведенного в 0,5 мл охлажденного цитратного буфера (рН=4,5) стрептозотоцина внутрибрюшинно в количестве 25 мг/кг массы тела экспериментального животного в месте предварительно обработанной области. Введение стрептозотоцина осуществляют через сутки после введения неполного адъюванта Фрейнда. После внутрибрюшинного введения в течение 30 секунд место инъекции умеренно прижимают асептическим спиртовым шариком с целью исключения обратного тока жидкости, после чего обрабатывают раствором повидон-йод.
4. Через 7 суток после первого введения неполного адъюванта Фрейнда осуществляют второе введение неполного адъюванта Фрейнда внутрибрюшинно в объеме 1 мл в месте предварительно обработанной области. После внутрибрюшинного введения в течение 30 секунд место инъекции умеренно прижимают асептическим спиртовым шариком с целью исключения обратного тока жидкости, после чего обрабатывают раствором повидон-йод.
5. После 12 часов голодания животному осуществляют второе введение разведенного в 0,5 мл охлажденного цитратного буфера (рН=4,5) стрептозотоцина внутрибрюшинно в количестве 20 мг/кг массы тела экспериментального животного в месте предварительно обработанной области. Введение стрептозотоцина осуществляют через сутки после второго введения неполного адъюванта Фрейнда. Таким образом, интервал между первым и вторым введениями стрептозотоцина составляет 7 суток. После внутрибрюшинного введения в течение 30 секунд место инъекции умеренно прижимают асептическим спиртовым шариком с целью исключения обратного тока жидкости, после чего обрабатывают раствором повидон-йод.
6. Через 7 суток после второго введения неполного адъюванта Фрейнда осуществляют третье введение неполного адъюванта Фрейнда внутрибрюшинно в объеме 1 мл в месте предварительно обработанной области. После внутрибрюшинного введения в течение 30 секунд место инъекции умеренно прижимают асептическим спиртовым шариком с целью исключения обратного тока жидкости, после чего обрабатывают раствором повидон-йод.
7. После 12 часов голодания животному осуществляют третье введение разведенного в 0,5 мл охлажденного цитратного буфера (рН=4,5) стрептозотоцина внутрибрюшинно в количестве 25 мг/кг массы тела экспериментального животного в месте предварительно обработанной области. Введение стрептозотоцина осуществляют через сутки после третьего введения неполного адъюванта Фрейнда. Таким образом, интервал между вторым и третьим введениями стрептозотоцина составляет 7 суток. После внутрибрюшинного введения в течение 30 секунд место инъекции умеренно прижимают асептическим спиртовым шариком с целью исключения обратного тока жидкости, после чего обрабатывают раствором повидон-йод.
Пример:
Предлагаемая методика моделирования была использована на 30 крысах породы Wistar, не предрасположенных к развитию аутоиммунных заболеваний, контрольную группу составили 15 животных той же породы.
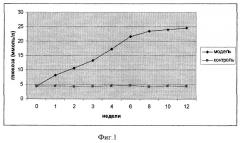
Уровень глюкозы у животных в группе с моделированием СД I типа начинал подниматься через 5-7 суток после последнего введения стрептозотоцина и к концу 3-4 недели достигал 17-20 ммоль/л (норма 4-6 ммоль/л), затем отмечалось дальнейшее увеличение уровня глюкозы, достоверно сохраняющееся в течение 3 месяцев, тогда как в контрольной группе уровень глюкозы не повышался и сохранялся в пределах нормы на всем сроке наблюдения.
На фиг.1 представлена динамика содержания глюкозы в крови у животных; линия с ромбами - после моделирования СД I типа; линия с квадратами - контроль. Данные показатели свидетельствуют о развитии устойчивого СД.
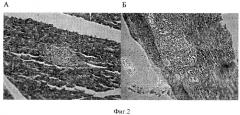
При гистологическом исследовании островковой ткани ПЖ животных из группы с моделированием СД I типа имелись признаки прогрессирования аутоиммунного повреждения островковой ткани ПЖ. Так, через месяц было отмечено наличие характерной выраженной лимфоцитарной инфильтрации островков Лангерганса (ОЛ) - инсулита, а через три месяца ОЛ уже не имели четких контуров, а ткань их характеризовалась признаками дистрофии и фиброза.
На фиг.2 представлено морфологическое состояние островковой ткани поджелудочной железы у животных при моделировании СД I типа. Окраска: гематоксилин и эозин. Увеличение ×200; А - через 1 месяц после моделирования; Б - через 3 месяца после моделирования. Данная морфологическая картина свидетельствует о специфическом аутоиммунном повреждении островковой ткани ПЖ.
Для доказательства аутоиммунной природы СД при моделировании у генетически не предрасположенных животных по предлагаемому способу на 40-е сутки эксперимента был выполнен адаптивный перенос заболевания путем введения интактным животным спленоцитов (лимфоцитов селезенки), полученных от животных с аутоиммунной моделью СД I типа. В результате у животных, которым был выполнен адаптивный перенос спленоцитов, через 2-3 недели было отмечено возрастание уровня глюкозы в крови и последующее развитие клиники сахарного диабета. Осуществление адаптивного переноса с помощью лимфоцитов свидетельствует о специфическом аутоиммунном характере заболевания.
Таким образом, эмпирически подобранное сочетанное использование стрептозотоцина и неполного адъюванта Фрейнда в определенном установленном нами взаимосвязанном режиме позволяет получить адекватную устойчивую аутоиммунную модель сахарного диабета I типа у генетически не предрасположенных к развитию аутоиммунных заболеваний животных, что коррелирует с широкой распространенностью этого заболевания.
Источники информации:
Способ моделирования сахарного диабета I типа у крыс, включающий выбор в качестве экспериментального животного крысы породы Wistar, генетически не предрасположенной к развитию аутоиммунных заболеваний, и внутрибрюшинное введение стрептозотоцина, отличающийся тем, что экспериментальному животному стрептозотоцин вводят трехкратно с интервалом в 7 суток, при этом во время первого введения количество вводимого препарата определяют из расчета 25 мг/кг массы тела экспериментального животного; во время второго введения количество вводимого препарата определяют из расчета 20 мг/кг массы тела экспериментального животного; во время третьего введения количество вводимого препарата определяют из расчета 25 мг/кг массы тела экспериментального животного; причем каждое введение стрептозотоцина осуществляют животному после 12 ч голодания; при этом за сутки перед каждым введением стрептозотоцина животному внутрибрюшинно вводят 1 мл неполного адъюванта Фрейнда.