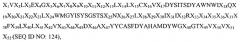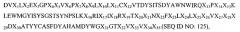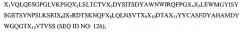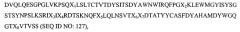Не мышиное анти-m-csf-антитело (варианты), его получение и использование
Иллюстрации
Показать всеИзобретение относится к анти-М-СSF-специфическим антителам, полученным на основе RX1 или происходящим от RX1, и которые более чем на 75% конкурируют с моноклональными антителами RX1, МС1 и/или МС3 за связывание с M-CSF (макрофагальному колониестимулирующему фактору). Не мышиное антитело является двухцепочечным, содержит определенную аминокислотную последовательность (приведенную в формуле изобретения и перечне последовательностей) и сохраняет высокую аффинность по отношению к M-CSF. Изобретение раскрывает выделенную нуклеиновую кислоту, кодирующую указанное антитело, вектор экспрессии, клетку-хозяина и способ получения анти-M-CSF-антитела с использованием клетки-хозяина или гибридомы, в частности гибридомы АТСС РТА-6263 или АТСС РТА-6264. Изобретение описывает фармацевтическую композицию, содержащую указанные антитела, наборы, содержащие фармацевтические композиции, и способы профилактики и лечения остеопороза у индивидуума, страдающего остеолитическим заболеванием. Полученные по изобретению антитела способны ингибировать дифференцировку остеокластов, что позволяет использовать их как высокоэффективные препараты для лечения остеолиза, рака с метастазами и остеопороза, ассоциированного с метастазами рака. 34 н. и 97 з.п. ф-лы, 30 ил., 12 табл.
Реферат
В настоящей заявке испрашивается приоритет предварительной заявки США №60/535181, поданной 7 января 2004, и предварительной заявки США №60/576417, поданной 2 июня 2004, каждая из которых во всей своей полноте вводится в настоящее описание посредством ссылки.
Область, к которой относится изобретение
Настоящее изобретение относится к способам предупреждения и лечения остеолиза, рака с метастазами и остеопороза, ассоциированного с метастазами рака, путем введения M-CSF-специфического антитела индивидууму.
Предшествующий уровень техники
Метастазы рака являются главной причиной постоперационных или посттерапевтических рецидивов рака у пациентов. Несмотря на интенсивные попытки разработать методику лечения рака, метастазы рака, в основном, не поддаются лечению. Кость является одной из самых распространенных участков, в которые метастазирует раковые опухоли человека различных типов (например, рак молочной железы, легкого, предстательной железы и щитовидной железы). Появление метастазов, вызывающих остеолиз кости, является причиной развития серьезных заболеваний, проявляющихся постоянной болью, высоким риском переломов, сдавлением нервов и гиперкальцемией. Несмотря на серьезность этих клинических симптомов, имеется очень немного способов лечения остеопороза, ассоциированного с метастазами рака.
Остеокласты опосредуют реадсорбцию кости. Остеокласты представляют собой многоядерные клетки, дифференцирующиеся из гемопоэтических клеток. Обычно принято считать, что остеокласты образуются в результате слияния мононуклеарных предшественников, происходящих от гемопоэтических стволовых клеток костного мозга, но не в результате неполного деления клеток (Chambers, Bone and Mineral Research, 6:1-25, 1989; Göthling et al., Clin. Orthop. Relat R. 120:201-228, 1976; Kahn et al., Nature 258:325-327, 1975, Suda et al., Endocr. Rev. 13:66-80, 1992; Walker, Science 180:875, 1973; Walker, Science 190:785-787, 1975; Walker, Science 190:784-785, 1975). Эти клетки происходят от тех же самых стволовых клеток, что и клетки линии дифференцировки моноцитов-макрофагов (Ash et al., Nature 283:669-670, 1980, Kerby et al., J. Bone Miner.Res. 7:353-62, 1992). Для дифференцировки предшественников остеокластов в зрелые многоядерные остеокласты требуется присутствие различных факторов, включая гормональные и локальные раздражители (Athanasou et al., Bone Miner. 3:317-333, 1988; Feldman et al., Endocrinology 107:1137-1143, 1980; Walker, Science 190:784-785, 1975; Zheng et al., Histochem. J.23:180-188, 1991), и было показано, что жизнеспособная костная ткань и костные клетки играют решающую роль в развитии остеокластов (Hagenaars et al., Bone Miner 6:179-189, 1989). Для дифференцировки остеокластов также требуется присутствие остеобластов или клеток стромы костного мозга. Одним из факторов, продуцируемых клетками, способствующими образованию остеобластов, является макрофагальный колониестимулирующий фактор, M-CSF (Wictor-Jedrzejczak et al., Proc. Natl. Acad. Sci. USA 87:4828-4823, 1990; Yoshida et al., Nature 345:442-444, 1990). Другим сигналом (Suda et al. Endocr. Rev. 13:66-80, 1992) является активатор рецептора для лиганда NF-kB (RANKL, также известный как TRANCE, ODF и OPGL), посредством которого остеобластные/стромальные клетки стимулируют образование и резорбцию остеокластов, а именно рецептора RANK (TRANCER), локализованного на остеокластах и предшественниках остеокластов (Lacey et al., Cell 93:165-176, 1998; Tsuda et al., Biochem Biophys Res. Co.234:137-142, 1997; Wong et al., J. Exp. Med. 186:2075-2080, 1997; Wong et al., J. Biol. Chem. 272:25190-25194, 1997; Yasuda et al., Endocrinology 139:1329-1337, 1998; Yasuda et al., Proc. Natl. Acad. Sci. US 95:3597-3602, 1998). Остеобласты также секретируют белок, который является сильным ингибитором образования остеокластов и называется остеопротегерином (OPG, также известный как OCIF), который действует как рецептор-“ловушка” для RANKL, то есть ингибирует позитивный сигнал между остеокластами и остеобластами посредством RANK и RANKL.
Остеокласты ответственны за растворение как минерального, так и органического костного матрикса (Blair et al., J. Cell Biol. 1164-1172, 1986). Остеокласты представляют собой клетки терминальной дифференцировки, имеющие уникальную поляризованную морфологию со специализированными мембранными областями и несколько мембранных и цитоплазматических маркеров, таких как резистентная к тартрату кислая фосфотаза (TRAP)(Anderson et al. 1979), (угольная кислота)-ангидраза II (Väänänen et al., Histochemistry 78:481-485, 1983), рецептор кальцитонина (Warshafsky et al., Bone 6:179-185, 1985) и рецептор витронектина (Davies et al., J. Cell. Biol. 109:1817-1826, 1989). Многоядерные остеокласты обычно содержат менее 10 ядер, но они могут содержать и до 100 ядер, диаметр которых составляет от 10 до 100 мкм (Göthling et al., Clin. Orthop. Relat. R. 120:201-228, 1976). Это позволяет относительно легко идентифицировать такие клетки под оптическим микроскопом. Указанные клетки, в их активном состоянии, являются в высокой степени вакуолизированными, а также содержат много митохондрий, что указывает на их высокую скорость метаболизма (Mundy, in Primer on the metabolic bone diseases and disorders of mineral metabolism, pages 18-22, 1990). Поскольку остеокласты играют главную роль в остеолизе, ассоциированном с метастазами кости, то необходимо выявить новые средства и разработать методы стимуляции и функционирования остеокластов.
Таким образом, необходимость в идентификации новых средств и в разработке способов профилактики или лечения остеолиза или метастазов рака, включая метастазы, вызывающие остеолиз кости, остается крайне актуальной.
Описание сущности изобретения
Материалы и способы согласно изобретению удовлетворяют вышеупомянутым и другим требованиям, относящимся к данной области. В одном из своих вариантов настоящее изобретение относится к не мышиному моноклональному антителу, включающему функциональный фрагмент, который специфически связывается с таким же эпитопом M-CSF, как и любое одно из мышиных моноклональных антител RX1, MC1 или МС3, имеющих аминокислотные последовательности, представленные на фигурах 4, 14 и 15 соответственно. В своем родственном варианте настоящее изобретение относится к вышеупомянутому антителу, выбранному из группы, состоящей из поликлонального антитела; моноклонального антитела, включая антитело Human Engineered™ (человеческое сконструированное антитело); гуманизированного антитела; человеческого антитела; химерного антитела; фрагментов антитела: Fab, F(ab')2, Fv, ScFv или SCA; диатела; линейного антитела или мутеина любого из указанных антител, где указанное антитело предпочтительно сохраняет аффинность связывания, равную, по меньшей мере, 10-7, 10-8 или 10-9 или выше. В настоящем изобретении также рассматривается не мышиное моноклональное антитело, включая его функциональный фрагмент, которые на более чем 75% конкурируют с моноклональными антителами RX1, MC1 и/или МС3, имеющими аминокислотную последовательность, представленную на фигуре 4, за связывание с M-CSF.
В другом своем варианте настоящее изобретение относится к не мышиному моноклональному антителу, включая его функциональный фрагмент, где указанное не мышиное моноклональное антитело или его функциональный фрагмент связывается с эпитопом M-CSF, который включает, по меньшей мере, 4, 5, 6, 7 или 8 смежных аминокислотных остатков 98-105 последовательности на фигуре 12.
В другом своем варианте настоящее изобретение относится к не мышиному моноклональному антителу, включая его функциональный фрагмент, где указанное не мышиное моноклональное антитело или его функциональный фрагмент связывается с эпитопом M-CSF, который включает, по меньшей мере, 4, 5, 6, 7 или 8 смежных аминокислотных остатков в положениях 65-73 или 138-144 последовательности, представленной на фигуре 12 (соответствующих эпитопам M-CSF, распознаваемым антителами 5Н5 или МС3).
В еще одном своем варианте настоящее изобретение относится к вышеупомянутому антителу или к его фрагменту, который связывается с эпитопом M-CSF, включающим аминокислоты 98-105, указанные на фигуре 12. В своем родственном варианте настоящее изобретение относится к вышеупомянутому антителу, содержащему область CDR3, показанную на фигуре 4А. В другом своем варианте настоящее изобретение относится к антителу, содержащему, по меньшей мере, 1, 2, 3, 4, 5 или 6 областей CDR мышиного антитела RX1, представленных на фигуре 4А. Такое антитело, содержащее, по меньшей мере, 1, 2, 3, 4 или 5 из 6 областей CDR мышиного антитела RX1, может также содержать, по меньшей мере, любые 1, 2, 3, 4 или 5 из 6 областей CDR антитела 5Н4, представленных на фигуре 16А-В. Альтернативно, антитело, которое содержит, по меньшей мере, 1, 2, 3, 4 или 5 областей CDR мышиного антитела RX1, может также содержать, по меньшей мере, любые 1, 2, 3, 4 или 5 из 6 областей CDR антитела МС1, представленных на фигуре 16А-В. В еще одном альтернативном варианте вышеупомянутое антитело может также содержать любые, по меньшей мере, 1, 2, 3, 4 или 5 из 6 областей CDR антитела МС3, представленных на фигуре 16А-В. В своем родственном варианте настоящее изобретение относится к антителу, которое содержит, по меньшей мере, 1, 2, 3, 4 или 5 областей CDR мышиного антитела RX1 и которое может содержать, по меньшей мере, 1, 2, 3, 4 или 5 областей консенсусной последовательности CDR, представленной на фигуре 16А-В. В еще одном родственном варианте изобретения один или несколько остатков в консенсусной последовательности областей CDR в вышеупомянутом антителе заменены соответствующим остатком любого из CDR мышиного антитела RX1, 5Н4, МС1 или МС3. При этом желательная аффинность связывания может сохраняться, даже если одна или несколько аминокислот в данном антителе являются мутированными, например, в результате консервативных замен в CDR, и/или консервативных или неконсервативных замен в остатках низкого и умеренного риска.
В другом своем варианте настоящее изобретение относится к вариантам вышеупомянутого антитела, содержащего аминокислотную последовательность вариабельной области тяжелой цепи, которая, по меньшей мере, на 60, 65, 70, 75, 80, 85, 90, 91, 92, 93, 94, 95, 96, 97, 98 или 99% гомологична аминокислотной последовательности, представленной на фигурах 4А, 13, 14 или 15. В родственном варианте изобретения указанное антитело содержит аминокислотную последовательность вариабельной области легкой цепи, которая, по меньшей мере, на 60, 65, 70, 75, 80, 85, 90, 91, 92 93, 94, 95, 96, 97, 98 или 99% гомологична аминокислотной последовательности, представленной на фигурах 4А, 13, 14 или 15.
В еще одном варианте изобретения указанное антитело содержит константную область и один или несколько вариабельных каркасных областей тяжелой и легкой цепей последовательности человеческого антитела. В родственном варианте изобретения указанное антитело содержит модифицированную или немодифицированную константную область человеческого иммуноглобулина IgG1, IgG2, IgG3 или IgG4. В предпочтительном варианте изобретения константной областью является человеческий IgG1 или IgG4, который может быть, но необязательно, модифицирован в целях усиления или ослабления некоторых свойств этого антитела. В случае IgG1, модификации, внесенные в константную область, а в частности в шарнирную область или в СН2-область, могут усиливать или ослаблять эффекторную функцию, включая ADCC- и/или CDC-активность. В других вариантах изобретения константная область IgG2 модифицирована в целях снижения уровня образования комплекса “антитело-антиген”. В случае IgG4, модификации в константной области, а в частности в шарнирной области, могут приводить к снижению уровня образования полуантител.
В еще одном варианте изобретения вышеупомянутое антитело является производным, или получено на основе, или содержит часть человеческой консенсусной последовательности, последовательности человеческой зародышевой линии, консенсусной последовательности человеческой зародышевой линии, или любой одной из последовательностей человеческого антитела, представленных в базах данных Kabat, NCB1 Ig Blast, http://www.ndci.nlm.nih.gov/igblast/showGermline.cgi, в базах данных Kabat http://www.bioinf.org.uk/abs/seqtest.htlm, на FTP-сайте для версии Kabat Release 5.0 (1992) ftp:/ftp.ndci.nih.gov/repository/kabat/Rel5.0, в базе данных ImMunoGeneTics (Montpellier France), http://imgt.cnusc.fr:8104/, V-Base http://www.mrc-cpe.cam.ac.uk/LIST.php?menu=901, Zurich University http://www.unizh.ch/~antibody/Sequences/index.html, The Therapeutic Antibody Human Homology Project (TAHHP) http://www.path.cam.ac.uk/~mrc7/humanisation/TAHHP.html, Protein Sequences and Structure Analysis of Antibody Domains http://how to/AnalyseAntibody/, Humanisation by design, http://people.cryst.bbk.ac.uk/~ubcg07s/, Antibody Resources http://www.antibodyresource.com/education.html, Antibody Engineering (by TT Wu), Humana Press.
В предпочтительном аспекте настоящего изобретения вышеупомянутое антитело представляет собой антитело Human Engineered™. Так, например, последовательность антитела Human Engineered™ представляет собой любую из последовательностей, указанных на фигурах 23-24. Рассматриваются также и другие антитела Human Engineered™ или их варианты.
Так, например, в одном из своих вариантов настоящее изобретение относится к вышеупомянутому антителу, полученному на основе антитела RX1, где вариабельная область тяжелой цепи этого антитела содержит аминокислотную последовательность
где Х представляет собой любую аминокислоту. В своем родственном варианте настоящее изобретение относится к антителу, в котором вариабельная область тяжелой цепи содержит аминокислотную последовательность
где Х представляет собой любую аминокислоту.
В другом своем варианте настоящее изобретение относится к вышеупомянутому антителу, в котором вариабельная область тяжелой цепи содержит аминокислотную последовательность
где Х представляет собой любую аминокислоту. В своем родственном варианте настоящее изобретение относится к антителу, в котором вариабельная область тяжелой цепи содержит аминокислотную последовательность
где Х представляет собой любую аминокислоту. В другом своем варианте настоящее изобретение относится к антителу, в котором вариабельная область тяжелой цепи содержит аминокислотную последовательность
В другом своем варианте настоящее изобретение относится к антителу, в котором вариабельная область тяжелой цепи содержит аминокислотную последовательность
В другом своем варианте настоящее изобретение относится к вышеупомянутому антителу, в котором вариабельная область легкой цепи содержит аминокислотную последовательность
где Х представляет собой любую аминокислоту. В своем родственном варианте настоящее изобретение относится к антителу, в котором вариабельная область легкой цепи содержит аминокислотную последовательность
где Х представляет собой любую аминокислоту. В еще одном своем варианте настоящее изобретение относится к антителу, в котором вариабельная область легкой цепи содержит аминокислотную последовательность
где Х представляет собой любую аминокислоту.
В другом своем варианте настоящее изобретение относится к вышеупомянутому антителу, в котором вариабельная область легкой цепи содержит аминокислотную последовательность
где Х представляет собой любую аминокислоту. В своем родственном варианте настоящее изобретение относится к антителу, в котором вариабельная область легкой цепи содержит аминокислотную последовательность
где Х представляет собой любую аминокислоту. В другом своем варианте настоящее изобретение относится к антителу, в котором вариабельная область легкой цепи содержит аминокислотную последовательность
В другом своем варианте настоящее изобретение относится к вышеупомянутому антителу, в котором вариабельная область легкой цепи содержит аминокислотную последовательность В другом своем варианте настоящее изобретение относится к антителу, в котором вариабельная область легкой цепи содержит аминокислотную последовательность
В другом своем варианте настоящее изобретение относится к вышеупомянутому антителу, в котором, по меньшей мере, один Х представляет собой соответствующую аминокислоту в аминокислотной последовательности, представленной на фигуре 4А. В своем родственном варианте настоящее изобретение относится к антителу, в котором, по меньшей мере, один Х представляет собой консервативную замену (в соответствии с таблицей 1) соответствующей аминокислоты в аминокислотной последовательности, представленной на фигуре 4А. В другом родственном варианте настоящее изобретение относится к антителу, в котором, по меньшей мере, один Х представляет собой не консервативную замену (в соответствии с таблицей 1) соответствующей аминокислоты в аминокислотной последовательности, представленной на фигуре 4А. В еще одном своем варианте настоящее изобретение относится к антителу, в котором, по меньшей мере, один Х представляет собой соответствующую аминокислоту в последовательности человеческого антитела.
Вышеупомянутое антитело Human Engineered™ является производным, или получено на основе, или содержит часть консенсусной последовательности человеческого антитела, последовательности человеческой зародышевой линии, консенсусной последовательности человеческой зародышевой линии, или любой одной из последовательностей человеческого антитела, представленных в базе данных Kabat, NCB1 Ig Blast, http://www.ndci.nlm.nih.nih.gov/igblast/showGermline.cgi, в базе данных Kabat http://www.bioinf.org.uk/abs/seqtest.htlm, на FTP-сайте для версии Kabat Release 5.0/ (1992) ftp:/ftp.ncbi.nih.gov/repository/kabat/Rel5.0/, в базе данных ImMunoGeneTics (Montpellier France), http://imgt.cnusc.fr:8104/, V-Base http://www.mrc-cpe.cam.ac.uk/LIST.php?menu=901, Zurich University http://www.unizh.ch/~antibody/Sequences/index.htlm, The Therapeutic Antibody Human Homology Project (TAHHP) http://www.path.cam.ac.uk/~mrc7/humanisation/TAHHP.html, Protein Sequence and Structure Analysis of Antibody Domains http://how to/AnalyseAntibodies/, Humanisation by design, http://people.cryst.bbk.ac.uk/~ubcg07s/, Antibody Resources http://www.antibodyresource.com/educational.html, Antibody Engineering (by TT Wu), Humana Press.
В другом своем варианте настоящее изобретение относится к вышеупомянутому антителу Human Engineered™, последовательность которого представляет собой одну из последовательностей, указанных на фигурах 23-24 или 29-30. В другом варианте изобретения вышеуказанное антитело содержит аминокислотную последовательность вариабельной области тяжелой цепи, которая, по меньшей мере, на 60, 65, 70, 75, 80, 85, 90, 91, 92, 93, 94, 95, 96, 97, 98 или 99% идентична одной из аминокислотных последовательностей, представленных на фигуре 19В. В другом варианте изобретения указанное антитело содержит аминокислотную последовательность вариабельной области легкой цепи, которая, по меньшей мере, на 60, 65, 70, 75, 80, 85, 90, 91, 92 93, 94, 95, 96, 97, 98 или 99% идентична одной из аминокислотных последовательностей легкой цепи, представленных на фигурах 20В-22В.
В еще одном варианте изобретения вышеупомянутое антитело, такое как 5Н4, МС1 или МС3, имеющее последовательности, указанные на одной из фигур 24С-24Е, представляет собой антитело Human Engineered™, полученное методами, описанными в патенте США №5766886, Studnicka et al., и в примере 4A настоящего изобретения, и эти последовательности пронумерованы согласно нумерации Кэбата, как показано на фигурах 24С-24Е, с идентификацией остатков с заменами низкого, умеренного или высокого риска. В своем родственном варианте настоящее изобретение относится к вышеупомянутому антителу, где все остатки низкого риска в тяжелой или легкой цепи или в обеих цепях были модифицированы, если это необходимо, так, чтобы эти остатки были идентичны остаткам исходной последовательности человеческого иммуноглобулина. Аналогичным образом, в другом своем варианте, настоящее изобретение относится к вышеупомянутому антителу, где все остатки низкого + умеренного риска в тяжелой или легкой цепи или в обеих цепях были модифицированы, если это необходимо, так, чтобы эти остатки были идентичны остаткам исходной последовательности человеческого иммуноглобулина. Тяжелая цепь, где все остатки низкого риска являются модифицированными, могут быть объединены с легкой цепью, где все остатки низкого и умеренного риска являются модифицированными, и наоборот. Аналогичным образом, легкая цепь и тяжелая цепь вышеупомянутого антитела Human Engineered™ могут быть объединены с легкой или тяжелой цепью гуманизированного антитела или химерного антитела.
В другом варианте изобретения указанное антитело содержит аминокислотную последовательность вариабельной области тяжелой цепи, которая, по меньшей мере, на 60, 65, 70, 75, 80, 85, 90, 91, 92, 93, 94, 95, 96, 97, 98 или 99% идентична одной из аминокислотных последовательностей тяжелой цепи вышеописанного антитела Human Engineered™, полученного в соответствии с методом Studnicka et al. В еще одном варианте изобретения указанное антитело содержит аминокислотную последовательность вариабельной области легкой цепи, которая, по меньшей мере, на 60, 65, 70, 75, 80, 85, 90, 91, 92, 93, 94, 95, 96, 97, 98 или 99% идентична одной из аминокислотных последовательностей легкой цепи вышеописанного антитела Human Engineered™, полученного в соответствии с методом Studnicka et al.
В другом своем варианте настоящее изобретение относится к антителу, содержащему тяжелую цепь, описанную выше, и легкую цепь, описанную выше.
В еще одном варианте изобретения вышеупомянутое антитело имеет аффинность Kd, равную по меньшей мере 10-7. В родственном варианте изобретения, указанное антитело имеет аффинность Kd, равную по меньшей мере 10-9.
В другом своем варианте настоящее изобретение относится к вышеупомянутому антителу, которое представляет собой поликлональное антитело; моноклональное антитело, включая антитело Human Engineered™; гуманизированное антитело; человеческое антитело; химерное антитело; фрагменты антитела: Fab, F(ab')2, Fv, ScFv или SCA; диатело; линейное антитело или мутеин любого из указанных антител. В родственном варианте изобретения моноклональное антитело представляет собой выделенное антитело.
В еще одном своем варианте настоящее изобретение относится к выделенной нуклеиновой кислоте, содержащей нуклеотидную последовательность, кодирующую легкую цепь вышеупомянутого антитела. В родственном варианте изобретения указанная выделенная нуклеиновая кислота содержит нуклеотидную последовательность тяжелой цепи, которая, по меньшей мере, на 60, 65, 70, 75, 80, 85, 90, 91, 92, 93, 94, 95, 96, 97, 98 или 99% идентична нуклеотидной последовательности тяжелой цепи, представленной на фигурах 4А, 13, 14 или 15. В другом родственном варианте изобретения указанная выделенная нуклеиновая кислота содержит нуклеотидную последовательность легкой цепи, которая, по меньшей мере, на 60, 65, 70, 75, 80, 85, 90, 91, 92, 93, 94, 95, 96, 97, 98 или 99% идентична нуклеотидной последовательности легкой цепи, представленной на фигурах 4А, 13, 14 или 15.
В другом своем варианте настоящее изобретение относится к вектору, содержащему вышеупомянутую выделенную нуклеиновую кислоту. В родственном варианте настоящее изобретение относится к вышеупомянутому вектору, в котором указанная выделенная нуклеиновая кислота функционально связана с регуляторной последовательностью. В другом своем варианте настоящее изобретение относится к клетке-хозяину, содержащему вышеупомянутый вектор.
В данной заявке рассматриваются несколько способов осуществления настоящего изобретения. Так, например, в настоящем изобретении рассматривается способ продуцирования вышеупомянутого антитела, включающий культивирование вышеупомянутой клетки-хозяина, так, чтобы экспрессируемая в этой клетке выделенная нуклеиновая кислота продуцировала данное антитело. В родственном варианте настоящее изобретение также относится к способу, включающему стадию выделения антитела из культуры клетки-хозяина. В родственном варианте настоящее изобретение также относится к выделенному антителу, продуцированному вышеупомянутым способом.
Настоящее изобретение также относится к гибридоме, которая секретирует вышеупомянутое антитело согласно изобретению. Кроме того, настоящее изобретение относится к вышеупомянутому антителу, конъюгированному с токсином.
В другом своем варианте настоящее изобретение относится к фармацевтической композиции, содержащей одно из вышеупомянутых антител и фармацевтически приемлемый носитель, наполнитель или разбавитель. В родственном варианте изобретения указанная фармацевтическая композиция дополнительно содержит второе терапевтическое средство. В другом своем родственном варианте настоящее изобретение относится к фармацевтической композиции, где указанным вторым терапевтическим средством является противораковое химиотерапевтическое средство. В еще одном родственном варианте настоящее изобретение относится к фармацевтической композиции, в которой указанным вторым терапевтическим средством является бифосфонат. В другом варианте изобретения указанным вторым терапевтическим средством является другое антитело.
В настоящем изобретении рассматриваются антитела, которые обладают рядом желательных свойств, эффективных для лечения заболеваний и расстройств. В одном из своих вариантов настоящее изобретение относится к любому из вышеупомянутых антител, которое связывается с M-CSF и может быть использовано для предотвращения у пациента заболевания, вызывающего или стимулирующего развитие остеолиза, и которое способствует значительному ослаблению тяжести остеопороза, ассоциированного с указанным заболеванием. Аналогичным образом, настоящее изобретение относится к любому из вышеупомянутых антител, которое связывается с M-CSF и которое может быть использовано для лечения пациента, страдающего заболеванием, вызывающим или стимулирующим развитие остеолиза, где указанное антитело способствует значительному ослаблению тяжести остеопороза, ассоциированного с указанным заболеванием.
В настоящем изобретении рассматривается ряд заболеваний и расстройств, которые могут поддаваться лечению с использованием антитела в соответствии с изобретением. В одном из своих вариантов настоящее изобретение относится к вышеупомянутому антителу, которое может быть использовано для лечения заболевания, выбранного из группы, состоящей из метаболических болезней кости, ассоциированных с относительно повышенной активностью остеокластов, включая эндокринопатии (включая гиперкортицизм, гипогонадизм, первичный или вторичный гиперпаратиреоз, гипертиреоз), гиперкальцемию, дефицитные состояния (включая рахит/остеомаляцию, цингу, нарушение питания), хронические заболевания (включая синдромы малабсорбции, хроническую почечную недостаточность (включая остеодистрофию почек)), хроническое заболевание печени (включая остеодистрофию печени)), заболевания, ассоциированные с приемом лекарственных средств (включая глюкокортикоиды (индуцированный глюкокортикоидами остеопороз), гепарин, алкоголь), наследственные заболевания (несовершенный остеогенез, гомоцистинурию), рак, остеопороз, остеопетроз, воспаление кости, ассоциированное с артритом и ревматоидным артритом, периодонтальное заболевание, фиброзную дисплазию и/или болезнь Педжета.
В своем родственном варианте настоящее изобретение относится к вышеупомянутому антителу, которое связывается с M-CSF и которое может быть использовано для профилактики или лечения рака с метастазами в кости, где указанным метастазирующим раком является рак молочной железы, рак легкого, рак почек, множественная миелома, рак щитовидной железы, рак предстательной железы, аденокарцинома, злокачественные заболевания клеток крови, включая лейкоз и лимфому; рак головы и шеи; рак желудочно-кишечного тракта, включая рак пищевода, рак желудка, рак толстой кишки, рак тонкой кишки, рак ободочной кишки, рак прямой кишки, рак поджелудочной железы, рак печени, рак желчных протоков или желчного пузыря; злокачественные заболевания женских половых органов, включая карциному яичника, рак эндометрия, рак влагалища и рак шейки матки; рак мочевого пузыря; рак головного мозга, включая нейробластому; саркома, остеосаркома; и рак кожи, включая злокачественную меланому или плоскоклеточный рак.
В другом своем варианте настоящее изобретение относится к способу скрининга на M-CSF-специфическое антитело, включающему стадии контактирования среды метастатических опухолевых клеток, остеокластов и антитела-кандидата; детекции образования остеокластов, пролиферации и/или дифференцировки остеокластов и идентификацию указанного антитела-кандидата как M-CSF-специфического антитела, если было обнаружено снижение уровня образования, пролиферации и/или дифференцировки остеокластов. Аналогичным образом, настоящее изобретение относится к вышеупомянутому способу, в котором указанная среда метастатических опухолевых клеток включает опухолевые клетки.
В другом своем варианте настоящее изобретение относится к вышеупомянутому способу, где указанная стадия контактирования (а) протекает in vivo; указанная стадия детекции (b) включает детекцию размера и/или числа метастазов в кости, а антитело-кандидат идентифицируют как M-CSF-специфическое антитело, если было обнаружено уменьшение размера и/или числа метастазов в кости. В своем родственном варианте настоящее изобретение относится к вышеупомянутому способу, дополнительно предусматривающему стадию определения наличия связывания антитела-кандидата с M-CSF. Аналогичным образом, в другом своем варианте настоящее изобретение относится к вышеупомянутому способу, который дополнительно предусматривает стадию определения факта ингибирования взаимодействия указанного антитела-кандидата с M-CSF и его рецептором M-CSFR.
В другом своем варианте настоящее изобретение относится к способу идентификации M-CSF-специфического антитела, которое может способствовать профилактике или лечению метастазов рака кости, где указанный способ предусматривает стадии: (а) детекции связывания антитела-кандидата с эпитопом M-CSF, включающим, по меньшей мере, 4 смежных аминокислотных остатка 98-105, указанных на фигуре 12; и (b) анализа способности указанного антитела-кандидата к профилактике или лечению метастазов рака в кости in vitro или in vivo.
В другом своем варианте настоящее изобретение относится к способу идентификации M-CSF-специфического антитела, которое может способствовать профилактике или лечению метастазов рака в кости, где указанный способ предусматривает стадии: (а) детекции связывания антитела-кандидата с эпитопом M-CSF, включающим, по меньшей мере, 4 смежных аминокислотных остатка 65-73 или 138-144, указанных на фигуре 12 (соответствующих эпитопам M-CSF, распознаваемым антителом 5Н4 или МС3); и (b) анализа способности указанного антитела-кандидата к профилактике или лечению метастазов рака в кости in vitro или in vivo.
В еще одном своем варианте настоящее изобретение относится к способу модификации CDR антитела, которое связывается с эпитопом M-CSF, включающим аминокислоты 98-105, представленные на фигуре 12, где указанный способ предусматривает: модификацию аминокислот в CDR аминокислотной последовательности, представленной на фигуре 4А, и отбор антитела, которое связывается с M-CSF с аффинностью Ка, составляющей по меньшей мере, 10-7. В другом своем варианте настоящее изобретение относится к способу системной модификации вплоть до 60% аминокислотной последовательности тяжелой цепи, представленной на фигуре 4А, где указанный способ предусматривает модификацию любых остатков Х1-Х52 в аминокислотной последовательности: и тестирование антитела, содержащего модифицированную аминокислотную последовательность, на связывание с эпитопом M-CSF, который включает аминокислоты 98-105, указанные на фигуре 12.
В своем родственном варианте настоящее изобретение относится к способу системной модификации вплоть до 60% аминокислотной последовательности легкой цепи, представленной на фигуре 4А, где указанный способ предусматривает модификацию любых остатков Х1-Х52 в аминокислотной последовательности: и тестирование антитела, содержащего модифицированную аминокислотную последовательность, на связывание с эпитопом M-CSF, который включает аминокислоты 98-105, указанные на фигуре 12.
В еще одном своем варианте настоящее изобретение относится к способу модификации CDR антитела, которое связывается с эпитопом M-CSF, включающим аминокислоты 65-73 или 138-144, указанные на фигуре 12 (соответствующие эпитопам M-CSF, распознаваемым антителом 5Н4 или МС3), где указанный способ включает модификацию аминокислот в аминокислотной последовательности области CDR, представленной на одной из фигур 13, 14 и 15, и отбор антитела, которое связывается с M-CSF с аффинностью Ка, составляющей, по меньшей мере, 10-7. В другом своем варианте настоящее изобретение относится к способу системной модификации до 60% аминокислотной последовательности тяжелой цепи, представленной на одной из фигур 13, 14 и 15, где указанный способ включает модификацию вышеупомянутых последовательностей, полученных методами, описанными в патенте США №5766886, Studnicka et al., и в примере 4А настоящей заявки, и пронумерованных в соответствии с нумерацией по Кэбату, как показано на фигурах 24С-24Е; и тестирование антитела, содержащего модифицированную аминокислотную последовательность, на связывание с эпитопом M-CSF, включающим аминокислоты 65-73 или 138-144, указанные на фигуре 12 (соответствующие эпитопам M-CSF, распознаваемым антителом 5Н4 или МС3). В родственном варианте изобретения все остатки низкого риска являются модифицированными. Аналогичным образом, в другом варианте изобретения все остатки низкого и умеренного риска являются модифицированными. В еще одном варианте изобретения все остатки низкого и умеренного риска, за исключением пролина, являются модифицированными.
В другом своем варианте настоящее изобретение относится к способу экспрессии антитела, имеющего области CDR, сконструированные вышеупомянутым способом. В другом своем варианте настоящее изобретение относится к фармацевтической композиции, содержащей антитело, связывающееся с M-CSF, где указанное антитело получают вышеупомянутым способом.
В еще одном своем варианте настоящее изобретение относится к способу профилактики или ослабления остеопороза, включающему введение индивидууму, страдающему заболеванием, вызывающим или стимулирующим развитие остеолиза, терапевтически эффективного количества любого из вышеупомянутых антител, которое предупреждает или ослабляет остерпороз, ассоциированный с указанным заболеванием. В своем родственном варианте настоящее изобретение относится к способу лечения индивидуума, страдающего заболеванием, вызывающим или стимулирующим развитие остеолиза, где указанный способ предусматривает введение указанному индивидууму терапевтически эффективного количества любого из вышеупомянутых антител, ослабляющего тяжесть остерпороза, ассоциированного с указанным заболеванием.
В своем родственном варианте настоящее изобретение относится к вышеупомянутому способу, в котором указанное заболевание выбрано из группы, состоящей из метаболических болезней кости, ассоциированных с относительно повышенной активностью остеокластов, включая эндокринопатии (включая гиперкортицизм, гипогонадизм, первичный или вторичный гиперпаратиреоз, гипертиреоз), гиперкальцемию, дефицитные состояния (включая рахит/остеомаляцию, цингу, нарушение питания), хронические заболевания (включая синдромы малабсорбции, хроническую почечную недостаточность (включая остеодистрофию почек)), хроническое заболевание печени (остеодистрофию печени)), заболевания, ассоциированные с приемом лекарственных средств (включая глюкокортикоиды (включая индуцированный глюкокортикоидами остеопороз), гепарин, алкоголь), наследственные заболевания (включая несовершенный остеогенез, гомоцистинурию), рак, остеопороз, остеопетроз, воспаление кости, ассоциированное с артритом и ревматоидным артритом, периодонтальное заболевание, фиброзную дисплазию и/или болезнь Педжета.
В еще одном своем варианте настоящее изобретение относится к способу профилактики или лечения метастазов рака в кости, включающему введение индивидууму, страдающему метастазами рака, терапевтически эффективного количества любого из вышеупомянутых антител. В своем родственном варианте настоящее изобретение относится к способу, в котором указанным метастазирующим раком является рак молочной железы, рак легкого, рак почек, множественная миелома, рак щитовидной железы, рак предстательной железы, аденокарцинома, злокачественные