Измерение степени полимеризации менингококковых капсульных сахаридов, содержащих сиаловую кислоту
Иллюстрации
Показать всеИзобретение относится к способу измерения степени полимеризации капсульных полисахаридов, содержащих сиаловую кислоту. Способ предусматривает стадии восстановление концевого моносахаридного звена сиаловой кислоты с получением восстановленного моносахаридного звена сиаловой кислоты, гидролиз сахарида с получением гидролизата, содержащего моносахаридные звенья. Причем сахарид содержит моносахаридные звенья сиаловой кислоты, которые связаны α 2→9, и концевое моносахаридное звено сиаловой кислоты. Далее определяют отношение общего количества сиаловой кислоты к количеству восстановленной сиаловой кислоты в гидролизате. Изобретение позволяет измерять величину степени полимеризации сахаридов и проводить оценку качества вакцин, в состав которых входят сахариды, новым способом, характеризующимся высокой точностью и достоверностью. 5 н. и 8 з.п. ф-лы, 21 ил., 8 табл.
Реферат
Все цитируемые в настоящем описании документы включены в него во всей полноте посредством ссылки.
Область техники изобретения
Настоящее изобретение относится к области анализа и контроля качества вакцин, содержащих бактериальные капсульные сахариды, и, в частности, вакцин, в которых сахариды конъюгированы с носителем.
Предшествующий уровень техники изобретения
Иммуногены, содержащие капсульные сахаридные антигены, конъюгированные с белками-носителями, хорошо известны в данной области техники. Конъюгирование превращает Т-независимые антигены в Т-зависимые антигены, тем самым усиливая реакции с созданием памяти и позволяя формироваться защитному иммунитету, и прототипной конъюгированной вакциной являлась вакцина против Haemophilus influenzae типа b (Hib) [см., например, главу 14 ссылки 1]. После создания вакцины против Hib были разработаны конъюгированные сахаридные вакцины для защиты от Neisseria meningitidis (менингококка) и Streptococcus pneumoniae (пневмококка). Другие микроорганизмы, создание вакцины против которых представляет интерес, представляют собой Streptococcus agalactiae (стрептококк группы В) [2], Pseudomonas aeruginosa [3] и Staphylococcus aureus [4].
Помимо использования полноразмерных капсульных сахаридов, после гидролитической обработки можно отобрать олигосахаридные фрагменты желаемого размера [например, ссылка 5], и были опубликованы сообщения о том, что конъюгаты, образованные олигосахаридами с промежуточной длиной цепи, характеризуются повышенной иммуногенностью [например, ссылки 6 и 7]. Из трех конъюгированных вакцин против N. meningitidis серогруппы С, одобренных для использования у человека, Menjugate™ [8] и Meningitec™ основаны на олигосахаридах, тогда как в NeisVac-C™ использован полноразмерный полисахарид. Таким образом, измерение длины олигосахарида (например, путем измерения степени полимеризации, или DP, т.е. количества повторяющихся звеньев в цепи) может быть использовано для косвенной оценки иммуногенности.
Если в состав вакцины входят олигосахаридные фрагменты, контроль качества производства и выпуска должен гарантировать, что олигосахариды имеют определенную длину и что эта длина постоянна от партии к партии. Таким образом, оценка DP также применима в контроле качества, и в структуру Европейского управления по качеству лекарственных средств (the European Directorate for Quality of Medicines, EDQM) входит Официальное ведомство по контролю качества выпускаемых партий (Official Control Authority Batch Release, OCABR), которое для вакцин против Hib особо требует представлять сведения, относящиеся к DP и распределению размеров молекул сахаридов, используемых в производстве.
Оценка DP также может быть использована для мониторинга стабильности вакцины. Сахаридные антигены могут легко деполимеризовываться при температурах окружающей среды [9, 10], что приводит к снижению иммуногенности и повышению гетерогенности вакцины. Такие изменения могут отслеживаться путем определения DP с течением времени хранения.
Среднее значение DP в пуле олигосахаридов может быть измерено в соответствии с рядом методик, и в некоторых случаях выбор метода зависит от анализируемого сахарида. Для анализа олигосахаридов oligosaccharides Hib и менингококков серогрупп А и С были описаны такие методики как колориметрический и/или ферментный анализы [5, 11, 12], но авторы настоящего изобретения обнаружили, что гликозидные связи в сахаридах менингококков серогрупп W135 и Y ('MenW135' и 'MenY') делают невозможным использование этих методик.
Хотя ранее были описаны способы измерения DP сахаридов МеnА и МеnС для конъюгированных вакцин [например, ссылки 5 и 13], существует потребность в способах, которые были бы применимы для анализа сахаридов серогрупп W135 и Y. Таким образом, целью изобретения является обеспечение усовершенствований способов оценки DP сахаридов и, в частности, разработка способов, которые могут быть использованы для измерения DP сахаридов менингококков серогрупп W135 и Y.
Раскрытие изобретения
Авторы изобретения разработали способ, который может быть использован для измерения DP капсульных сахаридов менингококков серогрупп W135 и Y. Таким образом, изобретение относится к способу измерения степени полимеризации капсульного сахарида, отличающемуся тем, что сахарид относится к менингококкам серогруппы W135 или серогруппы Y. Способ легко осуществляется путем включения стадии хроматографического разделения. Для композиции, содержащей популяцию капсульных сахаридов различных размеров, изобретение относится к способу измерения среднего значения DP.
Способ, как правило, предусматривает гидролиз сахаридов с высвобождением составляющих моносахаридов, причем анализ проводится по моносахаридам. Таким образом, изобретение относится к способу измерения степени полимеризации капсульного сахарида менингококка серогруппы W135 или серогруппы Y, причем способ предусматривает следующие стадии: (i) гидролиз сахарида с получением гидролизата сахарида, содержащего моносахаридные звенья; (ii) определения количества моносахаридных звеньев в гидролизате, причем количественные результаты определения на стадии (ii) используют для расчета степени полимеризации.
Перед гидролизом способ, как правило, предусматривает химическое модифицирование концевого остатка (либо по восстанавливающему концу, либо по невосстанавливающему концу) сахарида таким образом, что после гидролиза до моносахаридов концевой остаток можно отличить от неконцевых остатков. Таким образом, изобретение относится к способу измерения степени полимеризации капсульного сахарида менингококка серогруппы W135 или серогруппы Y, причем способ предусматривает следующие стадии: (i) модификация концевого моносахаридного звена сахарида с получением модифицированного концевого моносахарида; (ii) гидролиз сахарида с получением гидролизата сахарида, содержащего моносахаридные звенья, включая модифицированный концевой моносахарид; (iii) определение количества моносахаридных звеньев в гидролизате; (iv) определение количества модифицированного концевого моносахарида в гидролизате; и (v) использование количественных результатов определения на стадиях (iii) и (iv) для расчета степени полимеризации.
В более общем смысле, способ применим к любому сахариду, содержащему два или более различных типов моносахаридных звеньев и содержащему концевой остаток сиаловой кислоты. Предпочтительно, способ обеспечивает получение информации о DP на основании только определения количества остатков сиаловой кислоты в сахариде без необходимости анализа какого-либо иного типа моносахарида. Таким образом, изобретение относится к способу измерения степени полимеризации капсульного сахарида, в котором (а) сахарид содержит моносахаридные звенья сиаловой кислоты или отличные от сиаловой кислоты моносахаридные звенья; (b) сахарид содержит концевое моносахаридное звено сиаловой кислоты; и (с) способ предусматривает следующие стадии: (i) модификация концевого звена сахарида в виде сиаловой кислоты с получением модифицированного концевого звена сиаловой кислоты; (ii) гидролиз сахарида с получением гидролизата сахарида, содержащего звенья сиаловой кислоты, включая модифицированные концевые звенья сиаловой кислоты; (iii) определение количества звеньев сиаловой кислоты в гидролизате, включая модифицированные концевые звенья сиаловой кислоты; и (iv) использование количественных результатов определения на стадии (iii) для расчета степени полимеризации.
Предпочтительный способ по изобретению основан на восстановлении концевых остатков сиаловой кислоты на сахаридах с последующим расчетом DP путем сравнения молярного отношения общего количества сиаловой кислоты к количеству восстановленной сиаловой кислоты. Таким образом, изобретение относится к способу измерения степени полимеризации капсульного сахарида, в котором (а) сахарид содержит моносахаридные звенья сиаловой кислоты или отличные от сиаловой кислоты моносахаридные звенья; (b) сахарид содержит концевое моносахаридное звено сиаловой кислоты; и (с) способ предусматривает следующие стадии: (i) восстановление концевого моносахаридного звена сиаловой кислоты с получением восстановленного моносахаридного звена сиаловой кислоты; (ii) гидролиз сахарида с получением гидролизата, содержащего моносахаридные звенья; (iii) определение отношения общего количества сиаловой кислоты (т.е. восстановленной и невосстановленной) к количеству восстановленной сиаловой кислоты в гидролизате.
Применительно к композиции, содержащей популяцию капсульных сахаридов различных размеров, изобретение относится к способу измерения среднего значения степени полимеризации сахаридов, в котором (а) сахариды содержат моносахаридные звенья сиаловой кислоты или отличные от сиаловой кислоты моносахаридные звенья; (b) сахариды содержат концевые моносахаридные звенья сиаловой кислоты; и (с) способ предусматривает следующие стадии: (i) восстановление концевых моносахаридных звеньев сиаловой кислоты с получением восстановленных моносахаридных звеньев сиаловой кислоты; (ii) гидролиз сахаридов с получением гидролизата сахаридов, содержащего моносахаридные звенья; (iii) определение отношения общего количества сиаловой кислоты (т.е. восстановленной и невосстановленной) к количеству восстановленной сиаловой кислоты в гидролизате. Композиция может содержать сахариды, не содержащие концевые моносахаридные звенья сиаловой кислоты.
Был описан способ анализа длины и состава сахаридов на основе полисиаловой кислоты [14], в котором концевые остатки окисляли и/или восстанавливали, после чего сахарид расщепляли ферментом нейраминидазой с высвобождением его моносахаридных звеньев сиаловой кислоты. Однако этот известный из предшествующего уровня техники способ был описан только для сахаридов, состоящих исключительно из сиаловых кислот (включая N-ацетилнейраминовую кислоту, N-гликолилнейраминовую кислоту и дезаминированную сиаловую кислоту), и был технически ограничен сахаридами, которые могут быть ферментативно расщеплены на моносахариды. Напротив, способ по изобретению может быть осуществлен с использованием сахаридов, содержащих отличные от сиаловых кислот моносахариды, и не требует (но и не исключает) использования ферментативного гидролиза.
Авторы настоящего изобретения также открыли способ, который может быть использован для измерения DP для капсульных сахаридов менингококков серогруппы С. Способ, опять же, основан на восстановлении концевых остатков сиаловой кислоты, причем значение DP рассчитывают тем же способом. Способ находит более общее применение к любому сахариду, содержащему остатки сиаловой кислоты, которые связаны α 2 9. Предпочтительно, способ не предусматривает ферментативную деполимеризацию. Таким образом, изобретение относится к способу измерения степени полимеризации капсульного сахарида, в котором (а) сахарид содержит моносахаридные звенья сиаловой кислоты, которые связаны α 2 9; (b) сахарид содержит концевое моносахаридное звено сиаловой кислоты; и (с) способ предусматривает следующие стадии: (i) восстановление концевого моносахаридного звена сиаловой кислоты с получением восстановленного моносахаридного звена сиаловой кислоты; (ii) гидролиз сахарида с получением гидролизата, содержащего моносахаридные звенья; (iii) определение отношения общего количества сиаловой кислоты (т.е. восстановленной и невосстановленной) к количеству восстановленной сиаловой кислоты в гидролизате.
Применительно к композиции, содержащей популяцию капсульных сахаридов различных размеров, изобретение относится к способу измерения среднего значения степени полимеризации сахаридов, в котором (а) сахариды содержат моносахаридные звенья сиаловой кислоты, которые связаны α 2 9; (b) сахариды содержат концевые моносахаридные звенья сиаловой кислоты; и (с) способ предусматривает следующие стадии: (i) восстановление концевых моносахаридных звеньев сиаловой кислоты с получением восстановленных моносахаридных звеньев сиаловой кислоты; (ii) гидролиз сахаридов с получением гидролизата, содержащего моносахаридные звенья; (iii) определение отношения общего количества сиаловой кислоты (т.е. восстановленной и невосстановленной) к количеству восстановленной сиаловой кислоты в гидролизате.
Был описан способ анализа длины и состава сахаридов на основе полисиаловой кислоты [14], в котором концевые остатки окисляли и/или восстанавливали, после чего сахарид расщепляли ферментом нейраминидазой с высвобождением его моносахаридных звеньев сиаловой кислоты. Однако этот известный из предшествующего уровня техники способ был описан только для сахаридов, состоящих из α 2 8-связанных сиаловых кислот, и был технически ограничен сахаридами, которые могут быть ферментативно расщеплены на моносахариды. Напротив, способ по изобретению предусматривает использование α 2 9-связанных сиаловых кислот и предпочтительно предусматривает использование неферментативного гидролиза, как правило, химического (т.е. кислотного) гидролиза.
Известен способ определения длины сахарида серогруппы С [5], в котором значение DP определяли путем сравнения отношения между общим количеством сиаловой кислоты и формальдегида, образующегося в результате обработки сахарида МеnС перйодатом. Этот известный из предшествующего уровня техники способ предусматривает модификацию невосстанавливающего конца полимера и не предусматривает образование сиалитола.
Капсульные сахариды, содержащие остатки сиаловой кислоты и отличные от сиаловой кислоты остатки
В некоторых вариантах выполнения изобретение относится к способу анализа сахаридов, содержащих как моносахаридные звенья сиаловой кислоты, так и отличные от сиаловой кислоты моносахаридные звенья. Более конкретно, сахариды предпочтительно состоят из повторяющихся звеньев, а повторяющиеся звенья состоят из моносахаридных звеньев сиаловой кислоты и отличных от сиаловой кислоты моносахаридных звеньев.
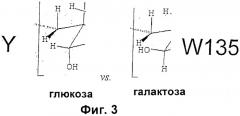
Два особенно интересующих сахарида представляют собой капсульные сахариды Neisseria meningitidis серогрупп W135 и Y. Эти сахариды естественно содержат остаток сиаловой кислоты на восстанавливающем конце и либо глюкозу, либо галактозу на невосстанавливающем конце. Сиаловая кислота в составе нативных сахаридов этих серогрупп представляет собой N-ацетилнейраминовую кислоту или 'NeuNAc'.
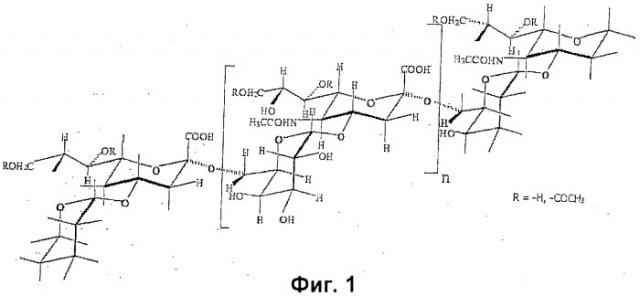
Сахарид серогруппы W135 представляет собой полимер, состоящий из дисахаридных звеньев сиаловая кислота-галактоза. Он характеризуется изменчивым O-ацетилированием по положениям 7 и 9 сиаловой кислоты [15]. Структура показана на фиг.1 и записывается как 4)-D-Neup5Ac(7/90Ac)-α-(2 6)-D-Gal-α-(1.
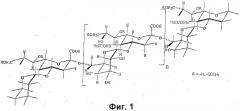
Сахарид серогруппы Y схож с сахаридом серогруппы W135 за исключением того, что дисахаридное повторяющееся звено содержит глюкозу вместо галактозы (см. фиг.3). Он характеризуется изменчивым O-ацетилированием по положениям 7 и 9 сиаловой кислоты [15]. Структура сахарида серогруппы Y показана на фиг.2 и записывается как 4)-D-Neup5Ac(7/90Ac)-α-(2 6)-D-Glc-α-(1.
В других вариантах выполнения изобретение относится к способам анализа сахаридов, содержащих (α 2 9)-связанные сиаловые кислоты. Капсульный сахарид серогруппы С представляет собой гомополимер (α 2 9)-связанной сиаловой кислоты, характеризующийся изменчивым O-ацетилированием по положениям 7 и/или 8.
Капсулы менингококков серогрупп С, W135 и Y отличаются от таковой менингококка серогруппы А, содержащей гомополимер (α1→6)-связанного N-ацетил-D-маннозамин-1-фосфата, и от таковой менингококка серогруппы В, содержащей гомополимер (α 2 8)-связанной сиаловой кислоты.
Степень полимеризации
Степень полимеризации сахарида определяется как число повторяющихся звеньев в этом сахариде. Таким образом, для гомополимера степень полимеризации представляет собой то же, что и число моносахаридных звеньев. Однако для гетерополимера степень полимеризации равна числу моносахаридных звеньев во всей цепи, деленному на число моносахаридных звеньев в минимальном повторяющемся звене, например DP (Glc-Gal)10 равна 10, а не 20, a DP (Glc-Gal-Neu)10 равна 10, а не 30.
В смеси сахаридов, характеризующихся одинаковой основной повторяющейся структурой, но различной длиной (например, в частичном гидролизате длинного полисахарида), обычно измеряют среднее значение DP отдельных молекул. Если интервал размеров слишком велик, настолько, что среднее значение не имеет смысла, существует возможность измерения DP для отдельных фракций смеси после разделения (например, после разделения по размеру). Вообще, изобретение применимо для измерения среднего значения DP в композициях, содержащих сахариды переменной длины.
Восстановление концевого моносахаридного звена сиаловой кислоты
Изобретение применимо для анализа сахаридов, содержащих концевые остатки сиаловой кислоты. В частности, оно применимо для анализа сахаридов, содержащих остатки сиаловой кислоты на восстанавливающем конце.
Для восстановления концевого остатка сиаловой кислоты может быть использована любая химическая методика, предусматривающая, как правило, инкубирование сахарида с восстановителем. Подходящие для каждого данного восстановителя и каждого данного сахарида условия могут быть определены в соответствии с рутинным анализом.
Предпочтительным восстановителем является боргидрид натрия (NaBH4), который восстанавливает концевые остатки сиаловой кислоты [14] в щелочных условиях. Продукт такого восстановления иногда называют сиалитолом [16]. Как правило, достаточным является инкубирование с NaBH4 в течение 2 часов при 37°С. После восстановления в щелочных условиях композицию предпочтительно нейтрализуют, например, путем добавления умеренно кислого ацетата аммония.
Гидролиз сахарида с получением гидролизата сахарида
После восстановления концевого остатка сиаловой кислоты сахарид расщепляют на составляющие моносахаридные звенья. Вообще говоря, деполимеризация сахаридов с получением моносахаридов может быть проведена химически и ферментативно. Однако, если фермента для осуществления данной реакции расщепления не существует, то следует использовать химический способ.
Химический гидролиз сахаридов, как правило, предусматривает обработку либо кислотой, либо основанием в стандартных для данной области техники условиях. Условия деполимеризации капсульных сахаридов на составляющие моносахариды известны в данной области техники. Для сахаридов серогрупп W135 и Y предпочтительным является кислотный гидролиз. Для гидролиза каждого из сахаридов серогрупп С, W135 и Y может быть использован кислотный гидролиз с помощью ТФУ (трифторуксусной кислоты) с предпочтительным использованием слегка более низкой температуры инкубации для сахаридов серогруппы С во избежание разрушения их сиаловых кислот (90°С вместо 100°С). Типичная обработка ТФУ предусматривает добавление ТФУ до конечной концентрации 2 М с последующим нагреванием до 90-100°С в течение 90 минут. Для проведения анализа общего содержания сахарида сахарид серогруппы С может быть гидролизован путем обработки 100 мМ HCI при 80°С в течение 2 часов [17]. Другие типичные условия гидролиза предусматривают использование миллимолярных концентраций слабой кислоты (например, уксусной кислоты) при повышенных температурах (например, 70-80°С).
Доступны ферменты для расщепления связей α 2 9, обнаруженных в сахаридах серогруппы С, и они могут быть использованы в соответствии с изобретением. Однако для ферментативной обработки, как правило, требуется, чтобы сахариды были дез-O-ацетилированы перед гидролизом, так что если желательным является сохранение O-ацетилирования [15], то предпочтительно гидролизовать сахарид химически. Химический гидролиз также может быть предпочтительным, если ферментативный гидролиз протекает медленно. Ферменты для расщепления сахаридов серогрупп W135 и Y, как правило, недоступны.
Хотя выше изобретение раскрыто применительно к получению и анализу гидролизата, содержащего моносахаридные звенья, изобретение также применимо к гидролизатам, содержащим дисахаридные, трисахаридные, тетрасахаридные и т.д. фрагменты капсульного сахарида, но гидролизат в виде моносахаридов является более легким в получении. Условия гидролиза, обеспечивающие получение настолько гомогенной популяции ди-, три-, тетра- и т.д. сахаридов, что количественному анализу подвергается единственное соединение, гораздо сложнее контролировать, чем таковые, просто позволяющие протекать деполимеризации до конца, т.е. с получением моносахаридов.
После деполимеризации гидролизаты сахаридов могут быть высушены, например, с помощью вакуумной сушки.
Определение отношения общего количества сиаловой кислоты к количеству восстановленной сиаловой кислоты
Гидролиз позволяет получить гидролизат сахарида, содержащий моносахаридные звенья исходного сахарида. В вариантах выполнения, в которых сахариды содержат как звенья сиаловой кислоты, так и отличные от сиаловой кислоты звенья, гидролизат содержит сиаловую кислоту и отличные от сиаловой кислоты моносахариды; в вариантах выполнения, в которых сахариды представляют собой гомополимеры сиаловой кислоты, гидролизат содержит только сиаловую кислоту; в обоих случаях фракция моносахаридов сиаловой кислоты находится в модифицированной форме (например, в восстановленной форме). Эта фракция может быть использована для определения значения DP исходного сахарида. Например, если в смеси модифицирован один из десяти остатков сиаловой кислоты, а минимальное повторяющееся звено сахарида содержит единственный остаток сиаловой кислоты, то значение DP исходного сахарида равно 10.
Количества отдельных моносахаридов могут быть определены в виде количества (т.е. молей) молекул, масс, отношений или концентраций. Обычно для облегчения расчета отношений работают с мольными значениями, особенно если составляющие моносахариды имеют различные молекулярные массы, но для определения содержания моносахаридов в смеси могут быть использованы и взаимозаменяемы любые из этих величин. Для измерения количества результаты анализа могут быть сравнены со стандартом, характеризующимся известным содержанием конкретного сахарида.
Деполимеризованная смесь предпочтительно гидролизована полностью до моносахаридов. Авторы настоящего изобретения обнаружили, что иногда происходит неполный гидролиз с получением смесей, в которых присутствуют дисахаридные фрагменты (т.е. Gal-NeuNAc в MenW135 и Glc-NeuNAc в MenY). Например, существуют наблюдения, что обработка сахаридов MenW135 или MenY 2M ТФУ при 90°С позволяла получить смесь моносахаридов и дисахаридов, тогда как повышение температуры гидролиза до 100°С позволяло получить по существу только моносахариды. Неполный гидролиз не ожидался даже при 90°С, но, как показали наблюдения, специалист в данной области техники способен при необходимости модифицировать любую конкретную методику гидролиза для обеспечения полного гидролиза, например, путем повышения температуры и т.д.
Способы определения количества моносахаридов сиаловой кислоты хорошо известны в данной области техники. Способы могут быть прямыми и непрямыми (например, они могут предусматривать дериватизацию моносахаридов с последующим анализом, результаты которого коррелируют с исходным содержанием моносахаридов). Предпочтительные способы позволяют анализировать содержание сиаловой кислоты в присутствии других моносахаридов, так что их не требуется отделять друг от друга перед анализом. Кроме того, способы могут быть использованы для анализа конъюгированных сахаридов, в которых после деконъюгирования нет необходимости разделения носителя и сахарида. Один такой способ представляет собой анионообменную хроматографию и, в частности, высокоэффективную анионообменную хроматографию (НРАЕС), обычно с импульсным амперометрическим обнаружением (PAD) [18, 19]. Системы HPAEC-PAD поставляются Dionex™ Corporation (Sunnyvale, CA), например система BioLC™, в которой используется такая колонка как РА1 [диаметр 10 мкм, полистирольный субстрат, сшитый 2% дивинилбензола, аггломерированный с 500 нм функционализированным четвертичным аммонием латексом MicroBead (сшитым на 5%)] или РА10 [диаметр 10 мкм, этилвинилбензольный субстрат, сшитый 55% дивинилбензола, аггломерированный с 460 нм дифункционализированным ионом четвертичного аммония MicroBead (сшитым на 5%)]. Эти системы позволяют проводить количественный анализ отдельных сахаридов в смесях без необходимости дериватизации или разделения перед анализом. Для анализа сахаридов может быть желательно отфильтровать другие соединения перед нанесением на колонку, и Dionex™ производит для этих целей предколонки и ловушки, например аминоуловитель для удаления аминокислот, боратный уловитель и т.д.
Альтернативным способом определения количества моносахаридов сиаловой кислоты в деполимеризованной смеси является ядерный магнитный резонанс (ЯМР). Однако для легкости использования и высокой чувствительности предпочтительны хроматографические методики по изобретению. Однако какой бы способ не был выбран, в некоторых вариантах выполнения изобретения важно отличить восстановленную сиаловую кислоту от невосстановленной сиаловой кислоты. Это может предусматривать получение от каждой из них уникальных сигналов или может предусматривать получение одного уникального сигнала и одного объединенного сигнала, причем различие между двумя данными сигналами предоставляет необходимую информацию.
Другим способом определения количества моносахаридов сиаловой кислоты является колориметрический анализ [80]. Этот способ особенно применим для определения количества невосстановленной сиаловой кислоты после гидролиза в ТФУ.
Определив относительные количества модифицированной и немодифицированной (например, восстановленной и невосстановленной) сиаловой кислоты, легко установить значение DP исходного сахарида.
Помимо определения количества сиаловых кислот в гидролизате, способы по изобретению могут предусматривать определение количества других моносахаридов (например, глюкозы или галактозы), которые могут быть производными того же сахарида, что и сиаловые кислоты, или других сахаридов. Эти измерения могут быть использованы для определения параметров, отличных от DP, или могут быть использованы как часть определения значения DP, например в качестве подтверждения или вместо измерения общего количества сиаловой кислоты, особенно если мольные количества сиаловой кислоты и другого моносахарида такие же, как и сахариды W135 и Y.
Способ по изобретению, как правило, является деструктивным. Более типично взять образец интересующей композиции и затем проводить анализ образца, чем осуществлять способ на всей композиции.
Конъюгаты
Изобретение применимо для анализа содержания сахарида в вакцинах и, в частности, в вакцинах, содержащих конъюгированный сахарид. Ковалентное конъюгирование применяют для повышения иммуногенности сахаридов благодаря их переходу из разряда Т-независимых антигенов в разряд Т-зависимых антигенов, обеспечивая таким образом прайминг с созданием иммунной памяти. Конъюгирование особенно применимо для создания педиатрических вакцин и представляет собой хорошо известный метод [обзор приводится, например, в ссылках 20-29]. Сахариды могут быть связаны с носителями непосредственно [30, 31], но, как правило, используют линкер, например адипиновую кислоту, β-пропионамидо [32], нитрофенилэтиламин [33], галогенацилгалогениды [34], гликозидные связи [35], 6-аминокапроновую кислоту [36], ADH [37], радикалы C4-C-12 [38] и т.д.
Типичными белками-носителями для использования в конъюгатах являются бактериальные токсины или анатоксины, такие как дифтерийный анатоксин или столбнячный анатоксин. В Menjugate™ и Meningitec™ белком-носителем является производное дифтерийного токсина CRM197 [39-41], тогда как в составе NeisVac™ использован столбнячный анатоксин. В Menactra™ в качестве носителя используют дифтерийный анатоксин. Другие подходящие белки-носители включают в себя белок внешней мембраны N. meningitidis [42], синтетические пептиды [43, 44], белки теплового шока [45, 46], белки возбудителя коклюша [47, 48], цитокины [49], лимфокины [49], гормоны [49], факторы роста [49], искусственные белки, содержащие множественные эпитопы человеческих CD4+ Т-клеток из антигенов различных патогенов [50], белок D Н. influenzae [51, 52], поверхностный белок PspA пневмококков [53], железосвязывающие белки [54], токсин А или В С.difficile [55] и т.д. В составе композиций может быть использовано более одного белка-носителя, например для снижения риска возникновения супрессии носителем, а один белок-носитель может нести более одного сахаридного антигена [56]. Конъюгаты, как правило, характеризуются отношением сахарид:белок (по массе) от 1:5 (т.е. избытка белка) до 5:1 (т.е. избытка сахарида). Помимо конъюгатов композиции могут содержать свободный белок-носитель [57].
Изобретение особенно применимо перед конъюгированием на стадии, на которой необходимо обеспечить, что для получения конъюгата отобраны сахаридные цепи нужного размера.
Изобретение обеспечивает подлежащее контролю или мониторингу протекание фрагментации полноразмерного полисахарида перед конъюгированием. Если желательно получение олигосахаридов конкретной длины (интервала длин), то важно, чтобы фрагментация полисахарида не была настолько полной, что деполимеризация проходила желаемую точку (например, как максимум с получением моносахаридов). Изобретение обеспечивает мониторинг протекания этой частичной деполимеризации путем измерения средней длины цепи во времени. Таким образом, изобретение относится к способу измерения степени полимеризации сахарида(ов) в композиции, предусматривающему следующие стадии: (а) начало деполимеризации сахарида(ов) в композиции; и в одной или нескольких временных точках после этого (b) измерение значения DP сахарида(ов), как описано выше. При первоначальном проведении экспериментов обычно измеряют значение DP в нескольких временных точках для определения хода процесса во времени, а после того как стандартные условия определены, обычно измеряют значение DP в определенной временной точке для подтверждения. Когда DP достигает желаемого значения, способ может предусматривать следующую стадию: (с) остановки деполимеризации, например, путем промывания, разделения, охлаждения и т.д. Способ также может предусматривать дополнительную стадию конъюгирования деполимеризованного сахарида с белком-носителем после химической активации при необходимости.
Изобретение также позволяет проводить отбор олигосахаридных цепей желаемой длины после фрагментации. Таким образом, изобретение относится к способу отбора сахаридов для использования в получении гликоконъюгата, предусматривающему следующие стадии: (а) приготовление композиции, содержащей смесь различных полисахаридных фрагментов, характеризующихся различными степенями полимеризации; (b) разделение смеси на подсмеси; (с) определение значения DP одной или нескольких подсмесей в соответствии со способом, описанным выше; и (d) использование результатов стадии (с) для отбора одной или нескольких подсмесей для использования в конъюгировании. Способ может предусматривать фрагментацию полисахарида перед стадией (а) или может начинаться с использования заранее приготовленной смеси. Фрагменты могут представлять собой фрагменты одного и того же полисахарида, например сахарида той же серогруппы. После стадии (d) способ может предусматривать стадию конъюгирования с белком-носителем после химической активации при необходимости.
Для сахарида перед конъюгированием вполне обычной является химическая активация с целью введения функциональной группы, способной реагировать с носителем. Условия активации сахарида могут вызвать гидролиз, и, соответственно, после активации полезно проверить значение DP. Термин "сахарид" следует, где уместно, понимать как охватывающий эти активированные сахариды. Более того, изобретение относится к способу получения активированного сахарида для использования в получении гликоконъюгата, предусматривающему следующие стадии: (а) получение сахарида; (b) химическая активация сахарида с целью введения функциональной группы, способной реагировать с белком-носителем; и (с) измерение значения DP продукта стадии (b), описанного выше. Способ может предусматривать дополнительную стадию (d) реакции активированного сахарида с белком-носителем (который сам может быть активирован) с получением гликоконъюгата. Способ может предусматривать фрагментацию полисахарида перед стадией (а) или может начинаться с использования заранее приготовленной смеси.
Изобретение также может быть использовано после конъюгирования. После конъюгирования композиции могут быть проанализированы с помощью изобретения тремя способами: во-первых, может быть измерено общее значение DP сахаридов композиции, например, перед смешиванием различных конъюгатов или перед выпуском вакцины (в целях соблюдения регламента или контроля качества); во-вторых, может быть измерено значение DP свободного неконъюгированного сахарида в композиции, например, для контроля неполного конъюгирования или для слежения за гидролизом конъюгатов путем мониторинга повышения содержания свободного сахарида с течением времени; в-третьих, для тех же целей может быть измерено значение DP конъюгированного сахарида в композиции. Для первого и третьего способов требуется, чтобы сахарид высвобождался из состава конъюгата до проведения анализа. Однако в ситуациях, в которых конъюгирование сахарида предусматривает такие реакцию или модификацию остатка сиаловой кислоты на его восстанавливающем конце, что остаток теряет способность к восстановлению, изобретение может быть применимо только к тем сахаридам, концевая сиаловая кислота которых может быть регенерирована (или в которых восстановленная концевая сиаловая кислота может быть получена прямо).
Для раздельной оценки конъюгированных и неконъюгированных сахаридов они должны быть разделены. Свободный (т.е. неконъюгированный) сахарид в водной композиции может быть отделен от конъюгированного сахарида различными способами. Реакция конъюгирования изменяет различные химические и физические параметры сахарида, и различия могут быть использованы для разделения. Например, для разделения свободного или конъюгированного сахаридов может быть использовано разделение по размеру, поскольку конъюгированное вещество характеризуется более высокой массой благодаря наличию белка-носителя. Предпочтительным методом разделения по размеру является ультрафильтрация. В качестве дополнительной альтернативы, если конъюгаты адсорбированы на адъюванте, то центрифугирование позволяет разделить адсорбированный конъюгат (в осадке) от свободного сахарида (в супернатанте), который десорбируется после гидролиза.
Изобретение относится к способу анализа гликоконъюгата, предусматривающему следующие стадии: (а) обработка гликоконъюгата для высвобождения сахарида с носителя; и (b) измерение значения DP высвобожденного сахарида, как описано выше. Изобретение относится к способу анализа композиции гликоконъюгата, предусматривающему следующие стадии: (а) отделение неконъюгированного сахарида в составе композиции от конъюгированного сахарида; и (b) измерение значения DP неконъюгированного и/или конъюгированного сахарида, как описано выше.
Изобретение также относится к способу выпуска вакцины для клинического применения, предусматривающему следующие стадии: (а) производство вакцины, содержащей конъюгат капсульного сахарида, причем сахарид содержит моносахаридные звенья сиаловой кислоты и отличные от сиаловой кислоты моносахаридные звенья; (b) анализ DP сахарида в составе вакцины, как описано выше; и, если результаты стадии (b) свидетельствуют о приемлемом для клинического применения значении DP, (с) выпуск вакцины для клинического применения. Стадия (b) может быть осуществлена на упакованной вакцине или на неупакованной вакцине перед упаковкой.
Смешанные сахариды
Изобретение позволяет проводить анализ DP в композициях, содержащих менингококковые капсульные сахариды, содержащие сиаловую кислоту. Композиции также могут содержать дополнительные капсульные сахариды (например, капсульные сахариды N. meningitidis серогруппы А, капсульный сахарид Н. influenzae b и т.д.) при условии, что эти сахариды не