Аптамерный олигонуклеотид - прямой ингибитор тромбина
Иллюстрации
Показать всеИзобретение относится к области биотехнологии, конкретно к прямым ингибиторам тромбина, и может быть использовано в медицине. ДНК-аптамер специфически и высокоафинно связывается с тромбином и характеризуется общей формулой: ,
где N - любой нуклеотид из ряда G, А, Т, С или может отсутствовать; R - химический радикал из ряда 5'-O-метил-, 5'O-алкил, 5'-O-аллил; 3'-O-метил, 3'O-алкил, 3'-О-аллил или может отсутствовать; d - дезоксирибоза (олигонуклеотид содержит дезоксирибозу во всех позициях). Изобретение позволяет получить ДНК-аптамер, который высокоафинно связывается с тромбином, ингибирует фибрин-образующую активность очищенного тромбина, ингибирует активность тромбина в плазме крови человека, удлиняя АЧТВ, протромбиновое и тромбиновое время, а также ингибирует стимулируемую тромбином агрегацию тромбоцитов, опосредуемую связыванием тромбина с PAR рецепторами тромбоцитов. 1 з.п. ф-лы, 13 ил., 1 табл.
Реферат
Изобретение относится к области биотехнологии и медицине, а именно к ДНК - аптамерам, представляющим собой олигодезоксирибонуклеотиды, обладающие антикоагулянтными свойствами, антитромботической и фибринолитической активностью, и более конкретно к прямым ингибиторам тромбина, которые могут служить основой для лекарственных антитромботических препаратов.
Для лечения и профилактики тромбозов, а также в сердечно-сосудистой хирургии применяются препараты, которые либо растворяют уже образовавшийся тромб, либо препятствуют процессу тромбообразования (Машковский М.Д. Лекарственные средства. М.: Медицина, 2000, т.2, стр.73-76; Энциклопедия лекарств, изд. 8, М., РЛС, 2001, стр.1503, Справочник ВИДАЛЬ, М., АстраФармСервис, 2001, стр.725).
По механизму действия все известные препараты разбиты на три группы.
- Тромболитики, действие которых направлено на активацию фибринолитической системы крови и растворение тромба (стрептокиназа, урокиназа, тканевой активатор плазминогена).
- Антиагреганты, действие которых направлено на ингибирование агрегации тромбоцитов (аспирин, тиенопиридины - тиклопидин и клопидогрель, антагонисты гликопротеинов IIb-IIIa).
- Антикоагулянты - препараты, действующие на свертывающую систему крови и ингибирующие образование фибрина (гепарин и его производные, непрямые антикоагулянты, прямые ингибиторы тромбина).
То, что препараты действуют на разные системы тромбообразования, дает возможность их комбинированного применения, что повышает эффективность и специфичность терапии.
Традиционным антикоагулянтным препаратом, принадлежащим к третьей группе, является гепарин и его производные. Механизм действия гепарина основан на связывании и активации антитромбина III, главного эндогенного ингибитора тромбина.
Однако гепарин способен связывать многие другие белки плазмы крови и клеток сосудистого русла. Последние обстоятельства определяют негативные побочные эффекты применения гепарина, например тромбоцитопению. Кроме того, гепарин медленно выводится из организма, что определяет высокий риск кровотечений. В связи с этим разработка новых эффективных антикоагулянтов является актуальным вопросом профилактики и терапии тромбообразования.
Известен гепарин, обладающий антикоагулянтной активностью (Zaman S.M., Neiroring P., Gandhi M.R., Gaines P.A. The pharmacokinetics and US usage of heparin in vascular intervention // Clin. Radiol. 1996. V 51. №2. P.113-116.)
Однако он имеет следующие недостатки:
1) не обладает антитромбоцитарными свойствами,
2) не обладает фибринолитическим действием,
3) при передозировке высокомолекулярные фракции могут вызвать нежелательные побочные явления кровоточивости.
Известен препарат плазмина, оказывающий фибринолитическое действие (Gitabert J., Estelles A., Grancella S. Espana F., Aznar J. Fibrinolytic system and reproductive process with special reference to fibronolytic faiture in preeclampsia // Hum. Reprod. 1995. V.10. Suppl.2. P.121-131).
Он имеет следующие недостатки:
1) не имеет антикоагулянтных эффектов,
2) не имеет антитромботического действия,
3) не имеет фибриндеполимеризационной активности,
4) проявляет протеолитическое действие.
Известен препарат ацетилсалициловой кислоты, который обладает только антитромбоцитарным действием и слабой фибриндеполимеризационной активностью (McKee S.A., Sane D.C., Deliargyris significance // Thromb. Haemost (Schattauer). 2002. V.88. №5. P.711-715).
Однако препарат имеет следующие недостатки:
1) не обнаруживает антикоагулянтной активности,
2) имеет побочные эффекты - кровоточивость со стороны желудочно-кишечного тракта.
Известно антитромботическое средство комплекса высокомолекулярного гепарина с протеолитическим ферментом тромбином (Кудряшов, Ляпина. 1982: Kudriashov, Lyapina, 1986), обладающего антикоагулянтными и тромболитическими свойствами.
Однако и оно имеет следующие недостатки:
1) неэкономичность способа,
2) препарат эффективен лишь при внутривенном и внутримышечном введениях,
3) наличие отрицательных побочных эффектов,
4) небольшая длительность действия препарата - 1,5-2 ч,
5) невысокая антикоагулянтная активность препарата.
Из RU 2138269, опубл. 27.09.1999 известно антитромботическое средство, содержащее гепарин и пептид "Семакс" при определенном соотношении компонентов, а способ получения средства заключается в смешении комплексного препарата высокомолекулярного гепарина с регуляторным пептидом "Семакс" в весовом соотношении 1:1, инкубации при 37°С в течение 50-60 мин. Данный препарат обладает широким спектром противосвертывающих и антитромботических свойств при интраназальном введении в организм.
Тромбин играет ключевую роль в процессах остановки кровотечения (гемостаза) и внутрисосудистого тромбообразования. Эта протеиназа участвует как в реакциях коагуляции крови, так и в стимуляции активности тромбоцитов. Наиболее известная реакция тромбина - это отщепление фибринопептидов А и В с образованием мономеров дезААВВ-фибрина, которые затем агрегируют, сшиваются и переходят в нерастворимое состояние с формированием тромба. В процессе свертывания крови тромбин не только вызывает образование фибрина из фибриногена, но и активирует многие факторы коагуляционного каскада. Другая важная функция тромбина - индукция активации и агрегации тромбоцитов, реакции, запускающей остановку кровотечения и образование тромбов в сосудах артериального русла. Эта функция осуществляется путем взаимодействия тромбина со специфическими PAR (protease activated receptors, рецепторы, активируемые протеазами). Тромбин отщепляет N-концевой пептид рецептора, а появляющийся новый N-концевой фрагмент взаимодействует со специальным внеклеточным участком рецептора. Именно это взаимодействие и приводит к активации рецептора и переводу активирующего сигнала внутрь клетки. Очевидно, что ингибирование прокоагулянтных активностей тромбина представляет собой один из наиболее перспективных и эффективных путей профилактики и терапии тромбозов.
Тромбин является многофункциональной протеиназой, регулирующей ряд физиологических процессов. Направленность (специфичность) его действия определяется местом образования, количеством тромбина, концентрацией субстратов и «кофакторов», которые взаимодействуют с разными участками молекулы тромбина. В реакциях гидролиза высокомолекулярных субстратов принимают участие, как минимум, два участка молекулы тромбина - активный центр фермента и область специфичного «узнавания» субстрата, связывание с которой ориентирует субстрат относительно активного центра. Высокоафинное и специфичное связывание двух упомянутых выше субстратов тромбина - фибриногена и PAR рецептора осуществляется через участок, получивший название экзосайт I.
Разработка новых препаратов, которые относятся к прямым ингибиторам тромбина, идет двумя путями.
Первый путь - создание препаратов, блокирующих активный центр фермента. Эти препараты ингибируют все реакции тромбина. К ним относятся низкомолекулярные соединения (аргатробан, мелагатран) и пептидные ингибиторы, которые связываются с активным центром.
В частности, из RU2289423, опубл. 20.12.2006, известен пептид формулы Pro-Arg-Pro-Gly-Pro, обладающий антикоагулянтной, фибриндеполимеризационной, антитромботической и фибринолитической активностями.
Синтез пептида осуществляли классическими методами пептидной химии с использованием природных L-аминокислот. Сначала получали трипептид Pro-Gly-Pro, а затем ступенчатым наращиванием пептидной цепи с N-конца получали пентапептид.
Примером препаратов, блокирующих активный центр фермента, является действующее вещество пиявок - гирудин и его рекомбинантные производные (лепирудин, дезирудин, бивалирудин). Преимущества блокаторов активного центра тромбина - достаточно высокая специфичность к тромбину, которая определяет высокую предсказуемость действия препарата, а также активность по отношению не только к свободному тромбину, но и к фибрин-связанному тромбину. Их недостатками является ингибирование всех активностей тромбина, включая антикоагулянтную, а также отсутствие антидота (производные гирудина) или гепатотоксичность.
Второй путь - разработка препаратов, которые конкурентно ингибируют связывание субстратов, не влияя на активный центр тромбина. К такому типу веществ относятся аптамерные ДНК. Аптамерные ДНК представляют собой олигодезоксирибонуклеотиды размером в несколько десятков мономерных звеньев, которые способны специфически и с высоким сродством связываться с мишенью. В качестве мишени могут быть как низкомолекулярные вещества, так и полимеры и даже целые клетки. Аптамеры отбираются с помощью метода SELEX селекцией по аффинности к выбранной мишени. Преимуществами терапевтического использования аптамеров являются их низкая иммуногенность, а также возможность применения антидота, блокирующего действие препарата.
Этот путь открывает перспективы создания препаратов, селективно ингибирующих лишь некоторые из функций тромбина.
Для тромбина получены аптамерные ДНК, биомедицинские свойства которых описаны, например, в ряде публикаций: (список которых приводится далее)
[Bock L.C., Griffin L.C., Latham J.A., Vermaas Е.Н., Toole J.J. // Nature. 1992. v.355, p.564-566]
[Macaya RF, Gao H, Joesten ME, Yang M, Patel R, Bertelsen AH, Cook AF, Biochemistry, 1995, v. 34, p.4478-92;
Tasset DM, Kubik MF, Steiner W J.Mol.Biol., 1997, v.272, p.688-698].
Kubik M.F., Stephens A.W., Schneider D., Marlar R.A., Tasset D. Nucleic Acids.Res., 1994, v.22, p.2619-2626].
[Ikebukuro K, Okumura Y, Sumikura K, Karube I, NAR, 2003, RS 3, p.205-206;
Ikebukuro K, Okumura Y, Sumikura K, Karube I, NAR, 2005, v.33, N12, e108;
Ikebukuro K, Yoshida W, NomaT, SodeK, Biotechnol Lett, 2006, v.28, p.1933-1937]
[Pagano В., Martino L., Randazzo A., Giancola C, 2008, Biophys. J., v.94, p.562-569].
[Griffin LC, Tidmarsh GF, Bock LC, Toole JJ, Leung LLK, Blood, 1993, v.12, p.3271-3276;
Li W-X, Kaplan AV, GrantGW, Toole JJ, Leung LL Blood, 1994, v.3, p.677-682].
Reyderman L, Stavchansky S, Pharmaceutical research, 1998, v.15, p.904-910.
[Shaw JP, Fishback JA, Cundy КС, Lee WA, Pharmaceutical research, 1995, v.12, p.1937-1942; Lee WA, Fishback JA, Shaw JP, Bock LC, Griffin LC, Cundy КС, Pharmaceutical research, 1995, v.12, p.1943-1947].
И, в частности, из заявки на изобретение RU 2007112945, опубл. 20.10.2008, известны аптамеры к фактору фон Виллебранда в качестве лекарственных средств против тромботических заболеваний, содержащий последовательность нуклеиновой кислоты, которая на 95% идентична последовательности, выбранной из группы, состоящей из: ARC1029 (SEQ ID NO 214), ARC1115 (SEQ ID NO 221), ARC1172 (SEQ ID NO 222), ARC1346 (SEQ ID NO 281), ARC1361 (SEQ ID NO 284), ARC1368 (SEQ ID NO 291), SEQ ID NO 1635 (SEQ ID NO 319), ARC1759 (SEQ ID NO 318) и ARC1884 (SEQ ID NO 322).
Аптамер конъюгирован с высокомолекулярным неиммуногенным соединением или с липофильным соединением, где неиммуногенным высокомолекулярным соединением является полиалкиленгликоль (полиэтиленгликоль, в частности).
Из IE 920561, опубл. 26.08.1992 известны аптамерные олигонуклеотиды, способные специфически связываться с тромбином; данный аптамер выбран из группы, содержащей однонитиевую ДНК, однонитиевую (одноцепогенную) РНК, двунитиевую (двухцепогенную) ДНК (дезоксирибонуклеиновую кислоту) и их химические модификации; этот аптамер содержит нуклеотидную последовательность формулы GGXTGG, где X есть Т, A, U, dU или G, в частности содержит нуклеотидную последовательность GGTTGGTGTGGTTGG.
Технической задачей настоящего изобретения является расширение арсенала средств, относящихся к прямым ингибиторам тромбина на основе аптамерных олигонуклеотидов, способных связываться с тромбином, а также повышение антикоагулянтных и антитромботических свойств его.
Поставленная техническая задача достигается ДНК - аптамером, представляющим собой олигодезоксирибонуклеотид, содержащим нуклеотидную последовательность формулы,
где N - любой нуклеотид G, А, Т, С или может отсутствовать, R - химический заместитель или может отсутствовать, d - дезоксирибоза (олигонуклеотид содержит дезоксирибозу во всех позициях); и который специфически и высокоафинно связывается с тромбином.
Аптамерный олигонуклеотид (ДНК - аптамер) по изобретению выбран из группы, включающей нуклеотидную последовательность формулы
условное наименование RE 31,
или нуклеотидную последовательность формулы
условное наименование ST43, или их химические модификации.
Оба аптамера по изобретению:
- высокоафинно связываются с тромбином,
- ингибируют фибрин-образующую активность очищенного тромбина,
- ингибируют активность тромбина в плазме крови человека, удлиняя АЧТВ, протромбиновое и тромбиновое время,
- ингибируют стимулируемую тромбином агрегацию тромбоцитов, опосредуемую связыванием тромбина с PAR рецепторами тромбоцитов.
Под любым нуклеотидом (N) в общей формуле ДНК - аптамера по изобретению следует понимать любой нуклеотид G, А, Т, С.
Химическим заместителем (R) в общей формуле (1) ДНК - аптамера по изобретению могут быть химические радикалы: 5'-O-метил-, 5'О-алкил, 5'-O-аллил.
По 5' - положению может быть введен остаток холестерина.
(R) могут быть химические радикалы: 3'-O-метил-, 3'O-алкил, 3'-O-аллил.
По 3'- положению может быть введен остаток холестерина.
Таким образом ДНК-аптамеры как прямые ингибиторы тромбина могут содержать нуклеотидную последовательность, представленную формулой (1) или (2), или их химические модификации.
Получают ДНК-аптамеры по изобретению следующим образом.
Синтез проводится по стандартной методике на твердофазном носителе. Oligonucleotide Synthesis (M.J.Gait ed. 1984); Sambrook, Fritsch & Maniatis, Molecular Cloning: A Laboratory Manual, Second Edition (1989).
Синтез был проведен твердофазным методом на автоматическом синтезаторе Applied BioSystems 380b с использованием стандартных производных (синтонов) нуклеотидов. В качестве полимерного носителя использовали CPG (control pore glass) стеклянные шарики с размером пор 500 и 1000 Å. Первый нуклеозид 3'-гидроксильной группой присоединяли к карбоксильной группе модифицированного полимерного носителя.
Каждый цикл синтеза состоял из четырех шагов:
- Детритирование, в ходе которого удаляется диметокситритильная группа путем взаимодействия с трихлоруксусной кислотой и освобождается 5'-ОН группа.
- Присоединение нуклеотида, который представляет собой β-цианэтил-N,N-бис-диизопропиламидофосфит одного из нуклеозидов.
- β-Цианэтильная группа является не только защитной, но и повышающей растворимость соединения в ацетонитриле. Удаляется она после завершения синтеза под действием раствора аммиака. Активирующим реагентом при конденсации является тетразол.
- Кэпирование. Степень присоединения амидофосфита на стадии конденсации не является 100%-ной. Вследствие этого около 2% 5'-ОН групп оказываются не вступившими в реакцию. На последующих этапах синтеза к ним возможно присоединение нуклеотидов, что в конечном счете приводит к пропускам нуклеозидов в последовательности требуемого олигонуклеотида. В связи с этим проводили защиту непрореагировавших 5'-ОН групп: это облегчает отделение таких укороченных олигонуклеотидов. Эту операцию, называемую кэпированием, проводили с помощью уксусного ангидрида в присутствии N-метилимидазола.
Окисление. Окисление фосфитного эфира до фосфатного проводили йодом в пиридине.
Нижеследующие примеры иллюстрируют свойства ДНК-аптамера как прямого ингибитора тромбина по изобретению и его применение (использование), но не ограничивают их.
Пример 1.
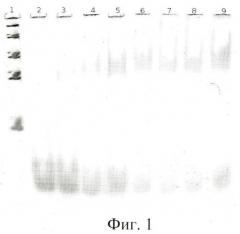
При изучении комплексообразования данных препаратов с раствором тромбина в буфере с хлористым калием использовали электрофорез в полиакриламидном геле, в котором наблюдали отделение комплекса от тромбина, не связавшегося с препаратом. Были изучены комплексы в присутствии повышающегося количества тромбина. Суммарный объем реакционной смеси составлял в каждом опыте 25 мкл, реакцию проводили при постоянной концентрации ДНК (80 nМ) и варьировали концентрацию тромбина в пределах 20-1500 nМ. Инкубировав реакционную смесь при 25°С не менее часа, комплексы белка с олигонуклеотидами отделяли от свободных олигонуклеотидов при помощи электрофореза в 8% неденатурирующем полиакриламидном геле (ПААГ). Построение изотерм связывания для каждой серии опытов позволило оценить сродство нуклеиновых препаратов к белку, рассчитать константы диссоциации комплексов (см. фиг.1-6).
Пример 2.
При изучении влияния аптамерной ДНК на ферментативную активность тромбина было установлено, что аптамер RE31 ингибирует гидролиз фибриногена. Этот эффект наблюдали при использовании 15 нМ раствора тромбина и увеличивающихся концентраций ДНК-аптамера вплоть до 700 нМ, что значительно превышало концентрацию фермента в реакции. При этом различные мольные соотношения тромбин - аптамер составляли от 1:1 до 1:50. В присутствии аптамера наблюдается падение активности тромбина в сравнении с контрольным препаратом. На фиг.7 приведены кривые ингибирования фибриноген-гидролизующей активности тромбина. Концентрацию субстрата (фибриногена) варьировали в пределах 19-38 мкМ, что существенно превышало концентрацию тромбина, приблизительно в 1000 раз (фиг.7).
На фиг.7 приведены кривые ингибирования тромбина аптамером RE31 при различных концентрациях фибриногена: 1. - 19 мкМ; 2 - 26 мкМ; 3 - 38 мкМ.
На фиг.1 показан электрофорез в 8% ПААГ комплекса тромбина с «аптамером RE31». Дорожка 1 - ДНКовые маркеры сверху вниз: 1500 н.о., 800 н.о., 400 н.о., 200 н.о., 50 н.о.; дорожки 2-9 - комплексы ДНК-аптамеров с тромбином, ДНК-аптамер - 80 nM, тромбин дорожка 2 - 0 nM; 3 - 20 nM ; 4 - 40 nM; 5 - 60 nM; 6 - 80 nM; 7 - 100 nM; 8 - 120 nM; 9 - 140 nM.
На фиг.2 приведена изотерма связывания тромбина с «аптамером RE31»; на графике (фиг.3) иллюстрации в координатах Скетчарда комплекса «аптамера RE31» и тромбина.
На фиг.4 показан электрофорез в 8% ПААГ комплекса тромбина с «аптамером «ST43». Дорожка 1 - ДНКовые маркеры сверху вниз: 1500 н.о., 800 н.о., 400 н.о., 200 н.о., 50 н.о.; дорожки 2-9 - комплексы ДНК-аптамеров с тромбином, ДНК-аптамер - 80 nM, тромбин дорожка 2 - 0 nM; 3 - 40 nM; 4 - 60 nM; 5 - 80 nM; 6 - 100 nM; 7 - 120 nM; 8 - 140 nM; 9 - 160 nM.
Пример 3.
Анализ влияния 31-звенного аптамера ДНК на систему свертывания крови включал исследование 3-х показателей: тромбинового времени (ТВ), АЧТВ и протромбинового времени. Исследования проводили в сравнении с ранее описанным и высокоактивным аптамером 31 ТВ A (CACTGGTAGGTTGGTGTGGTTGGGGCCAGTG) [Ikebukuro К et al., NAR, 2005, v.33, N12, е108].
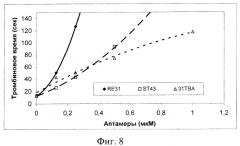
В тесте «Тромбиновое время», который моделирует финальную стадию активации свертывания крови - свертывание фибриногена, показано, что исследованные аптамеры значительно удлиняют время образования фибрина после добавления экзогенного тромбина к нормальной человеческой плазме. Наиболее эффективным ингибитором оказался аптамер RE31, который в концентрации 0.125 мкМ вызвал удлинение показателя с 13 до 50 секунд (фиг.8). Это свидетельствует, что данный аптамер способен связывать и ингибировать внесенный в плазму (экзогенный) тромбин с высокой скоростью в присутствии других белков плазмы, суммарная концентрация которых много выше, чем добавленного тромбина (80 мг/мл против ~1 мкг/мл тромбина). Для получения аналогичной степени ингибирования требуется в ~2 раза более высокая концентрация аптамеров ST43, или 31ТВА.
На фиг.8 показано ингибирование аптамерами свертывания фибриногена плазмы экзогенным тромбином. В кювету коагулометра внесли 0.1 мл раствора аптамеров в 25 мМ HEPES буфере (рН 7,4), содержащем 150 мМ NaCl и 5 мМ КСl и 0.1 мл цитратной плазмы человека. После инкубирования в течение 2 мин при 37°С реакцию стартовали добавлением 0.1 мл тромбина активностью 6 Е/мл. Регистрировали время образования сгустка.
В двух следующих сериях экспериментов изучалось влияние аптамера на свертывание фибриногена в процессе активации образования эндогенного тромбина.
В тесте АЧТВ - активация внутреннего пути свертывания крови (каскад реакций, ведущий к образованию сериновых протеиназ - ФХII/калликреин, ФХI, IX, X и тромбина + положительные обратные реакции тромбина - активация OVIII и V) аптамер RE31 также оказался наиболее эффективным ингибитором из 3-х исследованных. Удлинение АЧТВ в присутствии 0.25 мкМ RE31 (фиг.9) соответствует тому, которое наблюдается при стандартном режиме лечения тромбозов гепарином.
На фиг.9 показано влияние аптамеров на АЧТВ. В кювету коагулометра вносили 20 мкл раствора аптамера в 25 мМ HEPES буфере (рН 7,4), содержащем 150 мМ NaCl и 5 мМ КСl, затем 100 мкл нормальной цитратной плазмы человека. Инкубировали в течение 2 мин при 37°C, добавляли 100 мкл реактива "STA АРТТ" и через 3 мин реакцию стартовали добавлением 100 мкл 25 мМ СаСl. Регистрировали время образования сгустка.
На фиг.10 показано влияние аптамеров на протромбиновое время. В кювету коагулометра вносили 20 мкл раствора аптамера в 25 мМ HEPES буфере (рН 7,4), содержащем 150 мМ NaCl и 5 мМ КСl, затем 100 мкл нормальной цитратной плазмы человека. После инкубации в течение 2 мин при 37°С реакцию стартовали добавлением 100 мкл Ca-тромбопластина ("STA Neoplastin Plus" производства "Diagnostica Stago"). Регистрировали время образования сгустка.
Протромбиновое время (ПТ-тест, активация свертывания крови по внешнему пути, ведущая к образованию сериновых протеиназ - OVII, X и тромбина + положительная обратная реакция тромбина - активация ФУ) увеличивается в 2 раза при повышении концентрации RE31 до 0.25 мкМ (фиг.10). Для получения аналогичного удлинения протромбинового времени требуются в 2 раза более высокие концентрации аптамеров ST43, или 31 ТВА.
Исследованные аптамеры не влияют на амидолитическую активность в отношении низкомолекулярного субстрата, который связывается только с активным центром тромбина (табл.1).
| Таблица 1 | ||||
| Влияние аптамеров на амидолитическую активность тромбина. К 150 мкл раствора тромбина (0.4 Е/мл) в 0,1 М Трис-HCl буфере, рН 8.2, содержащем 5 мМ КС1, добавили аптамеры до конечной концентрации 1 мкМ и после инкубации в течение 5 мин при 37°С реакцию стартовали добавлением 50 мкл 2 мМ раствора хромогенного субстрата "Chromozym ТН". Регистрировали нарастание оптической плотности при 405 нм | ||||
| Аптамер (мкМ) | RE31 | ST43 | 31 ТВ А | |
| 0 | 0,253 | |||
| 1 | 0,253 | 0,259 | 0,273 |
Пример 4.
Ингибирование аптамерами RE31 и ST43 тромбин-индуцированной агрегации тромбоцитов.
Отмытые тромбоциты получали из крови здоровых доноров в соответствии с ранее описанным методом [Mazurov, A.V., et al. (1991) Thromb. Haemost, 66, 494-499] Отмытые тромбоциты суспендировали в растворе Тироде/Hepes (137 мМ NaCl, 2,7 мМ КС1, 0,36 мМ NaH2PO4, 0,1% декстрозы, 1 мМ MgCl2, 0,35% БСА, 5 мМ Hepes, рН 7,35) в концентрации 3×108 на 1 мл. После ресуспендирования к отмытым тромбоцитам добавляли СаCl2 в конечной концентрации 1 мМ. Агрегацию тромбоцитов изучали в агрегометре БИОЛА. В кювету агрегометра добавляли по 300 мкл суспензии отмытых тромбоцитов и регистрировали агрегацию по изменению светопропускания суспензии (Т, %) при 37°С и перемешивании со скоростью 800 об/мин. Для стимуляции агрегации использовали тромбин человека с удельной активностью более 2500 ед на 1 мг. Аптамеры добавляли в агрегационную кювету не менее чем за 2 мин до добавления тромбина, а тромбин (0,1 ед/мл) добавляли через 30 с после начала регистрации светопропускания и регистрировали агрегацию в течение 4,5 мин. Определяли максимальный уровень агрегации суспензии (Т % макс). За 100% принимали уровень тромбин-индуцированной агрегации в отсутствие аптамеров.
Как видно из фиг.11, оба аптамера и RE31 и ST43 эффективно ингибируют агрегацию тромбоцитов. В концентрации 0,1 мкМ они полностью подавляют агрегацию, индуцированную 0,1 ед/мл тромбина. RE31 несколько превосходит по своей способности ингибировать агрегацию, a ST43 несколько уступает ранее описанному атамеру 31ТВА [[Ikebukuro К et al., NAR, 2005, v.33, N12, е108].
Известно, что тромбин стимулирует агрегацию тромбоцитов, связываясь со специфическими PAR (protease activated receptor, рецептор активируемый протеазами) рецепторами на их поверхности [Coughlin (1999) Proc Natl Acad Sci USA, 96, 11023-11027].
Полученные результаты указывают на то, что оба аптамера способны подавлять взаимодействия тромбина с этими рецепторами.
На фиг.11 показано ингибирование тромбин-индуцированной агрегации аптамерами RE31 (а) и ST43 (б) в сравнении с аптамером 31ТВА. К отмытым от плазмы тромбоцитов человека добавляли аптамеры в указанных концентрациях и стимулировали агрегацию 0,1 ед/мл тромбина человека. За 100% (контроль) принимали максимальный уровень агрегации тромбоцитов в отсутствие аптамеров. Представлены результаты одного из 3 воспроизводимых экспериментов.
Пример 5. Введение О-алкильного заместителя по 5'-концу аптамера RE31.
По 5'-концу аптамера RE31 вводили О-алкильный заместитель - О-пропил с присоединенным к нему гетероциклическим флюоресцентным красителем Су3 (тетраметилиндокарбоцианинхлорид). Радикал с флуоресцентным красителем был использован для упрощения регистрации его присоединения. Для ввода заместителя использовали стандартную методику с применением коммерчески доступного фосфоамидитного производного (1-[3-(4-монометокситритилокси)пролил]-1'-[3-[(2-цианоэтил)-(N,N-диизопропил)фосфорамидитил]пропил]-3,3,3',3'-тетраметилиндокарбоцианин хлорид) (Су3ТМ - Phosphoramidite, Glenn Research, США, кат №10-5913-хх). Трехвалентный фосфор в виде диизопропиламидного производного атаковывается гидроксильной группой на 5'- конце растущей олигонуклеотидной цепи в реакторе. Включение идет по типу нуклеофильного замещения при атоме фосфора. Полученное амидное производное трехвалентного фосфора далее окисляется до пятивалентного состояния по стандартной методике. Монометокситретильная защита удаляется в синтезаторе в кислых условиях (добавление уксусной кислоты). Цианэтиловая группа удаляется с помощью насыщенного раствора аммиака при комнатной температуре. В результате проведенных реакций образуется аптамер RE31 с включенной по 5'-концу группой пропил-Су3 (RE31-Cy3).
На фиг.12 представлен электрофорез в 8% ПААГ аптамера RE31-Cy3 и тромбина человека. Концентрация аптамера везде (дорожки 1-9) - 200 nM, концентрации тромбина: дорожка 1 - 0 nM; 2 - 80 nM; 3 - 160 nM; 4 - 240 nM; 5 - 320 nM; 6 - 400 nM; 7 - 640 nM; 8 - 800 nM. Регистрация полос проводилась на приборе ((Fluorescent Image Analyzer» (серия FLA-3000, Fujifilm, Япония) при длине волны возбуждения 550 нм и поглощения 570 нм. Образование комплексов RE-Су3 с тромбином зарегистрировано по появлению высокомолекулярных флюоресцентных полос на электрофореграмме.
На фиг.13 представлены результаты измерения тромбин-индуцированной агрегации тромбоцитов в отсутствие (кривая 1) и в присутствии 0,5 и 1,0 мкМ аптамера RE31-Су3 (кривые 2 и 3 соответственно). Агрегацию отмытых тромбоцитов регистрировали, как описано в примере 4. Из фигуры видно, что аптамер эффективно ингибирует агрегацию.
Таким образом, из данного примера следует, что аптамер RE31, модифицированный введением О-алкильного радикала (пропил-Су3), сохраняет способность образовывать комплексы с тромбином и ингибировать тромбин-индуцированную агрегацию тромбоцитов, т.е. функциональную активность фермента.
Таким образом, полученные данные свидетельствуют о том, что исследованные аптамеры ингибируют, как минимум, две прокоагулянтные реакции тромбина - свертывание фибриногена и активацию PAR-1, а механизм ингибирования заключается в конкуренции за участок связывания высокомолекулярных субстратов (фибриногена, PAR).
1. Аптамерный олигонуклеотид, представляющий собой олигодезоксирибонуклеотид (ДНК-аптамер), характеризующийся нуклеотидной последовательностью общей формулы ,где N - любой нуклеотид из ряда G, А, Т, С или может отсутствовать;R - химический радикал из ряда 5'-O-метил-, 5'O-алкил, 5'-O-аллил;3'-O-метил, 3'O-алкил, 3'-O-аллил или может отсутствовать;d - дезоксирибоза (олигонуклеотид содержит дезоксирибозу во всех позициях); и который специфически и высокоафинно связывается с тромбином.
2. Аптамерный олигонуклеотид по п.1, выбранный из группы, включающий ДНК-аптамер RE31, содержащий нуклеотидную последовательность формулы или ДНК-аптамер ST43, содержащий нуклеотидную последовательность формулы или химические модификации их.