Антагонисты и способы их применения
Иллюстрации
Показать всеИзобретение относится к области биотехнологии и представляет собой антагонист рецептора фактора некроза опухоли 1, представляющий собой доменное антитело против TNFR1 (dAb). Также изобретение представляет собой к мономеру доменного антитела (dAb) против TNFR1, которое связывает рецептор фактора некроза опухоли 1, а также к лиганду, содержащему такой мономер. Кроме того, изобретение относится к способу ингибирования передачи сигнала через рецептор TNFR1 с использованием данных антагонистов. Также предложены нуклеиновая кислота, кодирующая указанный антагонист, вектор, содержащий указанную нуклеиновую кислоту, клетку-хозяина, содержащую указанный вектор, фармацевтическую композицию, содержащую указанный антагонист или указанный мономер dAb. Изобретение можно эффективно использовать при лечении воспалительных заболеваний (например, хронических воспалительных заболеваний). 23 н. и 34 з.п. ф-лы, 28 ил., 14 табл.
Реферат
Родственные заявки
Настоящая заявка на изобретение представляет собой частичное продолжение заявки на патент США №10/985847, поданной 10 ноября 2004 г., представляющей собой:
1) частичное продолжение международной заявки на патент № PCT/GB2004/004253, которая указывает Соединенные Штаты Америки и подана 8 октября 2004 г.; и
2) частичное продолжение международной заявки на патент № PCT/GB2003/005646, которая указывает Соединенные Штаты Америки, подана 24 декабря 2003 г. и заявляет приоритет заявки на патент Великобритании № GB 0230202.4, поданной 27 декабря 2002 г., и заявки на патент Великобритании № GB 0327706.8, поданной 28 ноября 2003 г., представляющей собой:
частичное продолжение международной заявки на патент № PCT/GB2003/002804, которая указывает Соединенные Штаты Америки, подана 30 июня 2003 г. и заявляет приоритет заявки на патент Великобритании № GB 0230202.4, поданной 27 декабря 2002 г., представляющей собой:
частичное продолжение международной заявки на патент № PCT/GB02/03014, которая указывает Соединенные Штаты Америки и подана 28 июня 2002 г.
Полное содержание вышеупомянутых заявок на изобретения включены в настоящее описание путем ссылки.
Предшествующий уровень техники
Антиген-связывающий домен антитела включает две отдельные области: вариабельный домен тяжелой цепи (VH) и вариабельный домен легкой цепи (VL, который может представлять собой либо VK, либо Vλ). Антиген-сайт связывания сам по себе образован шестью полипептидными петлями: три из VH-домена (Н1, Н2 и Н3) и три из VL-домена (L1, L2 и L3). Разнообразный первоначальный репертуар V-генов, кодирующих VH- и VL-домены, формируется в результате комбинаторной перегруппировки генных сегментов. Ген VH формируется в результате рекомбинации трех генных сегментов VH, D и JH. У людей существует примерно 51 функциональный сегмент VH (Cook and Tomlinson (1995) Immunol Today, 16: 237), 25 функциональных сегментов D (Corbett et al (1997) J. Mol. Biol., 268: 69) и 6 функциональных сегментов JH (Ravetch et al. (1981) Cell, 27: 583) в зависимости от гаплотипа. Сегмент VH кодирует область полипептидной цепи, которая образует первую и вторую антиген-связывающие петли VH-домена (Н1 и Н2), тогда как сегменты VH, D и JH объединяются с образованием третьей антиген-связывающей петли VH-домена (Н3). Ген VL формируется в результате рекомбинации лишь двух генных сегментов VL и JL. У людей существует примерно 40 функциональных сегментов VK (Schable and Zachau (1993) Biol. Chem. Hoppe-Seyler, 374: 1001), 31 функциональный сегмент VK (Williams et al. (1996) J. Mol. Biol., 264: 220; Kawasaki et al. (1997) Genome Res., 7: 250), 5 функциональных сегментов JK (Hieter et al. (1982) J. Biol. Chem., 257: 1516) и 4 функциональных сегмента Jλ (Vasicek and Leder (1990) J. Exp. Med., 172: 609), в зависимости от гаплотипа. Сегмент VL кодирует область полипептидной цепи, которая образует первую и вторую антиген-связывающие петли VL-домена (L1 и L2), тогда как сегменты VL и JL объединяются с образованием третьей антиген-связывающей петли VL-домена (L3). Полагают, что антитела, выбранные из этого первоначального репертуара, достаточно разнообразны, чтобы связывать почти все антигены по меньшей мере с умеренной аффинностью. Высокоаффинные антитела продуцируются путем "аффинного созревания" перегруппированных генов, в которых образуются точечные мутации, и отбираются иммунной системой на основе улучшенного связывания.
Анализ структур и последовательностей антител демонстрирует, что пять из шести антиген-связывающих петель (Н1, Н2, L1, L2, L3) обладают ограниченным количеством конформаций основной цепи или канонических структур (Chothia and Lesk (1987) J. Mol. Biol, 196: 901; Chothia et al. (1989) Nature, 342: 877). Конформации основной цепи определяются (1) длиной антиген-связывающей петли и (2) конкретными остатками или типами остатка, находящимися в определенном ключевом положении в антиген-связывающей петле и каркасе антитела. Анализ длин петель и ключевых остатков позволил авторам изобретрения предсказать конформации основных цепей Н1, Н2, L1, L2 и L3, кодируемых большинством последовательностей человеческих антител (Chothia et al (1992) J. Mol. Biol, 227: 799; Tomlinson et al (1995) EMBO J., 14: 4628; Williams et al (1996) J. Mol. Biol, 264: 220). Хотя область Н3 гораздо более разнообразна с точки зрения последовательности, длины и структуры (вследствие применения сегментов D), она также образует ограниченное количество конформаций основной цепи для коротких петель, зависящих от длины и присутствия конкретных остатков или типов остатка, находящихся в ключевых положениях в петле и каркасе антитела (Martin et al (1996) J. Mol. Biol, 263: 800; Shirai et al (1996) FEBS Letters, 399:1.
В данной области известны биспецифические антитела, включающие комплементарные пары VH - и VL-областей. Эти биспецифические антитела должны включать две пары VH и VL, причем каждая пара VH/VL связывается с одним антигеном или эпитопом. Описанные способы включают гибридные гибридомы (Milstein & Cuello AC, Nature 305:537-40), мини-антитела (Hu et al, (1996) Cancer Res 56:3055-3061;), диа-антитела (Holliger et al, (1993) Proc. Natl. Acad. Sci. USA 90, 6444-6448; WO 94/13804), хелатообразующие рекомбинантные антитела (CRAbs; (Neri et al, (1995) J. Mol. Biol. 246, 367-373), biscFv (например, Atwell et al, (1996) Mol. Immunol. 33, 1301-1312), антитела, стабилизированные по механизму "knobs in holes" ("выступы в углубления") (Carter et al, (1997) Protein Sci. 6, 781-788). В каждом случае каждая разновидность антитела включает два антиген-связывающих сайта, каждый из которых моделируется комплементарной парой доменов VH и VL. Таким образом, каждое антитело способно связываться с двумя различными антигенами или эпитопами одновременно, причем связывание с КАЖДЫМ антигеном или эпитопом опосредуется VH и его комплементарным VL-доменом. Каждый из этих способов имеет свои конкретные недостатки; например, в случае гибридных гибридом неактивные пары VH/VL могут значительно уменьшать фракцию биспецифического IgG. Кроме того, большая часть биспецифических подходов основана на ассоциации различных пар VH/VL или ассоциации VH- и VL-цепей для воссоздания двух различных VH/VL-связывающих сайтов. Поэтому невозможно контролировать соотношение связывающих сайтов для каждого антигена или эпитопа в собранной молекуле, и, таким образом, множество собранных молекул будет связываться с одним антигеном или эпитопом, а не с другим. В некоторых случаях можно конструировать тяжелые или легкие цепи на поверхности раздела субъединиц (Carter et al, 1997) с целью повышения количества молекул, которые имеют сайты связывания с обоими антигенами или эпитопами, но это никогда не приведет к тому, что все молекулы будут связываться с обоими антигенами или эпитопами.
Существует доказательство того, что специфичности связывания двух различных антител могут быть включены в один и тот же сайт связывания, но они, как правило, представляют две или более чем две специфичности, которые соответствуют структурно родственным антигенам или эпитопам, или антителам, которые обладают широкой перекрестной реактивностью. Например, описаны перекрестно реактивные антитела, обычно когда два антигена имеют родственную последовательность и структуру, такие как лизоцим белка куриного яйца и лизоцим индюшки (McCafferty et al., WO 92/01047), или свободный гаптен и гаптен, конъюгированный с носителем (Griffiths AD et al. EMBO J 1994 13:14 3245-60). В еще одном примере WO 02/02773 (Abbott Laboratories) описаны молекулы антитела с "двойной специфичностью". Молекулы антитела, названные антителами, образуются или отбираются против множества антигенов, так что их специфичность распространяется более чем на один антиген. Каждая комплементарная пара VH/VL в антителах WO 02/02773 обуславливает единичную связывающую специфичность в отношении двух или более чем двух структурно родственных антигенов; каждый из VH- и VL-доменов в таких комплементарных парах не обладает отдельной специфичностью. Таким образом, антитела обладают широкой единичной специфичностью, охватывающей два структурно родственных антигена. Кроме того, описаны природные аутоантитела, которые являются полиреактивными (Casali & Notions, Ann. Rev. Immunol. 7, 515-531), вступающими в реакцию по меньшей мере с двумя (обычно более чем с двумя) различными, структурно не родственными антигенами или эпитопами. Кроме того, продемонстрировано, что выбор произвольных пептидных репертуаров с использованием технологии фагового дисплея на моноклональном антителе будет определять диапазон пептидных последовательностей, которые соответствуют антиген-связывающему сайту. Некоторые из последовательностей являются высоко родственными, соответствуя консенсусной последовательности, тогда как другие весьма различны и названы мимитопами (Lane & Stephen, Current Opinion in Immunology, 1993, 5, 268-271). Поэтому очевидно, что природное четырехцепочечное антитело, включающее ассоциированные и комплементарные VH- и VL-домены, обладают возможностью связываться с множеством различных антигенов из большой совокупности известных антигенов. В меньшей степени понятно, как конструировать сайт связывания для двух данных антигенов в одном и том же антителе, в частности антигенов, которые не обязательно структурно родственны.
Предложены способы белковой инженерии, которые могут быть основаны на этом. Например, также было предложено, что может быть сконструировано каталитическое антитело со связывающей активностью к иону металла, опосредованной одним вариабельным доменом, и к гаптену (субстрату), опосредованной контактами с ионом металла и комплементарным вариабельным доменом (Barbas et al, 1993 Proc. Natl. Acad. Sci USA 90, 6385-6389). Однако в этом случае предложено связывание и катализ субстрата (первый антиген), необходимые для связывания с ионом металла (второй антиген). Таким образом, связывание с парами VH/VL относится к единичному, но многокомпонентному антигену.
Описаны способы создания биспецифических антител из единичных доменов тяжелой цепи антитела Camelid, в которых связывающие контакты для одного антигена созданы в одном вариабельном домене, а для второго антигена - во втором вариабельном домене. Однако вариабельные домены не были комплементарными. Таким образом, первый вариабельный домен тяжелой цепи выбран против первого антигена, а второй вариабельный домен тяжелой цепи - против второго антигена, и затем оба домена связывают вместе на одной и той же цепи с получением фрагмента биспецифического антитела (Conrath et al., J. Biol. Chem. 270, 27589-27594). Однако единичные домены тяжелой цепи антитела Camelid не обычны тем, что они получены из природных антител Camelid, которые не имеют легких цепей, и действительно единичные домены тяжелой цепи не способны ассоциироваться с легкими цепями антитела Camelid с образованием комплементарных пар VH и VL.
Также описаны единичные вариабельные домены тяжелой цепи, полученные из природных антител, которые обычно ассоциированы с легкими цепями (из моноклональных антител или из репертуаров доменов; смотри ЕР-А-0368684). Показано, что эти вариабельные домены тяжелой цепи специфически взаимодействуют с одним или более чем одним родственным антигеном, но не комбинируются с другими вариабельными доменами тяжелой или легкой цепей с образованием лиганда, обладающего специфичностью в отношении двух или более чем двух различных антигенов. Кроме того, было показано, что эти единичные домены обладают очень коротким периодом полувыведения in vivo. Таким образом, такие домены обладают ограниченной терапевтической ценностью.
Предложено получать фрагменты биспецифического антитела путем связывания вместе вариабельных доменов тяжелой цепи, обладающих различными специфичностями (как описано выше). Недостаток этого подхода заключается в том, что вариабельные домены выделенного антитела могут обладать гидрофобной поверхностью контакта, которая в норме обеспечивает взаимодействия с легкой цепью и доступна для растворителя, и может быть "липкой", что позволяет единичному домену связываться с гидрофобными поверхностями. Кроме того, в отсутствие легкой цепи-партнера комбинация двух или более чем двух различных вариабельных доменов тяжелой цепи и их ассоциация, возможно через их гидрофобные поверхности контакта, может предотвращать их связывание с одним, а не с обоими лигандами, с которыми они способны связываться при выделении. Кроме того, в этом случае вариабельные домены тяжелой цепи могут быть не ассоциированы с комплементарными вариабельными доменами легкой цепи и, таким образом, могут быть менее стабильными и легко разворачивающимися (Worn & Pluckthun, 1998 Biochemistry 37, 13120-7).
Краткое изложение сущности изобретения
Изобретение относится к антагонистам фактора некроза опухоли 1 (TNFR1, р55, CD120a, P60, член 1А суперсемейства рецепторов TNF, TNFRSF1A) и способам применения этих антагонистов. Предпочтительные антагонисты обладают эффективностью при лечении, подавлении или предупреждении хронического воспалительного заболевания и по существу не оказывают антагонистического действия на фактор некроза опухоли 2 (TNFR2, Р75, Р80, CD120b, член 1 В суперсемейства рецепторов TNF, TNFRSF1B). В некоторых воплощениях антагонист является моновалентным.
В других воплощениях антагонист представляет собой антитело или его антиген-связывающий фрагмент, такой как моновалентный антиген-связывающий фрагмент (например, scFv, Fab, Fab', dAb), который обладает связывающей специфичностью в отношении TNFR1.
Другие предпочтительные антагонисты представляют собой описанные в данном изобретении лиганды, которые связывают TNFR1. Лиганды включают в себя единичный вариабельный домен иммуноглобулина или доменное антитело (dAb), которые обладают связывающей специфичностью в отношении TNFR1, или области, определяющие комплементарность, такого dAb в подходящем формате. В некоторых воплощениях лиганд представляет собой мономер dAb, который состоит по существу или состоит из единичного вариабельного домена иммуноглобулина или dAb, обладающего связывающей специфичностью в отношении TNFR1. В других воплощениях лиганд представляет собой полипептид, который включает dAb (или CDR (области, определяющие комплементарность) dAb) в подходящем формате, таком как формат антитела.
В некоторых воплощениях лиганд представляет собой лиганд с двойной специфичностью, который включает первое dAb, которое связывает TNFR1, и второе dAb, которое имеет связывающую специфичность, отличающуюся от связывающей специфичности первого dAb. В одном из примеров лиганд с двойной специфичностью включает первое dAb, которое связывает первый эпитоп на TNFR1, и второе dAb, которое связывает эпитоп на отличающейся мишени. В одном из примеров второе dAb связывает эпитоп на сывороточном альбумине.
В других воплощениях лиганд представляет собой полиспецифический лиганд, который включает первый эпитоп-связывающий домен, обладающий связывающей специфичностью в отношении TNFR1, и по меньшей мере один другой эпитоп-связывающий домен, обладающий связывающей специфичностью, отличающейся от связывающей специфичности первого эпитоп-связывающего домена. Например, первый эпитоп-связывающий домен может представлять собой dAb, которое связывает TNFR1, или может представлять собой домен, который включает CDR dAb, связывающего TNFR1 (например, CDR, перенесенные на подходящий белковый каркас или скелет, например аффитело, каркас SpA, домен класса А рецептора LDL (липопротеинов низкой плотности) или домен EGF (эпидермального фактора роста)) или может представлять собой домен, который связывает TNFR1, где домен выбран из антитела, домена SpA, домена класса А рецептора LDL или домена EGF).
В некоторых воплощениях лиганд или мономер dAb характеризуется одним или более чем одним из следующих: 1) диссоциирует из человеческого TNFR1 с константой диссоциации (Kd) от 50 нМ до 20 пМ, и константой скорости диссоциации Koff от 5×10-1 до 1×10-7 с-1; 2) ингибирует связывание фактора некроза опухоли альфа (TNFα) с TNFR1 с IC50 (50% ингибирующая концентрация) от 500 нМ до 50 пМ; 3) нейтрализует человеческий TNFR1 в стандартном анализе клеток L929 с ND50 (50% нейтрализующая доза) от 500 нМ до 50 пМ; 4) оказывает антагонистическое действие на активность TNFR1 в стандартном клеточном анализе с ND50 не более 100 нМ, и в концентрации не более 10 мкМ dAb оказывает агонистическое действие на активность TNFR1 не более чем 5% в анализе; 5) ингибирует смертность мышей в модели септического шока, индуцированного ЛПС (липополисахаридом)/D-галактозамином; 6) противодействует агрегации; 7) секретируется в количестве, составляющем по меньшей мере примерно 0,5 мг/л при экспрессии в Е. coli или видах Pichia (например, Р. pastoris); 8) обратимо разворачивается; 9) обладает эффективностью в модели хронического воспалительного заболевания, выбранной из группы, состоящей из модели коллаген-индуцированного артрита у мышей, модели артрита у мышей ДАРЕ, модели воспалительного заболевания кишечника у мышей AARE, модели воспалительного заболевания кишечника у мышей, индуцированного декстрансульфатом натрия, модели хронического обструктивного заболевания легких у мышей, индуцированного табачным дымом, и подходящих моделей у приматов (например, модели коллаген-индуцированного артрита у приматов); и/или 10) обладает эффективностью при лечении, подавлении или предупреждении хронического воспалительного заболевания.
В конкретных воплощениях лиганд или мономер dAb диссоциирует из человеческого TNFR1 с константой диссоциации (Kd) от 50 нМ до 20 пМ и константой скорости диссоциации Koff от 5×10-1 до 1×10-7 с-1; ингибирует связывание фактора некроза опухоли альфа (TNFα) с TNFR1 с IC50 от 500 нМ до 50 пМ; и нейтрализует человеческий TNFR1 в стандартном анализе клеток L929 с ND50 от 500 нМ до 50 пМ. В других конкретных воплощениях лиганд или мономер dAb диссоциирует из человеческого TNFR1 с константой диссоциации (Kd) от 50 нМ до 20 пМ и константой скорости диссоциации Koff от 5×10-1 до 1×10-7 с-1; ингибирует связывание фактора некроза опухоли альфа (TNFα) с TNFR1 с IC50 от 500 нМ до 50 пМ; и обладает эффективностью в модели хронического воспалительного заболевания, выбранной из группы, состоящей из модели коллаген-индуцированного артрита у мышей, модели артрита у мышей AARE, модели воспалительного заболевания кишечника у мышей AARE, модели воспалительного заболевания кишечника у мышей, индуцированного декстрансульфатом натрия, модели хронического обструктивного заболевания легких у мышей, индуцированного табачным дымом, и подходящих моделей у приматов (например, модели коллаген-индуцированного артрита у приматов). В других конкретных воплощениях лиганд или мономер dAb диссоциирует из человеческого TNFR1 с константой диссоциации (Kd) от 50 нМ до 20 пМ и константой скорости диссоциации Koff от 5×10-1 до 1×10-7 с-1; нейтрализует человеческий TNFR1 в стандартном анализе клеток L929 с ND50 от 500 нМ до 50 пМ; и оказывает антагонистическое действие на активность TNFR1 в стандартном клеточном анализе с ND50 не более 100 нМ, и в концентрации не более 10 мкМ dAb оказывает агонистическое действие на активность TNFR1 не более чем 5% в анализе.
В более конкретном воплощении лиганд или мономер dAb содержит аминокислотную последовательность, которая по меньшей мере примерно на 90% гомологична аминокислотной последовательности dAb, выбранной из группы, состоящей из TAR2h-12 (SEQ ID NO:32), TAR2h-13 (SEQ ID NO:33), TAR2h-14 (SEQ ID NO:34), TAR2h-16 (SEQ ID NO:35). TAR2h-17 (SEQ ID NO:36), TAR2h-18 (SEQ ID NO:37), TAR2h-19 (SEQ ID NO:38), TAR2h-20 (SEQ ID NO:39), TAR2h-21 (SEQ ID NO:40), TAR2h-22 (SEQ ID NO:41), TAR2h-23 (SEQ ID NO:42), TAR2D-24 (SEQ ID NO:43), TAR2h-25 (SEQ ID NO:44), TAR2h-26 (SEQ ID NO:45), TAR2h-27 (SEQ ID NO:46), TAR2h-29 (SEQ ED NO:47), TAR2h-30 (SEQ ID NO:48), TAR2h-32 (SEQ ID NO:49), TAR2h-33 (SEQ ID NO:50), TAR2h-10-1 (SEQ ID NO:51), TAR2h-10-2 (SEQ ID NO:52), TAR2h-10-3 (SEQ ID NO:53), TAR2h-10-4 (SEQ ID NO:54), TAR2h-10-5 (SEQ ID NO:55), TAR2h-10-6 (SEQ ID NO:56), TAR2h-10-7 (SEQ ID NO:57), TAR2h-10-8 (SEQ ID NO:58), TAR2h-10-9 (SEQ ID NO:59), TAR2h-10-10 (SEQ ID NO:60), TAR2h-10-11 (SEQ ID NO:61), TAR2h-10-12 (SEQ ID NO:62), TAR2h-10-13 (SEQ ID NO:63), TAR2h-10-14 (SEQ ID NO:64), TAR2h-10-15 (SEQ ID NO:65), TAR2h-10-16 (SEQ ID NO:66), TAR2h-10-17 (SEQ ID NO:67), TAR2h-10-18 (SEQ ID NO:68), TAR2h-10-19 (SEQ ID NO:69), TAR2h-10-20 (SEQ ID NO:70), TAR2h-10-21 (SEQ ID NO:71), TAR2h-10-22 (SEQ ID NO:72), TAR2h-10-27 (SEQ ID NO:73), TAR2h-10-29 (SEQ ID NO:74), TAR2h-10-31 (SEQ ID NO:75), TAR2h-10-35 (SEQ ID NO:76), TAR2h-10-36 (SEQ ID NO:77), TAR2h-10-37 (SEQ ID NO:78), TAR2h-10-38 (SEQ ID NO:79), TAR2h-10-45 (SEQ ID NO:80), TAR2h-10-47 (SEQ ID NO:81), TAR2h-10-48 (SEQ ID NO:82), TAR2h-10-57 (SEQ ID NO:83), TAR2h-10-56 (SEQ ID NO:84), TAR2h-10-58 (SEQ ID NO:85), TAR2h-10-66 (SEQ ID NO:86), TAR2h-10-64 (SEQ ID NO:87), TAR2h-10-65 (SEQ ID NO:88), TAR2h-10-68 (SEQ ID NO:89), TAR2h-10-69 (SEQ ID NO:90), TAR2h-10-67 (SEQ ID NO:91), TAR2h-10-61 (SEQ ID NO:92), TAR2h-10-62 (SEQ ID NO:93), TAR2h-10-63 (SEQ ID NO:94), TAR2h-10-60 (SEQ ID NO:95), TAR2h-10-55 (SEQ ID NO:96), TAR2h-10-59 (SEQ ID NO:97), TAR2h-10-70 (SEQ ID NO:98), TAR2h-34 (SEQ ID NO:373), TAR2h-35 (SEQ ID NO:374), TAR2h-36 (SEQ ID NO:375), TAR2h-37 (SEQ ID NO:376), TAR2h-38 (SEQ ID NO:377), TAR2h-39 (SEQ ID NO:378), TAR2h-40 (SEQ ID NO:379), TAR2h-41 (SEQ ID NO:380). TAR2h-42 (SEQ ID NO:381), TAR2h-43 (SEQ ID NO:382), TAR2h-44 (SEQ ID NO:383), TAR2h-45 (SEQ ID NO:384), TAR2h-47 (SEQ ID NO:385), TAR2h-48 (SEQ ID NO:386), TAR2h-50 (SEQ ID NO:387), TAR2h-51 (SEQ ID NO:388), TAR2h-66 (SEQ ID NO:389), TAR2h-67 (SEQ ID NO:390), TAR2h-68 (SEQ ID NO:391), TAR2h-70 (SEQ ID NO:392), TAR2h-71 (SEQ ID NO:393), TAR2h-72 (SEQ ID NO:394), TAR2h-73 (SEQ ID NO:395), TAR2h-74 (SEQ ID NO:396), TAR2h-75 (SEQ ID NO:397), TAR2h-76 (SEQ ID NO:398), TAR2h-77 (SEQ ID NO:399), TAR2h-78 (SEQ ID NO:400), TAR2h-79 (SEQ ID NO:401) и TAR2h-15 (SEQ ID NO:431).
В дополнительных воплощениях лиганд или мономер dAb содержит аминокислотную последовательность, которая по меньшей мере примерно на 90% гомологична аминокислотной последовательности dAb, выбранной из группы, состоящей из TAR2h-131-8 (SEQ ID NO:433), TAR2h-131-24 (SEQ ID NO:434), TAR2h-15-8 (SEQ ID NO:435), TAR2h-15-8-1 (SEQ ID NO:436), TAR2h-15-8-2 (SEQ ID NO:437), TAR2h-185-23 (SEQ ID NO:438), TAR2h-154-10-5 (SEQ ID NO:439), TAR2h-14-2 (SEQ ID NO:440), TAR2h-151-8 (SEQ ID NO:441), TAR2h-152-7 (SEQ ID NO:442), TAR2h-35-4 (SEQ ID NO:443), TAR2h-154-7 (SEQ ID NO:444), TAR2h-80 (SEQ ID NO:445), TAR2h-81 (SEQ ID NO:446), TAR2h-82 (SEQ ID NO:447), TAR2h-83 (SEQ ID NO:448), TAR2h-84 (SEQ ID NO:449), TAR2h-85 (SEQ ID NO:450), TAR2h-86 (SEQ ID NO:451), TAR2h-87 (SEQ ID NO:452), TAR2h-88 (SEQ ID NO:453), TAR2h-89 (SEQ ID NO:454), TAR2h-90 (SEQ ID NO:455), TAR2h-91 (SEQ ID NO:456), TAR2h-92 (SEQ ID NO:457), TAR2h-93 (SEQ ID NO:458), TAR2h-94 (SEQ ID NO:459), TAR2h-95 (SEQ ID NO:460), TAR2h-96 (SEQ ID NO:461), TAR2h-97 (SEQ ID NO:462), TAR2h-99 (SEQ ID NO:463), TAR2h-100 (SEQ ID NO:464), TAR2h-101 (SEQ ID NO:465), TAR2h-102 (SEQ ID NO:466), TAR21h-103 (SEQ ID NO:467), TAR2h-104 (SEQ ID NO:468), TAR2h-105 (SEQ ID NO:469), TAR2h-106 (SEQ ID NO:470), TAR2h-107 (SEQ ID NO:471), TAR2h-108 (SEQ ID NO:472), TAR2h-109 (SEQ ID NO:473), TAR2h-110 (SEQ ID NO:474), TAR2h-111 (SEQ ID NO:475), TAR2h-112 (SEQ ID NO:476), TAR2h-113 (SEQ ID NO:477), TAR2h-114 (SEQ ID NO:478), TAR2h-115 (SEQ ID NO:479), TAR2h-116 (SEQ ID NO:480), TAR2h-117 (SEQ ID NO:481), TAR2h-118 (SEQ ID NO:482), TAR2h-119 (SEQ ID NO:483), TAR2h-120 (SEQ ID NO:484), TAR2h-121 (SEQ ID NO:485), TAR2h-122 (SEQ ID NO:486), TAR2h-123 (SEQ ID NO:487), TAR2h-124 (SEQ ID NO:488), TAR2h-125 (SEQ ID NO:489), TAR2h-126 (SEQ ID NO:490), TAR2h-127 (SEQ ID NO:490), TAR2h-128 (SEQ ID NO:492), TAR2h-129 (SEQ ID NO:493), TAR2h-130 (SEQ ID NO:494), TAR2h-131 (SEQ ID NO:495), TAR2h-132 (SEQ ID NO:496), TAR2h-133 (SEQ ID NO:497), TAR2h-151 (SEQ ID NO:498), TAR2h-152 (SEQ ID NO:499), TAR2h-153 (SEQ ID NO:500), TAR2h-154 (SEQ ID NO:501), TAR2h-159 (SEQ ID NO:502), TAR2h-165 (SEQ ID NO:503), TAR2h-166 (SEQ ID NO:504), TAR2h-168 (SEQ ID NO:505), TAR2h-171 (SEQ ID NO:506), TAR2h-172 (SEQ ID NO:507), TAR2h-173 (SEQ ID NO:508), TAR2h-174 (SEQ ID NO:509), TAR2h-176 (SEQ ID NO:510), TAR2h-178 (SEQ ID NO:511), TAR2h-201 (SEQ ID NO:512), TAR2h-202 (SEQ ID NO:513), TAR2h-203 (SEQ ID NO:514), TAR2h-204 (SEQ ID NO:515), TAR2h-185-25 (SEQ ID NO:516), TAR2h-154-10 (SEQ ID NO:517) и TAR2h-205 (SEQ ID NO:627).
Изобретение относится к антагонисту фактора некроза опухоли I (TNFR1), связывающему фактор некроза опухоли I (TNFR1) и ингибирующему передачу сигнала через TNFR1, где указанный антагонист не ингибирует связывание TNFα с TNFR1. В некоторых воплощениях антагонист включает мономер первого доменного антитела (dAb) и мономер второго dAb, где указанный мономер первого dAb связывает домен TNFR1, выбранным из группы, состоящей из домена 1, домена 2, домена 3 и домена 4, и указанный мономер второго dAb связывает домен TNFR1, выбранный из группы, состоящей из домена 1, домена 2, домена 3 и домена 4, где указанный антагонист не оказывает агонистического действия на TNFR1, когда присутствует в концентрации примерно 1 мкМ в стандартном анализе цитотоксичности в отношении L929 или стандартном анализе IL-8 в HeLa.
В некоторых воплощениях изобретение представляет собой мономер доменного антитела (dAb) или лиганд, содержащий dAb, которое связывает фактор некроза опухоли I (TNFR1) и ингибирует передачу сигнала через TNFR1, где указанный мономер dAb не ингибирует связывание TNFα с TNFR1.
В других воплощениях изобретение представляет собой мономер доменного антитела (dAb) или лиганд, содержащий dAb, которое связывает фактор некроза опухоли I (TNFR1), где указанное dAb связывает домен 1 TNFR1 и конкурирует с TAR2m-21-23 за связывание с мышиным TNFR1 или конкурирует с TAR2h-205 за связывание с человеческим TNFR1.
В других воплощениях изобретение представляет собой мономер доменного антитела (dAb) или лиганд, содержащий dAb, которое связывает фактор некроза опухоли I (TNFR1), где указанное dAb связывает домен 3 TNFR1 и конкурирует с TAR2h-131-8, TAR2h-15-8, TAR2h-35-4, TAR2h-154-7, TAR2h-154-10 или TAR2h-185-25 за связывание с человеческим TNFR1.
Изобретение также относится к антителу или его антиген-связывающему фрагменту, обладающему связывающей специфичностью в отношении TNFR1 и эффективному при лечении, подавлении или предупреждении хронического воспалительного заболевания. В некоторых воплощениях антитело или антиген-связывающий фрагмент представляет собой моновалентный антиген-связывающий фрагмент.
В изобретении также предложен мономер dAb и лиганды, включающие мономер dAb, который обладает связывающей специфичностью в отношении TNFR1 и ингибирует TNFR-1-опосредованную передачу сигнала, но по существу не ингибирует связывание TNFα с TNFR1. В некоторых воплощениях мономер dAb ингибирует TNFα-индуцированное перекрестное связывание или кластеризацию TNFR1 на поверхности клетки.
В изобретении также предложены выделенные и/или рекомбинантные молекулы нуклеиновой кислоты, которые кодируют лиганды по изобретению, и векторы, которые включают рекомбинантные молекулы нуклеиновой кислоты. Также предложены клетки-хозяева, включающие рекомбинантные молекулы нуклеиновой кислоты или векторы по изобретению, и способы получения лигандов.
Изобретение также относится к фармацевтическим композициям, содержащим антагонист или лиганд по изобретению и фармакологически, физиологически или фармацевтически приемлемый носитель.
Изобретение также относится к способам лечения, подавления или предупреждения заболевания или расстройства (например, хронического воспалительного заболевания, аутоиммунного расстройства, воспалительного заболевания, артрита, рассеянного склероза, воспалительного заболевания кишечника, хронического обструктивного заболевания легких, пневмонии, септического шока), включающим введение млекопитающему, нуждающемуся в этом, терапевтически эффективного количества или дозы антагониста или лиганда по изобретению.
Изобретение также относится к антагонисту или лиганду по изобретению для применения в терапии или диагностике, и к применению антагониста или лиганда по изобретению для изготовления лекарственного средства для лечения, подавления или предупреждения заболевания или расстройства, как описано в данном изобретении (например, хронического воспалительного заболевания, аутоиммунного расстройства, воспалительного заболевания, артрита, рассеянного склероза, воспалительного заболевания кишечника, хронического обструктивного заболевания легких, пневмонии или септического шока. В других воплощениях заболевание может представлять собой муковисцидоз или тяжелую стероидорезистентную астму).
Изобретение также относится к фармацевтической композиции для лечения, подавления или предупреждения заболевания или расстройства, как описано в данном изобретении (например, хронического воспалительного заболевания, аутоиммунного расстройства, воспалительного заболевания, артрита, рассеянного склероза, воспалительного заболевания кишечника, хронического обструктивного заболевания легких, пневмонии или септического шока. В других воплощениях заболевание может представлять собой муковисцидоз или тяжелую стероидорезистентную астму), содержащей антагонист или лиганд по изобретению в качестве активного ингредиента.
Единичные вариабельные домены или доменные антитела (dAb), которые обладают связывающей специфичностью в отношении TNFR1, и лиганды, включающие эти единичные вариабельные домены или dAb, имеют несколько преимуществ. Например, описанные в данном изобретении единичные вариабельные домены или dAb, которые обладают связывающей специфичностью в отношении TNFR1, обладают антагонистическим эффектом на TNFR1. Соответственно, могут быть введены терапевтические агенты, которые включают единичный вариабельный домен иммуноглобулина против TNFR1 или dAb по изобретению (например, для терапевтических, диагностических или профилактических целей) с существенно сниженным риском побочных эффектов, вызванных связыванием и/или антагонистическим действием в отношении TNFR2 (например, иммуносупрессия). Терапевтические агенты, нацеленные на TNF-альфа, такие как ENBREL® (entarecept; Immunex Corporation) оказывают антагонистическое действие на TNFR1 и TNFR2, и введение таких агентов может вызывать иммуносупрессию и родственные побочные эффекты (например, тяжелые инфекции). Эти побочные эффекты могут ограничить применение таких агентов, в частности при хронических заболеваниях, при которых агент вводят в течение длительного периода времени (Kollias G. and Kontoyiannis D., Cytokine Growth Factor Rev., 73(4-5):315-321 (2002).) Напротив, поскольку лиганды по изобретению оказывают специфический антагонистическое действие на TNFR1, то их можно вводить в течение длительных периодов при хронических заболеваниях со сниженным риском побочных эффектов и обеспечивают преимущества при лечении воспалительных состояний и хронических воспалительных состояний (включая продолжительные заболевания, характеризующиеся периодами покоя и периодами активного воспаления, такие как воспалительное заболевание кишечника и артрит).
Краткое описание графических материалов
На Фиг.1 показано разнообразие VH/HAS (человеческий сывороточный альбумин) в положениях Н50, Н52, Н52а, Н53, Н55, Н56, Н58, Н95, Н96, Н97, Н98 (кодируемые соответственно DVT или NNK), которые располагаются в антиген-связывающем сайте VH HSA. (SEQ ID NO:1, нуклеотидная последовательность; SEQ ID NO:2, аминокислотная последовательность). Последовательность VK варьируется в положениях L50, L53.
На Фиг.2 представлено схематическое изображение структуры плазмиды pIT1/pIT2, используемой для получения библиотек одноцепочечных Fv (scFv), и показана нуклеотидная последовательность плазмиды от областей, регулирующих экспрессию и клонирование (SEQ ID NO:3), до кодируемой аминокислотной последовательности (SEQ ID NO:4). Плазмиду использовали для получения:
Библиотеки 1: Герминальный VK/DVT VH,
Библиотеки 2: Герминальный VK/NNK VH,
Библиотеки 3: Герминальный VH/DVT VK и
Библиотеки 4: Герминальный VH/NNK VK в формате фагового дисплея/ScFv.
Эти библиотеки предварительно подвергали селекции на связывание с типичными лигандами белком А и белком L, так чтобы большая часть клонов и выбранных библиотек была функциональной. Библиотеки подвергали селекции на HSA (первый раунд) и β-gal (второй раунд) или HSA β-gal, или на β-gal (первый раунд) и HSA (второй раунд) или β-gal HSA. Растворимый scFv из этих клонов ПЦР последовательно амплифицируют.Один из клонов, кодирующих антитело К8 с двойной специфичностью, выбрали для дальнейшей работы.
На Фиг.3 показано выравнивание VH-цепей (пустой VH (SEQ ID NO: 5), К8 (SEQ ID NO:6), VH2 (SEQ ID NO:7), VH4 (SEQ ID NO:8), VHC11 (SEQ ID NO:9), VHA-10sd (SEQ ID NO: 10), VHA-1sd (SEQ ID NO:11), VHA5sd (SEQ ID NO: 12), VHC5sd (SEQ ID NO:13), VHC11sd (SEQ ID NO: 14), VHC11sd (SEQ ID NO: 15)) и VK-цепей (пустой VK (SEQ ID NO: 16), K8 (SEQ ID NO: 17), E5sc (SEQ ID NO: 18), C3 (SEQ ID NO: 19)).
На Фиг.4 представлена характеристика связывающих свойств антитела K8, связывающие свойства антитела K8, охарактеризованные моноклональным фаговым иммуноферментным анализом (ИФА). Обнаружено, что антитело K8 с двойной специфичностью связывает HSA и β-gal и представлено на поверхности фага с сигналами абсорбции более 1,0. Не обнаружено перекрестной реактивности с другими белками.
На Фиг.5 показан ИФА растворимого scFv, осуществляемый с использованием известных концентраций фрагмента антитела K8. 96-луночный планшет покрывали 100 мкг HSA, BSA (бычий сывороточный альбумин) и β-gal в концентрации 10 мкг/мл и 100 мкг/мл белка А в концентрации 1 мкг/мл. Наносили по 50 мкг серийных разведении scFv K8 и фрагменты связанного антитела обнаруживали с использованием белка L, конъюгированного с HRP (пероксидаза хрена). Результаты ИФА подтверждают двойную специфическую природу антитела K8.
На Фиг.6 показаны связывающие характеристики клона К8VK/пустой VH, проанализированные с использованием ИФА растворимого scFv. Получение растворимых фрагментов scFv индуцировали с помощью IPTG (изопропилтиогалакгозид), как описано Harrison et al. Methods Enzymol. 1996;267:83-109, и непосредственно анализировали супернатант, содержащий scFv. ИФА растворимого scFv осуществляют, как описано в примере 1, и связанные scFv обнаруживают с помощью белка L, конъюгированного с HRP. Результаты ИФА показали, что этот клон способен связывать β-gal, тогда как связывание BSA отменялось.
На Фиг.7 показана последовательность (SEQ ID NO:2 и SEQ ID NO:3) векторов 1 и 2 для вариабельных доменов.
На Фиг.8 представлена карта вектора CH, используемого для конструирования полиспецифического лиганда VH1/VH2.
На Фиг.9 представлена карта вектора CK, используемого для конструирования полиспецифического лиганда VK1/VK2.
На Фиг.10 представлен анализ рецептора TNF, сравнивающий димер 4 TAR1-5, димер 4 TAR1-5-19 и мономер TAR1-5-19.
На Фиг.11 представлен анализ рецептора TNF, сравнивающий димеры 1-6 TAR1-5. Все димеры были очищены с помощью FPLC (быстрая жидкостная хроматография пептидов), и результаты представлены для оптимальных видов димеров.
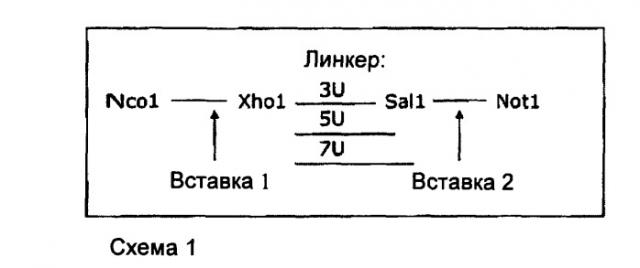
На Фиг.12 представлен анализ рецептора TNF для гомодимеров TAR1-5 19 в различных форматах: формат dAb-линкер-dAb с линкером 3U, 5U или 7U, формат Fab и формат, представляющий собой цистеиновый шарнир-линкер.
На Фиг.13 показана пустая последовательность VH для библиотеки 1 (аминокислотная последовательность ((SEQ ID NO:5; нуклеотидные последовательности: кодирующая цепь (SEQ ID NO:20), некодирующая цепь (SEQ ID NO:21)). Последовательность каркаса VH, основанная на герминальной последовательности DP47-JH4b. Положения, где рандомизация NNK (N=нуклеотиды А или Т, или С, или G; К=нуклеотиды G или Т) включена в библиотеку 1, указаны жирным подчеркнутым текстом.
На Фиг.14 показана пустая последовательность VH для библиотеки 2 (аминокислотная последовательность ((SEQ ID NO:22; нуклеотидные последовательность: кодирующая цепь (SEQ ID NO:23), некодирующая цепь (SEQ ID NO:24). Последовательность каркаса VH, основанная на герминальной последовательности DP47-JH4b. Положения, где рандомизация NNK (N=нуклеотиды А или Т, или С, или G; К=нуклеотиды G или Т) включена в библиотеку 2, указаны жирным подчеркнутым текстом.
На Фиг.15 показана пустая последовательность VK для библиотеки 3. (аминокислотная последовательность ((SEQ ID NO:16; нуклеотидные последовательность: кодирующая цепь (SEQ ID NO:25), некодирующая цепь (SEQ ID NO:26). Последовательность каркаса VK, основанная на герминальной последовательности DPK9-JK1. Положения, где рандомизация NNK (N=нуклеотиды А или Т, или С, или G; К=нуклеотиды G или Т) включена в библиотеку 3, указаны жирным подчеркнутым текстом.
На Фиг.16 показана нуклеотидная и аминокислотная последовательность dAb против MSA (мышиный сывороточный альбумин) MSA 16 (нуклеотидная последовательность (SEQ ID NO:27), аминокислотная последовательность (SEQ ID NO:28) и MSA 26 (нуклеотидная последовательность (SEQ ID NO:29), аминокислотная последовательность (SEQ ID NO:30).
На Фиг.17 показано biacore ингибирование MSA 16 и 26. Очищенные dAb MSA16 и MSA26 анализировали с помощью biacore ингибирования для определения Кd. Кратко, dAb тестировали для определения концентрации dAb, необходимой для достижения ответа 200 единиц на biacore чипе СМ5, покрытом MSA с высокой плотностью. После того как необходимые концентрации dAb были определены, антиген MSA в диапазоне концентраций около ожидаемой Кd предварительно смешивали с dAb и инкубировали в течение ночи. Связывание dAb с biacore чипом, покрытым MSA, в каждой из предварительных смесей затем измеряли при высокой скорости потока 30 мкл/мин.
На Фиг.18 показаны уровни MSA16 в сыворотке крови после инъекции. У мышей определяли период полувыведения dAb MSA16 из сыворотки крови. MSA16 дозировали в виде разовых внутривенных (в/в) инъекций в концентрации приблизительно 1,5 мг/кг мышам CD1. Моделирование с использованием 2-компартментной модели продемонстрировало, что MSA16 имел t1/2α 0,98 ч, t1/2β 36,5 ч и AUC (площадь под кривой) 913 ч.мг/мл. MSA16 имел сравнительно удлиненный период полувыведения по сравнению с HEL4 (dAb против лизоцима белка куриного яйца), имеющего t1/2α 0,06 ч и t1/2β 0,34 ч.
На Фиг.19а-19в показан ИФА (Фиг.19а) и анализ рецептора TNF (Фиг.196, 19в), демонстрирующий ингибирование связывания TNF с Fab-подобным фрагментом, включающим MSA26Ck и TAR1-5-19CH. Добавление MSA с Fab-подобным фрагментом уменьшает уровень ингибирования. Планшет для ИФА, покрытый 1 мкг/мл TNFα, зондировали обладающим двойной специфичностью VKCH и VKCK Fab-подобным фрагментом, а также контрольным TNFα-связывающим dAb в концентрации, рассчитанной для получения похожего сигнала на ИФА. Как обладающее двойной специфичностью, так и контрольное dAb использовали для зондирования планшета для ИФА в присутствии и в отсутствие 2 мг/мл MSA. Сигнал в лунке с антителами с двойн