Способ волкова для производства химически активных металлов и устройство для его осуществления
Иллюстрации
Показать всеИзобретение относится к способу производства химически активных металлов и устройству для его осуществления. Способ включает подачу реакционной шихты, состоящей из соединения получаемого металла и металла-восстановителя, в реакционную зону и нагрев шихты для восстановления металла. При этом реакционную шихту подают в реакционную зону внутренней полости графитового электрода, являющегося анодом, и проводят сначала металлотермическое восстановление внутри электрода. Затем перемещают шихту и при выходе шихты на торец электрода в зону горения дуги продолжают плазменно-химическое и электрохимическое восстановление металла при образовании ванны жидкого металла. Затем охлаждают жидкий металл на кристаллизаторе, являющемся катодом. Устройство содержит корпус, подающее шихту из соединения получаемого металла и металла-восстановителя механическое устройство, бункер и патрубок для создания вакуума и подачи инертного газа. Оно снабжено кристаллизатором, подключенным к отрицательному полюсу и являющимся катодом, и графитовым электродом, подключенным к положительному полюсу и являющимся анодом. Графитовый электрод выполнен с центральным отверстием и внутренней полостью для восстановления и перемещения шихты. Механическое устройство расположено внутри бункера. Техническим результатом является повышение скорости процесса и чистоты получаемого металла. 2 н. и 1 з.п. ф-лы, 4 ил.
Реферат
Предлагаемое изобретение относится к области производства химически активных металлов и может быть использовано для получения титана, циркония, ванадия, вольфрама, ниобия и т.п. металлов.
Близким техническим решением, в качестве первого аналога, является кембриджский способ производства титана [1]. (Научно-технический журнал "Титан" №2(19) 2006 г., стр.9÷10). До настоящего времени это один из новых способов в производстве химически активных металлов.
В последние годы проявляется значительный интерес к возможности электрохимического получения титана из оксидного сырья. Установлено, что достехиометрическая двуокись титана обладает высокой электропроводностью и может служить катодом как для восстановления оксидов титана до металла, так и для удаления из него растворенного кислорода.
В 2000 г., исходя из результатов, полученных ранее Фрэем, Фартингом и Ченом на факультете материаловедения Кембриджского университета, предложено прямое электрохимическое восстановление TiO2 до титана в расплавленном CaCl2. Для внедрения нового процесса, который в научной литературе получил название Кембриджский процесс или процесс Фрэя, Фартинга и Чена (FFC), в производство в коммерческих целях была создана новая компания British Titanium (BTi).
В процессе используется электрохимическая дезоксидация твердого диоксида титана, что изначально применялось Окабэ и др. для рафинирования металлического титана. Разработчики продемонстрировали в лабораторных масштабах, что реакция восстановления шла при 950°С на катоде, выполненном из твердого TiO2, тогда как окисление анионов кислорода происходит на графитовом аноде с выделением СО2. Удаление небольшого количества кислорода из изолятора-рутила превращает его в высокопроводящую фазу Магнелли (ТiO2-X). Чистый хлорид кальция (СаСl2) был выбран в качестве расплавленного солевого электролита из-за высокой растворимости в нем окиси кальция и превосходных свойств миграционного переноса анионов кислорода.
Процесс производства чистого титана состоит из следующей последовательности операций. Порошок чистого диоксида титана смешивается с соответствующим связующим до пасты или шликера и отливается в катоды прямоугольной формы с помощью одного из способов, традиционного для производства керамики, например прокатом или шликерным литьем. Необожженный катод затем прокаливается в сушильном шкафу, где начинается процесс спекания, чтобы получить цельный керамический материал. После спекания фасонные изделия используются как цельные катоды. Восстановление титана идет в закрытом электролизере, заполненном инертным газом. Электролизер спроектирован для непрерывной работы с катодами, устанавливаемыми и вынимаемыми на разных этапах по ходу процесса через герметичные шлюзы, заполненные инертным газом. Контролируя катодный потенциал, можно удалить кислород из диоксида титана, при этом получить металл высокой чистоты, сходный с точки зрения морфологии с губкой, полученной магнийтермическим способом. Напряжение на ванне приблизительно 3В, что слегка ниже напряжения разложения СаСl2 (3,25 В при 950°С), но намного выше напряжения разложения ТiO2 (1,85 В при 950°С), поэтому хлоргаз на аноде не образуется. Для снижения содержания кислорода в титане необходимо достаточное перенапряжение. Разработчики заявляют, что смеси оксидов других металлов с TiO2 в исходном катоде также восстанавливаются до металлов, обеспечивая возможность производства титановых сплавов несмотря на различную микроструктуру. Процесс был продемонстрирован в опытном реакторе (мощность 1 кг в день).
Вторым аналогом предлагаемого изобретения является способ алюмотермического восстановления диоксида титана [2]. (А.Н.Зеликман. Металлургия тугоплавких редких металлов, Москва: "Металлургия", 1986, стр.417÷419).
В соответствии со сродством кислорода к алюминию и титану в его различных оксидах диоксид титана при температурах до 1400°С может быть восстановлен до TiO. Однако алюминий образует с титаном твердые растворы и интерметаллиды с дополнительным высвобождением энергии Гиббса, что способствует восстановлению до образования титаноалюминиевого сплава.
Возможность алюминотермического восстановления в условиях внепечного процесса с использованием выделяющегося тепла реакции упрощает и удешевляет его аппаратурное оформление. При восстановлении TiO2 алюминием суммарный тепловой эффект с учетом дополнительного тепла, выделяемого при образовании титаноалюминиевого сплава, составляет около 1590 кДж/кг шихты, содержащей 25% избытка алюминия против стехиометрического расчета. Этого количества тепла недостаточно для самопроизвольного развития реакции с выплавленном сплава и шлака. Поэтому, чтобы увеличить тепловыделение, в шихту добавляют бертолетову соль и для уменьшения вязкости расплава хлорид кальция. Шихту, набитую в графитошамотный тигель, поджигают запальной смесью и после быстрого распространения реакции по всему объему на дне тигля получают слиток сплава, легко отделяемый после остывания от шлака.
В качестве восстановителей из двуокиси титана термодинамически возможно применение магния, кальция, алюминия, углерода. Однако алюминий и углерод хорошо растворимы в титане, в связи с чем алюминотермические и карботермические процессы при необходимости могут быть использованы лишь для получения титана, легированного алюминием или углеродом.
Корректная оценка термодинамической вероятности процессов восстановления оксидов титана должна учитывать энергию образования твердых растворов кислорода в титане. В связи с этим металлотермическая реакция восстановления оксидов титана в общем виде может быть представлена уравнением
Титаноалюминиевые сплавы могут быть использованы как лигатуры в производстве сплавов, а также для получения из них чистого титана электролитическим рафинированием. Сочетание алюминотермического восстановления диоксида титана с последующим электролитическим рафинированием может стать одним из производственных методов получения титана.
Третьим аналогом [2] (А.Н.Зеликман. Металлургия тугоплавких редких металлов, - Москва: "Металлургия", 1986, стр.414÷416) можно принять восстановление циркония из тетрафторида. Тетрафторид циркония в отличие от тетрахлорида устойчив на воздухе и имеет относительно высокую температуру сублимации (давление пара над твердым ZrF4 достигает 0,1 МПа при 908°С). Это позволяет проводить металлотермическое восстановление тетрафторида, допуская развитие высокой температуры, при которой возможна выплавка слитка циркония (tпл Zr 1850°С).
Получают ZrF4 за счет взаимодействия фтора или фтористого водорода с диоксидом циркония при 500-550°С:
Материал аппаратуры - никель или сплавы Ni-Сu (монель).
Производимый этим способом тетрафторид циркония содержит недопустимо высокое содержание кислорода и требует очистки. Очистку проводят сублимацией в вакууме при 650-850°С.
Тетрафторид циркония восстанавливают кальцием по экзотермической реакции
или 2480 кДж/кг шихты.
Образующийся CaF2 плавится при 1419°С, кипит при 2630°С, что благоприятно для выплавки слитка циркония.
Восстановление проводят в герметичном стальном реакторе, футерованном оксидом кальция, прокаленным при высокой температуре. Используют кальций высокой чистоты (очищенный двукратной дистилляцией), который вводят в шихту в виде стружки. Для обеспечения выплавки слитка согласно одному из вариантов применяют в качестве подогревающей добавки, увеличивающей термичность процесса, иод (теплота реакции иода с кальцием 533 кДж/моль 12). Реактор вакуумируют, заполняют аргоном и нагревают в печи до 850°С, после чего процесс протекает самопроизвольно с большой скоростью. При диаметре реактора 460 мм получают слиток циркония массой до 450 кг. Из слитков изготовляют расходуемые электроды для дугового переплава, обеспечивающего удаление примесей.
К недостаткам процесса следует отнести значительный расход дорогого иода и возможность загрязнения слитка вследствие контакта с футеровкой. Для снижения температуры выплавляемого слитка предложено вводить в шихту цинк, что приводит к образованию относительно легкоплавкого сплава циркония с цинком (сплав с содержанием цинка 25% плавится при 1400°С). После отгонки цинка в вакууме при 1500°С остается цирконий в виде губки, которая поступает в переплавку. Примерное содержание примесей в слитках после дуговой плавки следующее, %: С 0,03; О 0,1; N 0,005; Si 0,02; Al 0,01; Ca 0,003; Fe 0,02; Ti 0,001. Примеси других металлов в пределах 0,001-0,003%.
В случае необходимости в шихту кальциетермического восстановления добавляют легирующие металлы, получая слитки легированного циркония.
Другой разновидностью третьего аналога является следующий способ. Если порошок циркония предназначен не для производства пластичного металла, а для непосредственного использования в пиротехнике или в некоторых случаях в электровакуумной технике (например, в качестве геттера) и к нему не предъявляют высоких требований по чистоте, он может быть получен восстановлением К2ZrF6 натрием подобно получению порошков тантала и ниобия из фтористых комплексных солей.
Фтороцирконат калия негигроскопичен, устойчив на воздухе. Образующиеся в результате восстановления фториды натрия и калия отмываются от циркония водой.
Удельный тепловой эффект реакции
составляет около 1105 кДж/кг шихты. Для развития реакции требуется дополнительный подвод тепла нагревом шихты в электропечи.
Восстановление проводят в стальных стаканах, куда загружают послойно К2ZrF6 и кусочки натрия (115-120% от стехиометрического количества). Стакан герметизируют, присоединяя крышку к фланцу, или, что проще, приваривая ее. Стакан выдерживают в печи при 800-900°С. После охлаждения оплавленную массу выбивают пневматическим молотком, обрабатывают раствором NH4Cl для растворения остатков натрия, измельчают в воде в шаровой мельнице и выщелачивают KF и NaF водой в реакторах с мешалками. Во избежание возгорания остатков натрия и образующегося при отмывке водорода материал подают в воду постепенно, небольшими порциями.
Для удаления железа порошок обрабатывают разбавленной соляной кислотой, промывают водой, фильтруют и сушат при 60°С. При сушке следует соблюдать осторожность, так как порошок склонен к самовоспламенению, поэтому сушку предпочтительней проводить в вакууме. Порошки содержат примерно 98-98,5% Zr [2]. Наиболее близким техническим решением, в качестве прототипа, является способ восстановления титана и циркония кальцием.
Восстановление диоксидов титана и циркония кальцием применяют для получения мелкозернистых порошков титана и циркония, которые могут быть использованы для получения изделий методом порошковой металлургии, а также в виде порошков (преимущественно циркония) в пиротехнике и в качестве геттера в электронных приборах.
Восстановление ТiO2 и ZrO2 кальцием протекает по реакции:
где Me - Ti или Zr.
Восстановление TiO2 и ZrO2 по реакции (1) сопровождается значительным выделением тепла (ΔН°1300K=-392 кДж для TiO2 и -240 кДж для ZrO2), однако его недостаточно для самопроизвольного хода процесса. Необходим постоянный нагрев реактора при 950-1100°С. Даже при избытке кальция в шихте 50-100% и проведении процесса в герметичном аппарате, заполненном чистым аргоном, принципиально невозможно получить порошки титана и циркония с содержанием кислорода ниже 0,1%. Это объясняется тем, что при содержании кислорода 0,005-0,07% сродство кальция к кислороду при 1000-1100°С равно сродству циркония и титана к растворенному в них кислороду. Реальное содержание кислорода в порошках 0,2-0,3%, поскольку часть кислорода находится там в форме оксидных пленок, образовавшихся при отмывке порошков от кальция.
В соответствии с термодинамическими расчетами для 1100 К в случае магниетермического восстановления оксидов титана энергия Гиббса окислительно-восстановительного процесса принимает нулевое значение при содержании кислорода в титане 0,42% (по массе). В практических условиях вследствие кинетических трудностей, обусловленных низкой скоростью диффузионных процессов в твердых веществах, равновесное состояние не достигается. Поэтому остаточное содержание кислорода оказывается более высоким: при магниетермическом восстановлении до 2,5%.
Восстановление кальцием проводят в герметичных аппаратах из жаростойкой стали, куда загружают брикетированную смесь TiO2 или ZrO2 с кальцием (в виде стружки). Необходимо использовать кальций, очищенный дистилляцией. Аппарат откачивают, заполняют аргоном, нагревают до 1000-1100°С и выдерживают при этой температуре примерно 1 ч. Продукт восстановления измельчают, обрабатывают большим объемом воды [для удаления части СаО в форме Са(ОH)2], затем разбавленной НСl, промывают водой и сушат в вакууме при 40-50°С.
В результате восстановления получаются тонкодисперсные порошки титана и циркония (крупностью 2-3 мкм), так как их росту препятствуют прослойки тугоплавкого оксида кальция. Укрупнению частиц содействуют добавки CaCl2, образующего жидкую фазу. Механизм действия хлористого кальция заключается в том, что образующийся оксид кальция растворяется в расплавленном CaCl2. При 1000°С растворимость СаО составляет ~25%. Даже если количества добавленного СаСl2 в шихту недостаточно для полного растворения СаО в нем, то оставшиеся нерастворенные частицы СаО перекристаллизовываются через расплав, приобретая при этом некоторую подвижность, что позволяет кристаллам титана сращиваться в более крупные частицы. Добавляя различные количества СаСl2 в исходную шихту (TiO2+Са+CaCl2), можно регулировать размер частиц получающегося порошка титана. Если ввести хлористый кальций в количестве, достаточном для растворения всего образующегося СаО (примерно в молярных соотношениях СаО:CaCl2=2:1), то получаются частицы металла размерами до 10 мкм.
Для того чтобы решить проблему получения химически активного металла из его соединений более дешево и быстро, чем при электролизе и более качественно и чисто по включениям, чем при металлотермии, был предложен этот способ.
Поставленная задача достигается тем, что в способе получения химически активных металлов, который включает подачу реакционной шихты, состоящей из соединения получаемого металла и металла-восстановителя, в реакционную зону и нагрев шихты для восстановления металла, согласно изобретению реакционную шихту, состоящую из соединения восстанавливаемого металла и металла-восстановителя, подают в ракционную зону внутренней полости графитового электрода, являющегося анодом, и проводят сначала металлотермическое восстановление внутри электрода, перемещают шихту, и при выходе шихты на торец электрода в зону горения дуги продолжают плазменно-химическое и электрохимическое восстановление металла с образованием ванны жидкого металла и охлаждают его в кристаллизаторе, являющемся катодом.
Устройство для получения химически и реакционно активных металлов, содержащее корпус, подающее шихту из соединения получаемого металла и металла-восстановителя механическое устройство, бункер и патрубок для создания вакуума и подачи инертного газа, отличается тем, что оно снабжено кристаллизатором, подключенным к отрицательному полюсу и являющимся катодом, и графитовым электродом, подключенным к положительному полюсу и являющимся анодом, причем графитовый электрод выполнен с центральным отверстием и внутренней полостью для восстановления и перемещения шихты, механическое устройство расположено внутри бункера. Корпус имеет два патрубка для отдельного создания вакуума или подачи инертного газа в бункер и корпус устройства, а кристаллизатор выполнен в виде конуса или полусферы.
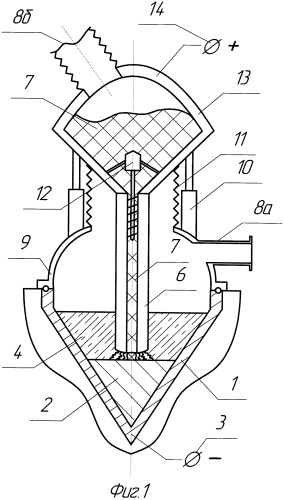
Предложенный способ реализует установка, представленная на Фиг.1. Установка включает медный охлаждаемый кристаллизатор 1, подключенный к отрицательному полюсу 3, что делает его катодом. Электрод 6 подключен к положительному полюсу 14 и является анодом, через внутреннюю полость которого подается реакционная шихта 7, за счет механического устройства 12. Кристаллизатор 1 герметично закрыт корпусом 9, который через трубчатую гофру 11 соединен с бункером 13, в котором находится реакционная шихта 7. Механический привод 10 регулирует положение электрода 6 над зеркалом ванны металла 2, выше которого находится электролит 4. Внутренняя полость установки вакуумируется через патрубок 8а, который напрямую соединен с корпусом 9, и патрубок 8б, который соединен с бункером 13. В связи с тем, что установка может работать в нейтральной среде, через патрубки 8 можно в процессе восстановления металла во внутреннюю полость подавать гелий или аргон. Кроме того, режим подачи газа и создания вакуума может быть смешанным.
Так, например, для того чтобы облегчить поступление шихты 7 через полость анода 6 в бункер 13, через патрубок 8б подается под определенным давлением аргон, который не только проталкивает шихту в полость плавления, но и, проходя сквозь расплав и электролит, очищает металл от газовых и нерастворимых примесей. При этом через патрубок 8а возможно создание вакуума. При подаче аргона через патрубок 8б, который в дальнейшем выходит на торце электрода, возможно восстановление металла на этой установке, когда не применяется защитная камера 9, т.е. когда установка работает на открытом воздухе. При этом восстанавливаемый металл будет производиться достаточно высокого качества, так как на его зеркало поступает аргон и защищает от загрязнения газами, присутствующими в воздухе. Данная установка будет достаточно недорогая и может применяться для широкого спектра восстанавливаемых металлов. Схема может быть обратной, для снижения летучих испарений от зеркала электролита через патрубок 8а подается аргон под определенным давлением, которое, действуя на зеркало электролита, загоняет часть расплава во внутреннюю полость анода, так как через патрубок 8б создается вакуум. За счет этого металлотермические процессы начинают протекать внутри анода на большей его длине, в отличие от обратной схемы, под действием высокой температуры, так как электрод 6 может в процессе плавки разогреваться до температуры 2000÷3000°С. Кроме того, образующийся газ СО и CO2, не попадая в электролит и не окисляя его, будет удаляться через бункер и патрубок 8б. По данной схеме можно в качестве электролита использовать CaCl2 и восстанавливать металл методом электролиза на небольшом напряжении. Как известно, CaCl2 очень хорошо растворяет оксиды металлов, имеет очень хорошие свойства переноса анионов кислорода. То есть в данном случае при движении окиси металла и металла восстановителя во внутренней полости анода будут протекать процессы металлотермического восстановления. Этот процесс характеризуется высокой производительностью, но восстанавливаемый металл при этом не полностью освобождается от присутствующего в нем кислорода. Содержание кислорода в восстанавливаемом металле может колебаться от 0,2 до 12%. После того как металл выходит на торец электрода, он попадает под дуговой разряд, в котором температура нагрева может достигать 2000÷3000°С, при этой температуре нагрева резко усиливаются процессы термической ионизации. То есть молекулы вещества начинают распадаться на составляющие их атомы, которые затем превращаются в ионы. Ионизация вещества может усиливаться за счет бомбардировки вещества заряженными частицами, так как восстанавливаемый металл, выходя на торец электрода-анода, подвергается воздействию отрицательных ионов, под действием которых на аноде происходит растворение металла, которое будет сопровождаться выделением кислорода.
Как известно, электролиз лежит в основе электрохимического метода получения чистых веществ. То есть на аноде происходит электрохимическое окисление, где отрицательно заряженные ионы становятся нейтральными и выделяются из раствора. На катоде происходит восстановительная реакция, где положительные ионы получают недостающие электроны.
В зоне выхода восстанавливаемой шихты так же происходят сложные электрохимические процессы, к которым в частности относится плазмохимический процесс, за счет которого могут ускорятся некоторые химические реакции. Высокие температуры плазмы приводят к высокой скорости протекания химических реакций, как прямых реакций синтеза, так и обратных реакций разложения. Если в данном случае восстанавливать металл в максимальном температурном поле анодного ядра, а затем его перемещать до зеркала ванны расплава, где более низкая температура, то можно затруднить обратные реакции окисления восстанавливаемого металла и существенно повысить выход требуемого продукта.
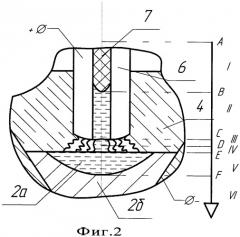
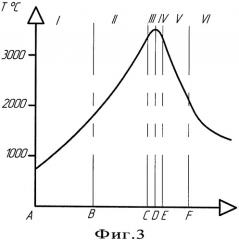
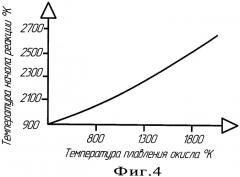
Общая схема реализации способа изображена на Фиг.2, где указаны основные технологические зоны восстановления и кристаллизации металла, а так же одно из возможных температурных полей, через которое может проходить вещество в этих зонах, изображенное на графике (Фиг.3). То есть шихта 7, продвигаясь по внутренней части электрода 6, в зоне I начинает прогреваться до высоких температур, диапазон которых может колебаться от 1000 до 2000°С. Продолжающийся нагрев вещества в зоне II приводит к тому, что когда величина температуры нагрева шихты превысит температуру плавления восстанавливаемого окисла на определенную величину, согласно графика (Фиг.4) начинается самопроизвольная восстановительная реакция. [3]. За счет протекания реакции в этой зоне начинает восстанавливаться металл, при этом выделяется дополнительное тепло. При попадании восстановленного и недовосстановленного металла в зону III, то есть при его выходе на торец электрода, металл дополнительно будет нагреваться за счет электродуги в анодном пятне и его температура еще более увеличиться, при этом ее повышение может достигать 2500-3500°С. То есть в этой зоне начинают протекать плазмохимические процессы, значительно ускоряющие протекание реакций восстановления металла. В этой же зоне начинает протекать электрохимический процесс окисления, за счет которого из восстановленного и недовосстановленного металла удаляется в виде газа кислород, выделяясь на аноде и удаляясь из реакции за счет системы откачки. В четвертой зоне продолжают протекать как электрохимический, так и металлотермический процессы восстановления металла, за счет которых формируются капли металла, образуя ванну расплава 2а. В этой зоне начинает падать температура и начинают замедляться все процессы. В зоне V идет формирование ванны металла 2а и его кристаллизация 2б за счет охлаждения кристаллизатором, при этом продукт восстановления в виде металла выходит из реакции, смещая ее вправо. В VI зоне идет окончательное остывание полученного металла. В общем виде процесс восстановления металла складывается из следующей цепочки: постепенный нагрев восстанавливаемой шихты внутри электрода, металлотермическое восстановление металла внутри электрода, металлотермическое, плазменно-химическое и электрохимическое восстановление металла в зоне горения дуги, образование ванны металла и его охлаждение на кристаллизаторе.
Схема работы установки может включать режим, когда через оба патрубка 8а и 8б подается давление инертного газа, причем давление может быть разное или переменное в зависимости от решаемой задачи по выплавке металла из его окиси, а так же из его хлоридов, карбидов и фторидов. То есть данная схема и конструкция установки позволяют в очень широких пределах настраивать режимы восстанавления металла. При этом можно в широких пределах регулировать ток и напряжение на аноде и катоде, а так же величину давления атмосферы в камере плавления и бункере, от глубокого вакуума до давления инертных газов в несколько десятков атмосфер. Данные возможности обусловлены простотой компановки конструкции установки, где нет ничего лишнего.
Схема подачи шихты через внутреннюю часть электрода аналогична схеме подачи шихты на шахтных печах, которые по эффективности и производительности занимают первое место среди других печей. Схема подачи шихты имеет следующие преимущества:
1. Не требуется брикетирования, то что используется в руднотермических печах. Брикетирование шихты удорожает процесс на 27%.
2. Не требуется создания специального электрода из оксидов восстанавливаемых металлов, то что применяется в Кембриджском процессе, еще более удорожающем производство.
3. Схема подачи шихты внутри электрода прямоточная и не тормозит процесс шлакообразования. В руднотермическом процессе загружаемая шихта поступает через шлак, охлаждая его и повышая его вязкость, что приводит к потере по выходу металла, так как шлаковая ванна захолаживается. В случае подачи шихты через электрод происходит противоположный процесс, шихта нагревается, забирая тепло от электрода, тем самым, увеличивая срок его службы. Постепенный нагрев шихты позволяет за проходящее время постепенно протекать процессам восстановления, которые, все ускоряясь, завершаются тем, что уже при достижении торца электрода формируется из шихты металл, который продолжает очищаться от кислорода за счет электролиза при максимально возможной температуре. При этом капли металла не проходят сквозь весь слой шлаковой ванны, в которой они могли бы остаться, а проходят по короткому пути от торца электрода до ванны расплава. На данном пути в зоне горения дуги самая высокая температура, а следовательно, самая низкая вязкость электролита, поэтому образующийся металл сможет легко и без потерь преодолевать этот путь.
Технологический процесс производства химически активных металлов можно раскрыть на примере восстановления двуокиси титана согласно Кембриджского процесса и второго аналога, доработав и ускорив процесс тем, что совместно с электролизом двуокись титана будет восстанавливаться алюминием и углеродом. В качестве сырья, возможно, применить как природный, так и искусственный рутил, содержащий не менее 95% ТiO2. Алюминий применяется в порошке фракцией, соответствующей наибольшему восстановлению титана.
[3]. В порошковую смесь ТiO2 и Аl добавляется сухой порошковый флюс для того, чтобы образуемая ванна металла около электрода постоянно обновлялась и не теряла своей жидкотекучести. Алюминия в двуокись титана по количеству можно вводить на 10÷50% меньше стехиометрического состава. Флюсующих добавок можно вводить от 1 до 10%, которыми может являться CaF2.
В реакции восстановления титана источником углерода служит электрод, который одновременно является анодом.
На первой стадии процесса производится расплавление электролита в кристаллизаторе, за счет графитового электрода электролит расплавляют в отдельной емкости, а затем заливают в кристаллизатор. В качестве электролита может служить CaF2, CaCl2 (как и в первом аналоге), а так же их сочетание или любой другой, применяемый для электролиза титановых сплавов. Через патрубок 8а в плавильном пространстве создается вакуум в пределах от 104 до 10-4Па. Между кристаллизатором и электродом зажигается дуга и в полость электрода, за счет механизма 12, подается реакционная шихта 7. В качестве подающего механизма 12 может служить шнек, поршень, механизм свободной засыпки, а так же любой другой механизм, обеспечивающий регулируемую и бесперебойную подачу шихты.
Для того чтобы в камере плавления можно было создать глубокий вакуум, который смещает реакцию восстановления в сторону производства титана, кристаллизатор изготовлен цельным, не разборным. Для того чтобы значительный объем образующего шлака над кристаллизуемым титаном не сливать в другую емкость и при этом не удлинять электрод, кристаллизатор выполняется в виде конуса или полушария. При этом, если одна нижняя половина кристаллизатора будет заполнена металлом, то верхняя половина кристаллизатора сможет в себя вместить шлака, по объему в 2÷3 раза больше объема восстанавливаемого металла. Кроме того, в установке применяется гофрированная труба 11, обеспечивающая глубокий вакуум, через которую передается движение на электрод, за счет механизмов 10. В качестве механизмов могут выступать пневмо-, гидро- или винтовые приводы. Бункер 13 после смешивания и засыпки в него реакционной шихты герметично закрыт. Компановка предлагаемой установки за счет своей простоты и минимального применения механизмов и деталей способна выдержать как глубокий вакуум, так и высокое давление и быть достаточно простой и надежной в работе.
Скорость подачи шихты зависит от силы тока и напряжения на электроде. Для протекания более полной реакции электролиза напряжение на электроде нужно держать в пределах 3 В, как в Кембриджском процессе. Оптимально скорость подачи шихты подбирается так, чтобы максимально освободить титан от кислорода, при этом, чтобы было использовано минимальное количество восстановителя, которым в данной реакции будет служить Аl и С, при максимальной скорости производства металла.
В данном случае восстановление титана пойдет по реакциям вышеописанным во втором аналоге. Дополнительные реакции будут протекать при образовании в электролите глинозема Аl2О3 за счет реакции восстановления титана. Но за счет протекания электролизных реакций в этой зоне будет протекать процесс восстановления алюминия:
На катоде Al3+(ж)+3 →Аl(тв)
На аноде 2O2- → O2(г)+4
2С(тв)+O2→2СО(г)
Из реакции будет удаляться кислород и углерод, а в реакцию повторно будет возвращаться основной металл-восстановитель - алюминий. Данные реакции способствуют повышению выхода восстанавливаемого титана и снижению количества загружаемого алюминия. Повышение восстанавливаемости окислов титана возможно путем вывода из сферы реакции образующегося глинозема, например введением в электролит криолита, который растворяет образующийся глинозем.
Дополнительно увеличение концентрации восстанавливаемого диоксида титана будет способствовать сдвигу равновесия реакции вправо. Это экономически целесообразно в связи с более низкой стоимостью двуокиси титана по сравнению со стоимостью порошкового алюминия.
При сравнении Кембриджского способа с предлагаемыми можно отметить следующее:
1. Скорость восстановления титана в предлагаемом способе будет значительно выше за счет сочетания металлотермического, плазмохимического и электрохимического восстановления, так как в Кембриджском процессе участвует только один электрохимический процесс восстановления титана.
2. Себестоимость продукции так же будет меньше, так как процесс не требует дополнительного производства для изготовления электродов.
При сравнении предлагаемого способа со вторым аналогом, где титан производят алюмотермией с помощью дополнительного экзотермического тепла от вводимых термитных добавок, можно отметить следующее:
1. Скорость производства титана в предлагаемом способе, его чистота, количество будет значительно выше, так как он не использует термитных добавок, по сравнению со вторым аналогом.
2. Процесс управляем по ходу выплавки титана, в отличии от второго аналога.
3. Себестоимость его ниже, так как не используются термитные добавки.
Аналогично данной схемы раскрытия работы способа на примере восстановления TiO2 алюминием пойдут и другие процессы, где будут восстанавливаться металлы, описанные в других аналогах и прототипе, а именно:
1. При восстановлении циркония из тетрафторида циркония кальцием в предлагаемом способе при их засыпке в бункер флюсующих добавок не требуется, так как при протекании реакции образуется СаF2, который и является электролитом. В отличие от третьего аналога, в предлагаемом способе футеровка и предлагаемый прогрев не требуются. Кроме того, не требуется добавка йода, повышающего термичность, но загрязняющая расплав. В дальнейшем, если не вводятся металлические добавки, не требуется дополнительного дугового переплава и т.п. Поэтому предлагаемый способ намного более прост и производителен, при этом обеспечивает более высокое качество металла при более низкой себестоимости.
2. При восстановлении предлагаемым способом циркония из фторцирконат калия натрием картина восстановления и преимущества будет той же, что описана выше.
3. При восстановлении Ti и Zr новым способом, по сравнению с прототипом из TiO2 и ZrO2 кальцием, преимущества будут теми же. Поэтому предлагаемый способ и устройство для его реализации в производстве металлов, особенно химически активных, могут считаться полезными для широкого внедрения.
Как можно отметить, за последние годы к возможности восстановления титана из оксидного сырья резко возрос интерес, так как хлорный метод достаточно трудоемок и экологически достаточно опасен. С другой стороны, за прошедшие полвека далеко изменились технологии производства титана, о чем говорят вновь появившиеся способы электрохимического получения титана из оксидного сырья, такие как кембриджский процесс, OS- процесс, ОКАВЕ процесс и другие.
В отличие от металлотермического восстановления титана за счет магния, кальция, алюминия, эти способы напрямую пытаются решить задачу получения титана из его оксидов. В связи с этим данные способы становятся непроизводительными, энергопотребляющими и трудоемкими.
В предлагаемом изобретении способ восстановления титана использует комплексный эффект за счет применения металлотермических, плазмохимических и электрохимических процессов. Их эффективность усиливается введением в реакцию вакуума или давления инертного газа. Оборудование, которое используется для реализации способа, по сложности подобно оборудованию для вакуумно дугового переплава (ВДП). Переплав готового слитка на печи ВДП удорожает его себестоимость только на 2%. В данном случае это удорожание будет точно таким же. При хлормагниетермическом восстановлении титана методом Кроля это удорожание составляет 26%. То есть полученный металл для его последующей очистки можно переплавлять 13 раз, чтобы достигнуть той же себестоимости.
Экономическая эффективность производства титана на первой стадии: для производства первичного титана требуется: Al - 1 часть; TiO2 - 3 части; С - 0,2 части; CaF2 - 0,5 части.
Цена: Al - 4,8 $/кг; ТiO2(95%) - 0,4 $/кг; С - 0,2 $/кг; CaF2 - 0,2 $/кг.
Стоимость одного килограмма шихты в смеси будет стоить 1,3 $/кг. При производстве примем выход годного 70%, который состоит из 67% Ti и 10% Al, следовательно, на 1 кг полученного продукта будет затрачено материала на сумму 1,69 $. Данный продукт без какой-либо очистки можно применить взамен ферротитана и ферроалюминия при производстве высококачественных сталей. При стоимости ферротитана 70%, равного на сегодня 7,5 $/кг, стоимость 67% Ti и 10% Al могут составить ту же сумму, так как в этом сочетании и титан, и алюминий для стали являются активными раскислителями. Общие затраты, энергия, работа, зарплата и т.п. расходы на 1 кг достигают 0,2 $/кг. Поэтому общие затраты на продукцию будут 1,89 $/кг при конечной ее цене 7,5 $/кг, т.е. общая прибыль составит 5,61 $/кг. Данная прибыль достаточно неплохая, если учесть, что в процессе участвует только одно оборудование. Для увеличения прибыли полученные шлаки идут в повторную переработку за счет электролиза алюминия, а так же извлечения остального рутила и флюса.
Литература
[1]. Научно-технический журнал "Титан", №2(19), 2006 г., стр.9-10.
[2]. А.Н.Зеликман. Металлургия тугоплавких редких металлов, - Москва: Из-во "Металлургия", 1986, стр.414-419.
[3]. Ю.Л.Плинер, С.И.Сучильников, Е.А.Рубинштейн. Алюминотермическое производство ферросплавов и лигатур. - Москва: "Государственное научно-техническое из-во литературы по черной и цветной металлургии", 1963 г., стр.28, 33.
1. Способ получения химически активных металлов, в