Способ коррекции инсулинорезистентности при метаболическом синдроме
Иллюстрации
Показать всеИзобретение относится к медицине, а именно к терапии и эндокринологии, и касается коррекции инсулинорезистентности при метаболическом синдроме. Для этого вводят крусмарин, содержащий омега-3 жирные кислоты и алкилдиглицериды, по 5-6 капсул 3 раза в сутки в течение 15 дней с последующим перерывом приема препарата на 15 дней курсом 1 год. Введение крусмарина в разработанном режиме обеспечивает эффективную коррекцию инсулинорезистентности и отсутствие побочных эффектов у данной группы больных за счет нормализующего синергетического действия омега-3 жирных кислот и алкилдиглицеридов на углеводный и липидный обмен. 4 табл.
Реферат
Изобретение относится к медицине, а именно к восстановительным технологиям, применяемым в терапии.
В научной литературе метаболический синдром (МС) все чаще обсуждается с позиций риска таких серьезных заболеваний, как сахарный диабет 2 типа и атеросклероз [19, 23]. Комплекс многих патобиохимических и патофизиологических факторов, характеризующих МС, обусловливает чрезвычайно высокий суммарный риск развития ИБС и других заболеваний, связанных с атеросклерозом [14].
МС, включающий ожирение, артериальную гипертонию, дислипидемию, в конечном итоге ведет к развитию атеросклеротических заболеваний, сахарного диабета [14]. Согласно резолюции Международной федерации диабета (2005) к критериям МС отнесены также нарушения в системе гемостаза и хроническое субклиническое воспаление [5, 6]. Согласно современным научным взглядам на механизм развития МС объединяющей основой всех его проявлений является первичная инсулинорезистентность (ИР) и сопутствующая системная гиперинсулинемия, запускающая каскад патологических реакций [20].
Развитию инсулинорезистентности способствуют как генетические факторы, так и влияние внешних факторов, среди которых в первую очередь следует выделить формирование ожирения (особенно андрогенного). Хроническая гиперинсулинемия ведет к развитию артериальной гипертонии. Атеросклероз у больных с инсулинорезистентностью развивается в 3-5 раз чаще, чем у пациентов без нарушений углеводного обмена. При наличии инсулинорезистентности исчезает вазодилатирующий эффект инсулина. Решающую роль при этом может играть нарушение синтеза окиси азота в результате повышения концентрации свободных жирных кислот, что часто имеет место при ожирении. Более того, показано, что гиперинсулинемия непосредственно способствует катаболизму ЛПВП. Таким образом, развитие ИР и гиперинсулинемии сопровождается развитием дислипидемии, характеризующейся повышением концентрации ЛПОНП (триглицеридов) и понижением концентрации ЛПВП в плазме крови. Данная дислипидемия является атерогенной.
На основании обобщенных данных многочисленных исследований сделан вывод, что в результате понижения чувствительности клеток тканей к инсулину или ИР могут развиваться гиперинсулинемия, нарушение толерантности к глюкозе, повышение уровня триглицеридов (ТГ) и понижение уровняв липопротеинов высокой плотности (ЛПВП) в плазме крови, а также артериальная гипертония.
При этом, учитывая патогенетическую роль инсулинорезистентности в развитии МС, основные мероприятия должны быть направлены на повышение чувствительности тканей к инсулину. Главная цель, которая преследуется при лечении больных с метаболическим синдромом, - это максимальное снижение общего риска сердечно-сосудистой заболеваемости и летальности.
Предполагается, что улучшение чувствительности к инсулину и уменьшение хронической гиперинсулинемии у лиц без клинических проявлений синдрома способны предотвратить клиническую манифестацию синдрома, а при развившихся клинических проявлениях снизить тяжесть их течения.
На сегодняшний день не разработана так называемая панацея, влияющая на инсулинорезистеность и связанные с ней метаболические нарушения. Современная фармакотерапия пока не имеет эффективных препаратов, при помощи которых можно решать проблему метаболического синдрома, поэтому чаще всего используются лекарственные средства, действие которых направлено на снижение уровня холестерина в крови, артериального давления (АД), подавление аппетита, тогда как центральный механизм МС - нарушение инсулинрецепторного взаимодействия на клеточной мембране - плохо поддается фармакокоррекции [13]. Кроме того, практически все применяемые для этой цели лекарственные средства в той или иной степени обладают побочным действием, привыканием к препарату, «синдромом отмены» и др., экономически далеко не всегда доступны для большей части населения.
Известно, что восстановить чувствительность тканей к инсулину можно путем немедикаментозных методов лечения (коррекция образа жизни, снижение массы тела и висцерального жира в том числе), но при этом не всегда удается компенсировать нарушения липидного и углеводного обменов и уменьшить инсулинорезистентность и гиперинсулинемию. Поэтому при лечении больных с метаболическим синдромом активно применяются медикаментозные препараты, способные воздействовать на инсулинорезистентность.
Известен способ предотвращения развития МС, наиболее часто применяемый в медицинской практике, включающий стандартные рекомендации относительно здорового образа жизни и прием метформина (850 мг дважды в день [22]. Но применение этого способа не всегда является безопасным. Так, лечение метформином начинают с дозы 500 мг в сутки потому, что назначение сразу большой дозы может вызвать развитие диспептических явлений, в частности металлический вкус во рту, тошноту. Одним из основных побочных эффектов бигуанидов является лактатацидоз. Противопоказаниями к назначению метформина являются: нарушение функции почек (снижение клиренса креатинина ниже 50 мл/мин, концентрация креатинина в крови >132 ммоль/л у мужчин и >123 ммоль/л у женщин); гипоксические состояния любой этиологии; злоупотребление алкоголем. Сердечная недостаточность является официальным противопоказанием для назначения метформина. [7]. Гипогликемические препараты (метформин), наряду со снижением инсулинорезистентности, влияют и на уровень глюкозы, а это может привести к гипогликемическому состоянию, что нежелательно у больных с нарушением толерантности к глюкозе без инсулиннезависимого сахарного диабета [4].
Безусловно для коррекции МС необходимо применение гипотензивной, гиполипидемической терапии, препаратов, улучшающих функцию эндотелия (антиоксиданты, L-аргинин и др.), а также методов, направленных на снижение избыточной массы тела. Однако у инсулинрезистентных больных использование гипотензивных, антиангинальных и других сердечно-сосудистых препаратов в определенной степени проблематично.
Для коррекции липидного состава мембран и активности тромбоцитов при метаболическом синдроме больным на фоне индивидуально подобранной гипокалорийной диеты вводят симвастатин и небиволол. При этом обеспечивается оптимизация внутрисосудистой активности тромбоцитов за счет нормалицации липидного состава их мембран и повышения уровня антиоксидантной защиты (Патент РФ №2272622). Лечение длится 6 месяцев. Для усиления антиоксидантной защиты тромбоцитов у больных артериальной гипертонией с МС назначают индивидуально подобранную гипокалорийную диету, дозированные физические нагрузки и препараты вальсартан и триматазидин, это позволяет избежать осложнений со стороны гемостаза (Патент РФ №2331416). Нормализовать липидный состав мембран тромбоцитов позволяет сочетанное применение пиоглитазона, ирбесартана и леркандипина при дозированных физических нагрузках и гипокалорийной диете в течение 3 месяцев лечения (Патент РФ №2345766).
При лечении и профилактике преддиабетического состояния при МС или сахарном диабете назначают препараты из антидиабетического ряда. Ведется активный поиск средств и способов профилактики нарушений, связанных с инсулинорезистентностью, дислипидемией и последствиями этих нарушений. Так, известен способ профилактики или лечения преддиабетического сотояния, метаболического синдрома-Х или сахарного диабета у больных с эндогенными нарушениями обмена веществ, инсулинорезистентностью, дислипидемией и эндокринными нарушениями, согласно которому больному вводят терапевтически эффективное количество синергичного фармацевтического состава, представляющего собой композицию из противодиабетического или антилипидемического активного агента и производного гидроксамовой кислоты (Патентная заявка №2004105149).
В настоящее время известные способы коррекции МС, как правило, направлены на конкретное патологическое звено, нормализацию каких-то единичных показателей нарушения обмена веществ.
Например, для коррекции уровня оксида азота в крови больных МС, при отсутствии вазодилатирующего эффекта инсулина, предложен способ, включающий применение индивидуально подобранной гипокалорийной диеты, дозированных физических нагрузок и препаратов метформин, нитрендипин и эпросартан в определенной дозировке, при этом синтез окиси азота в сосудистой стенке нормализуется через 6 месяцев.(Патент РФ №2338520). Также известен способ эффективной коррекции уровня оксида азота в крови больных метаболическим синдромом, согласно которому в течение 4 месяцев осуществляют терапию, включающую индивидуально подобранную гипокалорийную диету, а также введение препаратов метформин, эпросартан и розувастатин. Такой комплекс немедикаментозной терапии и конкретных препаратов при эмпирически определенной продолжительности лечения обеспечивают снижение риска тромботических осложнений у больных МС (Патент РФ №2333750). Для нормализации функции тромбоцитов, нивелирования признаков тромбоцитопатии и уменьшения тромботических осложнений при МС, сопровождающемся АГ, применяют лекарственный комплекс с доминирующей дозой метформина и другими препаратами, при сочетании с гипокалорийной диетой (Патент РФ №2339383, Патент РФ №2338522).
При нарушениях в синтезе жирных кислот для снижения риска тромбообразования при МС за счет быстрой и эффективной нормализации обмена арахидоновой кислоты в тромбоцитах больных назначают гипокалорийную диету и применение метформина в сочетании с аторвостатином, нитрендипином и дуовитом (патент РФ №2330652). Нормализовать обмен арахидоновой кислоты за 4 месяца лечения можно путем нормализации выработки тромбоксана в тромбоцитах больных АГ с МС (Патент РФ №2337681).
Как видно почти во всех способах лечения этого фактора МС применяют метформин. Однако, не доказано достоверное снижение уровня АГ и гиперлипидемии на фоне терапии метформином. Противопоказанием к назначению метформина являются гипоксические состояния любого генеза (шок, сепсис, кровопотеря, выраженная дыхательная недостаточность II-III ст., сердечно-сосудистая недостаточность II-III ст., выраженные нарушения печеночного и азотистого обмена, хронический алкоголизм и др.). В настоящее время такие препараты не могут широко применяться как лечебные и профилактические средства при МС.
Тем не менее, вопрос поиска новых препаратов и их применение пациентами при отсутствии клинических проявлений сахарного диабета находится на стадии разработки.
Известен способ лечения инсулинорезистентности диабета взрослых и метаболического синдрома и связанных с ним осложнений, включающий внутривенное введение терапевтически эффективного количества липосомальной суспензии липопротеиновых маленьних однослойных пузырьков (SUVs), содержащих преимущественно фосфоллипиды из группы, включающей фосфатидилхолин, фосфатидилглицерин и фосфатидилсерин; липопротеиновые SUVs дополнительно содержат сфингомиелин, холестерин или другие стерины в количестве меньше, чем 40 мол.%. (Патентная заявка №2005115956).
Как уже отмечалось, из немедикаментозных методов профилактики и лечения МС на настоящее время назначают диету, в том числе с увеличением потребления моно- и полиненасыщенных жирных кислот. Естественен интерес к поиску новых альтернативных подходов с использованием природных ресурсов.
С этих позиций наиболее обоснована восстановительная технология на основе липидов морских гидробионтов, которые привлекают пристальное внимание медицины как источники биологически активных веществ, в первую очередь омега-3 полиненасыщенных жирных кислот (ПНЖК омега-3), которые обладают гиполипидемическим, гипокоагуляционным, антигипертензивным, антивоспалительным эффектами [15,17,20], доказано их мембранотропное действие [2]. Подобный широкий спектр клинико-фармакологических эффектов чрезвычайно важен при первичном и вторичном МС, в том числе у лиц с высоким риском сердечно-сосудистых осложнений, когда требуется воздействие на целый ряд патофизиологических процессов.
Рыбные жиры богаты ПНЖК омега-3, в основном это эйкозапентаеновая и докозагексаеновая кислоты. Большим количеством клинических наблюдений во всем мире установлено положительное влияние ПНЖК омега-3 на состав липидов крови, на синтез эйкозаноидов (простагландинов, тромбоксанов, лейкотриенов), регулирующих процессы свертываемости крови, сосудистый тонус, иммунный статус организма и т.д.
В настоящее время широко используется препарат «Омакор», рекомендуемая доза приема 1-4 г в сутки с гиполипидемической целью. Не определено его влияние на инсулинорезистентность При этом гиполипидемический эффект достигается при приеме не менее чем через 6 месяцев, данный препарат рекомендуют принимать длительно и непрерывно, хотя он обладает массой побочных эффектов и требует наблюдения специалистами [10]. Кроме того, имеются сведения о том, что злоупотребление, входящего в Омакор витамина Е, может быть опасно. Это объясняется тем, что в больших дозах витамин Е начинает действовать как свободный радикал, повреждая протеины и липиды, которые в низких дозах он защищает [16]. Из отечественных препаратов широко используется препарат эйконол в капсулах по 1,0 г, который принимают 4 раза в день [11].
Если биологические свойства ПНЖК омега-3 широко изучены и эффективность их доказана при многих заболеваниях, то лечебный эффект еще одного полезного компонента рыбьего жира - алкилдиглицеридов (АДГ), обладающих антиокислительными и иммуномодулирующими свойствами, мало изучен. АДГ вовлечены в формирование иммунной системы млекопитающих с самых первых дней жизни и являются одним из главных факторов, поддерживающих ее нормальное функционирование в течение всего периода дальнейшего существования [21].
У медицинских специалистов и ученых не вызывает сомнения то, что воспалительный процесс является патогенетическим звеном МС. В настоящее время нет препаратов, воздействующих именно на это звено при развивающемся МС. Известно, что липопротеиды низкой и очень низкой плотности проявляют аутоиммунные свойства - индуцируют образование антител, а также образование продуктов распада структур артериальной стенки в результате ее атеросклеротического повреждения, что приводит к развитию иммунного ответа. Принимая во внимание сказанное о роли алкилдиглицеридов, а также аутоиммунные свойства липопротеидов низкой и очень низкой плотности, использование АДГ при МС является целесообразным, так как оказывают влияние не только на уровень холестерина в крови, но и на цитокины, иммунокомпетентные клетки, что увеличивает ценность морских липидов при данной патологии.
Использование препаратов, содержащих одновременно ПНЖК и АДГ, раскрывает широкие возможности перед восстановительной медициной в отношении пациентов, страдающих МС.
Известно, что в жире печени командорского кальмара содержится до 50% АДГ, однако применять его в чистом виде проблематично из-за избыточной нагрузки на организм.
Представителями препаратов, содержащих помимо ПНЖК омега-3, также и АДГ, являются преимущественно препараты иностранных производителей, например биологически активная добавка «Жир акулы» производства Coral Club International. Известен препарат - БД «Акулайф», представляющий собой натуральный жир печени глубоководных акул. В его состав входят АДГ - алкоксиглицериды, а также полиненасыщенные кислоты омега-3 и иные важные для здоровья вещества. Препарат выпускается в капсулах, масса содержимого капсулы 500 мг, в том числе: алкоксиглицеридов не менее 100 мг/капс; полиненасыщенных жирных кислот омега-3 не менее 15%. Алкоксиглицериды - природные соединения, стимулирующие иммунную систему, поддерживают на нормальном уровне воспроизведение лейкоцитов, тромбоцитов и антител, способствуют синтезу макрофагов, являются сильнейшими антиоксидантами, воздействуют на свободные радикалы не только на уровне клетки, но и на внутриклеточном (http://www.olisalvin.ru/products/aculife/).
Установлено, что при экспериментальной дислипидемии оптимальный биотропный эффект оказывают липиды из гепатопанкреаса краба, содержащие равные доли ПНЖК омега-3 и АДГ [8].
Российскими исследователями создано средство, обладающее, наряду с гипокоагуляционными и антиоксидантными, липидкорригирующими свойствами. Средство, полученное из гепатопанреаса камчатского краба, содержит ПНЖК омега-3 и АДГ (патент №2302248) [9].
Авторы настоящей заявки не нашли прямых сведений о применении АГД-содержащих препаратов для коррекции инсулинорезистентности при метаболическом синдроме.
Известен российский препарат БАД «Крусмарин», который изготавливают из печени краба (http://www.grinmed.ru). Препарат рекомендован к применению в случаях заболеваний сердечно-сосудистой системы, билиарной системы, дисфункции нервной системы и содержит ПНЖК омега-3 не менее 8% (http://www.grinmed.ru). В другом источнике информации в описании препарата указано, что в составе этого препарата содержание ПНЖК омега-3 составляет не менее 15%.(http://www.biomar). Наличие в составе препарата АДГ не упоминается.
Авторы настоящего изобретения исследовали БАД «Крусмарин» и установили, что наряду с ПНЖК омега-3 в его состав входит АДГ. При этом эти ингредиенты в БАД содержатся в количестве 10% каждый.
Один из основных аспектов, который ранее не изучался при проведении клинических и экспериментальных исследований БАД «Крусмарин», -это его воздействие на гиперинсулинемию.
Применение антиоксидантов рассматривается обычно с позиций профилактики сердечно-сосудистых заболеваний и сахарного диабета. Преимущественно исследования касаются витаминов и как профилактическое средство в дополнение к другим лекарственным средствам [1, 12]. Несмотря на то, что антиоксиданты имеют патогенетическое значение в профилактике гиперлипидемии, гиперинсулинемии, развития сахарного диабета и его осложнений [3, 18].
Авторы не нашли прямых аналогов способу коррекции инсулинорезистенции при метаболическом синдроме.
Задачей изобретения является разработка способа коррекции инсулинорезистентности при метаболическом синдроме на основе источников природного происхождения, позволяющего нивелировать изменения углеводного, липидного обменов, показатели воспаления и антиоксидантной защиты.
Для достижения поставленной задачи, согласно изобретению по способу коррекции инсулинорезистентности при метаболическом синдроме, пациенту назначают препарат «Крусмарин» в суточной дозировке, соответствующей содержанию полиненасыщенных жирных кислот омега-3 в количестве 0,5 г и содержанию алкилдиглицеридов в количестве 0,5 г, такая дозировка достигается при приеме 5-6 капсул препарата по 0,3 г 3 раза в сутки в течение 15 дней с последующим перерывом приема препарата на 15 дней, курсом 1 год с периодическим лабораторно-клиническим контролем.
При этом технический результат состоит в том, что коррекцию нарушений углеводно-инсулинового и липидного гомеостаза, осуществляют препаратом «Крусмарин», а ПНЖК омега-3 и АДГ, входящие в его состав, действуют как синергисты. Это позволяет снизить их суточную дозировку для исключения негативных проявлений, к которым может привести передозировка каждого из ингредиентов в отдельности; использование изобретения позволяет также снизить воспалительные проявления при МС.
Исследования проводились на базе клиники Владивостокского филиала НИИ медицинской климатологии и восстановительного лечения РАМН.
Обязательным условием изучения лечебной ценности суммарных фракций липидных препаратов, содержащих ПНЖК омега-3 и АДГ, стало определение эффективной и безопасной дозировки приема препарата.
Исследования БАД «Крусмарин» показали, что наряду с ПНЖК омега-3, указанными в публикациях, в его состав входят также триглицериды, АДГ, альфа-токоферол, бета-каротин (табл.1).
| Таблица 1 | |
| Состав липидов печени камчатского краба | |
| Фракционный состав | Содержание |
| Триглицериды | 80 г/100 г |
| АДГ | 10% |
| Альфа-токоферол | 0,129 г/100 г |
| Бета-каротин | 0,003 г/100 г |
| Общее содержание ПНЖК омега-3 | 10% |
| Другие | ~5 |
В результате клинических исследований БАД «Крусмарин» получены данные, свидетельствующие о его влиянии на снижение уровня инсулина крови и инсулинорезистентности у пациентов с метаболическим синдромом, принимающих препарат согласно разработанной авторами схеме лечения.
Для разработки способа в группу на условиях добровольного информированного согласия вошли 28 пациентов с МС, контрольную группу составили 24 человека без компонентов МС.У пациентов обеих групп были исключены заболевания сердечно-сосудистой системы, сахарный диабет.
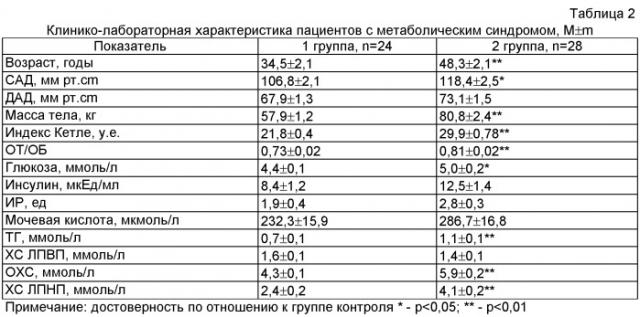
Для диагностики МС использовались критерии, разработанные Комитетом экспертов Всероссийского общества кардиологов (2007) [5]. Клиническая характеристика пациентов представлена в таблице 2.
Клинико-лабораторное обследование включало определение уровня мочевой кислоты, глюкозы, инсулина крови, оценивалось состояние липидного спектра. В сыворотке крови определяли содержание триглицеридов (ТГ), холестерина липопротеидов высокой плотности (ХС ЛПВП), общего холестерина (ОХС), мочевой кислоты, глюкозы (фотометр РМ 750, Германия), аполипопротеинов А1 (апо А1) и В (апо В), инсулина (спектрофотометр MQ 200R Power Wave XS, Biotech, США). Рассчитывались показатели холестерина липопротеидов низкой и очень низкой плотности (ХС ЛПНП и ХС ЛПОНП). Инсулинорезистентность (ИР) оценивалась по критерию НОМА по формуле:
где Ин - инсулин натощак (мкЕд/мл); Гл - глюкоза натощак (ммоль/л). Уровень индекса НОМА >2,7 оценивался как повышенный.
Для оценки состояния свертывающей и антисвертывающей системы определяли уровень фибриногена, протромбиновый индекс (ПТИ) и активированное частичное тромбопластиновое время (АЧТВ); скрининг в системе протеина С проводили с помощью парус-теста в плазме крови (полуавтоматический коагулометр KD1 Amelung, Германия).
Уровень липопероксидации оценивали по уровню конечного продукта перекисного окисления липидов (ПОЛ) - малонового диальдегида (МДА) в эритроцитах крови. Для характеристики системы антиоксидантной защиты измеряли содержание восстановленного глутатиона (ГЛ) крови, активность глутатионпероксидазы (ГП) и глутатионредуктазы (ГР), определяли интегральный показатель антиоксидантной активности (АОА) в плазме крови (спектрофотометр UNICO, модель UV-2800, США). Уровень ФНО-α в сыворотке крови определяли методом иммуноферментного анализа (спектрофотометр MQ 200R Power Wave XS, Biotech, США; тест-системы фирмы «BD Biosciences», США). В качестве сравнения использовали значения показателей у лиц в контрольной группе, не имеющих компонентов метаболического синдрома.
У больных в группе наблюдения были зафиксированы высокие цифры артериального давления (р<0,01), достоверно отличалась от группы контроля масса тела, соответственно - индекс Кетле, с инсулинорезистентностью и гипергликемией или сниженной толерантностью к глюкозе было 9 человек. Все больные из 2 группы имели дислипидемию.
Всем пациентам из группы наблюдения назначали биологически активную добавку «Крусмарин» (свидетельство о госрегистрации №77.99.23.3.У.8111.7.05 от 20.07.05, ТУ 9281-007-00038155-05) по схеме: прием в течение 15 дней по 5-6 капсул 0,3 г 3 раза в день во время еды (суточная доза составляет 0,5 г ПНЖК омега-3 и 0,5 г АДГ) с перерывом 15 дней, длительность курса - 1 год.
Показания: инсулинорезистентность, изменение липидного спектра крови в сочетании с нарушением глюкозо-инсулинового гомеостаза в виде нарушения толерантности к глюкозе, гиперинсулинемии, нарушения в системе липопероксидации.
Противопоказания: аллергические реакции на компоненты препарата, непереносимость рыбного жира; хронический панкреатит в стадии обострения, хронический холецистит в стадии обострения.
Наблюдение в динамике проводилось 1 раз в 3 месяца, включало осмотр, функциональное (электрокардиография, ультразвуковое исследование печени, желчного пузыря и поджелудочной железы по показаниям) и клинико-лабораторное исследование. Контрольное обследование включало не только показатели липидного и углеводного гомеостаза, но и определение уровней мочевой кислоты крови, фибриногена, С-реактивного белка, фактора некроза опухоли-α (ФНО-α), аминотрансфераз. Эти показатели определялись с целью определения влияния крусмарина на пуриновый обмен, гемостаз и скрытую воспалительную реакцию. С учетом возможного побочного влияния крусмарина на функцию печени проводились функциональные печеночные пробы.
В результате длительного приема БАД Крусмарин, полученного из липидов гепатопанкреаса краба, содержащего ПНЖК омега-3 и 1-O-алкил-диацилглицерины, зарегистрирована динамика измененных метаболических показателей. Уже через 3 месяца приема препарата отмечалась тенденция к снижению уровня триглециридов (ТГ) (от 1,7±0,1 до 1,7±0,2 ммоль/л, р<0,05) и достоверное увеличение интегрального показателя антиоксидантной активности (АОА) (от 56,1±2,7 до 69,0±3,3%, р<0,05), что соответственно привело к снижению индекса МДА/АОА (от 0,15±0,01 до 0,11±0,01, p<0,01) и свидетельствует о снижении выраженности оксидативного стресса (табл.3).
Через 6 месяцев наблюдения зарегистрирована более выраженная положительная динамика контролируемых показателей: произошло достоверное снижение уровней ТГ и аполипопротеина-В (АпоВ), увеличение холестерин липопротеидов высокой плотности (ХС ЛПВП), тенденция к снижению холестерин липопротеидов низкой плотности. Вышеперечисленные данные свидетельствуют о нормализующем влиянии приема в течение 6 месяцев крусмарина на липидный гомеостаз у пациентов с метаболическим синдромом.
Через 1 год приема крусмарина отмечалась отчетливая положительная динамика большинства контролируемых показателей, свидетельствующая о влиянии на основные звенья метаболического синдрома. У большинства пациентов за время наблюдения снизилась масса тела на 3-8 кг, что отразилось на среднем значении массы тела и индекса Кетле. Зарегистрировано снижение уровней инсулина (с 12,5±1,4 до 9,2±0,3 ммоль/л, р<0,05), мочевой кислоты (286,7±16,8 до 206,9±14,8 мкмоль/л, р<0,01) и ФНО-α (от 5,9±0,1 до 4,0±0,1 пг/мг, р<0,01). Липидмодулирующее действие выразилось в нормализации показателей общего холестерина (ОХС) (с 5,9±0,2 до 5,1±0,2 ммоль/л, р<0,01), ТТ (с 1,7±0,1 до 0,9±0,1 ммоль/л, р<0,01), ХС ЛПНП (от 4,1±0,2 до 3,4±0,2 ммоль/л, р<0,01), Апо-В (от 0,8±0,1 до 0,67±0,1 мг/дл, р<0,01) и увеличении ХС ЛПВП (от 1,2±0,1 до 1,7±0,1 ммоль/л, р<0,01). Крусмарин оказал влияние на процессы липопероксидации. Это выразилось в повышении уровня интегрального показателя АОА с 56,1±2,7 до 78,5±2,4% (р<0,01) и нормализации соотношения уровней МДА/АОА (р<0,01).
За время наблюдения у большинства наблюдаемых не только нивелировалась выраженность метаболического синдрома, но и уменьшилось количество компонентов, следовательно, у данных пациентов добились исчезновения или уменьшили выраженность основных проявлений метаболического синдрома. Так как по определению экспертов Всероссийского научного общества кардиологов (2007) основанием для диагностики метаболического синдрома служит наличие у пациента центрального ожирения и 2 из дополнительных критериев.
Представленные результаты позволяют говорить, что данный способ, основанный на приеме БАД «Крусмарин», полученного из природного сырья - липидов гепатопанкреаса краба, содержащего ПНЖК омега-3 и 1-O-алкил-диацилглицерины, является патогенетическим методом коррекции метаболического синдрома. Проведение своевременного лечения выявленных изменений липидного и углеводно-инсулинового обменов возможно с использованием БАД «Крусмарин», что, в свою очередь, позволяет улучшить качество жизни пациентов, будет способствовать снижению сердечно-сосудистой заболеваемости и смертности в России.
Результативность заявляемого способа подтверждается результатами проведенного в институте клинического исследования, которые отражены в следующих примерах.
Пример 1
Пациентка, 52 лет, обратилась с жалобами на избыточный вес, головокружения.
При обследовании: гиперстенический тип телосложения, подкожно-жировая клетчатка развита избыточно. Вес 78 кг, рост - 1,56 м, ИМТ - 32,1 кг/м2. ОТ - 108 см, ОБ-112 см, ОТ/ОБ - 0,96. Ожирение носит центральный характер. АД - 100/60 мм рт.ст.
| Таблица 3 | ||
| Результаты лабораторных исследований | ||
| Референтный диапазон | ||
| Общий холестерин | 6,4 ммоль/л | 3,1-5,2 ммоль/л |
| Триглицериды | 2,2 ммоль/л | 0,5-1,7 ммоль/л |
| ХС ЛПВП | 0,9 ммоль/л | >1,0 ммолъ/л |
| Глюкоза | 4,4 ммоль/л | 3,8-6,1 ммоль/л |
| Инсулин | 29,4 мкЕд/мл | <18 мкЕд/мл |
| ИР по НОМА | 5,75 | >2.27 |
| Мочевая кислота крови | 285,6 мкмоль/л | 142-339 мкмоль/л |
| МДА | 6,2 мкмоль/гНb | 7,4- 7,9 мкмоль/гНb |
| АОА | 30,8% | 56-64% |
Обсуждение
Пациентка поступила с жалобами только на избыточный вес и головокружения. При осмотре выявлено ожирение I стадии с преимущественным отложением жировой массы в абдоминальной области. Абдоминальному ожирению часто сопутствуют метаболические нарушения, которые были выявлены при биохимическом анализе крови - гиперхолестеринемия, гипертриглицеридемия, повышение гликемии натощак, инсулинорезистентность и гиперинсулинемия.
Этот клинический комплекс (абдоминальное ожирение, дислипидемия по атерогенному типу с повышением уровней атерогенных и снижением антиатерогенной фракций) свидетельствует о наличии метаболического синдрома. Основой этого синдрома является гиперинсулинемия и инсулинорезистентность, что и выявлено у пациентки.
Был рекомендован Крусмарин по схеме: прием в течение 15 дней по 5-6 капсул 0,3 г 3 раза в день во время еды (суточная доза составляет 0,5 г ПНЖК омега-3 и 0,5 г АДГ) с перерывом 15 дней, длительность курса - 1 год. Через 3 месяца курсового приема БАД самочувствие пациентки улучшилось, она потеряла в весе 1,5 кг, отметилась тенденция к нормализации липидного обмена, нормализовался уровень инсулина. Через 1 год наблюдения, в течение которого пациентка принимала Крусмарин, потеря веса составила 6 кг, уровни глюкозы крови, триглицеридов и ХС ЛПВП, инсулина и ИР по НОМА достигли целевых значений, уровни ПОЛ-АОЗ нормализовались.
Пример 2. Приводим историю болезни пациента Л., 39 лет, наблюдавшегося в клинике НИИ медицинской климатологии и восстановительного лечения с февраля 2007 г. Пациент обратился с жалобами на повышение уровня АД (135/85 мм рт.ст.), головные боли, головокружение, лишний вес.
Из анамнеза известно, что в течение последних 2 лет отмечаются эпизоды повышения АД, увеличение веса. Пациент не курит. Случаев раннего развития ССЗ и СД у ближайших родственников не выявлено.
При физикальном обследовании: состояние удовлетворительное. Повышенного питания. Рост 1,92 м, вес 112 кг (ИК=30,38 кг/м2), объем талии 100 см. Частота дыхания 16 в 1 минуту. Аускультативно в легких и сердце без особенностей. ЧСС 64 в минуту. АД 135/85 мм рт.ст. Живот при пальпации мягкий, безболезненный, печень не увеличена. Отеков на нижних конечностях нет.
По результатам клинического анализа крови и общего анализа мочи патологических изменений не выявлено. Изменение показателей биохимического анализа крови исходно представлены в таблице 4.
| Таблица 4 | ||
| Результаты лабораторных исследований | ||
| Референтный диапазон | ||
| Общий холестерин | 6,0 ммоль/л | 3,1-5,2 ммоль/л |
| Триглицериды | 1,3 ммоль/л | 0,5-1,7 ммоль/л |
| ХС ЛПВП | 1,4 ммоль/л | >1,0 ммоль/л |
| ХС ЛПНП | 4,03 ммоль/л | до 3,0 ммоль/л |
| Глюкоза венозной крови | 7,1 ммоль/л | 3,8-6,1 ммоль/л |
| Глюкоза капиллярной крови натощак | 5,9 ммоль/л | до 5,6 ммоль/л |
| Глюкоза капиллярной крови через 2 часа после нагрузки глюкозой | 5,3 ммоль/л | до 7,6 ммоль/л |
| Инсулин | 17,44 мкЕд/мл | <18 мкЕд/мл |
| ИР по НОМА | 5,49 | >2.27 |
| Мочевая кислота крови | 454 мкмоль/л | 202-416 мкмоль/л |
По данным ЭКГ: ритм синусовый с ЧСС 66 в минуту.
По данным ЭхоКГ: существенных отклонений от нормы не выявлено.
У пациента ожирение I стадии с преимущественным отложением жировой массы в абдоминальной области, а также сопутствующие метаболические изменения - гиперхолестеринемия, гиперХС ЛПНП, высокая гликемия натощак, инсулинорезистентность, гиперурикемия, что свидетельствует о наличии метаболического синдрома.
Пациенту были даны подробные диетические рекомендации, разъяснена важность контроля АД, уровня глюкозы крови и назначен Крусмарин по схеме: прием в течение 15 дней по 5-6 капсул 0,3 г 3 раза в день во время еды (суточная доза составляет 0,5 г ПНЖК омега-3 и 0,5 г АДГ) с перерывом 15 дней, длительность курса - 1 год. При наблюдении через 3, 6 и 12 месяцев курсового приема БАД отмечалась положительная динамика: состояние пациента улучшилось, головные боли и головокружение не беспокоило, АД фиксировалось на уровне 120 и 80 мм рт.ст., он потеряла в весе за год 7 кг, достигнут целевой уровень общего холестерина - 5,1 ммоль/л, глюкоза крови натощак при контроле составила 5,1 ммоль/л, ХС ЛПНП - 3,46 ммоль/л, уровень инсулина снизился до 7,6 мкЕд/мл, ИР по НОМА составила 1,67, показатель мочевой кислоты - 298,3 мкмоль/л.
Данный клинический пример демонстрирует возможность эффективного лечения МС в амбулаторных условиях при приеме Крусмарина в соответствующей дозировке.
Таким образом, влияние БАД «Крусмарин» на углеводно-инсулиновый гомеостаз, а именно снижение инсулинорезистентности (а также изученные и доказанные липидкорригирующее, гипокоагуляционное и антиоксидантное свойства) делают возможным рекомендовать применение БАД «Крусмарин» как средство патогенетического лечения МС - коррекции инсулинорезистентности.
В отличие от способов коррекции инсулинорезистентности, включающих прием медикаментов либо иных БАД, изобретение позволяет достигать коррекции использованием БАД «Крусмарин» - немедикаментозного патогенетически обоснованного средства.
Литература
1. Алексанян Л.А., Полосьянц О.Б. Витамины - антиоксиданты в профилактике и лечении сердечно-сосудистых заболеваний. РМЖ. 2005, 13 (11): 780.
2. Антонюк М.В., Новгородцева Т.П., Н.С. Журавская Принципы липотропной немедикаментозной терапии при вторичных дислипидемиях. Здоровье. Медицинская экология. Наука. 2006; 25(1): 34-37.
3. Балаболкин М.И., Клебанова Е.М., Креминская В.М. Применение витаминов с антиоксидантным действием в комплексной терапии сахарного диабета. Лечащий врач. 2007, 10: С.52-55.
4. Бугрова С.А. Эффективность Глюкофажа в профилактике сахарного диабета 2 типа. Русский медицинский журнал. 2003, 11 (27); 1494-1498.
5. Диагностика и лечение метаболического синдрома. Российские рекомендации. Кардиоваскулярная терапия и профилактика. Приложение 2. 2007; 6: 1-26.
6. Мамедов М.Н. Метаболический синдром - больше, чем сочетание факторов риска: принципы диагностики и лечения. Пособие для врачей. М.: Печатных дел мастер; 2006.
7. Мкртумян A.M., Бирюкова Е.В. Метформин эффективно влияет на все компоненты метаболического синдрома. В чем секрет? Consilium medicum. 2007, 02(2): 111-119.
8. Новгородцева Т.П., Караман Ю.К., Виткина Т.И., Касьянов С.П. Сравнительная характеристика биологической активности жиров из гепатопанкреаса камчатского краба и печени командорского кальмара. Вестник ДВО РАН. 2007; 6: 105-110.
9. Патент №2302248 «Средство, обладающее липидкорригирующими, гипокоагуляционными, антиоксидантными свойствами» от 10.07.2007. Авт.Касьянов С.П., Новгородцева Т.П., Бочаров Л.Н., Акулин В.Н. и др.
10. Перова Н.В. Омега-3 полиненасыщенные жирные кислоты в кардиологии. Кардиоваскулярная терапия и профилактика. 2005,4: 112-118.
11. Самсонов М.А., Исаев В.А. Эйконол в профилактике и лечении сердечно-сосудистых заболеваний. Лечащий врач. 1999, 9: 78-79.
12. Спиричев В.Б. Витамины - антиокисданты в профилактике и лечении сердечно-сосудистых заболеваний. Витамин Е. Вопросы питания. 2003, 6: 45-51.
13. Стрюк Р.И., Цыганок Н.Ю. Диагностика инсулинорезистентности и коррекция метаболических нарушений. Клин. геронтолог