Карборанильные производные фторированных порфиринов и их металлокомплексы, проявляющие свойства фотосенсибилизатора, и способ их получения
Иллюстрации
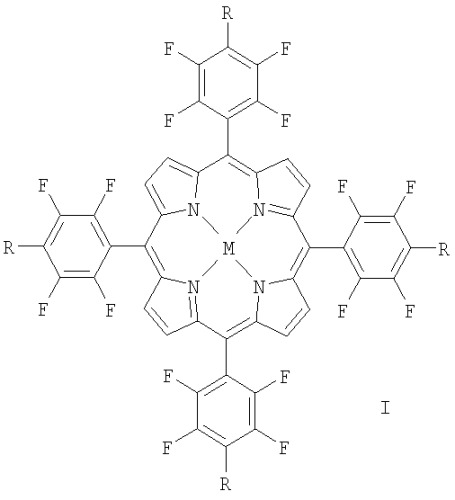
Показать всеНастоящее изобретение относится к новому карборанильному производному фторированных порфиринов общей формулы I
где Ia: M=2H, R=o-CB10H10C-, Iб: M=2H, R=о-С6Н5-СВ10Н10С-, Iв: М=2Н, R=-CB11H11 -Cs+, Iг: M=Cu, R=-CB11H11 -Cs+, Iд: M=Pd, R=-CB11H11 -Cs+, Ie: M=2H, R=-CB11H11 -Na+, Iж: M=Cu, R=-CB11H11 -Na+, Iз: M=Pd, R=-CB11H11 -Na+, проявляющему свойства фотосенсибилизатора. Также предложены способы получения соединений. Полученные соединения, проявляющие свойства фотосенсибилизатора, позволяют использовать их в борнейтронозахватной терапии (БНЗТ) и фотодинамической терапии (ФДТ) онкологических заболеваний. 5 н. и 1 з.п. ф-лы, 1 табл.
Реферат
Изобретение относится к новым соединениям, а именно к карборанильным производным фторированных порфиринов и их металлокомплексам, конкретно к карборанильным производным 5,10,15,20-тетракис(пентафторфенил)порфирина общей формулы I, и к способу их получения.
где
Ia M=2H, R=o-CHB10H10C-
Iб M=2H, R=о-С6Н5-СВ10Н10С-
Iв M=2H, R=-CB11H11 -Cs+
Iг M=Cu, R=-CB11H11 -Cs+
Iд M=Pd, R=-CBllH11 -Cs+
Ie M=2H, R=-CB11H11 -Na+
Iж M=Cu, R=-CB11H11 -Na+
Iз M=Pd, R=-CB11H11 -Na+
Указанные соединения наиболее эффективно могут быть использованы в качестве фото/радиосенсибилизаторов в фотодинамической терапии (ФДТ) и борнейтронозахватной терапии (БНЗТ) онкологических заболеваний.
Указанные соединения, их свойства и способ получения в литературе не описаны.
Ранее не были известны структуры, описываемые формулой I, которые одновременно содержат порфириновый макроцикл, икосаэдрический 12-вершинный карборановый заместитель или 1-карба-клозо-додекаборанил цезий (или натрий), полностью фторированные ароматические группы и, в ряде случаев, металл.
В медицине известно использование порфиринов для лечения рака. Для использования в борнейтронозахватной терапии рака соединения должны создавать терапевтически эффективную концентрацию бора в опухоли, но при этом они должны быть минимально токсичны для нормальных живых клеток и органов.
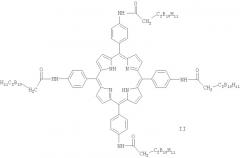
Известно соединение, структура которого аналогична структуре заявляемого соединения (Ol'shevskaya V.A., Zaitsev A.V., Luzgina V.N., Kondratieva T.T., Kononova E.G, Petrovskii P.V., Mironov A.F., KalininV.N., Shtil A.A. / Novel boronated derivatives of 5,10,15,20-tetraphenylporphyrin: Synthesis and toxicity for drug-resistant tumor cells // Bioorg. Med. Chem., 2006, Vol.42, pp.109-120) формулы II.
Соединение II получают путем взаимодействия хлорангидрида 9-о-карборанилуксусной кислоты и 5,10,15,20-тетракис(n-аминофенил)порфирина в растворителе - смеси хлористого метилена и пиридина в присутствии 4-диметиламинопиридина. Хлорангидрид 9-о-карборанилуксусной кислоты получают трудоемким 4-стадийным способом из о-карборана (Р.П.Евстигнеева, В.Н.Лузгина, В.А.Ольшевская, Л.И.Захаркин / Синтез о- и м-карбораносодержащих производных 5,10,15,20-тетра (n-аминофенил) порфирина // ДАН, 1997, Т. 357, №5, с.637-639. Л.И.Захаркин, В.А.Ольшевская, Р.П.Евстигнеева, В.Н.Лузгина, Л.Е.Виноградова, П.В.Петровский / Синтез 5,10,15,20-тетра [3-(о- и м-карборанил) бутил] порфиринов, содержащих σ-связь С-В. // Изв. АН., Сер. хим., 1998, №2, с.347-349).
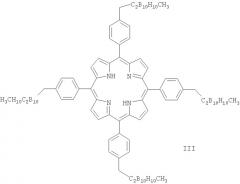
Известны карборанилпорфирины общей формулы III, которые получают конденсацией Ротемунда карборановых бензальдегидов (получаемых многостадийным способом в жестких условиях) с пирролом при кипячении в пропионовой кислоте с выходом 30% (M.G.H.Vicente, B.F.Edwards, S.J.Shetty, Y.Hou, J.E.Boggan / Synthesis and Preliminary Biological Studies of Four meso-Tetra[(nido-carboranylmethyl)phenyl] porphyrins // Bioorg. Med. Chem., 2002, Vol.10, pp.481-492).
Хотя соединения формул II и III проявляют низкую темновую токсичность и нетоксичны для неопухолевых клеток в концентрациях до 100 мкмоль, их использование в медицине для БНЗТ и ФДТ вряд ли возможно, так как они являются труднодоступными веществами, которые получают многостадийными способами и с низкими выходами.
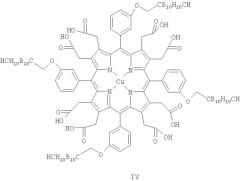
Известны металлокомплексы карборанилпорфиринов формулы IV, обладающие противоопухолевой активностью в отношении отдельных видов опухолей (М.Muira, P.L.Micca, C.D.Fisher, C.R.Gordon, J.C.Heinrichs, D.N.Slatkin / Evaluation of Carborane-Containing Porphyrins as Tumour Targeting Agents for Boron Neutron Capture Therapy // The British Journal of Radiology, 1998, vol. 71, pp.773-781).
Известны металлокомплексы карборанилпорфиринов, обладающие противоопухолевой активностью (патент РФ №2236411), но высокая темновая токсичность ограничивает возможности их использования в БНЗТ и ФДТ.
Известны металлопорфирины, которые могут быть использованы в качестве радиосенсибилизаторов в лучевой терапии рака (патент РФ №2310447).
Известен способ получения карборанильных производных гексафторбензола и пентафторхлорбензола, заключающийся в их взаимодействии с литиевыми солями карборанов, такими как литий-1-метил-о- и литий-1-метил-o-карбораны. Реакции проводят в бензоле при комнатной температуре. Гексафторбензол дает преимущественно дизамещенный продукт (выход 30%), а пентафторхлорбензол дает монозамещенный продукт с выходом 25%. (Л.И.Захаркин, В.Н.Лебедев / Действие литий-1-метил-о- и литий-1-метил-м-карборанов на гексафторбензол или пентафторхлорбензол // Известия АН СССР, сер. хим., 1972, №10, стр.2337-2339).
Однако этот способ для получения карборанильных производных фторированных порфиринов не используется.
Задачей настоящего изобретения является создание карборанильных производных фторированных порфиринов и их металлокомплексов, которые проявляют свойства фотосенсибилизаторов и позволяют использовать их для БНЗТ и ФДТ, а также разработка способа их получения.
Поставленная задача решается карборанильными производными фторированных порфиринов и их металлокомплексов формулы I, в которых М представляет собой два атома водорода, R выбран из группы: о-карборанил и о-фенилкарборанил, или R представляет собой 1-карба-клозо-додекаборанил цезий, а М выбран из группы: водород (два атома), медь и палладий, и способом получения указанных соединений, который заключается в том, что соответствующий карборан, растворенный в безводном тетрагидрофуране, металлируют действием гексанового раствора бутиллития при температуре 10-12°С при перемешивании в атмосфере инертного газа с последующим взаимодействием полученного карбораниллития с 5,10,15,20-тетракис(пентафторфенил)порфирином или его медным, или палладиевым комплексом, при перемешивании в атмосфере инертного газа при температуре 20-25°С с последующим выделением готового продукта известными методами; а также карборанильными производными фторированных порфиринов и их металлокомплексов формулы I, в которых R представляет собой 1-карба-клозо-додекаборанил натрий, а М выбран из группы: водород (два атома), медь и палладий, и способом их получения, который заключается в том, что 1-карба-клозо-додекаборат цезия, растворенный в безводном тетрагидрофуране, металлируют действием гексанового раствора бутиллития, при температуре 10-12°С при перемешивании с последующим взаимодействием образовавшегося карбораниллития с 5,10,15,20-тетракис(пентафторфенил)порфирином или его медным, или палладиевым комплексом при перемешивании в атмосфере инертного газа при температуре 20-25°С, а выделенный и очищенный продукт растворяют в ацетонитриле, затем пропускают дважды через ионообменную смолу и выделяют готовый продукт путем отгонки растворителя в вакууме.
Реакцию осуществляют по следующей схеме:
1)
Выходы заявляемых соединений составляют 40-65%. Реакции проводят в атмосфере инертного газа, такого как аргон или азот. Исходные вещества и реагенты, необходимые для синтеза заявляемых соединений, являются коммерчески доступными, например 5,10,15,20-тетракис(пентафторфенил)порфирин (Fluka, 87637), о-карборан (Aldrich, 288187), гексановый раствор бутиллития (Aldrich, 186171), ионообменная смола DOWEX 50 WX8-200 (Aldrich, 44514).
Металлокомплексы 5,10,15,20-тетракис(пентафторфенил)порфирина и 1-карба-клозо-додекаборанил цезий получают по известным методикам с высокими выходами (Порфирины: структура, свойства, синтез // Под ред. Н.С.Ениколопяна, 1985, М.: Наука, С.299; L.I.Zakharkin, V.A.Ol'shevskaya, P.V.Petrovskii, J.H.Morris / Simple synthesis of anions of closo-monocarbon carborane-substituted alcohols // Mendeleev Commun., 2000, 10, 71-72).
Изобретение иллюстрируется конкретными примерами его осуществления, приведенными ниже.
Пример 1. Получение 5,10,15,20-тетракис[4-(о-карборан-1-ил)тетрафторфенил]порфирина (Iа). К раствору 230 мг (1,6 ммоль) о-карборана в 20 мл безводного тетрагидрофурана прибавляют при 10-12°С 1,6 ммоль (1,35 М) гексанового раствора бутиллития. Перемешивают 30 минут и прибавляют 100 мг (0,1 ммоль) 5,10,15,20-тетракис(пентафторфенил)порфирина. Реакционную массу перемешивают в течение 48 часов при 20-25°С в токе аргона (ТСХ-контроль) и выливают в воду (30 мл), экстрагируют этилацетатом (3×15 мл). Растворитель отгоняют в вакууме, остаток очищают хроматографией на колонке с силикагелем (2×20 см), элюент-хлороформ, хлороформ-ацетон (1:1), хлороформ-ацетон (2:3). Выход 90 мг (61%).
ИК-спектр (KBr), ν (см-1): 3429 (NH порфирина), 2973 (СН порфирина), 2578 (ВН).
Электронный спектр (CH3CN), λmax, нм, (ε·10-3): 410 (225,0), 504 (21,0), 579 (7,9), 635 (6,9).
1Н ЯМР ((СD3)2СО), δ, м.д.: -2,6 (с, 2Н, NH); 4,10 (уш.с, 4Н, СН карборана); 8,98 (с., 8Н, β-пиррол). 11В ЯМР ((СD3)2СО), δ, м.д.: -1,85 (д, 4 В, J=153 Гц), - 4,60 (д, 4В, J=151 Гц), -8,30 (д, 8В, J=155 Гц), -10,82 (д, 8 В, J=168 Гц), -12,46 (д, 16 В, J=171 Гц). 19F ЯМР ((СD3)2СО), δ, м.д.: -138,4 - -138,2 (м., 8 F, мета F); -133,7 (с., 8 F, орто F). Масс-спектр (m/z): 1467 [M]+.
Пример 2. Получение 5,10,15,20-тетракис[4-(2-фенил-о-карборан-1 -ил)тетрафторфенил]порфирина (Iб). К раствору 350 мг (1,6 ммоль) 1-фенил-о-карборана в 20 мл безводного тетрагидрофурана прибавляют при 10-12°С 1,6 ммоль (1,35 М, 1,2 мл) гексанового раствора бутиллития. Перемешивают 30 минут и прибавляют 100 мг (0,1 ммоль) 5,10,15,20-тетракис(пентафторфенил)порфирина. Реакционную массу перемешивают в течение 48 часов при 20-25°С в токе аргона (ТСХ-контроль). Реакционную массу выливают в 30 мл воды, экстрагируют этилацетатом (3×15 мл). Растворитель отгоняют в вакууме, остаток очищают хроматографией на колонке с силикагелем (2×20 см), элюент- хлороформ, хлороформ-ацетон (1:1), хлороформ-ацетон (2:3). Выход 70 мг (40%).
ИК-спектр (KBr), ν (см-1): 3443 (NH порфирина), 2974 (СН порфирина), 2598 (ВН).
Электронный спектр (CH3CN), λmax, нм, (ε·10-3): 411 (234,0), 507 (20,5), 581 (8,2), 637 (7,1).
1Н ЯМР ((СD3)2СО), δ, м.д.: -2,53 (с, 2Н, NH); 7,35-8,65 (м., 30Н, Ph карборана); 9,12 (с., 8Н, β-пиррол). 11В ЯМР-спектр ((CD3)2СО), δ, м.д.: -1,75 (д, 4В, J=154 Гц), - 4,25 (д, 4В, J=150 Гц), -8,10 (d, 8В, J=149 Гц), -10,65 (д, 8В, J=169 Гц), -12,35 (д, 16В, J=173 Гц). 19F ЯМР-спектр ((СD3)2СО), δ, м.д.: -140,7 - -140,5 (м., 8F, мета F); -132,9 (с., 8F, орто F).
Масс-спектр (m/z): 1776 [M]+.
Пример 3. Получение {5,10,15,20-тетракис[4-(1-карба-клозо-додекаборан-1-ил)тетрафторфенил]порфирин)}цезия (Iв).
К раствору 450 мг (1,6 ммоль) 1-карба-клозо-додекабората цезия в 20 мл безводного тетрагидрофурана прибавляют при 10-12°С 1,6 ммоль (1,35 М, 1,2 мл) гексанового раствора бутиллития. Перемешивают 30 минут и прибавляют 100 мг (0,1 ммоль) 5,10,15,20-тетракис(пентафторфенил)порфирина. Реакционную массу перемешивают в течение 48 часов при 20-25°С в токе аргона (ТСХ-контроль). Реакционную массу выливают в 30 мл воды, экстрагируют этилацетатом (3×15 мл). Растворитель отгоняют в вакууме, остаток очищают хроматографией на колонке с силикагелем (2×20 см), элюент-хлороформ, хлороформ-ацетон (1:1), хлороформ-ацетон (2:3). Выход 103 мг (51%).
ИК-спектр (KBr), ν, см-1: 3447 (NH порфирина), 2927 (СН порфирина), 2525 (ВН).
Электронный спектр (СН3СN), λmах, нм, (ε·10-3): 410 (238,0), 506 (21,3), 583 (8,3), 647 (7,0).
1H ЯМР ((СD3)2СО), δ, м.д.: -2,92 (с, 2Н, NH); 9,26 (с., 8Н, β-пиррол). 11В ЯМР ((СD3)2СО), δ, м.д.: -12,30 (д., 24 В, J=136,1 Гц); -11,87 (д., 20В, J=101,7 Гц). 19F ЯМР ((СD3)2СО), δ, м.д.: -140,7 - -140,5 (м., 8F, мета F); -132,9 (с., 8F, орто - F).
Масс-спектр (m/z): 2002 [М]+.
Пример 4. Получение {5,10,15,20-тетракис[4-(1-карба-клозо-додекаборан-1-ил]тетрафторфенил)порфиринато медь (II)]} цезия (Iг)
К раствору 450 мг (1,6 ммоль) 1-карба-клозо-додекабората цезия в 20 мл безводного тетрагидрофурана прибавляют при 10-12°С 1,6 ммоль (1,35 М, 1,2 мл) гексанового раствора бутиллития. Перемешивают 30 минут и прибавляют 103 мг (0,1 ммоль) медного комплекса 5,10,15,20-тетракис(пентафторфенил)порфирина. Реакционную массу перемешивают в течение 48 часов при 20-25°С в токе аргона (ТСХ-контроль). Реакционную массу выливают в 30 мл воды, экстрагируют этилацетатом (3×15 мл). Растворитель отгоняют в вакууме, остаток очищают хроматографией на колонке с силикагелем (2×20 см), элюент- хлороформ, хлороформ-ацетон (1:1), хлороформ-ацетон (2:3). Выход 128 мг (62%).
ИК-спектр (KBr), ν, см-1: 2956 (СН порфирина), 2523 (ВН)
Электронный спектр (СН3СN), λmах, нм, (ε·10-3): 410 (186,2), 506 (14,3), 535 (8,3), 578 (6,5), 647 (3,2).
Масс-спектр (m/z): 2064 [M]+.
Пример 5. Получение {[5,10,15,20-тетракис(4-(1-карба-клозо-додекаборан-1-ил)тетрафторфенил)порфиринато палладий (II)]}цезия (Iд)
К раствору 450 мг (1,6 ммоль) 1-карба-клозо-додекабората цезия в 20 мл безводного тетрагидрофурана прибавляют при 10-12°С 1,6 ммоль (1,35 М, 1,2 мл) гексанового раствора бутиллития. Перемешивают 30 минут и прибавляют 106 мг (0,1 ммоль) палладиевого комплекса 5,10,15,20-тетракис(пентафторфенил)порфирина. Реакционную массу перемешивают в течение 48 часов при 20-25°С в токе аргона (ТСХ-контроль). Реакционную массу выливают в 30 мл воды, экстрагируют этилацетатом (3×15 мл). Растворитель отгоняют в вакууме, остаток очищают хроматографией на колонке с силикагелем (2×20 см), элюент-хлороформ, хлороформ-ацетон (1:1), хлороформ-ацетон (2:3). Выход 137 мг (65%).
ИК-спектр (KBr), ν, см-1: 2979 (СН порфирина), 2527 (ВН).
Электронный спектр (СН3СN), λmax, нм, (ε·10-3): 413 (60,5), 607 (15,5).
1H ЯМР-спектр ((СD3)2СО), δ, м.д.: 9,26 (с., 8Н, β-пиррол). 11В ЯМР ((СD3)2СО), δ, м.д.: -12,44 (д., 24В, J=135,2 Гц); -11,83 (д., 20В, J=101,3 Гц). 19F ЯМР ((СD3)2СО), δ, м.д.: -137,6 - -137,1 (м., 8F, мета F); -130,2 (с., 8F, орто F).
Масс-спектр (m/z): 2107 [М]+.
Пример 6. Получение {[5,10,15,20-тетракис(4-(1-карба-клозо-додекаборан-1-ил)тетрафторфенил)порфирин]}натрия (Ie). Растворяют 40 мг (0,02 ммоль) соединения (Iв) в 100 мл ацетонитрила и пропускают через колонку (2×5 см) с ионообменной смолой DOWEX 50 WX8-200. Растворитель отгоняют в вакууме, остаток растворяют в 100 мл ацетонитрила и пропускают через ионообменную смолу. Растворитель отгоняют в вакууме. Выход 31 мг (99,5%).
ИК-спектр (KBr), ν, см-1: 3447 (NH порфирина), 2927 (СН порфирина), 2525 (ВН).
Электронный спектр (СН3СN), λmах, нм, (ε·10-3): 410 (304,6), 506 (27,3), 583 (10,6), 647 (9,0).
1H ЯМР-спектр ((СD3)2СО), δ, м.д.: -2,86 (с, 2Н, NH); 9,22 (с., 8Н, β-пиррол). 11В ЯМР-спектр ((СD3)2СО), δ, м.д.: -12,40 (д., 24В, J=136,2 Гц); -11,82 (д., 20В, J=101,4 Гц). 19F ЯМР-спектр ((СD3)2СО), δ, м.д.: -140,6 - -140,4 (м., 8F, мета F); -132,7 (с., 8 F, орто F). Масс-спектр (m/z): 1563 [M]+.
Пример 7. Получение {[5,10,15,20-тетракис(4-(1-карба-клозо-додекаборан-1-ил)тетрафторфенил)порфиринато медь (II)]}натрия (Iж).
Растворяют 41 мг (0,02 ммоль) (Iг) в 100 мл ацетонитрила и пропускают через колонку (2×5 см) с ионообменной смолой DOWEX 50 WX8-200. Растворитель отгоняют в вакууме, остаток растворяют в 100 мл ацетонитрила и пропускают через ионообменную смолу. Растворитель отгоняют в вакууме. Выход 32 мг (99%).
ИК-спектр (KBr), ν, см-1: 2958 (СН порфирина), 2524 (ВН).
Электронный спектр (CH3CN), λmax, нм, (ε·10-3): 410 (236,5), 506 (18,2), 535 (10,5), 578 (8,3), 647 (4,1).
Масс-спектр, m/z: 1624 [M]+.
Пример 8. Получение {[5,10,15,20-тетракис(4-(1-карба-клозо-додекаборан-1-ил)тетрафторфенил)порфиринато палладий (II)]} натрия (Iз).
Растворяют 42 мг (0,02 ммоль) (1д) в 100 мл ацетонитрила и пропускают через колонку (2х5 см) с ионообменной смолой DOWEX 50 WX8-200. Растворитель отгоняют в вакууме, остаток растворяют в 100 мл ацетонитрила и пропускают через ионообменную смолу. Растворитель отгоняют в вакууме. Выход 33 мг (99,7%).
ИК-спектр (KBr), ν, см-1: 2980 (СН порфирина), 2526 (ВН).
Электронный спектр (СН3СN), λmах, нм, (ε·10-3): 414 (50,0), 607 (13,0).
1Н ЯМР-спектр ((СD3)2СО), δ, м.д.: 9.18 (с., 8Н, β-пиррол). 11B ЯМР-спектр ((СD3)2СО), δ, м.д.: -12,40 (д., 24В, J=134,9 Гц); -11,80 (д., 20 В, J=101,5 Гц). 19F ЯМР-спектр ((СD3)2СО), δ, м.д.: -137,8 - -137,3 (м., 8F, мета F); -130,1 (с., 8F, орто F).
Масс-спектр (m/z): 1667 [М]+.
Все полученные карборанильные производные представляют собой микрокристаллы темно-красного или темно-зеленого цвета, хорошо растворимые в ацетоне, ацетонитриле (соединения Ia - Iз), воде (соединения Iв - Iз).
Ниже представлены результаты испытаний фототоксической активности основных представителей заявляемых карборанильных производных фторированных порфиринов и их металлокомплексов.
На первом этапе проводят исследование цитотоксичности заявляемых соединений. В качестве модели служит линия рака толстой кишки человека НСТ116. Заявляемые соединения растворяют в диметилсульфоксиде до концентрации 10 мМ; в день эксперимента готовят разведения соединений в культуральной среде (модифицированная Дальбекко среда Игла с добавлением 5% эмбриональной телячьей сыворотки, 2 мМ L-глутамина, 100 ЕД/мл пенициллина и 100 мкг/мл стрептомицина при 37°С, 5% СО2 в увлажненной атмосфере). Клетки рассевают в 96-луночные планшеты (Costar, США) (5×103 клеток в 200 мкл культуральной среды). В лунки вносят препараты в концентрациях 0-25 мкМ. Культуры инкубируют при 37°С, 5% СО2 до 72 часов. По окончании инкубации в лунки вносят 20 мкл 3-(4,5-диметилтиазол-2-ил)-2,5-дифенилтетразолия бромида, и планшеты инкубируют 3 часа. О жизнеспособности клеток судят по цветной реакции, развивающейся при восстановлении тетразолия в формазан дегидрогеназами митохондрий [Sidorova ТА., Nigmatov A.G., Kakpakova E.S., Stavrovskaya A.A., Gerassimova G.K., Shtil A.A., Serebryakov E.P. Effects of isoprenoid analogues of SDB-ethylenediamine on multidrug resistant tumor cells alone and in combination with chemotherapeutic drugs.//J. Med. Chem. 2002, 45(24):5330-5339]. Окраску регистрируют на спектрофотометре при длине волны возбуждения 540 нм. Оптическую плотность в лунках, где клетки инкубировали без новых соединений (контроль), принимают за 100%. Показатели оптической плотности в лунках с каждой концентрацией испытуемых препаратов усредняют и вычисляют процент выживших клеток при той или иной концентрации исследуемого токсина.
Соединения Ia - Iз не вызывали гибель клеток в концентрациях до 25 мкМ в течение 72 час (таблица 1), поэтому они могут быть применимы для ФДТ. Это подтверждается экспериментами с облучением клеток линии НСТ 116 в присутствии заявляемых соединений.
Клетки рассевают в 35 мм чашки Петри; через 16 час. Плотность посева составляет -50%. В 3 мл культуральной среды вносят соединения Iа - Iз до конечной концентрации 1 мкМ, и клетки инкубируют 30 мин. Культуральную среду удаляют, монослой клеток промывают физиологическим буфером, вносят 0,5 мл этого буфера и облучают клетки красным светом при длине волны 650 нм в течение 20 мин. После окончания облучения удаляют буфер, вносят 3 мл культуральной среды и инкубируют 24 часа при 37°С, 5%СО2. Гибель клеток учитывают по характерной морфологии клеток и количественно по включению иодида пропидия и проточной цитофлуориметрии. Гибель клеток наступала в первые 2 часа после облучения. Через 24 часа > 95% клеток включали иодид пропидия (признак необратимой гибели клеток). Таким образом, соединения Ia - Iз проявляют выраженные свойства фотосенсибилизатора (Таблица 1).
| Таблица 1 | ||
| Фототоксические свойства новых соединений. | ||
| Соединение | ИК10, мкМ* | ЭКфдт, мкМ** |
| Iа | >25 | 1 |
| Iб | >25 | 1.5 |
| Iв | >25 | 1 |
| Iг | >25 | 1.8 |
| Iд | >25 | 1 |
| Ie | >25 | 1 |
| Iж | >25 | 1 |
| Iз | >25 | 1.4 |
| * концентрация, вызывающая торможение пролиферации клеток линии рака толстой кишки НСТ116 на 10% по сравнению с контрольными клетками (МТТ-тест);** концентрация, вызывающая гибель>95% клеток линии рака толстой кишки НСТ116 через 24 часа после облучения красным светом (ФДТ). |
Темновая токсичность заявляемых соединений существенно ниже темновой токсичности известных карборанильных производных порфиринов, пригодных для использования в БНЗТ и ФДТ, например такого соединения, как [2-(1'-карба-клозо-додекаборан-1'-ил гидроксиметил)-5,10,15,20-тетрафенилпорфиринато] медь(II) цезий, который вызывает гибель клеток рака молочной железы в концентрации около 2 мкМ [Ol'shevskaya V.A., Zaitsev A.V., Luzgina V.N., Kondratieva T.T., Kononova E.G, Petrovskii P.V., Mironov A.F., Kalmin V.N., Shtil A.A. / Novel boronated derivatives of 5,10,15,20-tetraphenylporphyrin: Synthesis and toxicity for drug-resistant tumor cells // Bioorg. Med. Chem., 2006, Vol.42, pp.109-120 и патент РФ №2236411]. Повышенная темновая токсичность многих других карборанилпорфиринов ограничивает возможность их применения в терапии рака. [A.S.Phadke, A.R.Morgan / Synthesis of Carboranyl Porphyrins: Potential Drugs for Boron Neutron Capture Therapy// Tetrahedron Lett., 1993, Vol.34, pp.1725-1728.].
Преимуществами заявляемых соединений формулы I являются их высокая растворимость в воде (соединения Iв - Iз), низкая темновая токсичность в сочетании с высокой фотодинамической активностью, что делает возможным их использование в медицине для БНЗТ и ФДТ онкологических заболеваний.
Заявляемые соединения обладают оптимальным сочетанием липофильных и гидрофильных свойств, так как они обладают повышенной растворимостью в липидах (благодаря наличию значительного числа атомов фтора), что увеличивает скорость транспорта заявляемых соединений через биологические мембраны опухолевых клеток. Наличие переходных металлов в молекуле порфирина (соединения Iг - Iд и Iж - Iз) увеличивает фотодинамическую активность синтезированных соединений, что позволяет снизить дозу соединения и использовать его в флуоресцентной диагностике.
Заявляемые соединения в отличие от других производных порфиринов можно легко получать простым технологичным синтезом, который осуществляют без выделения промежуточного продукта (в одном сосуде) из доступных исходных веществ с выходами 40-65%. Способ не требует применения жестких условий, специального оборудования, высоких и низких температур.
1. Карборанильное производное фторированных порфиринов общей формулы где Ia M=2H, R=o-CHB10H10C-Iб M=2H, R=о-С6Н5-СВ10Н10С-Iв M=2H, R=-CB11H11 -Cs+ Iг M=Cu, R=-CB11H11 -Cs+ Iд M=Pd, R=-CBllH11 -Cs+ Ie M=2H, R=-CB11H11 -Na+ Iж M=Cu, R=-CB11H11 -Na+ Iз M=Pd, R=-CB11H11 -Na+ проявляющее свойства фотосенсибилизатора.
2. Карборанильное производное фторированных порфиринов по п.1, отличающееся тем, что М представляет собой два атома водорода, a R выбран из группы: о-карборанил и о-фенилкарборанил.
3. Карборанильное производное фторированных порфиринов, отличающееся тем, что R представляет собой 1-карба-клозо-додекаборанил цезий, а М выбран из группы: водород (два атома), медь и палладий.
4. Карборанильное производное фторированных порфиринов, отличающееся тем, что R представляет собой 1-карба-клозо-додекаборанил натрий, а М выбран из группы: водород (два атома), медь и палладий.
5. Способ получения соединений по пп.2 и 3, заключающийся в том, что соответствующий карборан, растворенный в безводном тетрагидрофуране, подвергают металлированию действием гексанового раствора бутиллития при температуре 10-12°С при перемешивании в атмосфере инертного газа с последующим взаимодействием полученного карбораниллития с 5,10,15,20-тетракис(пентафторфенил)порфирином или его медным, или палладиевым комплексом при перемешивании в атмосфере инертного газа при температуре 20-25°С, с последующим выделением готового продукта известными методами.
6. Способ получения соединений по п.4, заключающийся в том, что 1-карба-клозо-додекаборат цезий, растворенный в безводном тетрагидрофуране подвергают металлированию действием гексанового раствора бутиллития при температуре 10-12°С при перемешивании, с последующим взаимодействием полученного карбораниллития с 5,10,15,20-тетракис(пентафторфенил)порфирином или его медным, или палладиевым комплексом при перемешивании в атмосфере инертного газа при температуре 20-25°С; выделенный и очищенный продукт по п.3 растворяют в ацетонитриле и дважды пропускают через ионообменную смолу с последующим выделением продукта по п.4 путем отгонки растворителя в вакууме.