Способ оценки качества продуктов убоя животных
Иллюстрации
Показать всеИзобретение относится к области ветеринарии, в частности к ветеринарно-санитарной экспертизе. Способ включает помещение биопробы в раствор фенилизотиоцианата в изопропиловом спирте, воздействие на нее капиллярным зонным электрофорезом с использованием рабочего буфера на основе β-циклодекстрина, обнаружение аминокислот и их качественный и количественный анализ. При этом в качестве биопробы используют вытяжку из органов и тканей животных, для получения которой навеску в количестве 0,1-0,2 г заливают до 10 см3 20%-ной соляной кислотой, закрывают и помещают в термостат на 14 ч при температуре 105°С. Охлаждают, отбирают не более 0,05 см3 гидролизата и высушивают. Добавляют до 0,1 см3 0,1 М раствора карбоната натрия, перемешивают и добавляют не более 0,3 см3 раствора фенилизотиоцианата в изопропиловом спирте. Оставляют для прохождения реакции на 40 минут. После того, как полученная смесь высохнет в естественных условиях, добавляют не более 0,5 см3 дистиллированной воды, перемешивают и центрифугируют. Затем методом капиллярного зонного электрофореза с использованием рабочего буфера на основе β-циклодекстрина определяют концентрацию связанных аминокислот и сравнивают ее с контрольным результатом концентрации связанных аминокислот у клинически здоровых животных. В случае, если концентрация связанных аминокислот по сравнению с контролем уменьшается, то продукты убоя животных считаются зараженными гельминтами. Способ позволяет обеспечить безопасность продуктов убоя животных для потребителя. 3 ил., 14 табл.
Реферат
Изобретение относится к области ветеринарии, в частности к ветеринарно-санитарной экспертизе.
Известно определение белка в сыворотке крови методом электрофореза [см. Лабораторные исследования в ветеринарии под ред. В.Я.Антонова и П.Н.Блинова. М.: «Колос», 1971, С.423-427], где путем электрофореза осуществляют разделение белка на четыре группы: альбумины, альфа-, бета- и гаммаглобулины. При pH 8,6 белки в электрическом поле движутся к аноду, т.к. они в этих условиях заряжены отрицательно. Наиболее быстро движутся альбумины, затем альфаглобулины, бетаглобулины и наконец гаммаглобулины. Используют прибор для электрофореза на бумаге; фотоэлектроколориметр для определения количества элюированного из электрофореграмм красителя, денситометр, хроматографическую фильтровальную бумагу. Электрофорез проводят на полосках бумаги, затем проводят колориметрическое определение соотношения отдельных фракций белка путем извлечения краски из бумаги. После окраски на электрофореграмме выявляются четыре пятна, соответствующие альбумину, альфа-, бета- и гаммаглобулинам.
При электрофорезе на бумаге определяется лишь соотношение между отдельными фракциями сывороточных белков. Поэтому необходимо определить общее количество белка и вычислить абсолютное количество отдельных белковых фракций.
Наиболее близким по технической сущности является способ определения аминокислот в сыворотке крови животных посредством системы капиллярного электрофореза «Капель» (см. Практическое руководство по использованию систем капиллярного электрофореза «Капель», Н.В.Комарова, Я.С.Каменцев, С-П, 2008 г., с.102), включающий дериватизацию биопробы на основе раствора фенилизотиоцианата в изоприловом спирте, воздействие на нее капиллярным зонным электрофорезом с использованием рабочего буфера на основе β-циклодистрина, обнаружение аминокислот и их качественный и количественный анализ.
Недостатками известных способов являются ограниченные возможности, сложность исследования, длительный процесс определения, отсутствие возможности определения количественного состава связанных аминокислот в вытяжке органов и тканей (длиннейшая мышца спины, сердечная мышца, печень, легкие, селезенка и почки) при метастронгилезе (Metastrongylus elongates) на качество продуктов убоя свиней, у крупного рогатого скота при дикроцелиозе (Dicrocoelium lanceatum) и эхинококкозе (Echinococcus granulosus) на качество продуктов убоя крупного рогатого скота.
Техническим решением задачи является расширение функциональных и технологических возможностей, сокращение сроков выполнения и повышение точности определения связанных аминокислот при установлении качества и безопасности продуктов убоя животных при метастронгилезе свиней (Metastrongylus elongates); при дикроцелиозе (Dicrocoelium lanceatum) у крупного рогатого скота; эхинококкозе (Echinococcus granulosus) крупного рогатого скота.
Поставленная задача достигается тем, что в способе определения питательной ценности продуктов убоя животных, зараженных гельминтами, например свиней, зараженных метастронгилезом (Metastrongylus elongates); крупного рогатого скота, зараженного дикроцелиозом (Dicrocoelium lanceatum) и эхинококкозом (Echinococcus granulosus), включающем дериватизацию биопробы на основе раствора фенилизотиоцианата в изопропиловом спирте, воздействие на нее капиллярным зонным электрофорезом с использованием рабочего буфера на основе β-циклодекстрина, обнаружение аминокислот и их качественный и количественный анализ, согласно изобретению в качестве биопробы используют водную вытяжку органов и тканей животных, зараженных гельминтами, предварительно проводят гидролиз биопробы, для этого берут навеску мышечной ткани 0,1-0,2 г пробы и заливают до 10 см3 20%-ной соляной кислотой в сосуды для гидролиза, затем их закрывают пробками и помещают в термостат на 14 ч при температуре не более 105°C, далее охлаждают, отбирают пипеткой в микрососуд не более 0,05 см3 гидролизата и высушивают досуха, добавляют до 0,1 см3 0,1 M раствора карбоната натрия, перемешивают, затем добавляют не более 0,3 см3 раствора фенилизотиоцианата в изопропиловом спирте и оставляют для прохождения реакции на 40 минут, после высушивания содержимого в естественных условиях добавляют не более 0,5 см3 дистиллированной воды, перемешивают, переносят в пробирку Эппендорфа и центрифугируют для удаления газов и взвесей, затем полученные данные в результате качественного и количественного анализов сравнивают с контрольным результатом концентрации связанных аминокислот клинически здоровых животных и определяют качество продуктов, если концентрация связанных аминокислот у зараженных животных по сравнению с контролем уменьшается, то продукты убоя животных считаются недоброкачественными.
Преимущество данного способа состоит в следующем: высокая эффективность разделения компонентов, недоступная при других методах исследования; низкий расход реактивов и растворителей; простота аппаратуры; высокая скорость анализа и высокая воспроизводимость условий реакции; хорошая растворимость производных в водной среде; коммерческая доступность; широкие возможности капиллярного электрофореза при анализе связанных аминокислот. Кроме того, заявляемое предложение является экономичным, т.к. не требует применения дорогостоящих химических реактивов.
Новизна заявляемого предложения обусловлена тем, что в способе определения концентрации связанных аминокислот в водной вытяжке органов и тканей (длиннейшая мышца спины, сердечная мышца, печень, легкие, селезенка и почки) при метастронгилезе свиней, дикроцелиозе и эхинококкозе крупного рогатого скота используется метод капиллярного электрофореза для определения массовой концентрации связанных аминокислот, основанный на разделении анионных форм N-фенилтиокарбамилпроизводных аминокислот под действием электрического поля вследствие их различной электрофоретической подвижности. Для идентификации и количественного определения анализируемых компонентов регистрируют ультрафиолетовое поглощение при длине волны 254 нм в органах и тканях при метастронгилезе свиней, дикроцелиозе и эхинококкозе крупного рогатого скота с целью установления влияния продуктов их жизнедеятельности Metastrongylus elongates на качество продуктов убоя свиней, Dicrocoelium lanceatum и Echinococcus granulosus - на качество продуктов убоя крупного рогатого скота.
Кроме того, новизна заявленного предложения обусловлена тем, что экспресс-анализом установлены параметры изменения концентрации связанных аминокислот в органах и тканях (длиннейшая мышца спины, сердечная мышца, печень, легкие, селезенка и почки) при инвазии свиней возбудителем Metastrongylus elongates, крупного рогатого скота - Dicrocoelium lanceatum, крупного рогатого скота - Echinococcus granulosus.
Сущность изобретения поясняется чертежами, где на фиг.1 представлен график концентрации связанных аминокислот в вытяжке легочной ткани у свиней при метастронгилезе; на фиг.2 - график концентрации связанных аминокислот в вытяжке тканей печени у крупного рогатого скота при дикроцелиозе; на фиг.3 - график концентрации связанных аминокислот в вытяжке тканей печени у крупного рогатого скота при эхинококкозе.
Пример конкретного осуществления способа определения питательной ценности продуктов убоя животных, зараженных гельминтами, например свиней, зараженных метастронгилезом (Metastrongylus elongates); крупного рогатого скота, зараженного дикроцелиозом (Dicrocoelium lanceatum) и эхинококкозом (Echinococcus granulosus)
В процессе проведения послеубойной диагностики свиней в количестве 500 животных среди них у 100 животных нами был установлен диагноз на основании обнаружения большого количества гельминтов метастронгилюсов в просвете бронхов. В процессе проведения послеубойной диагностики у крупного рогатого скота в количестве 2500 животных среди них у 557 животных в печени выявлены дикроцелии, у 350 животных - эхинококки в печени и у 150 животных - в легких.
Для определения концентрации связанных аминокислот при метастронгилезе свиней, дикроцелиозе и эхинококкозе крупного рогатого скота используют вытяжку органов и тканей (длиннейшая мышца спины, сердечная мышца, печень, легкие, селезенка и почки). Для этого при каждом заболевании животных берут средние пробы у 10 животных. При этом исследуемых животных разделили на 2 группы по 10 средних проб в каждой. Контрольная группа - клинически здоровые животные (свиньи и крупный рогатый скот), опытные группы - пораженные метастронгилюсами, дикроцелиями и эхинококками.
Для определения концентрации связанных аминокислот предварительно проводят гидролиз, для этого берут навеску мышечной ткани 0,1-0,2 г пробы и заливают до 10 см3 20%-ной соляной кислоты в специальных сосудах для гидролиза. Сосуды закрывают пробками и помещают в термостат на 14 ч при температуре 105°C. Затем охлаждают, отбирают пипеткой в микрососуд (стаканчик или бюкс) 0,05 см3 гидролизата и высушивают досуха. После добавляют до 0,1 см3 0,1 M раствора карбоната натрия, перемешивают, затем добавляют 0,3 см3 раствора фенилизотиоцианата (ФИТЦ) в изопропиловом спирте (0,2 см3 ФИТЦ в 12 см изопропилового спирта) и оставляют для прохождения реакции на 40 минут. После высыхания содержимого в естественных условиях добавляют 0,5 см3 дистиллированную воду, перемешивают, переносят в пробирку Эппендорфа и центрифугируют для удаления газов и взвесей.
Условия анализа капиллярного электрофореза: кварцевый капилляр длиной 0,5 м до детектора, внутренним диаметром 75×10-6 м; регулируемый источник высокого напряжения положительной полярности 3-25 кВ; гидростатический ввод пробы под давлением 30 мбар в течение 5 с; буферный рабочий раствор на основе β-циклодекстрина (54 мг в 12,5 см3 буферного раствора дигидрофосфата и гидрофосфата натрия); напряжение «плюс 10 кВ»; время анализа проходит в течение 40 мин; принудительное воздушное охлаждение капилляра до комнатной температуры; вывод и обработка результатов на компьютере.
Метод капиллярного электрофореза для определения массовой концентрации аминокислот основан на разделении анионных форм N-фенилтиокарбамилпроизводных аминокислот под действием электрического поля вследствие их различной электрофоретической подвижности. Для идентификации и количественного определения анализируемых компонентов регистрируют ультрафиолетовое поглощение при длине волны 254 нм.
Альфааминокислоты при взаимодействии с фенилизотиоцианатом в щелочной среде дают N-фенилтиокарбамильные (ФТК) производные, которые представляют собой кислоты, в щелочных условиях существующие в форме анионов. Благодаря наличию в структуре полученных соединений бензольного кольца фенилкарбамильные производные имеют полосу поглощения при 254 нм. Содержание связанных аминокислот определяют через производные с фенилизотиоцианатом методом капиллярного электрофореза.
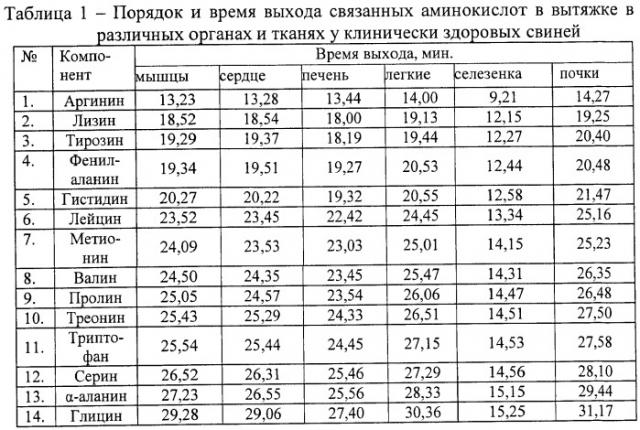
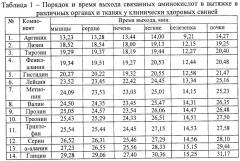
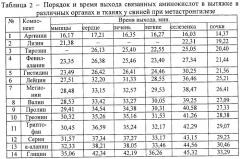
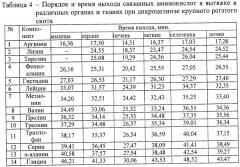
В процессе проведения анализа установлен порядок и время выхода связанных аминокислот в органах и тканях у клинически здоровых животных и при гельминтозах (табл.1, табл.2, табл.3, табл.4 и табл.5).
В результате проведенных исследований установлено, что при инвазии свиней метастронгилюсами в длиннейшей мышце спины концентрация связанных аминокислот была ниже в 3,6 раза лизина, в 1,9 раза - триптофана, в 1,6 раза - метионина, в 1,5 раза - фенилаланина, в 1,4 раза - серина, в 1,3 раза - валина, лейцина, пролина и α-аланина, в 1,2 раза - аргинина, гистидина, глицина и треонина относительно клинически здоровых животных (табл.6).
При инвазии свиней метастронгилюсами концентрация связанных аминокислот в экстракте сердечной мышцы была ниже аргинина в 2,9 раза, в 2,8 раза - гистидина и валина, в 2,7 раза - α-аланина, в 2,5 раза - глицина, лейцина и серина, в 2,4 раза - треонина, в 2 раза - пролина, и, напротив, выше тирозина в 8,7 раза, в 1,1 раза - триптофана относительно клинически здоровых животных (табл.6).
Концентрация связанных аминокислот у инвазированных метастронгилюсами свиней в экстракте печени была ниже в 1,6 раза - аргинина, в 1,5 раза - треонина и серина, в 1,4 раза - валина и глицина, в 1,3 раза - лейцина и α-аланина, в 1,2 раза - пролина и, напротив, выше тирозина в 44 раза, в 1,8 раза - фенилаланина, в 1,6 раза - гистидина и в 1,4 раза - триптофана относительно клинически здоровых животных. В то же время концентрация связанной аминокислоты метионина была практически на уровне клинически здоровых животных (табл.7).
При инвазии свиней метастронгилюсами концентрация связанных аминокислот в экстракте легочной ткани была ниже глицина в 3 раза, в 2,6 раза - валина, в 2,5 раза - пролина, в 2 раза - аргинина, α-аланина, треонина, серина, в 1,8 раза - гистидина и метионина, в 1,7 раза - лейцина, в 1,5 раза - триптофана, в 1,3 раза - фенилаланина и, напротив, в 3 раза выше тирозина относительно клинически здоровых животных (табл.7).
Концентрация связанных аминокислот у инвазированных метастронгилюсами свиней в экстракте селезенки была выше лейцина в 60 раз, в 34 раза - метионина, в 32 раза - гистидина, в 20 раз - аргинина, в 2,4 раза - лизина и тирозина, в 2 раза - пролина и валина, в 1,5 раза - серина, треонина, в 1,3 раза - α-аланина, глицина и фенилаланина относительно клинически здоровых животных. Следует отметить, что связанная аминокислота триптофан не была зарегистрирована у свиней, больных метастронгилезом (табл.8).
При инвазии свиней метастронгилюсами концентрация связанных аминокислот в экстракте почечной ткани была ниже фенилаланина в 2,4 раза, гистидина - в 1,9 раза, метионина и глицина - в 1,8 раза, аргинина, α-аланина и серина - в 1,7 раза, лизина - в 1,6 раза, валина, пролина и треонина - в 1,5 раза, лейцина и тирозина - в 1,4 раза, относительно клинически здоровых животных. В то же время концентрация связанной аминокислоты триптофана была практически на уровне клинически здоровых животных (табл.8).
Таким образом, при инвазии гельминтами Metastrongylus elongatus происходило снижение связанных аминокислот и распад их на свободные аминокислоты, а также изменение их концентрации в зависимости как от функциональных особенностей органа, так и от места локализации (легкие) половозрелых личинок Metastrongylus elongatus. При инвазии свиней половозрелыми личинками Metastrongylus elongatus установлено, что в легочной ткани в 2 раза происходило снижение общей концентрации связанных аминокислот относительно клинически здоровых животных. В длиннейшей мышце спины и в тканях печени в 1,3 раза происходило снижение общей концентрации связанных аминокислот, в сердечной мышце - в 2,6 раза, в тканях селезенки - в 2,8 раза, в почечной ткани - в 1,7 раза относительно клинически здоровых животных.
Необходимо отметить, что при метастронгилезе у свиней в длиннейшей мышце спины связанная аминокислота тирозин не была зарегистрирована, в сердечной мышце - лизина и тирозина, в тканях печени и легочной - лизина, в тканях селезенки - триптофана. В длиннейшей мышце спины, сердечной мышце, в тканях печени, легочной и почечной максимальная концентрация приходилась на гистидин, а в тканях селезенки - на α-аланин как в контрольной, так и в опытной группах.
В результате проведенных исследований установлено, что при эхинококкозе крупного рогатого скота концентрация связанных аминокислот в вытяжке длиннейшей мышце спины была ниже в 2 раза глицина, метионина, пролина, треонина, триптофана и серина, в 1,6 раза - аргинина, валина и лейцина, в 5 раз - лизина, в 1,3 раза - α-аланина, в 1,2 раза - тирозина и, напротив, выше в 1,2 раза гистидина и фенилаланина относительно клинически здоровых животных (табл.9).
При эхинококкозе крупного рогатого скота концентрация связанных аминокислот в вытяжке сердечной мышцы была ниже в 3 раза тирозина, в 2,4 раза - фенилаланина, в 1,4 раза - метионина, в 1,1 раза - глицина, серина, пролина, треонина и, напротив, выше в 1,3 раза - триптофана, в 1,1 раза - α-аланина, аргинина, валина, гистидина относительно клинически здоровых животных. Концентрация связанной аминокислоты лейцин находилась практически на уровне клинически здоровых животных. Связанная аминокислота лизин не была выявлена при эхинококкозе (табл.9).
Концентрация связанных аминокислот у инвазированных эхинококками крупного рогатого скота в вытяжке тканей печени была ниже в 3 раза триптофана и фенилаланина, в 2 раза - α-аланина, аргинина, валина, глицина, пролина, серина, треонина, в 1,5 раза - лейцина, в 1,1 раза - метионина и, напротив, выше в 1,4 раза гистидина относительно клинически здоровых животных. Связанные аминокислоты лизин и тирозин не были выявлены (табл.10).
При инвазии эхинококками крупного рогатого скота концентрация связанных аминокислот в вытяжке легочной ткани была ниже в 1,4 раза валина, в 1,3 раза - гистидина в 1,2 раза - глицина, лейцина, треонина, серина, в 1,1 раза - аргинина, метионина, пролина, триптофана и фенилаланина относительно клинически здоровых животных. Связанная аминокислота α-аланин находилась практически на одном уровне с клинически здоровыми животными. Связанные аминокислоты лизин и тирозин не были выявлены (табл.10).
Концентрация связанных аминокислот при эхинококкозе крупного рогатого скота в вытяжке селезенки снижалась: в 10 раз тирозина, в 2 раза - триптофана, в 1,6 раза - гистидина, лизина и пролина, в 1,5 раза - лейцина, метионина и серина и, напротив, повышение в 2 раза фенилаланина, в 1,6 раза - аргинина, в 1,5 раза - треонина, в 1,4 раза - α-аланина, в 1,3 раза - глицина, в 1,2 раза - валина относительно клинически здоровых животных (табл.11).
При инвазии эхинококками крупного рогатого скота концентрация связанных аминокислот в вытяжке почечной ткани была ниже в 17 раз тирозина, в 5 раз - лизина, в 2 раза - триптофана и фенилаланина, в 1,3 раза - аргинина в 1,1 раза - гистидина, валина, лейцина и пролина, и, напротив, повышение в 1,2 раза серина и треонина, в 1,1 раза - α-аланина, связанная аминокислота глицин находилась практически на одном уровне с клинически здоровыми животными (табл.11).
Общая концентрация связанных аминокислот у клинически здорового крупного рогатого скота в вытяжке длиннейшей мышцы спины составила 155454,74 мг/кг фарша, в сердечной мышце - 138380,29 мг/кг фарша, в печени - 161367,88 мг/кг фарша, в легких - 72837,32 мг/кг фарша, в селезенке - 124095,40 мг/кг фарша, в почках - 115536,74 мг/кг фарша. Наибольшее содержание связанных аминокислот отмечено в тканях печени и было выше в 2,2 раза, чем в тканях легких, в 1,4 раза - почек, в 1,3 раза - селезенки; 1,2 раза - длиннейшей мышцы спины и сердечной мышцы.
Общая концентрация связанных аминокислот в вытяжке длиннейшей мышцы спины при эхинококкозе крупного рогатого скота составила 109453,32 мг/кг фарша, в сердечной мышце - 132490,23 мг/кг фарша, в печени - 109013,30 мг/кг фарша, в легких - 627006,90 мг/кг фарша, в селезенке - 115536,74 мг/кг фарша, в почках - 109247,03 мг/кг фарша. Наибольшее содержание связанных аминокислот отмечено в легких и было выше в 6 раз, чем в вытяжке длиннейшей мышце спины, печени и почек, в 5 раз - сердечной мышцы и селезенки.
Таким образом, при эхинококкозе (Echinococcus granulosus) крупного рогатого скота установлено, что в тканях печени происходило снижение в 1,5 раза общей концентрации связанных аминокислот относительно клинически здоровых животных. В длиннейшей мышце спины происходило снижение в 1,4 раза общей концентрации связанных аминокислот, в 1,1 раза - в сердечной мышце, почечной, селезенки относительно клинически здоровых животных. В легочной ткани общая концентрация связанных аминокислот находилась практически на одном уровне с клинически здоровыми животными.
Необходимо отметить, что при эхинококкозе у крупного рогатого скота не были зарегистрированы следующие связанные аминокислоты: в сердечной мышце - лизин, в тканях печени и легких - лизин и тирозин. У клинически здоровых животных не выявлена связанная аминокислота лизин в тканях печени, лизин и тирозин - в легочной ткани.
В длиннейшей мышце спины и в тканях печени среди связанных аминокислот максимальная концентрация приходилась на α-аланин у клинически здоровых животных, а при эхинококкозе - на гистидин. В легочной ткани и селезенке у клинически здоровых животных максимальная концентрация приходилась на гистидин, при эхинококкозе - на α-аланин. Как у клинически здоровых, так и инвазированных эхинококками животных в сердечной мышце и почечной ткани максимальная концентрация приходилась на гистидин.
В результате проведенных исследований установлено, что при дикроцелиозе крупного рогатого скота концентрация связанных аминокислот в длиннейшей мышце спины была ниже в 3 раза триптофана, в 2 раза глицина, валина, пролина и серина, в 1,6 раза - треонина, в 1,5 раза - α-аланина и лейцина, в 1,4 раза - аргинина и метионина, в 1,3 раза - фенилаланина, в 1,1 раза - гистидина относительно клинически здоровых животных. Связанные аминокислоты лизин и тирозин не были выявлены при дикроцелиозе (табл.12).
При дикроцелиозе крупного рогатого скота концентрация связанных аминокислот в вытяжке сердечной мышцы была ниже в 2 раза лизина, глицина и фенилаланина, в 1,5 раза - лейцина, метионина, серина и треонина, в 1,4 раза - валина и пролина, в 1,3 раза - α-аланина и гистидина, в 1,2 раза - аргинина и, напротив, выше в 3 раза тирозина относительно клинически здоровых животных. Связанная аминокислота триптофан находилась практически на одном уровне с клинически здоровыми животными (табл.12).
Концентрация связанных аминокислот у инвазированного дикроцелиами крупного рогатого скота в вытяжке печени была ниже в 4 раза триптофана, в 3 раза - глицина, валина, пролина и фенилаланина, в 2 раза - α-аланина, аргинина, лейцина, серина и тирозина, в 1,6 раза - треонина, в 1,2 раза - метионина относительно клинически здоровых животных. Связанная аминокислота гистидин находилась практически на одном уровне с клинически здоровыми животными. При дикроцелиозе в тканях печени была выявлена связанная аминокислота лизин, концентрация которой составила 52,96±1,94 мг/кг (табл.13).
При дикроцелиозе крупного рогатого скота концентрация связанных аминокислот в вытяжке легочной ткани была ниже в 3 раза тирозина, в 1,6 раза - фенилаланина, в 1,3 раза - глицина и валина, в 1,2 раза - гистидина, в 1,1 раза - α-аланина и пролина, и, напротив, выше в 1,4 раза триптофана, в 1,2 раза - метионина, в 1,1 раза - треонина относительно клинически здоровых животных. Концентрации связанных аминокислот аргинина, лейцина и серина находились практически на одном уровне с клинически здоровыми животными. При дикроцелиозе в легочной ткани была выявлена связанная аминокислота лизин, концентрация которой составила 355,85±5,33 мг/кг (табл.13).
Концентрация связанных аминокислот у инвазированных дикроцелиами крупного рогатого скота в вытяжке селезенки снижалась: в 18 раз тирозина, в 4 раза - лизина, в 3 раза - гистидина, лейцина, пролина, серина и триптофана, в 2 раза - α-аланина, валина, глицина, метионина и треонина, 1,6 раза - аргинина, в 1,4 раза - фенилаланина относительно клинически здоровых животных (табл.14).
При инвазии дикроцелиами крупного рогатого скота концентрация связанных аминокислот в вытяжке почечной ткани была ниже в 23 раза гистидина, в 14 раз - треонина, в 12 раз - лейцина, в 10 раз - метионина, в 7 раз - валина, в 6 раз - лизина, в 4 раза - серина и тирозина, в 2 раза - α-аланина, триптофана и фенилаланина, в 1,5 раза - аргинина и, напротив, выше в 4 раза пролина относительно клинически здоровых животных. Связанная аминокислота глицин находилась практически на одном уровне с клинически здоровыми животными (табл.14).
Общая концентрация связанных аминокислот в вытяжке длиннейшей мышцы спины при дикроцелиозе крупного рогатого скота составила 106525,94 мг/кг фарша, в сердечной мышце - 100518,56 мг/кг фарша, в печени - 92036,26 мг/кг фарша, в легких - 68754,07 мг/кг фарша, в селезенке - 51873,04 мг/кг фарша, в почках - 32327,40 мг/кг фарша. Наибольшее содержание связанных аминокислот отмечено в вытяжке длиннейшей мышцы спины и было выше в 3,3 раза, чем в вытяжке почечной ткани, в 2 раза - селезенки, в 1,5 раза - легочной ткани, в 1,2 раза - печени и в 1,1 раза - сердечной мышцы.
Таким образом, при инвазии крупного рогатого скота гельминтами Dicrocoelium lanceatum установлено, что тканях печени в 1,8 раза происходит снижение общей концентрации связанных аминокислот относительно клинически здоровых животных. В длиннейшей мышце спины в 1,5 раза отмечается снижение общей концентрации связанных аминокислот, в сердечной мышце - в 1,4 раза, легочной ткани - в 1,1 раза, в тканях селезенки - в 2,4 раза, в почечной ткани - в 3,5 раза относительно клинически здоровых животных. Необходимо отметить, что при дикроцелиозе у крупного рогатого скота в длиннейшей мышце спины, в сердечной мышце, в тканях печени, легочной и селезенки максимальная концентрация приходилась на гистидин, а в почечной ткани - на глицин.
По концентрации, порядку и времени выхода связанных аминокислот можно установить качество продуктов убоя животных при гельминтозах.
Выявление концентрации связанных аминокислот в вытяжке мышечной ткани и органах имеет важное значение для установления качества и безопасности продуктов убоя клинически здоровых свиней и при метастронгилезе, дикроцелиозе и эхинококкозе крупного рогатого скота. Высокая концентрация связанных аминокислот у клинически здоровых животных свидетельствует об отсутствии процессов распада белков в тканях и органах. При гельминтозах происходит снижение связанных аминокислот и распад их на свободные аминокислоты, а также отмечается изменение их концентрации в зависимости как от функциональных особенностей органа, так и от места локализации гельминтов.
Следовательно, по концентрации связанных аминокислот можно установить, что при метастронгилезе свиней, дикроцелиозе и эхинококкозе крупного рогатого скота внутренние органы следует направлять на техническую утилизацию, туши - на промышленную переработку (изготовление вареных и варено-копченых колбас) в связи с низкой питательной ценностью продуктов убоя животных.
С целью обеспечения качества и безопасности продуктов убоя животных при метастронгилезе, дикроцелиозе и эхинококкозе в процессе первичной переработки на производстве и реализации необходимо: повысить контроль технологического производства, уровень лабораторного анализа продуктов убоя животных, включающих определение концентрации связанных аминокислот с использованием капиллярного электрофореза «Капель 103-Р» для установления степени деструкции тканей, вызванной продуктами жизнедеятельности гельминтов.
Способ оценки качества продуктов убоя животных, включающий помещение биопробы в раствор фенилизотиоцианата в изопропиловом спирте, воздействие на нее капиллярным зонным электрофорезом с использованием рабочего буфера на основе β-циклодекстрина, обнаружение аминокислот и их качественный и количественный анализ, отличающийся тем, что в качестве биопробы используют вытяжку из органов и тканей животных, для получения которой навеску в количестве 0,1-0,2 г заливают до 10 см3 20%-ной соляной кислотой, закрывают и помещают в термостат на 14 ч при температуре 105°С, после чего охлаждают, отбирают не более 0,05 см3 гидролизата и высушивают, затем добавляют до 0,1 см3 0,1 М раствора карбоната натрия, перемешивают и добавляют не более 0,3 см3 раствора фенилизотиоцианата в изопропиловом спирте, оставляют для прохождения реакции на 40 мин, а после того, как полученная смесь высохнет в естественных условиях, добавляют не более 0,5 см3 дистиллированной воды, перемешивают и центрифугируют, затем методом капиллярного зонного электрофореза с использованием рабочего буфера на основе β-циклодекстрина определяют концентрацию связанных аминокислот и сравнивают ее с контрольным результатом концентрации связанных аминокислот у клинически здоровых животных, и в случае, если концентрация связанных аминокислот по сравнению с контролем уменьшается, то продукты убоя животных считаются зараженными гельминтами.