Способ лечения ретинопатии при недоношенности и родственных ретинопатических заболеваний
Иллюстрации
Показать всеИзобретение относится к медицине, а именно к офтальмологии, и может быть использовано при лечении ретинопатии при недоношенности или родственных ретинопатических заболеваний. Для этого в сетчатку вводят эффективное количество клеток из популяции негативных по дифференцировочному антигену гематопоэтических стволовых клеток. При этом популяция таких стволовых клеток представляет собой популяцию выделенных миелоподобных клеток костного мозга, в которой большая часть клеток является негативной по дифференцировочному антигену и экспрессирует антиген CD44 и антиген CD11b. Способ позволяет обеспечить физиологическую реваскуляризацию в поврежденных участках сетчатки и ослабить уже вызванные заболеванием повреждения сетчатки за счет эксперессии антигенов, обладающих высокой вазотрофической активностью. 15 з.п. ф-лы, 3 табл., 36 ил.
Реферат
Релевантные заявки
Данная заявка заявляет преимущество предварительной заявки на патент США № 60/656122, поданной 24 февраля 2005 г., которая включена путем ссылки.
Заявление о заинтересованности государства
Часть работы, описанной здесь, поддерживалась грантами под номерами EY11254 и EY12598, предоставленными Национальным институтом глаза под эгидой Национальных институтов здоровья. Правительство США имеет некоторые права на данное изобретение.
Область техники, к которой относится изобретение
Данное изобретение относится к способам лечения ретинопатических заболеваний. Конкретнее, данное изобретение относится к способам лечения ретинопатии при недоношенности и родственных ретинопатических заболеваний введением негативных по дифференцировочному антигену гематопоэтических стволовых клеток в глаза млекопитающему, страдающему или имеющему риск развития указанных заболеваний.
Уровень техники
Сосудистые заболевания сетчатки, включающие ретинопатию при диабете, экссудативную возрастную дегенерацию желтого пятна сетчатки (ARMD), ретинопатию при недоношенности (ROP) и окклюзии сосудов, являются основными причинами нарушения зрения и слепоты. Данная группа заболеваний находится в центре интенсивных исследований, проводимых с целью разработки новых способов лечения, которые будут приводить к профилактике или модификации патологической реваскуляризации в глазах. Например, ARMD поражает 12-15 млн американцев в возрасте старше 65 лет и вызывает потерю зрения у 10-15% из них в результате хороидальной (субретинальной) реваскуляризации. Наиболее распространенной причиной потери зрения у американцев старше 65 лет является диабет; в США диабетом страдают 16 млн человек и 40000 тыс. человек страдают от глазных осложнений при данном заболевании, часто возникающих в результате реваскуляризации сетчатки. Несмотря на то что лазерная фотокоагуляция является эффективной для профилактики серьезной потери зрения в подгруппах с высоким риском у пациентов с диабетом, в целом частота развития ретинопатии за 10-летний период остается без изменений. Для пациентов с хороидальной реваскуляризацией за счет ARMD или воспалительных заболеваний глаза, таких как глазной гистоплазмоз, фотокоагуляция, за редким исключением, является не эффективной для предупреждения потери зрения. Несмотря на то что недавно разработанные, нетравматичные виды фотодинамического лечения дают надежду для временного снижения потери зрения у пациентов с ранее не поддающейся лечению хороидальной реваскуляризацией, только у 61,4% пациентов, подвергшихся лечению, имело место улучшение или стабилизация зрения по сравнению с 45,9% в группе пациентов, получавших плацебо.
Возрастная дегенерация желтого пятна сетчатки и ретинопатия при диабете являются основными причинами потери зрения в промышленно развитых странах и в основном в результате аномальной реваскуляризации сетчатки. Поскольку сетчатка состоит из хорошо выраженных слоев нейронов, глии и сосудистых элементов, относительно незначительные нарушения, такие, которые наблюдают при пролиферации сосудов или отеке, могут привести к значительной потере зрительной функции. Наследственные дегенеративные заболевания сетчатки, такие как пигментный ретинит (RP), также связаны с сосудистыми аномалиями, такими как сужение артериол и атрофия сосудов. Несмотря на достигнутый существенный прогресс в идентификации факторов, которые способствуют и подавляют ангиогенез, в настоящее время отсутствует терапия для специфического лечения глазных сосудистых заболеваний.
Наследственные дегенеративные заболевания сетчатки поражают 1 из 3500 человек и характеризуются прогрессирующей ночной слепотой, сужением поля зрения, атрофией зрительного нерва, аттенуацией артериол, изменением проницаемости сосудов и центральной потерей зрения, часто переходящей в полную слепоту (Heckenlively J.R., editor, 1988; Retinitis Pigmentosa, Philadelphia: JB Lippincott Co.). В результате молекулярного генетического анализа данных заболеваний были установлены мутации в более чем 110 различных генах, отвечающих только за относительно небольшой процент заболеваний у людей (Humphries et al., 1992, Science 256: 804-808; Farrar et al. 2002, EMBO J. 21: 857-864). Многие из данных мутаций ассоциированы с ферментными и структурными компонентами фототрансдукционного аппарата, включающего родопсин, сGMP-фосфодиэстеразу, rds-периферин и RPE65. Несмотря на эти наблюдения, по-прежнему отсутствуют эффективные способы лечения для замедления или остановки прогрессирования данных дегенеративных заболеваний сетчатки. Недавние достижения в генной терапии привели к успешному подавлению фенотипов rds (Ali et al., 2000, Nat. Genet. 25: 306-310) и rd (Takahashi et al., 1999, J. Virol. 73: 7812-7816) у мышей и фенотипа RPE65 у собак (Acland et al., 2001, Nat. Genet. 28: 92-95) при доставке трансгена дикого типа к фоторецепторам или в пигментный эпителий сетчатки (RPE) у животных со специфическими мутациями.
Ангиогенез представляет процесс, посредством которого образуются новые сосуды. В ответ на специфические химические сигналы капилляры простираются от уже существующих сосудов, в конечном итоге увеличиваясь в размере, исходя из потребностей организма. Первоначально эндотелиальные клетки, которые выстилают кровеносные сосуды, делятся в направлении, ортогональном по отношению к существующему сосуду, образуя сплошную ветвь. Затем смежные эндотелиальные клетки образуют крупные вакуоли и клетки перегруппировываются таким образом, что вакуоли ориентируют самих себя концом в конец и в конечном итоге образуют полость нового капилляра (образование трубки).
Ангиогенез стимулируется различными состояниями, такими как ответная реакция на рану, и он сопровождает практически любой рост ткани у позвоночных, таких как млекопитающие. Ангиогенез играет роль в развитии некоторых заболеваний, таких как ретинопатия при диабете и некоторые злокачественные опухоли. Для роста опухолей, например, требуется рост кровеносных сосудов для обеспечения кислородом и питательными веществами растущей опухолевой ткани.
Ангиогенез можно остановить или подавить интерференцией химических сигналов, которые стимулируют процесс ангиогенеза. Например, ангиогенные эндотелиальные клетки продуцируют протеазы для расщепления базальной пластинки, которая окружает кровеносные сосуды, «расчищая», таким образом, путь для нового капилляра. Ингибирование данных протеаз или их продукции может привести к предотвращению образования новых сосудов. Аналогично эндотелиальные клетки пролиферируют в ответ на химические сигналы. Особенно важные сигналы пролиферации включают васкулярный эндотелиальный фактор роста (VEGF) и фактор роста фибробластов (FGF) семейства протеинов. Было показано, что VEGF участвует в васкуляризации некоторых опухолей. Интерференция данных процессов передачи сигналов также может подавлять ангиогенез.
Некоторые факторы принимают участие в ангиогенезе. Молекулы кислого и основного факторов роста фибробластов являются митогенами для эндотелиальных клеток и клеток других типов. Васкулярный эндотелиальный фактор роста (VEGF) является высоко избирательным митогеном для эндотелиальных клеток.
В норме у взрослых людей ангионегез является строго регулируемым процессом, и он ограничен заживлением ран и маточными циклами. Ангиогенез «настраивается» на специфические ангиогенные молекулы, такие как кислотный и основной факторы роста (FGF), VEGF, ангиогенин, трансформирующий фактор роста (TGF), фактор-α некроза опухолей (TNF-α) и тромбоцитарный фактор роста (PDGF). Ангиогенез можно подавить ингибирующими молекулами, такими как итерферон-α, тромбоспондин-1, ангиостатин и эндостатин. Существует баланс данных природных стимуляторов и ингибиторов, с помощью которого регулируется находящаяся в норме в состоянии покоя капиллярная сосудистая сеть. Когда данный баланс нарушается, как это имеет место при некоторых заболеваниях, то эндотелиальные клетки капилляров индуцируются для пролиферации, миграции и в конечном итоге дифференциации.
Ангиогенез играет центральную роль в развитии некоторых заболеваний, включая злокачественные опухоли и реваскуляризацию в тканях глаз. Также было показано, что непрерывный рост и метастазирование различных опухолей зависит от прорастания новых кровеносных сосудов хозяина в опухоль в ответ на опухолевые ангиогенные факторы роста. Пролиферация новых кровеносных сосудов в ответ на различные стимулы имеет место в качестве доминирующего фактора при развитии большинства глазных болезней и слепоты, включая пролиферативную ретинопатию при диабете, ARMD, глаукому, интерстициальный кератит и ретинопатию при недоношенности. При данных заболеваниях повреждение тканей может стимулировать высвобождение ангиогенных факторов, приводя к пролиферации капилляров. VEGF играет доминирующую роль в реваскуляризации в радужке и развитии реваскулярных ретинопатий. Несмотря на то что сообщается о наличии четкой корреляции между концентрациями внутри глаза VEGF и развитием ишемической ретинопатической реваскуляризации глаз, вероятно, FGF играет роль. Известно, что кислотный и основной FGF присутствуют в сетчатке взрослого человека в норме, хотя, его детектируемые уровни не всегда коррелируют с реваскуляризацией. В основном это может быть результатом того, что FGF прочно связывается с заряженными компонентами внеклеточного вещества и не всегда может быть легко доступен в свободной диффундируемой форме, которая и детектируется обычными методами в глазных жидкостях.
Конечный общий путь в ангиогенной ответной реакции включает опосредуемый интегрином обмен информацией между пролиферирующими эндотелиальными клетками сосудов и внеклеточным веществом. Данная группа рецепторов адгезии, называемых интегринами, экспрессируется в виде гетеродимеров, имеющих α- и β-субъединицу, во всех клетках. Один такой интегрин, αvβ3, является наиболее «беспорядочным» членом данного семейства и позволяет эндотелиальным клеткам взаимодействовать с широким рядом компонентов внеклеточного матрикса. Антагонисты данного интегрина на основе пептидов и антител подавляют ангиогенез, избирательно индуцируя апоптоз пролиферирующих эндотелиальных клеток сосудов. Существует два цитокин-зависимых пути ангиогенеза, и их можно определить по зависимости от различных интегринов сосудистых клеток, αvβ3 и αvβ5. В частности, ангиогенез, индуцированный основным FGF и VEGF, зависит соответственно от интегрина αvβ3 и αvβ5, поскольку антагонисты на основе антител для каждого интегрина избирательно блокируют данные ангиогенные пути в роговице кроликов и хориоаллантоисной мембраны (САМ) цыплят. Пептидные антагонисты, которые блокируют все αv интегрины, подавляют индуцированный FGF и VEGF ангиогенез. Несмотря на то что в норме кровеносные сосуды глаза у человека не имеют никакого интегрина, αvβ3 и αvβ5 интегрины избирательно располагаются на кровеносных сосудах в тканях пациентов с реваскулярным заболеванием глаз в активной стадии. Несмотря на то что только αvβ3 постоянно присутствует в ткани у пациентов с ARMD, αvβ3 и αvβ5 находятся в тканях у пациентов с пролиферативной ретинопатией при диабете. Введенные системно пептидные антагонисты интегринов блокируют формирование кровеносных сосудов на модели васкулогенеза сетчатки на мышах.
Тестирование потенциальных способов лечения реваскулярных заболеваний сетчатки в значительной мере облегчилось после разработки моделей индуцированной кислородом ретинопатии (OIR) на различных видах животных, включая котят, щенков бигль, крыс и мышей. На каждой из этих моделей воздействие гипероксии на новорожденных животных (или чередование гипероксии и гипоксии) приводит к регрессии или задержке развития сосудов сетчатки с последующим аномальным ангиогенезом после их возвращения в среду с нормальным уровнем кислорода. Данные модели отражают события, имеющие место при ретинопатии при недоношенности (ROP), состояния, в котором принимает участие патологическая реваскуляризация, которая может оказывать отрицательное влияние на недоношенных новорожденных.
В течение последней декады мышиная модель OIR стала наиболее распространенной моделью для изучения аномального ангиогенеза, ассоциированного с индуцированными кислородом ретинопатиями. Характер сосудистых аномалий на данной модели несколько отличается от наблюдаемых при ROP; у мышей центральный, задний участок сетчатки становится аваскулярным после воздействия гипероксии, в то время как у человеческих младенцев аваскулярным является периферический участок. Тем не менее, это широко распространенная модель для исследования механизма развития заболевания и разработки потенциального лечения индуцированной гипоксией ретинопатии, и изменения сосудов являются очень последовательными, воспроизводимыми и поддающимися количественной оценке. В последние годы применение данной модели распространилось на общее изучение ишемических вазопатий и близких антиангиогенных вмешательств, и в настоящее время она широко используется при проведении фундаментальных и прикладных исследований.
Исторически сложилось, что общий метод количественной оценки пролиферативной реваскулярной ответной реакции на модели OIR на мышах основан на подсчете количества клеток, ассоциированных с новыми сосудами, выходящими из сетчатки в стекловидное тело («ядра превнутренней пограничной мембраны (ILM)»). Это осуществляется выполнением сагиттальных поперечных срезов, обычно в областях около (но не включая) диска зрительного нерва. Способ является очень трудоемким, длительным по времени и связан с трудностями, включающими необходимость в дифференциации клеток аномальных сосудов от гиалоидальных сосудов в стекловидном теле. За счет того, что, как правило, оцениваются только каждые 30 серийных срезов, то большая часть ткани не подвергается количественной оценке, что потенциально способствует введению большого количества ошибок. Кроме того, поскольку срезы сразу же готовятся из цельных образцов глаза, это исключает оценку одного и того же глаза по другому важному параметру данной модели, а именно степени облитерации сосудов и степени реваскуляризации, которая происходит одновременно с формированием аномальных реваскулярных ветвей. Данный параметр лучше всего оценивается на тотальных препаратах сетчатки.
В течение многих лет полагалось, что популяция стволовых клеток существует в кровотоке и костном мозге нормального взрослого человека. Различные субпопуляции данных клеток могут претерпевать дифференцировку в гематопоэтические позитивные по дифференцировочному антигену (Lin+) и негативные по дифференцировочному антигену (Lin-) клетки. Кроме того, недавно было показано, что популяция негативных по дифференцировочному антигену гематопоэтических стволовых клеток (HSC) содержит эндотелиальные клетки-предшественники (ЕРС), способные формировать кровеносные сосуды в условиях in vitro и in vivo (смотри Asahara et al., 1997, Science 275: 964-7). Данные клетки могут принимать участие в нормальном и патологическом ангиогенезе в постнатальном периоде развития (смотри Lyden et al., 2001, Nat. Med. 7, 1194-201; Kalka et al. 2000, Proc. Natl. Acad. Sci. USA 97: 3422-7; и Kocher et al. 2001, Nat. Med. 7, 430-6), а также дифференцироваться в различные типы клеток, не относящихся к эндотелиальным клеткам, включая гепатоциты (смотри Lagasse et al. 2000, Nat. Med. 6: 1229-34), микроглию (смотри Priller et al. 2002 Nat. Med. 7, 1356-61), кардиомициты (смотри Orlic et al., 2001, Proc. Natl. Acad. Sci. USA 98: 10344-9) и эпителий (смотри Lyden et al. 2001, Natl. Med. 7: 1194-1201). Несмотря на то что данные клетки использовались на нескольких экспериментальных моделях ангиогенеза, механизм направленности ЕРС на новую сосудистую сеть остается неизвестным и не была установлена стратегия, с помощью которой можно было бы эффективно повышать количество клеток, которые вносят свой вклад в конкретную сосудистую сеть.
В настоящее время гематопоэтические стволовые клетки из костного мозга являются единственным типом стволовых клеток, обычно используемым для терапевтических применений. Клетки HSC костного мозга применялись в течение 40 лет в трансплантатах. В настоящее время с помощью усовершенствованных способов сбора очищенных стволовых клеток можно проводить исследования с целью разработки лекарственных препаратов для лечения лейкемии, лимфомы и наследственных заболеваний крови. Клинические применения стволовых клеток у людей испытывались для лечения диабета и злокачественных опухолей почек на поздних стадиях на ограниченном количестве пациентов.
Сущность изобретения
Настоящее изобретение относится к способу лечения ретинопатии при недоношенности (ROP) и родственных ретинопатических заболеваний. Способ включает введение в сетчатку млекопитающего, страдающего или имеющего риск развития ретинопатии при недоношенности или родственного ретинопатического заболевания, количества клеток из вазотрофической популяции негативных по дифференцировочному антигену гематопоэтических стволовых клеток, эффективного для стимуляции лечебной физиологической реваскуляризации в поврежденных участках сетчатки и ослабления повреждения сетчатки, вызванного заболеванием. Предпочтительно млекопитающее является человеком. В одном предпочтительном варианте осуществления популяция негативных по дифференцировочному антигену гематопоэтических стволовых клеток представляет популяцию негативных по дифференцировочному антигену гематопоэтических стволовых клеток, содержащую гематопоэтические стволовые клетки и эндотелиальные клетки-предшественники (т.е. Lin- HSC). В другом предпочтительном варианте осуществления популяция негативных по дифференцировочному антигену гематопоэтических стволовых клеток представляет популяцию выделенных миелоподобных клеток костного мозга (MLBM), в которой большинство клеток является негативными по дифференцировочному антигену и экспрессирует антиген CD44, а также антиген CD11b. В качестве альтернативы для лечения новорожденных младенцев подходящую популяцию негативных по дифференцировочному антигену гематопоэтических стволовых клеток можно выделить из крови вены пупочного канатика.
Предпочтительно клетки, вводимые млекопитающему, являются аутологичными по отношению к конкретному млекопитающему, которое подвергается лечению. Предпочтительно клетки вводят посредством внутриглазной инъекции. В предпочтительном варианте осуществления клетки вводят млекопитающему, страдающему ретинопатией при недоношенности (ROP), такому как человеческий младенец на ранних стадиях развития заболевания. В другом предпочтительном варианте осуществления клетки вводят млекопитающему, имеющему риск развития ROP или близкого ретинопатического заболевания, в качестве профилактического средства в начале развития симптомов заболевания до воздействия гипероксии на новорожденного.
Результаты, полученные на модели ROP индуцированной кислородом ретинопатии (OIR), свидетельствуют о том, что настоящий способ лечения способствует заживлению и восстановлению сосудов в сетчатке млекопитающего, которое страдает ретинопатией. Кроме того, способ способствует восстановлению зрительных нейронов за счет нейротрофического действия клеток. Преимущественно клетки из популяции негативных по дифференцировочному антигену гематопоэтических стволовых клеток по изобретению включаются в сосудистую сеть сетчатки и дифференцируются в эндотелиальные клетки, одновременно включаясь в нейронную сеть и тем самым, ослабляя дегенерацию нейронов, таких как колбочки сетчатки. Популяции выделенных негативных по дифференцировочному антигену гематопоэтических стволовых клеток включают клетки, которые избирательно направлены на активированные астроциты сетчатки при интравитреальном введении в глаза и которые стабильно включаются в новую сосудистую и нейронную сеть глаза.
В еще одном предпочтительном варианте осуществления клетки из популяций негативных по дифференцировочному антигену гематопоэтических стволовых клеток трансфицируют терапевтически пригодным геном. Например, клетки можно трансфицировать полинуклеотидами, которые операбильно кодируют нейротрофические вещества и тому подобное, которые обладают избирательным действием на новую сосудистую сеть и дополнительно способствуют лечебной реваскуляризации и развитию нейронов посредством опосредуемой клетками генной терапии.
Конкретным преимуществом лечения глаз способами по настоящему изобретению является вазотрофический и нейротрофический эффект спасения, наблюдаемый в глазах после интравитреального введения клеток из популяций негативных по дифференцировочному антигену гематопоэтических стволовых клеток. Нейроны и фоторецепторы сетчатки, в частности колбочки, сохраняются и можно достичь некоторого улучшения зрительной функции в глазах, обработанных популяциями клеток по изобретению.
Предпочтительно сетчатка с патологией для лечения способом по изобретению включает активированные астроциты. Это можно осуществить ранней обработкой глаза популяцией негативных по дифференцировочному антигену гематопоэтических стволовых клеток, когда имеется ассоциированный глиоз, или применением лазера для стимуляции местной пролиферации активированных астроцитов.
Краткое описание фигур
На фигурах:
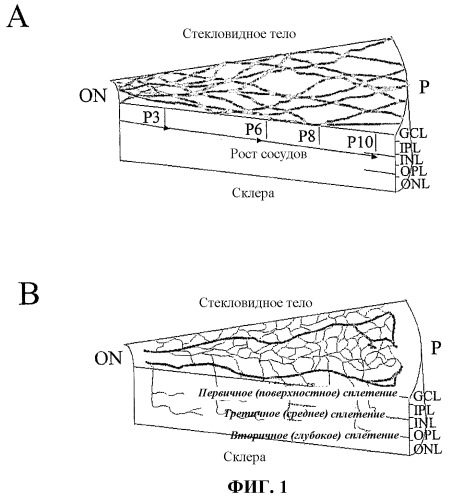
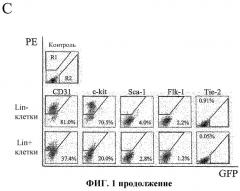
Фиг.1 представляет схематичные изображения развивающейся сетчатки у мышей. (А) Развитие первичного сплетения. (В) Вторая фаза формирования сосудов сетчатки. GCL, слой клеток ганглия; IPL, слой внутреннего сплетения; INL, внутренний ядерный слой; ОPL, слой внешнего сплетения; ОNL, внешний ядерный слой; RPE, пигментный эпителий сетчатки; ON, зрительный нерв; Р, периферическая область. Панель (С) отражает характеристику с использованием проточной цитометрии разделенных клеток, производных костного мозга, Lin+ HSC и Lin- HSC. Верхний ряд: точечный график распределения клеток, не меченных антителами, в которых R1 представляет оцениваемую количественно область позитивного окрашивания РЕ; R2 представляет GFP-позитивную область; средний ряд: клетки Lin- HSC (С57В/6) и нижний ряд: Lin+ HSC (С57В/6), каждую линию клеток метили РЕ-конъюгированными антителами против Sca-1, c-kit, Flk-1/KDR, CD31. Данные с Tie-2 получали на мышах Tie-2-GFP. Проценты указывают процент положительно-меченых клеток из популяции Lin- HSC и Lin+ HSC в целом.
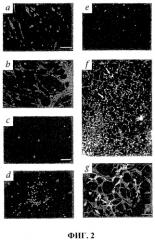
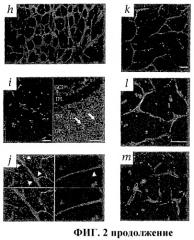
Фиг.2 показывает результаты подсадки клеток Lin- HSC в развивающуюся сетчатку у мыши. (а) На 4 сутки после интравитреальной инъекции (Р6) клетки еGFP+ Lin- HSC прикрепляются и дифференцируются в сетчатке. (b) Клетки Lin- HSC (мыши В6.129S7-Gtrosa26, окрашены антителами β-gal) прижились над сосудистой сетью, окрашенной антителами против коллагена IV (звездочки указывают наклон сосудистой сети). (с) Большая часть клеток Lin+ HSC (еGFP+) на четвертые сутки после инъекции (Р6) была не способна к дифференцировке. (d) Брыжеечные еGFP+ мышиных ЕС на четвертые сутки после инъекции (Р6). (е) Клетки Lin- HSC (еGFP+), введенные в глаза взрослым мышам. (f) Хоминг и дифференцировка клеток еGFP+ Lin- HSC (стрелки) при малом увеличении вдоль уже имеющейся астроцитной матрицы у трансгенных мышей GFAP-GFP. (g) Ассоциация клеток Lin- (еGFP) и лежащих под ними астроцитов (стрелки) при большем увеличении. (h) Трансгенные контрольные мыши GFAP-GFP без инъекции. (i) На 4 сутки после инъекции (Р6), клетки еGFP+ Lin- HSC мигрируют и подвергаются дифференцировке в области будущего глубокого сплетения. На левой фигуре показана активность Lin- HSC в тотальном препарате сетчатки; на правой фигуре показано расположение клеток Lin- HSC (стрелки) в сетчатке (верхняя часть - стекловидное тело, нижняя - склера). (j) Двойное мечение антителами против α-CD31-PE и α-GFP-alexa 488. Через 7 суток после инъекции введенные клетки Lin- HSC (еGFP, красный цвет) включались в сосудистую сеть (CD31). Кончики стрелок указывают на зоны включения. (k) Клетки еGFP+ Lin- HSC образуют сосуды на 14 сутки после введения (Р17). (l и m) Внутрикардиальная инъекция родамина-декстрана указывает, что сосуды являются интактными и функциональными в обоих первичном (l) и глубоком сплетениях (m).
Фиг.3 показывает, что клетки еGFP+ Lin- HSC подвергаются хомингу в зону глиоза (на что указывают экспрессирующие GFAP астроциты, левый снимок), индуцированного лазерным (а) и механическим (b) воздействием во взрослой сетчатке (звездочки показывают место повреждения). На правых снимках при большом увеличении показана тесная ассоциация клеток Lin- HSC и астроцитов. Масштаб=20 мкМ.
Фиг.4 показывает спасение под действием клеток Lin- HSC сосудистой сети мышиной, подвергающейся дегенерации сетчатки. (а-d) Образцы сетчатки на 27 сутки после введения (Р33) при окрашивании коллагеном IV; (а) и (b) отсутствие различий в образцах клетчатки после введении клеток Lin+ HSC (мыши Balb/c) в сосудистой сети по сравнению с нормальными мышами FVB; (с) и (d) в образцах сетчатки после введения Lin- HSC (мыши Balb/c) имеет место богато развитая сосудистая сеть, аналогичная мышам дикого типа; (а) и (с) замороженные срезы тотального препарата сетчатки (верхняя часть - стекловидное тело, нижняя - склера) при окрашивании DAPI; (b) и (d) глубокое сплетение тотального образца сетчатки; (е) график в столбцах, показывающий увеличение сосудистой сети глубокого сосудистого сплетения, образованного после введения клеток Lin- HSC в сетчатку (n=6). Степень глубокой васкуляризации сетчатки оценивали количественно по определению общей длины сосудов на каждом снимке. Проводили сравнение средней общей длины сосудов/большое увеличение (в микронах) для образцов сетчатки, обработанных клетками Lin- HSC, Lin+ HSC и контрольными образцами. (f) Сравнение длины глубокого сосудистого сплетения после введения клеток Lin- HSC (R, правый глаз) или Lin+ HSC (L, левый глаз) у мышей rd/rd. Представлены результаты по 6 отдельным мышам (каждый цвет представляет отдельную мышь). (g) и (h) Клетки Lin- HSC также (мыши Balb/c) спасали сосудистую сеть у мышей rd/rd при введении в глаза на Р15. Показаны промежуточное и глубокое сосудистое сплетение в образцах сетчатки после инъекции клеток Lin- HSC (g) и Lin+ HSC (h) (через один месяц после введения).
Фиг.5 представляет микрофотографии ткани мышиной сетчатки: (а) глубокий слой тотального препарата сетчатки (мыши rd/rd) на 5 сутки после введения (Р11) с видимыми клетками еGFP+ Lin- HSC (серым цветом). (b) и (c) Сосудистая сеть сетчатки на Р60 у Tie-2-GFP (мыши rd/rd), которым ввели клетки Balb/c Lin- HSC (b) или Lin+ HSC (с) на Р6. Видны только эндогенные эндотелиальные клетки (окрашенные GFP) на левых панелях (b) и (с). Средние панели (b) и (с), окрашенные антителами против CD31; стрелки указывают сосуды, окрашенные CD31, но не GFP, правые панели (b) и (с) показывают окрашивание обоими GFP и CD31. (d) Окрашивание α-SMA сетчатки после введения Lin- HSC (левая панель) и контрольной сетчатки (правая панель).
Фиг.6 показывает, что трансфицированные T2-TrpRS клетки Lin- HSC подавляют развитие сосудистой сети сетчатки у мышей. (а) Схематичное представление человеческих TrpRS, T2-TrpRS и Т2- TrpRS с сигнальной последовательностью Igk на аминоконце. (b) Сетчатки после введения трансфицированных T2-TrpRS клеток Lin- HSC экспрессируют белок T2-TrpRS в условиях in vivo. (1) Рекомбинантный T2-TrpRS, продуцированный E. coli; (2) рекомбинантный T2-TrpRS, продуцированный E. coli; (3) рекомбинантный T2-TrpRS, продуцированный E. coli; (4) контрольная сетчатка; (5) сетчатка после введения Lin- HSC + pSecTag2A (только вектор); (6) сетчатка после введения Lin- HSC + pKLe135 (Igk-T2-TrpRS в pSecTag). (а) Эндогенный TrpRS. (b) Рекомбинантный TrpRS. (с) Т2-TrpRS в сетчатке после введения Lin- HSC. (c-f) Показательные первичное (поверхностное) и вторичное (глубокое) сплетения в обработанной сетчатке на 7 сутки после введения. (с) и (d) Нормальное развитие глаза после обработки клетками Lin- HSC, трансфицированными пустой плазмидой. (е) и (f) В большинстве глаз, обработанных трансфицированными T2-TrpRS клетками Lin- HSC, наблюдалось подавление глубокого сплетения. (с) и (е) Первичное (поверхностное) сплетение. (d) и (f) Вторичное (глубокое) сплетение. Слабая линия сосудов, показанная на (f), представляет «протечку крови» сосудов первичной сети на (е).
Фиг.7 показывает последовательность ДНК, кодирующей меченный His6 Т2-TrpRS, SEQ ID NO: 1.
Фиг.8 показывает аминокислотную последовательность меченного His6 Т2-TrpRS, SEQ ID NO: 2.
Фиг.9 показывает микрофотографии и электроретинограммы (ERG) сетчатки от мышей, которым вводили в глаза клетки Lin- HSC и Lin+ HSC (контрольные).
Фиг.10 представляет статистические графики зависимости, показывающие корреляцию между спасением нейронов (ось Y) и спасением сосудов (ось X) для обоих промежуточного (Int.) и глубокого слоев глаз мыши rd/rd, обработанных Lin- HSC.
Фиг.11 представляет статистические графики зависимости, показывающие отсутствие корреляции между спасением нейронов (ось Y) и спасением сосудов (ось X) для глаз мышей rd/rd, обработанных Lin+ HSC.
Фиг.12 представляет график в столбцах длины сосудов (ось Y) в произвольных относительных единицах для глаз у мышей rd/rd, обработанных Lin- HSC (темные колонки) и не обработанных (светлые колонки) у мышей rd/rd через 1 месяц (1М), 2 месяца (2М) и 6 месяцев (6М) после введения.
Фиг.13 представляет графики в столбцах количества ядер во внешнем слое нейронов (ONR) у мышей rd/rd через 1 месяц (1М), 2 месяца (2М) и 6 месяцев (6М) после введения и показывает достоверное увеличение количества ядер в глазах, обработанных Lin- HSC (темные колонки) по сравнению с контрольными глазами, обработанными Lin+ HSC (светлые колонки).
Фиг.14 представляет графики зависимости количества ядер во внешнем слое нейронов (ONR) у мышей rd/rd при сравнении правого глаза (R, обработанного клетками Lin- HSC) с левым глазом (L, обработанным клетками Lin+ HSC) на периоды времени (после введения) через 1 месяц (1М), 2 месяца (2М) и 6 месяцев; каждая линия представляет график сравнения глаз для отдельной мыши.
Фиг.15 представляет изменения сосудистой сети и нейронов в сетчатке у мышей rd1/rd1 (CH3/HeJ, левые панели) или у мышей дикого типа (C57BL/6, правые панели). Показана сосудистая сеть промежуточного (верхние панели) или глубокого (средние панели) сосудистых сплетений в тотальном препарате сетчатки (красный цвет: коллаген IV, зеленый цвет: CD31) и срезах (красный цвет: DAPI, зеленый цвет: CD31, нижние панели) одних и тех же образцов сетчатки (Р: в день после рождения). GCL: слой клеток ганглия, INL: внутренний ядерный слой, ОNL: внешний ядерный слой.
Фиг.16 показывает, что введение клеток Lin- HSC элиминирует дегенерацию нейронов у мышей rd1/rd1. (А, В и С) Сосудистая сеть сетчатки промежуточного (Int.) или глубокого сплетения и срезы глаза после введения Lin- HSC (правые панели) и противоположного контрольного глаза с введением клеток (CD31-) (левые панели) на Р30 (А), Р60 (В) и Р180 (С). (D) Среднее значение общей длины сосудистой сети (+ или - стандартная ошибка средней) в образцах сетчатки после введения клеток Lin- HSC или контрольных клеток (CD31-) на Р30 (слева, n=10), на Р60 (в середине, n=10) и на Р180 (справа, n=6). Данные по промежуточному (Int.) и глубокому сосудистому сплетениям приведены отдельно (ось Y: относительная длина сосудистой сети). (Е) Среднее количество ядер клеток в ONL на Р30 (слева, n=10), на Р60 (в середине, n=10) и на Р180 (справа, n=6) при обработке сетчатки контрольными клетками (CD31-) или клетками Lin- HSC (ось Y: относительное количество ядер клеток в ONL). (F) Линейные корреляции между длиной сосудистой сети (ось X) и количеством ядер клеток в ONL (ось Y) на Р30 (слева), на Р60 (в середине) и на Р180 (справа) в сетчатке после введения Lin- HSC и в сетчатке, обработанной контрольными клетками.
Фиг.17 показывает, что функция сетчатки спасается при введении клеток Lin- HSC. Использовали электроретинографические исследования (ERG) для оценки функции сетчатки после введения клеток Lin- HSC и контрольных клеток (CD31-). (А и В) Показательные случаи спасенной и не спасенной сетчатки через 2 месяца после введения. Представлен срез сетчатки правого глаза, обработанного клетками Lin- HSC (А), и левого глаза, обработанного контрольными клетками (CD31-) (В), у одного и того же животного (зеленый цвет: окрашенная CD31 сосудистая сеть; красный цвет: окрашенные DAPI ядра). (С) Результаты ERG, полученные у одного и того же животного, представлены на (А) и (В).
Фиг.18 показывает, что популяция клеток человеческого костного мозга может спасать дегенерирующую сетчатку у мышей rd1 (А-С). Спасение также наблюдали на другой модели дегенерации сетчатки у мышей rd10 (D-K). (А) Человеческие клетки Lin- HSC (hLin- HSC), меченные зеленой краской, могут подвергаться дифференцировке в сосудистые клетки сетчатки после интравитреальной инъекции мышам C3SnSmn.CB17-Prkdc SCID. (В и С) Сосудистая сеть сетчатки (левые панели, сверху: промежуточное сплетение, внизу: глубокое сплетение) и нейроны (правая панель) в глазу после обработки клетками hLin- HSC (В) и в противоположном контрольном глазу (С) через 1,5 месяца после инъекции. (D-K) Спасение у мышей rd10 введением клеток Lin- HSC (обработка на Р6). Представлены показательные образцы сетчатки на Р21 (D: Lin- HSC, Н: контрольные клетки), на Р30 (Е: Lin- HSC, I: контрольные клетки), на Р60 (F: Lin- HSC, J: контрольные клетки), на Р105 (G: Lin- HSC, K: контрольные клетки) (обработанные и контрольные глаза от одного и того же животного на каждую временную точку). Сосудистую сеть сетчатки (верхний снимок на каждой панели представляет промежуточное сплетение; средний снимок на каждой панели представляет глубокое сплетение) окрашивали CD31 (зеленый цвет) и коллагеном IV (красный цвет). Нижний снимок на каждой панели представляет поперечный срез того же образца сетчатки (красный цвет: DAPI, зеленый цвет: CD31).
Фиг.19 показывает, что продукция кристаллина αА подвергается положительной регуляции в спасенных клетках внешнего ядерного слоя после введения клеток Lin- HSC, но не в противоположном глазу, обработанном контрольными клетками. Левая панель; контрольный IgG в спасенной сетчатке, средняя панель; кристаллин αА в спасенной сетчатке, правая панель; кристаллин αА в не спасенной сетчатке.
Фиг.20 включает таблицы генов, которые подвергаются положительной регуляции у мышей в сетчатке, обработанной клетками Lin- HSC по настоящему изобретению. (А) Гены, экспрессия которых повышается в 3 раза у мышей в сетчатке после обработки мышиными клетками Lin- HSC. (В) Гены кристаллина, которые подвергаются положительной регуляции у мышей в сетчатке после обработки мышиными клетками Lin- HSC. (С) Гены, экспрессия которых повышается в 2 раза у мышей в сетчатке после обработки человеческими клетками Lin- HSC. (D) Гены нейротрофических факторов или факторов роста, экспрессия которых подвергается положительной регуляции у мышей в сетчатке, обработанной человеческими клетками Lin- HSC.
Фиг.21 показывает распределение поверхностных антигенов CD31 и интегрина α6 в популяциях позитивных на CD33 (CD133+) и негативных на CD33 (CD133-) человеческих клеток Lin- HSC. На левых панелях приведены графики рассеивания, полученные проточной цитометрией. Центральные и правые панели представляют гистограммы, показывающие уровень экспрессии специфических антител в популяции клеток. Ось Y представляет количество эпизодов, и ось Х представляет интенсивность сигнала. Окрашенная гистограмма со сдвигом вправо от контрольной гистограммы (линия) представляет увеличение сигнала флуоресценции и экспрессии антител по сравнению с фоновым уровнем.
Фиг.22 показывает постнатальное развитие сетчатки у мышей С57/В16 дикого типа при нормальном уровне кислорода (нормоксия) в постнатальном периоде от Р0 до Р30.
Фиг.23 показывает модель индуцированной кислородом ретинопатии на мышах С57/В16 при высоких концентрациях кислорода (гипероксия; 75% кислорода) в период между Р7 и Р12 с последующей нормоксией в период Р12-Р17.
Фиг.24 показывает спасение сосудов при обработке популяциями Lin- HSC на модели индуцированной кислородом ретинопатии (OIR).
Фиг.25 показывает, что спасенные фоторецепторы во внешнем ядерном слое (ONL) у мышей rd1 после интравитреального введения клеток Lin- HSC преимущественно представляют колбочки. Небольшой процент фоторецепторов в сетчатке у мышей дикого типа (верхняя панель)