Способ получения сульфонных производных 2-нитро-2-(3-арил-1,2,4-оксадиазол-5-ил)этана
Иллюстрации
Показать всеИзобретение относится к способу получения новых сульфонных производных 2-нитро-2-(3-арил-1,2,4-оксадиазол-5-ил) этана общей формулы I, которые могут быть использованы в качестве потенциальных антимикобактериальных препаратов
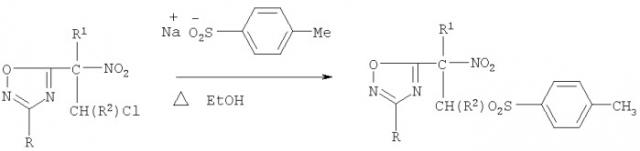
где, Ia R=3-NO2C6H4, R1=NO2, R2=H; б R=3-NO2C6H4, R1=NO2, R2=СН3; в R=4-СН3ОС6Н4, R1=NO2, R2=H; г R=4-СН3ОС6Н4, R1=NO2, R2=СН3; д R-4-СН3ОС6Н4 Rl=CO2Et, R2=H; e R=4-СН3ОС6Н4, Rl=CO2Et, R2=CH3; ж R=4-СН3С6Н4, Rl=CO2Et, R2=H. Способ заключается в нагревании и перемешивании в растворителе замещенного 2-нитро-1-хлоро-2-(3-арил-1,2,4-оксадиазол-5-ил)этана с эквимольным количеством 4-толилсульфината натрия и последующем выдерживании реакционной смеси при комнатной температуре. Заявленный способ исключает стадию подготовки растворителя и позволяет увеличить выход целевого соединения. 2 табл.
Реферат
Изобретение относится к области органической химии - синтезу сульфонных производных 2-нитро-2-(3-арил-1,2,4-оксадиазол-5-ил) этана, представляющих интерес в качестве препаратов фармацевтического назначения.
Изобретение относится к разработке оптимальных условий синтеза новых представителей сульфонных производных 2-нитро-2-(3-арил-1,2,4-оксадиазол-5-ил) этана общей формулы I, позволяющие существенно увеличить выход целевых соединений, которые могут быть использованы в качестве потенциальных антимикобактериальных препаратов [М.Д.Машковский. Лекарственные средства. М.: Новая Волна. 2006. С.872].
Ia R=3-NO2C6H4, R1=NO2, R2=H; б R-3-НО2С6Н4, R1=NO2, R2=СН3; в R-4-СН3ОС6Н4, R1=NO2, R2=H; г R=4-СН3ОС6Н4, R1=NO2, R2=СН3; д R=4-СН3ОС6Н4, R1=CO2Et, R2=H; e R=4-СН3ОС6Н4, R1=CO2Et, R2=СН3; ж R=4-СН3С6Н4, R1= CO2Et, R2=H
1,2,4-Оксадиазольный каркас, ковалентно связанный с сульфонной группой, является малоисследованной системой. Тем не менее соединения подобного типа перспективны с точки зрения их практического применения. В частности, 5-метил-3-фенилсульфонилимино-1,2,4-оксадиазол обладает антистрептококковой и антипневмококковой активностью, сравнимой с известным препаратом сульфопиридином [G.W.Anderson, H.E.Faith, H.W.Marson. J. Am. Chem. Soc. 1942, 64 (15), 2902].
Известен способ получения сульфонных производных 2-нитро-2-(3-фенил(метил)-1,2,4-оксадиазол-5-ил) этана общей формулы I, основанный на реакции нуклеофильного замещения терминального хлора в 5-нитрохлороэтильных производных 1,2,4-оксадиазола толилсульфонной группой [А.Г.Тырков. ЖОрХ. 2006. 42 (7), 1063; А.Г.Тырков, Н.Г.Урляпова, А.Д.Даудова. Хим.-фарм. журнал. 2006. 40 (7), 30] при нагревании реакционной смеси до 50°С в течение 2 часов в осушенном этаноле и последующем выдерживании смеси 48 часов. Недостатки этого способа получения сульфонов общей формулы I - предварительная подготовка растворителя, что удлиняет время синтеза, а также их низкий до 54% выход продуктов.
Задачей изобретения является разработка оптимальных условий синтеза новых представителей сульфонных производных 2-нитро-2-(3-арил-1,2,4-оксадиазол-5-ил) этана с высоким выходом, позволяющих расширить базу веществ, обладающих потенциальной антимикобактериальной активностью. Для достижения технического результата оптимальные условия получения новых сульфонных производных 2-нитро-2-(3-арил-1,2,4-оксадиазол-5-ил) этана общей формулы I
Ia R=3-NO2C6H4, R1=NO2, R2=H; б R=3-NO2C6H4, R1=NO2, R2=СН3; в R=4-СН3ОС6Н4, R1=NO2, R2=H; г R=4-СН3ОС6Н4, R1=NO2, R2=CH3; д R=4-СН3ОС6Н4, R1=CO2Et, R2=H; е R=4-СН3ОС6Н4, R1=CO2Et, R2=СН3; ж R=4-СН3С6Н4, R1=CO2Et, R2=H
заключаются в нагревании и перемешивании замещенных 2-нитро-1-хлоро-2-(3-арил-1,2,4-оксадиазол-5-ил) этана III в течение 4 ч при температуре 70°С в техническом этаноле с эквимольным количеством 4-толилсульфината натрия и последующем выдерживании при комнатной температуре 48 часов. Эти условия позволили исключить стадию предварительной подготовки растворителя и одновременно увеличить выход целевых соединений общей формулы I с 54% до 80%.
При этом замещенный нитроэтильный фрагмент структурно связан как с 1,2,4-оксадиазольным гетероциклом, так и с толилсульфонной группой. Исходные 2-нитро-1-хлоро-2-(3-арил-1,2,4-оксадиазол-5-ил) этаны III могут быть получены по известной методике [А.Г.Тырков ЖОрХ. 2000. 36(5), 788; А.Г.Тырков ЖОрХ. 2000. 36(10), 1580] из замещенных 5-нитрометил-1,2,4-оксадиазолов II [А.Г.Тырков, Б.Г.Суйханова ЖОрХ. 1999. 35(9), 1330].
II-III а R=3-NO2C6H4, R1=NO2, R2=H; б R=3-NO2C6H4, R1=NO2, R2=СН3; в R=4-СН3ОС6Н4, R1=NO2, R2=H; г R=4-СН3ОС6Н4, R1=NO2, R2=СН3; д R=4-СН3ОС6Н4, R1=CO2Et, R2=H; е R=4-СН3ОС6Н4, R1=CO2Et, R2=СН3; ж R=4-СН3С6Н4, R1=CO2Et, R2=H
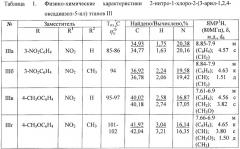
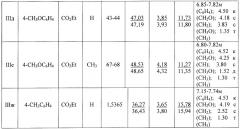
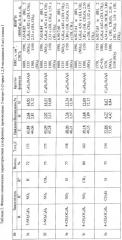
Физические константы, данные элементного анализа и ЯМР1Н спектров 2-нитро-1-хлоро-2-(3-арил-1,2,4-оксадиазол-5-ил) этанов III а-ж представлены в таблице 1.
Таким образом, полученный технический результат заключается в разработке оптимальных условий синтеза новых представителей сульфонных производных 2-нитро-2-(3-арил-1,2,4-оксадиазол-5-ил) этана с выходом до 80%, который основан на нагревании соединений III в течение 4 ч при температуре 70°С и перемешивании в техническом этаноле с эквимольным количеством 4-толилсульфината натрия с последующим выдерживанием реакционной смеси при комнатной температуре 48 часов. Разработанные оптимальные условия синтеза позволили расширить ряд сульфонов общей формулы I, а тем самым и спектр потенциально биологически активных веществ. Таким образом, совокупность существенных признаков, изложенных в формуле изобретения, позволяет достичь желаемого результата, а именно исключить стадию подготовки растворителя и значительно повысить выход заявляемых соединений.
Примеры разработанных оптимальных условий синтеза новых сульфонных производных 2-нитро-2-(3-арил-1,2,4-оксадиазол-5-ил) этанов Ia-ж представлены ниже. Выходы, температуры плавления, данные элементного анализа и спектральные характеристики приведены в таблице 2.
Пример 1.
2,2-Динитро-2-[3-(3-нитрофенил)-1,2,4-оксадиазол-5-ил]этил 4-толилсульфон (соединение Ia). К раствору 1,0 г (0,003 моль) 5-(2,2-динитро-1-хлороэтил)-3-(3-нитрофенил)-1,2,4-оксадиазола в 50 мл технического этанола в два приема присыпают 0,5 г (0,003 моль) 4-толилсульфината натрия. Реакционную смесь перемешивают 4 ч при 70°С и оставляют при комнатной температуре на 48 ч. Растворитель выпаривают на ротационном испарителе, остаток экстрагируют этоксиэтаном 2×10 мл, эфир удаляют в вакууме, а остаток хроматографируют, собирая элюент хлороформа.
Пример 2.
1-Метил-2,2-динитро-2-[3-(3-нитрофенил)-1,2,4-оксадиазол-5-ил]этил 4-толилсульфон (соединение Iб). Получают аналогично соединению Ia из 1,1 г (0,003 моль) 5-(3,3-динитро-2-хлоропропил)-3-(3-нитрофенил)-1,2,4-оксадиазола и 0,5 г (0,003 моль) 4-толилсульфината натрия.
Пример 3.
3-(4-Метоксифенил)-5-[2-(4-толил)сульфонил]-1,1-динитроэтил-1,2,4-оксадиазол (соединение Iв). Получают аналогично соединению Ia из 0,9 г (0,003 моль) 5-(2,2-динитро-2-хлороэтил)-3-фенил-1,2,4-оксадиазола и 0,5 г (0,003 моль) 4-толилсульфината натрия.
Пример 4.
3-(4-Метоксифенил)-5-[2-(4-толил)сульфонил]-1,1-динитропропил-1,2,4-оксадиазол (соединение Iг). Получают аналогично соединению Ia из 1,0 г (0,003 моль) 5-(3,3-динитро-2-хлоропропил)-3-фенил-1,2,4-оксадиазола и 0,5 г (0,003 моль) 4-толилсульфината натрия.
Пример 5.
Этил-2-[3-(4-метоксифенил)-1,2,4-оксадиазол-5-ил]-3-[(4-толил)сульфонил]-2-нитропропаноат (соединение Iд). Получают аналогично соединению Ia из 1,1 г (0,003 моль) этил-[3-(4-метоксифенил)-1,2,4-оксадиазол-5-ил]нитро (хлороэтил) ацетата и 0,5 г (0,003 моль) 4-толилсульфината натрия.
Пример 6.
Этил-2-[3-(4-метоксифенил)-1,2,4-оксадиазол-5-ил]-3-[(4-толил)сульфонил]-2-нитробутаноат (соединение Ie). Получают аналогично соединению Ia из 1,1 г (0,003 моль) этил-[3-(4-метоксифенил)-1,2,4-оксадиазол-5-ил]нитро(1-хлороэтил) ацетата и 0,5 г (0,003 моль) 4-толилсульфината натрия.
Пример 7.
Этил-2-(4-метилфенил-1,2,4-оксадиазол-5-ил)-3-(4-толил)сульфонил)-2-нитробутаноат (соединение Iж). Получают аналогично соединению Ia из 0,8 г (0,003 моль) этил-(4-метил-1,2,4-оксадиазол-5-ил)нитро(1-хлороэтил) ацетата и 0,5 г (0,003 моль) 4-толилсульфината натрия.
Таким образом, главными преимуществами способа получения сульфонных производных 2-нитро-2-(3-арил-1,2,4-оксадиазол-5-ил) этана, заявленного в настоящем изобретении, по сравнению с ранее описанным способом является исключение стадии подготовки растворителя и высокий выход целевых соединений.
Способ получения новых сульфонных производных 2-нитро-2-(3-арил-1,2,4-оксадиазол-5-ил)этана общей формулы I где Ia) R - 3-NO2C6H4, R1 - NO2, R2 - H; б) R - 3-NO2C6H4, R1 - NO2, R2 - CH3; в) R - 4-СН3ОС6Н4, R1 - NO2, R2 - H; г) R - 4-СН3ОС6Н4, R1 - NO2, R2 - CH3; д) R - 4-СН3ОС6Н4, R1 - CO2Et, R2 - H; e) R - 4-СН3ОС6Н4, R1 - CO2Et, R2 - СН3; ж) R - 4-СН3С6Н4, R1 - CO2Et, R2 - H,заключающийся в нагревании и перемешивании в растворителе замещенного 2-нитро-1-хлоро-2-(3-арил-1,2,4-оксадиазол-5-ил)этана с эквимольным количеством 4-толилсульфината натрия и последующем выдерживании реакционной смеси при комнатной температуре.