Тетра-(5-ацетиламино-7-гидрокси)-антрахинонопорфиразины меди и кобальта
Иллюстрации
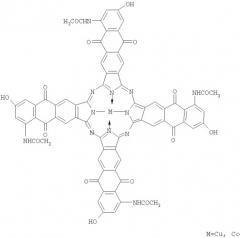
Показать всеИзобретение относится к тетра-(5-ацетиламино-7-гидрокси)антрахинонопорфиразинам меди и кобальта формулы
Полученные соединения могут быть использованы в качестве красителей и катализаторов. 7 ил.
Реферат
Введение
Изобретение относится к химической промышленности, а именно к получению новых производных металлопорфиразина - тетра-(5-ацетиламино-7-гидрокси)антрахинонопорфиразинов меди и кобальта как исходных соединений для синтеза металлокомплексов тетра-(5-ацетиламино-7-гептилокси)антрахинонопорфиразина, которые могут быть использованы в качестве красителей, катализаторов и в других отраслях науки и техники.
Уровень техники
Богатейшая возможность химической модификации соединений порфиразинового ряда позволяет использовать их по различному назначению, например в качестве светопрочных красителей и пигментов [Степанов Б.И. Введение в химию и технологию органических красителей. Учебн. для вузов. 3-е изд. перераб. и доп. М.: Химия, 1984. 592 с.], в качестве катализаторов различных процессов [Тарасевич М.С., Радюшкина К.А. Катализ и электрокатализ металлопорфиринами. - М.: Наука, 1982. 168 с., Стучинская Т.Л. Катализаторы окисления сернистых соединений на основе производных фталоцианина кобальта: Дисс.… канд. хим. наук. Новосибирск. ИК СО РАН. 1999. 131 с.].
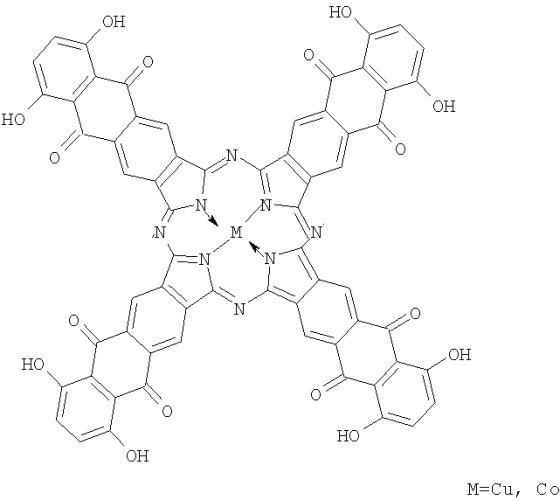
Наиболее близкими структурными аналогами медного и кобальтового комплексов заявляемого соединения являются тетра-(5,8-дигидрокси)антрахинонопорфиразины кобальта и меди [Борисов А.В., Майзлиш В.Е., Шапошников Г.П. Способ получения металлокомплексов тетра-(5,8-дигидрокси)антрахинонопорфиразина. Пат. РФ 2277098 БИ №15 от 27.05.06] формулы
Однако данные соединения не обладают растворимостью в органических средах, вследствие чего не могут быть использованы в качестве красителей и проявляют низкую каталитическую активность.
Сущность изобретения
Изобретательская задача состояла в поиске новых производных металлотетраантрахинонопорфиразинов, которые при использовании их в качестве исходных продуктов дали бы возможность синтезировать замещенные тетраантрахинонопорфиразина, обладающие свойствами красителей и катализаторов.
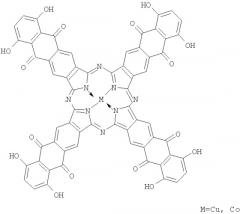
Поставленная задача решена медным или кобальтовым комплексами тетра-(5-ацетиламино-7-гидрокси)антрахинонопорфиразина формулы
Структура этих соединений доказана данными элементного анализа, ИК и электронной спектроскопии.
Так, в ИК спектре медного комплекса (фиг.1) можно выделить ряд общих полос поглощения с незамещенным аналогом [K.Sakamoto, E.Ohno Synthesis of Cobalt Phthalocyanine Derivatives and their Cyclic Voltammograms // Dyes and Pigments. 1997. Vol.35. N4. P.375-386].
В электронных спектрах поглощения тетра-(5-ацетиламино-7-гидрокси)антрахинонопорфиразина меди и кобальта наблюдается интенсивное поглощение при 744-746 нм в концентрированной серной кислоте (фиг.2, 3), при 704 нм в диметилформамиде, при 694 нм в 1%-м растворе гидроксида натрия.
Изобретение позволяет получить следующие преимущества: использование тетра-(5-ацетиламино-7-гидрокси)антрахинонопор-фиразина меди и кобальта дает возможность синтезировать металло-комплексы тетра-(5-ацетиламино-7-гептилокси)антрахинонопорфи-разина, обладающие свойствами красителей и катализаторов.
Сведения, подтверждающие возможность воспроизведения изобретения.
Для реализации способа используют следующие вещества:
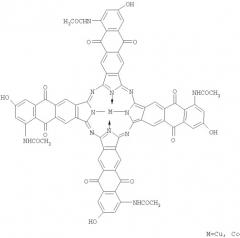
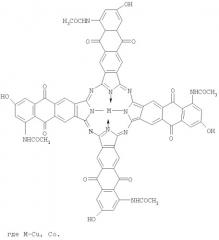
- тетра-(5-ацетиламино-7-метокси)антрахинонопорфиразины меди и кобальта
- гидроксид натрия - ГОСТ 2263-79.
Заявленные соединения получают из тетра-(5-ацетиламино-7-метокси)антрахинонопорфиразинов меди и кобальта гидролизом их в 1%-м растворе гидроксида натрия.
Поскольку тетра-(5-ацетиламино-7-метокси)антрахинонопорфиразины меди и кобальта являются новыми соединениями и не выпускаются промышленностью, они были получены следующим способом: сначала проводят ацилирование уксусным ангидридом м-анизидина, затем полученный 1-ацетиламино-3-метоксибензол подвергают взаимодействию с диангидридом пиромеллитовой кислоты в присутствии безводного хлористого алюминия, после чего проводят внутримолекулярную циклизацию путем обработки полученной на второй стадии 5-[(2'-ацетиламино-4'-метокси)бензоил]тримелитовой кислоты концентрированной серной кислотой (моногидратом). В результате внутримолекулярной циклизации получают 2,3-дикарбокси-5-ацетиламино-7-метоксиантрахинон, из которого затем методом тем-платного синтеза получают тетра-(5-ацетиламино-7-метокси)антрахинонопорфиразины меди и кобальта. Тетра-(5-ацетиламино-7-гидрокси)антрахинонопорфиразины меди и кобальта получают путем гидролиза последних в 1%-м растворе гидроксида натрия.
Стадия 1. Синтез 1-ацетиламино-3-метоксибензола.
В колбе, снабженной мешалкой, термометром и обратным холодильником, растворяют 6.1 г (0.05 моль) м-анизидина в 10 мл толуола. Затем к находящемуся в колбе раствору осторожно в течение 15 мин приливают 5.1 мл (0.5 моль) уксусного ангидрида, при этом происходит разогрев реакционной массы. После добавления всего количества уксусного ангидрида смеси дают охладиться. Выпавшие кристаллы игольчатой формы отфильтровывают на воронке Бюхнера. Промывают толуолом небольшим порциями до исчезновения запаха уксусной кислоты, промывают водой до нейтральной среды и сушат при температуре 75-80°C.
Выход: 1-ацетиламино-3-метоксибензол-6.5 г.
Стадия 2. Синтез 5-[(2'-ацетиламино-4'-метокси)бензоил]тримелитовой кислоты.
В трехгорловую колбу емкостью 100 мл, снабженную мешалкой, обратным холодильником и термометром, помещают 10.0 г (0.046 моль) диангидрида пиромеллитовой кислоты, 8.42 г (0.051 моль) 1-ацетиламино-3-метоксибензола и 20 мл гептана. Массу нагревают до 50°C и при перемешивании прибавляют 16.12 г (0.119 моль) безводного хлористого алюминия. Выдерживают 3 часа при кипении реакционной массы (≈100°C), а после отгонки гептана еще 6 часов при 120÷130°C. После охлаждения к реакционной массе добавляют 50 мл воды и после выдержки в течение 30 минут добавляют горячий раствор соды и отделяют выпавший в осадок гидроксид алюминия. К водному слою фильтрата добавляют соляную кислоту до pH 3-4. Выпадает осадок 5-[(2'-ацетиламино-4'-метокси)бензоил]тримелитовой кислоты. Его отфильтровывают, промывают водой до нейтральной среды и сушат при температуре 75-8°C.
Выход: 5-[(2'-ацетиламино-4'-метокси)бензоил]тримелитовой кислоты - 7.8 г.
Стадия 3. Синтез 2,3-дикарбокси-5-ацетиламино-7-метоксиантрахинона.
В колбу объемом 200 мл, снабженную мешалкой и термометром, помещают 10 мл моногидрата и нагревают до 130°C. Затем в течение 15 минут при интенсивном перемешивании вносят 5 г полученной 5-[(2'-ацетиламино-4'-метокси)бензоил]тримелитовой кислоты, температуру поднимают до 150°C и выдерживают в течение 5 часов. Массу после охлаждения при перемешивании выливают в 200 мл воды, фильтруют, промывают большим количеством ледяной воды, растворяют в содовом растворе и подкисляют соляной кислотой. Осадок отфильтровывают и промывают водой до исчезновения хлорид-ионов. Такую обработку повторяют дважды. Сушат при 100°C.
Выход: 2,3-дикарбокси-5-ацетиламино-7-метоксиантрахинон - 4.1 г. Тпл=360°C.
Стадия 4. Синтез тетра-(5-ацетиламино-7-метокси)антрахинонопорфиразинов меди и кобальта.
В кварцевую ампулу помещают растертую смесь 0.23 г (0.60 ммоль) 2,3-дикарбокси-5-ацетиламино-7-метоксиантрахинона 0.24 г (4.00 ммоль) мочевины, 0.036 г (0.18 ммоль) ацетата меди или 0.037 г (0.18 ммоль) ацетата кобальта, 0.02 г (0.40 ммоль) хлорида аммония и 0.002 г (0.01 ммоль) молибдата аммония. Массу медленно нагревают до 180°C в течение часа и выдерживают 3 часа. Полученную суспензию отфильтровывают, переосаждают из серной кислоты и промывают в аппарате Сокслета ацетоном в течение 10 часов. Сушат при 100°C.
Выход тетра-(5-ацетиламино-7-метокси)антрахинонопорфиразина меди - 0.13 г.
Выход тетра-(5-ацетиламино-7-метокси)антрахинонопорфиразина кобальта - 0.12 г.
Синтез тетра-(5-ацетиламино-7-гидрокси)антрахинонопорфиразинов меди и кобальта.
В колбу емкостью 25 мл с 10 мл 1%-го раствора гидроксида натрия вносят 0.1 г тетра-(5-ацетиламино-7-метокси)антрахинонопорфиразина меди или кобальта и нагревают на водяной бане при 80°C в течение 40-50 минут. Полученную суспензию отфильтровывают, переосаждают из серной кислоты и промывают в аппарате Сокслета ацетоном в течение 10 часов. Сушат при 100°C.
Темно-зеленые вещества обладают растворимостью в ДМФА, 1%-м растворе гидроксида натрия, концентрированной серной кислоте.
Выход тетра-(5-ацетиламино-7-гидрокси)антрахинонопорфиразина меди - 0.09 г.
Выход тетра-(5-ацетиламино-7-гидрокси)антрахинонопорфиразина кобальта - 0.08 г.
ЭСП медного комплекса в концентрированной серной кислоте, λmax, нм: 358, 641, 683 (фиг.2).
ЭСП кобальтового комплекса в концентрированной серной кислоте, λmax, нм: 358, 641, 684 (фиг.3).
Найдено, %: C 62.22; H 2.13; N 12.20. C72N12H36O16Cu.
С 62.36; Н 2.55; N 12.10. C72N12H36O16Co.
Вычислено, %: C 62.27; H 2.61; N 12.10. C72N12O16Cu.
C 62.26; H 2.62; N 12.15. C72N12H36O16Co.
Пример 1. Использование в качестве исходных соединений металлокомплексов тетра-(5-ацетиламино-7-гидрокси)антрахинонопорфиразина для синтеза медного и кобальтового комплексов тетра-(5-ацетиламино-7-гептилокси)антрахинонопорфиразина.
В одногорловую колбу на 50 мл, снабженную обратным холодильником, загружают 15 мл ДМФА, 0.12 г поташа (K2CO3), 0.05 г тетра-(5-ацетиламино-7-гидрокси)антрахинонопорфиразина меди или кобальта, 4 мл бромистого гептила (С7Н15Вr). Реакционную массу кипятят в течение 24 часов, далее выливают в холодную воду, фильтруют и промывают гексаном до исчезновения запаха бромистого гептана, далее водой, ацетоном и подвергают осадок колоночной хроматографии, сорбент - окись алюминия II степени активности, элюент - хлороформ.
Выход тетра-(5-ацетамино-7-гептилокси)антрахинонопорфиразина меди: 0.04 г (85%).
Выход тетра-(5-ацетамино-7-гептилокси)антрахинонопорфиразина кобальта: 0.04 г (84%).
Темно-зеленые вещества обладают растворимостью в ДМФА, хлороформе, o-ксилоле, концентрированной серной кислоте.
ЭСП медного комплекса в хлороформе, λmax, нм: 358, 641, 683 (фиг.4).
ЭСП кобальтового комплекса в хлороформе, λmax, нм: 358, 641, 684 (фиг.5).
Найдено, %: C 67.52; H 5.13; N 9.30. C100N12H92O16Cu.
C 67.56; H 5.15; N 9.50. C100N12H92O16Co.
Вычислено, %: C 67.42; H 5.21; N 9.44. C100N12H92O16Cu.
C 67.43; H 5.21; N 9.44. C100N12H92O16Co.
Пример 2. Использование тетра-(5-ацетиламино-7-гептилокси)-антрахинонопорфиразина меди в качестве красителя для крашения полиэтилена и полистирола.
Крашение полиэтилена. 2 г полиэтилена помещают в фарфоровую чашку и нагревают до расплавления, затем вливают раствор 5 мл хлороформа, в котором растворено 0.003 г тетра-(5-ацетиламино-7-гептилокси)антрахинонопорфиразина меди. Выдерживают при нагревании до полного удаления хлороформа и выливают полученную массу в форму.
Образец прилагается. (см. фиг.7)
Крашение полистирола. 0.1 г полистирола растворяют при нагревании в 1 мл бензола и добавляют 1 мл бензола, в котором растворено 0.002 г тетра-(5-ацетиламино-7-гептилокси)антрахинонопорфиразина меди. Раствор кипятят в течение 3 минут и полученную массу выливают в форму.
Образец прилагается. (см. фиг.7)
Пример 3. Использование тетра-(5-ацетиламино-7-гептилокси)-антрахинонопорфиразина кобальта в качестве красителя для крашения полиэтилена и полистирола.
Крашение полиэтилена. 2 г полиэтилена помещают в фарфоровую чашку и нагревают до расплавления, затем вливают раствор 5 мл хлороформа, в котором растворено 0.003 г тетра-(5-ацетамино-7-гептилокси)антрахинонопорфиразина кобальта. Выдерживают при нагревании до полного удаления хлороформа и выливают полученную массу в форму.
Образец прилагается. (см. фиг.7)
Крашение полистирола. 0.1 г полистирола растворяют при нагревании в 1 мл бензола и добавляют 1 мл бензола, в котором растворено 0.002 г тетра-(5-ацетиламино-7-гептилокси)антрахинонопорфиразина кобальта. Раствор кипятят в течение 3 минут и полученную массу выливают в форму.
Образец прилагается. (см. фиг.7)
Пример 4. Использование тетра-(5-ацетиламино-7-гептилокси)-антрахинонопорфиразина кобальта в качестве катализатора процессов окисления меркаптанов.
Исследование каталитической активности кобальтового комплекса тетра-(5-ацетиламино-7-гептилокси)антрахинонопорфиразина проводили на 0.02 M растворе диэтилдитиокарбомата натрия (ДЭДТК) на установке, изображенной на фиг.6.
Для приготовления гетерогенного катализатора раствор кобальтового комплекса тетра-(5-ацетиламино-7-гептилокси)антрахинонопорфиразина в ДМФА с концентрацией 0.01 моль/л в 50 мл погружают и полностью пропитывают образец нетканого полипропилена массой 2 г. Затем полипропилен извлекают и погружают в воду для удаления органического растворителя. При этом происходит быстрая кристаллизация и осаждение кобальтового комплекса на поверхности полипропиленовых волокон. Концентрация комплекса на поверхности нетканого материала при такой обработке составляет 1.5·10-5 моль на 1 г полипропилена. Полученный таким образом гетерогенный катализатор помещают в стакан с ДЭДТК, снабженный насосом CIRCULATOR 650 производительностью 600 л/ч для подачи воздуха, необходимого для окисления, с постоянной скоростью 2 л/мин. После того как в реакционной смеси в стакане установится постоянная температура, отбирают пробу 2 мл для определения начальной концентрации ДЭДТК и пропускают воздух. Момент подачи воздуха принимают за начало реакции. В ходе реакции через определенные промежутки времени отбирают пробы по 2 мл для спектрометрического определения текущей концентрации ДЭДТК.
Эффективная константа скорости окисления ДЭДТК составляет 2.6±0.4 сек-1.
Фиг.1 - ИК спектр тетра-(5-ацетиламино-7-гидрокси)-
антрахинонопорфиразина меди.
Фиг.2 - Электронный спектр поглощения тетра-(5-ацетиламино-7-гидрокси)антрахинонопорфиразина меди в концентрированной серной кислоте.
Фиг.3 - Электронный спектр поглощения тетра-(5-ацетиламино-7-гидрокси)антрахинонопорфиразина кобальта в концентрированной серной кислоте.
Фиг.4 - Электронный спектр поглощения тетра-(5-ацетиламино-7-гидрокси)антрахинонопорфиразина меди в хлороформе.
Фиг.5 - Электронный спектр поглощения тетра-(5-ацетиламино-7-гидрокси)антрахинонопорфиразина кобальта в хлороформе.
Фиг.6 - Схема установки для определения активности гетерогенного катализатора: 1 - термометр, 2 - барботер, 3 - стеклянный стакан, 4 - образцы гетерогенного катализатора, 5 - насос, 6 - пробоотборник, 7 - обратный холодильник.
Тетра-(5-ацетиламино-7-гидрокси)антрахинонопорфиразины меди и кобальта формулы