Полипептид актинии, обладающий анальгетическим действием
Иллюстрации
Показать всеИзобретение относится к биотехнологии и решает задачу поиска новых лекарственных средств, направленных против боли. Предложен полипептид актинии, проявляющий анальгетическую активность, аминокислотная последовательность которого выражается формулой:
H2N-Glyl-Ser2-Ile3-Cys4-Leu5-Glu6-Pro7-Lys8-Val9-Val10-Glyll-Prol2-Cys13-Thrl4-Alal5-Tyrl6-Phel7-X118-Argl9-Phe20-Tyr21-Phe22-X223-Ser24-Glu25-Thr26-Gly27-Lys28-Cys29-Thr30-Pro31-Phe32-Ile33-Tyr34-Gly35-Gly36-Cys37-Glu38-Gly39-Asn40-Gly41-Asn42-Asn43-Phe44-Glu45-Thr46-Leu47-Arg48-Ala49-Cys50-Arg51-X352-Ile53-Cys54-Arg55-Ala56-COOH, где аминокислотный остаток X1 соответствует Arg, аминокислотный остаток Х2 соответствует Asp и аминокислотный остаток Х3 соответствует А1а или аминокислотный остаток X1 соответствует Pro, аминокислотный остаток Х2 соответствует Asn и аминокислотный остаток Х3 соответствует Gly. Изобретение позволяет расширить ассортимент анальгетических лекарственных препаратов, имеющих направленное действие на клеточную мишень. 9 ил., 1 табл.
Реферат
Изобретение относится к биохимии, конкретно к биологически активным полипептидам, обладающим анальгетическим или противовоспалительным действием, которые могут найти применение в медицине или научных исследованиях.
В настоящее время одной из основных причин обращения людей за врачебной помощью является боль. Патологическая боль, появляющаяся при различных состояниях, представляет собой нежелательное явление, резко снижающее качество жизни, работоспособность и вызывающее страдания. До 40% взрослого населения развитых стран страдает от хронической боли. Наиболее широко в качестве анальгетических препаратов традиционно используются: морфин (и другие опиоиды), аспирин (а также другие нестероидные противовоспалительные средства) и разнообразные вещества неспецифического действия (антиконвульсанты, антидепрессанты). Несмотря на большой ассортимент анальгетических средств различной химической природы, некоторые типы болевых состояний, например, различные нейропатии, практически нечувствительны к этим агентам. Кроме того, неспецифичность действия вышеперечисленных веществ в ряде случаев вызывает нежелательные побочные эффекты, что сильно ограничивает возможность их применения.
В последнее время особое внимание было уделено разработке и получению принципиально новых анальгетических средств, специфично действующих на молекулярные механизмы генерации боли с минимальными побочными эффектами. Что подразумевает использование высокоселективных агентов, способных адресно включать, выключать или модифицировать определенный фрагмент на пути прохождения болевого сигнала от очага поражения в головной мозг.
Одними из наиболее перспективных источников таких соединений являются природные яды, как правило, содержащие в своем составе компоненты, проявляющие высокий уровень специфичности по отношению к различным рецепторам нервной системы. Общий анальгетический эффект был неоднократно описан как для препаратов, полученных на основе природных ядов, так и для отдельно выделенных компонентов.
Известны и нашли практическое применение полипептиды Ziconotide SNX-111 или омега-конотоксин MVIIA и АМ-336 или омега-конотоксин СУШ (оба - блокаторы Са2+-каналов). Эти нейротоксины и их близкие гомологи известны не только как анальгетические соединения, но и как средства для лечения гипертонии, шизофрении, снятия различных воспалительных процессов, восстановления нервной системы после ишемии [Olivera B.M., Mclntosh J.M., Watkins M., Garrett J.E., Cruz L.J., Grilley M., Walker C.S., Shetty R., Jones R.M., Schoenfeld R.M. // WO 02064740 - 2002].
Недостатком этих средств является подверженность остатков метионина, входящих в их состав, к окислению, что приводит к снижению терапевтических свойств препаратов на их основе. Кроме того, они вводятся в организм посредством длительной инъекции в спинномозговой столб (например, через имплантированные микронасосы), что во многих случаях трудновыполнимо и требует применения специального медицинского оборудования и высококвалифицированного персонала.
Известен полипептидный препарат конотоксин Vcl.1 (имеющий также название ACV1), который проходит испытание как средство борьбы с болью. Показано его действие на нейрональный ацетилхолиновый рецептор, и изучен эффект in vivo на нескольких животных моделях, воспроизводящих человеческие нейропатические боли [Livett B.G., Sandall D.W., Keays D., Down J., Gayler K.R., Satkunanathan N., Khalil Z. Therapeutic applications of conotoxins that target the neuronal nicotinic acetylcholine receptor. // Toxicon. - 2006. - vol.48. - p.810-829]. Кроме того, было показано его позитивное влияние на скорость регенерации поврежденных нервных тканей.
Недостатком ACV1 является ограниченность его применения, связанная с преимущественным расположением его молекулярной мишени в периферической нервной системе. Поэтому потенциальным кругом его применения, в первую очередь, является использование для анальгезии при механическом или тепловом разрушении поверхностных тканей. Возможность использования его при лечении нейрологических заболеваний центральной нервной системы не доказана.
Известен агонист нейротензинового рецептора, проходящий 2 стадию клинических испытаний контулакин-G или CGX-1160 -, эффективно подавляющий на животных моделях различные типы болевых ощущений, таких как острая посттравматическая, воспалительная и нейропатическая боль [Wagstaff J; Layer R; Mccabe R. Contulakin-G, analogs thereof and uses therefor. // US 2004072758 - 2004].
Недостатком контулакина как анальгетического средства является то, что его биологическая мишень - нейротензиновый рецептор не вовлечен напрямую в механизм передачи болевого сигнала, и анальгетический эффект этих препаратов на живые системы является, по-видимому, не основным.
Структурой, наиболее близкой к заявленному полипептиду, является АРНС1, выделенный из морской анемоны того же вида [Andreev YA, Kozlov SA, Koshelev SG, Ivanova EA, Monastymaya MM, Kozlovskaya EP, Grishin EV. Analgesic compound from sea anemone Heteractis crispa is the first polypeptide inhibitor ofvanilloid receptor 1 (TRPV1). // J Biol Chem. 2008, vol.283, p.23914-23921]. Это достаточно эффективное соединение, однако помимо него в яде морской анемоны существует много других родственных полипептидов со сходной структурой, но различающейся биологической активностью.
Природные полипептиды прошли долгий путь эволюционного отбора, в результате чего их структура считается наиболее оптимальной для использования в медицине [Escoubas Р, King GF. Venomics as a drug discovery platform. // Expert Rev Proteomics. 2009.vol.6 - p.221-224]. Даже единичная замена, если она затрагивает активный центр молекулы, изменяет биологическую активность молекулы, как, например, было показано для альфа-дендротоксина [Gasparini S, Danse JM, Lecoq A, Pinkasfeld S, Zinn-Justin S, Young LC, de Medeiros CC, Rowan EG, Harvey AL, Menez A. Delineation of the functional site of alpha-dendrotoxin. The functional topographies of dendrotoxins are different but share a conserved core with those of other Kvl potassium channel-blocking toxins. // J Biol Chem. 1998. vol.273 - p. 25393-25403].
Изобретение решает задачу расширения ассортимента анальгетических лекарственных препаратов нового поколения, имеющих направленное действие на клеточную мишень.
Поставленная задача решается за счет структуры полипептида из морской анемоны, аминокислотная последовательность которых выражается следующей формулой:
H2N-Gly1-Ser2-Ile3-Cys4-Leu5-Glu6-Pro7-Lys8-Val9-Val10-Gly11-Pro12-Cys13-Thr14-Ala15-Tyr16-Phe17-X118-Arg19-Phe20-Tyr21-Phe22-X223-Ser24-Glu25-Thr26-Gly27-Lys28-Cys29-Thr30-Pro31-Phe32-lle33-Tyr34-Gly35-Gly36-Cys37-Glu38-Gly39-Asn40-Gly41-Asn42-Asn43-Phe44-Glu45-Thr46-Leu47-Arg48-Ala49-Cys50-Arg51-X352-Ile53-Cys54-Arg55-Ala56-COOH,
где аминокислотный остаток X1 соответствует Arg, аминокислотный остаток Х2 соответствует Asp и аминокислотный остаток Х3 соответствует А1а
или аминокислотный остаток X1 соответствует Pro, аминокислотный остаток Х2 соответствует Asn и аминокислотный остаток Х3 соответствует Gly.
Заявляемый анальгетический полипептид состоит из 56 аминокислотных остатков, может быть выделен хроматографическими методами из нематоцитов морских анемон или получен в виде рекомбинантного белка генно-инженерными методами на основании нуклеотидной последовательности SEQ.№3 или SEQ.№4.
Заявляемые полипептиды представляют собой компоненты природного яда актинии, независимо друг от друга выделяемые хроматографическими методами из природного экстракта. Наблюдаемые точечные замены в аминокислотной последовательности полипептидов обнаруживаются методами определения аминокислотных последовательностей после их выделения и отражают природный мутагенез актинии, закрепленный эволюционно.
Заявляемые полипептиды проявляют анальгетическую активность на млекопитающих, как было показано в трех различных тестах на диком типе мышей.
Гомология первичной структуры заявляемых полипептидов с полипептидом АРНС1, являющимся полипептидным ингибитором ванилоидного рецептора типа 1 (TRPV1) (см фиг.1) позволяет утверждать, что заявленные полипептиды проявляют свою анальгетическую активность посредством модуляции TRPV1. Эти рецепторы были обнаружены как в периферических и висцеральных нервных тканях, так и в тканях головного мозга, и они признаны ответственными за нейрональный ответ при воспалительных процессах. Опыты с нокаутными мышами, дефектными по гену TRPV1 рецептора, убедительно доказывают его роль в восприятии боли [Caterina MJ, Leffler A, Malmberg AB, Martin WJ, Trafton J, Petersen-Zeitz KR, Koltzenburg M, Basbaum AI, Julius D. Impaired nociception and pain sensation in mice lacking the capsaicin receptor. // Science. - 2000. - vol.288. - p.306-313]. Широкое вовлечение TRPV1 в различные процессы нейропередачи позволяет применять заявляемые полипептиды для лечения самых различных заболеваний, связанных с воспалительными или нейропатологическими процессами, например, астма, интерстициальный цистит и артрит, а также использовать как анальгетические агенты.
Полипептиды, именуемые как АРНС2 и АРНС3, обладают пространственной структурой ингибиторов протеаз типа Куница, кроме того, они обладают повышенной устойчивостью к протеолитическим ферментам, это придает их молекулам стабильность при введении в организм. И, как следствие этого, улучшает потребительские свойства фармакологических препаратов на их основе, такие как длительность воздействия и простота использования.
Большая схожесть заявленных полипептидов между собой и с полипептидом АРНС1 позволяет предполагать одинаковую доменную организацию, но не идентичность биологической активности. Различия были доказаны при проведении экспериментов на животных моделях. Наиболее активный из двух полипептид АРНС3 превосходит всех в тесте горячая пластина и капсаициновом тесте, а в тесте тепловой гиперчувствительности он оказывает достоверное анальгетическое действие, но менее выраженное, чем АРНС1. Полипептид АРНС2 имеет сходный анальгетический потенциал с АРНС3 в тесте тепловой гаперчувствительности и равен по действию с АРНС1 в капсаициновом тесте. Его уникальная особенность проявляется в тесте на изменение температуры тела, где он единственный из трех полипептидов достоверно не изменяет температуру тела у испытуемых животных.
Все заявленные полипептиды могут быть использованы как терапевтические средства по отдельности для купирования боли. Каждый из них вызывает положительный эффект, но делает это с индивидуальными особенностями. Поэтому каждый из полипептидов может быть использован при разных патологических состояниях, вызывающих боль.
Изобретение иллюстрируют чертежи.
Фиг.1. Сравнение аминокислотных последовательностей АРНС2 и АРНС3 с близкими структурными гомологами, имеющих тип пространственной укладки полипептидной цепи «ингибиторов Кунитца типа». Сходные по свойствам аминокислотные остатки выделены серым цветом.
Фиг.2. Основные стадии хроматографического выделения анальгетического полипептида АРНС2 из спиртового экстракта нематоцитов актинии Heteractis crispa. На первом этапе используют гидрофобную колонку Полихром-1 (7×30 см) и скорость элюирования 1,2 л/час, используя ступенчатый градиент этанола к воде; на 2 этапе используют ионообменную колонку Bio-Rex 70 (2,5×60 см), 5 мМ аммоний-ацетатный буфер (рН 4,5) и скорость элюции 22 мл/час; на 3 этапе используют ионообменную колонку SP-Sephadex S-25 (2,5×40 см), 5 мМ аммоний-ацетатный буфер (рН 4,5) и скорость элюции 70 мл/час; на последнем 4 этапе используют обращеннофазную колонку Jupiter С5 (4,6×150 мм), буфер, содержащий 0,1% трифторуксусной кислоты и скорость элюции 1 мл/мин, где градиент создается вторым буфером 0,1% трифторуксусной кислоты в ацетонитриле. Активные фракции на каждом этапе выделены серым цветом.
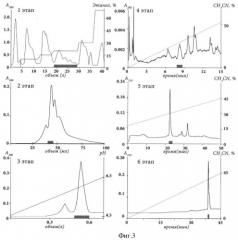
Фиг.3. Основные стадии хроматографического выделения анальгетического полипептида АРНС3 из спиртового экстракта нематоцитов актинии Heteractis crispa. На первом этапе используют гидрофобную колонку Полихром-1 (7×30 см) и скорость элюирования 1,2 л/час, где используют ступенчатый градиент спирта в воде; на 2 этапе используют гель-фильтрационную колонку Biogel P-4 (1,4×96 см), уравновешенную водой, и скорость элюции 0,25 мл/мин; на 3 этапе используют ионообменную колонку SP-Sephadex S-25 (2,5×50 см), 100 мМ аммоний-ацетатный буфер (рН 4,5) и скорость элюции 0,6 мл/мин в градиенте рН рабочего буфера от 4,5 до 6,5; на 4 этапе используют обращеннофазную колонку Delta-Pak C18-300 (4,6×250 мм), скорость элюции 2 мл/мин в 10 мМ аммоний-ацетатном (рН 7,2) буфере при линейном градиенте концентрации ацетонитрила 0-50% за 15 мин; на 5 этапе используют колонку модифицированную, обращеннофазную колонку RP-amide (2×100 мм), скорость элюции 0,3 мл/мин в 10 мМ аммоний-ацетатном (рН 7,2) буфере при линейном градиенте концентрации ацетонитрила 17,5-54% за 70 мин; на 6 этапе окончательно выделяют полипептид на обращеннофазной колонке Luna С 18 (2×150 мм), скорость элюции 0,15 мл/мин в буфере, содержащем 0,1% трифторуксусной кислоты, используя линейный градиент концентрации ацетонитрила 0-70% за 70 мин. Активные фракции заштрихованы на каждом этапе.
Фиг.4. Схема сборки конструкций для получения рекомбинантных аналогов на основе плазмидного вектора рЕТ32b+. Место вставки аминокислотного остатка Met для последующего расщепления бромцианом отмечено черным треугольником, черные прямоугольники обозначают домен тиоредоксина и последовательность 6 гистидинов для металлоаффинной хроматографии.
Фиг.5. ВЭЖХ гидролизата 2 мг химерного белка Тгх-АРНС2 (панель А) и 0,15 мг химерного белка Тгх-АРНС3 (панель Б) на обращеннофазной колонке Delta-Pak С 18-300 (4,6×250 мм). Разделение со скоростью 2 мл/мин проводят в линейном градиенте концентрации ацетонитрила в присутствии 0,1% трифторуксусной кислоты. Детекция при длине волны 280 нм. Время выхода рекомбинантных АРНС2 и АРНС3 обозначено стрелкой.
Фиг.6. Анальгетический эффект АРНС2 и АРНС3 в тесте горячей пластины. По оси ординат показано время реакции на болевой стимул. Для сравнения приведены данные анальгетического эффекта полипептида АРНС1. Статистически значимые различия отмечены *-р<0,05, **-р<0,01.
Фиг.7. Исследование влияния полипептидов АРНС2 и АРНС3 на тепловую гиперчувствительность, вызванную введением полного адъюванта Фрейда. Для сравнения приведены данные от введения полипептида АРНС1. По оси ординат показано время отдергивания соответствующей лапы от горячей пластины (t=53°C). Для контрольной группы животных не проводят введение полного адъюванта Фрейда. Статистически значимые различия от группы контроль отмечены *(р<0,01); статистически значимые различия от группы физ. р-р отмечены #(р<0,01).
Фиг.8. Анальгетический эффект АРНС2 и АРНС3 в капсаициновом тесте. Для сравнения приведены данные анальгетического эффекта полипептида АРНС1. По оси ординат показано время, которое мышь провела за лизанием лапы. Статистически значимые различия отмечены **(р<0,01).
Фиг.9. Влияние полипептидов АРНС1, АРНС2 и АРНС3 на температуру тела мышей линии CD-1. Изучаемые растворы вводят на 20 минуте измерения, что обозначено стрелкой. Данные собирают 2 часа, затемненные круги для инъекции физиологического раствора, для него показаны значения среднеквадратичного отклонения, открытые круги для инъекции АРНС1, затемненные квадраты для АРНС2, открытые ромбы для АРНС3. Время начала статистически значимых различий отмечено *- (р<0,05).
Изобретение иллюстрируют примеры.
Пример 1.
Выделение анальгетического полипептида АРНС2
Актинии гомогенизируют в холодной дистиллированной воде и выдерживают 24 часа при температуре 4°С, прибавляют этиловый спирт до конечной концентрации 70% и проводят экстракцию еще 4 часа, после чего фильтруют через несколько слоев ткани. Тонкий осадок удаляют центрифугированием при 3500g, а получаемый супернатант повторно центрифугируют при 8000g. Осветленный супернатант лиофильно высушивают и хранят при температуре (-20)°С до последующего применения.
Выделение и очистку анальгетического полипептида АРНС2 из этанольного экстракта актинии Heteractis crispa проводят по разработанной схеме (см. фиг.2), включающей гидрофобную хроматографию на полихроме-1 (политетрафторэтилене), позволяющем сорбировать биологически активные полипептиды актиний и не задерживать находящиеся в экстракте в значительных количествах ионогенные примеси (этап 1); ионообменную хроматографию на носителях Bio-Rex 70, SP-Sephadex G-25 (этап 2 и 3) и ВЭЖХ на колонке с обращенной фазой C5 Jupiter (4,6×150 мм, размер пор 300 Å, диаметр частиц 5 мкм, Phenomenex) - 4 этап. Активность промежуточных фракций подтверждают в биологических тестах на животных.
На 1 этапе выделения элюцию (скорость 1,2 л/час) адсорбировавшихся на полихроме-1 полипептидов проводят ступенчатым градиентом этанола от 0 до 70%. Детектирование хроматографических фракций на всех стадиях выделения проводят спектрофотометрически при длине волны 210 или 280 нм. Ионообменную хроматографию на Bio-Rex 70 и SP-Sephadex G-25 проводят в слабо кислом буферном растворе: 5 мМ аммоний-ацетатный буфер (рН 4,5) со скоростями элюции 22 мл/час и 70 мл/час соответственно. Для формирования градиента используют второй буферный раствор, содержащий 1М NaСl, а в случае хроматографии на SP-Sephadex G-25 после элюции 2 литров градиент формируют добавлением 3 буферного раствора: 5 мМ аммоний-ацетатный буфер (рН 7,3). На последнем этапе фракционирование проводят со скоростью 1 мл/мин в линейном градиенте концентрации ацетонитрила от 0 до 70% (v/v) в 0,1%-ной (v/v) трифторуксусной кислоте.
Пример 2.
Выделение анальгетического полипептида АРНС3
Актинии гомогенизируют в холодной дистиллированной воде и выдерживают 24 часа при температуре 4°С, прибавляют этиловый спирт до конечной концентрации 70% и проводят экстракцию еще 4 часа, после чего фильтруют через несколько слоев ткани. Тонкий осадок удаляют центрифугированием при 3500g, а получаемый супернатант повторно центрифугируют при 8000g. Осветленный супернатант лиофильно высушивают и хранят при температуре (-20)°С до последующего применения.
Выделение и очистку анальгетического полипептида из этанольного экстракта актинии Heteractis crispa проводят по разработанной схеме (см. фиг.3), включающей гидрофобную хроматографию на полихроме-1 (политетрафторэтилене), позволяющем сорбировать биологически активные полипептиды актиний и не задерживать находящиеся в экстракте в значительных количествах ионогенные примеси (этап 1); гель-фильтрационную хроматографию (этап 2); ионообменную хроматографию на SP-Sephadex G-25 сорбенте (этап 3) и ВЭЖХ на колонках с обращенной фазой (этап 4-6). Активность промежуточных фракций подтверждают в биологических тестах на животных. Детектирование хроматографических фракций на всех стадиях выделения проводят спектрофотометрически при длине волны 210 или 280 нм.
На 1 этапе выделения элюцию (скорость 1,2 л/час) адсорбировавшихся на полихроме-1 полипептидов проводят ступенчатым градиентом этанола от 0 до 70%. Фракцию, элюированную при концентрации спирта 20%, упаривают и наносят в воде на колонку Biogel P-4, где она далее разделяется при скорости потока 0,25 мл/мин. Ионообменную хроматографию на SP-Sephadex G-25 (Pharmacia) проводят в слабо кислом буферном растворе: 100 мМ аммоний-ацетатный буфер (рН 4,5) со скоростью элюции 0,6 мл/мин. Для формирования градиента используют второй буферный раствор той же ионной силы с рН 6,5.
Полипептид с чистотой более 99% получают после трех последовательных ВЭЖХ на различных сорбентах с обращенной фазой. Сперва активную фракцию после ионообменной хроматографии наносят на колонку Delta-Pak С 18-300 (Waters) 4,6×250 мм, уравновешенную в 10 мМ аммоний-ацетатном (рН 7,2) буфере и разделяют со скоростью 2 мл/мин в линейном градиенте концентрации ацетонитрила от 0 до 50% (v/v). Второй буфер для создания градиента содержит 10 мМ аммоний-ацетат (рН 7,2) и 90% (v/v) ацетонитрила. Следующую стадию проводят в тех же буферных растворах, используя колонку RP-amide (Supelco) 2×100 мм, скорость элюции 0,3 мл/мин и линейный градиент концентрации ацетонитрила 17,5-54% (v/v). Заключительную очистку осуществляют на колонке Luna С18 (Phenomenex) 2×150 мм, со скоростью 0,15 мл/мин в линейном градиенте концентрации ацетонитрила 0-70% (v/v) в 0,1%-ной (v/v) трифторуксусной кислоте.
Пример 3.
Алкилирование полипептидов
Предварительно полипептиды модифицируют по аминокислотным остаткам цистеина, чтобы повысить качество определения аминокислотной последовательномти. Для модификации лиофилизованные полипептиды растворяют в 10 мкл 100 мМ фосфатного буфера (рН 7,5), содержащего 6 М гуанидинхлорида и 3 мМ ЭДТА, и инкубируют ночь при 45°С. Затем раствор охлаждают до комнатной температуры и дегазируют в ультразвуковой бане, после чего добавляют 5 мкл восстанавливающего раствора (300 мМ фосфатный буфер (рН 12,3), 200 мМ дитиотриэтола, 3мМ ЭДТА) и выдерживают 1 ч при 37°С. Тиольные группы цистеинов алкилируют добавлением 3 мкл 10% 4-винилпиридина в метаноле в течение 15 мин при комнатной температуре в темноте. Модифицированный полипептид разводят в 100-300 мкл 0,1%-ной (v/v) трифторуксусной кислоты и обессоливают на обращеннофазной колонке Luna C18 (Phenomenex) 2×150 мм, применяя линейный или ступенчатый градиент концентрации ацетонитрила.
Пример 4.
Установление аминокислотной последовательности полипептида АРНС2
Определение полной аминокислотной последовательности очищенного полипептида проводят методом ступенчатой деградации по Эдману на автоматическом секвенаторе Procise 492 (Applied Biosystems, CШA). При деградации восстановленной полипептидной цепи полипептида АРНС2 устанавливают аминокислотную последовательность первых 23 аминокислотных остатков:
H2N-Gly1-Ser2-Ile3-Cys4-Leu5-Glu6-Pro7-Lys8-Val9-Val10-Glyll-Pro12-Cys13-Thr14-Ala15-Tyr16-Phe17-Arg18-Arg19-Phe20-Tyr21-Phe22-Asp23
Оставшуюся аминокислотную последовательность 4 пептидов определяют после того, как выделяют их из триптического гидролизата АРНС2:
Phe20-Tyr21-Phe22-Asp23-Ser24-Glu25-Thr26-Gly27
Lys28-Cys29-Thr30-Pro31-Phe32-Ile33-Tyr34-Gly35-Gly36-Cys37-Glu38-Gly39-Asn40-Gly41-Asn42-Asn43-Phe44-Glu45-Thr46-Leu47-Arg48-
Ala49-Cys50-Arg51
Ala52-Ile53-Cys54-Arg55
Последний аминокислотный остаток Ala56-COOH высчитывают по разнице масс между измеренной для выделенного полипептида и расчетной для первых 55 аминокислотных остатков. Полная аминокислотная последовательность полипептида АРНС2 соответствует SЕQ.№1.
Пример 5.
Установление аминокислотной последовательности полипептида АРНС3
Определение полной аминокислотной последовательности очищенного полипептида проводят методом ступенчатой деградации по Эдману на автоматическом секвенаторе Procise 492 (Applied Biosystems, США). При деградации восстановленной полипептидной цепи полипептида АРНС3 устанавливают аминокислотную последовательность первых 32 аминокислотных остатков:
H2N-Gly1-Ser2-Ile3-Cys4-Leu5-Glu6-Pro7-Lys8-Val9-Val10-Gly11-Pro12-Cys13-Thr14-Ala15-Tyr16-Phe17-Pro18-Arg19-Phe20-Tyr21-Phe22-Asn23-Ser24-Glu25-Thr26-Gly27-Lys28-Cys29-Thr30-Pro31-Phe32
Оставшуюся аминокислотную последовательность 3 пептидов определяют после того, как выделяют их из гидролизата АРНС3 эндопротеиназой Glu-C:
Thr26-Gly27-Lys28-Cys29-Thr30-Pro31-Phe32-Ile33-Tyr34-Gly35-Gly36-Cys37-Glu38
Gly39-Asn40-Gly41-Asn42-Asn43-Phe44-Glu45
Thr46-Leu47-Arg48-Ala49-Cys50-Arg51-Gly52-Ile53-Cys54-Arg55-Ala56-COOH.
Полная аминокислотная последовательность полипептида АРНС3 соответствует SEQ.№2.
Пример 6.
Пептидное картирование полипептидов
Предварительно высушенные алкилированные образцы растворяют в 10 мкл 100 мМ аммоний-бикарбонатного буфера (рН 8,5), содержащего 2 мМ CaCl2, далее прибавляют 2-3 мкл раствора фермента трипсин (КФ 3.4.21.4) или эндопротеиназа Glu-С (КФ 3.4.21.19) в том же буферном растворе с учетом конечного соотношения фермент:субстрат =1:20. Гидролиз проводят при температуре 37°С несколько часов, контроль полноты реакции осуществляют масс-спектрометрически. Продукты реакции разделяют ВЭЖХ на обращеннофазной микроколонке Luna C18 (Phenomenex) 1×150 мм, при элюции со скоростью 0,05 мл/мин в линейном градиенте концентрации ацетонитрила 0-60% (v/v) в 0,1%-ной (v/v) трифторуксусной кислоте.
Пример 7.
Определение относительной молекулярной массы
Индивидуальность очищенных веществ подтверждают масс-спектрометрическим анализом. Масс-спектры получают на MALDI-времяпролетном масс-спектрометре Ultraflex II TOF/TOF (Bruker Daltonik, Германия) с идентификацией положительных ионов в рефлекторном режиме. В качестве матрицы используют α-циано-4-гидроксикоричную кислоту (10 мг/мл) в 50%-ном (v/v) ацетонитриле, содержащем 0,1%-ную (v/v) трифторуксусную кислоту. Для калибровки прибора используют стандартную смесь пептидов с диапазоном молекулярных масс 700-3500 Да (Sigma, США).
Измеренная средняя молекулярная масса природного полипептида АРНС2 составляет 6185,0 Да, полипептида АРНС3 - 6111,0 Да. Расчетные средние молекулярные массы полипептидов составляют 6185,06 и 6110,98 Да соответственно, т.е. отличается от измеренной менее чем на 0,1 Да. С учетом точности метода определения масс выносят заключение об отсутствии любой пост-трансляционной модификации у природных полипептидов.
Пример 8.
Создание генно-инженерных конструкций для получения рекомбинантных АРНС2 и АРНС3
Генно-инженерные конструкции, способные экспрессировать полипептид АРНС2 или АРНС3 в клетках Е. coli, получают по одинаковой схеме (фиг.4). Аминокислотную последовательность преобразуют в нуклеотидную с учетом оптимизации использования кодонов в клетке хозяине (Е. coli). Синтезируют 5 олигонуклеотидных праймеров, перекрывающих полную аминокислотную последовательность полипептида, и два праймера для клонирования в плазмиду рЕТ-32b(+) (см. таблицу 1).
С праймерами, кодирующими внутреннюю часть гена (прямыми D1-D3 и комплементарными им обратными Rev1-Rev2), проводят 15 циклов ПЦР. Получаемую амплифицированную ДНК используют как матрицу для второго раунда ПЦР, которую проводят с парой праймеров, содержащих сайты рестрикции и комплементарных краям внутренних частей генов (R1, L1). Все раунды ПЦР проводят при сходных условиях 94°С - 20 сек, 55°С - 20 сек, 72°С - 20 сек, 25 циклов, используя Taq Platinum polymerase (Gibco).
После обработки рестриктазами EcoRI и Xhol собранные гены и экспрессирующий вектор pET32b+ (Novagen) лигируют друг с другом. Полученные плазмиды проверяют секвенированием. В результате получают плазмиды, несущие гены химерного белока Тrх-АРНС2 или химерного белока Тrх-АРНС3 под контролем Т7 промотера.
Белки Тrх-АРНС2 и Тгх-АРНС3 представляют собой аминокислотную последовательность каждого полипептида в составе гибридного белка, состоящего из фрагмента тиоредоксина и последовательности 6 аминокислотных остатков гистидина.
| Таблица 1Структура олигонуклеотидов, используемых для сборки генов, кодирующих последовательности зрелых полипептидов. В скобках указано, для какого полипептида они используются: (2) - АРНС2, (3) - АРНС3. Жирным шрифтом обозначен кодон метионина, вводимый перед первой аминокислотой целевого продукта для химического выщепления рекомбинантного АРНС1 из гибридного белка. Сайты рестрикции для клонирования в плазмиду pET-32b(+) EcoRI (праймер L1) и Xhol (праймер R1) подчеркнуты. | |
| Олигонуклеотид | Структура олигонуклотида (5'-3') |
| D1 (2) | CCTGGAACCGAAAGTTGTTGGTCCGTGCACCGCTTACTTCCGTCGTTTCT |
| D2 (2) | ACTTCGACTCTGAAACCGGTAAATGCACCCCTTTCATCTACGGTGGTTGC |
| D3 (2) | GAAGGTAACGGTAACAACTTCGAAACCCTGCGTGCTTGCCGTGCTATC |
| D1 (3) | CCTGGAACCGAAAGTTGTTGGTCCGTGCACCGCTTACTTCCCGCGTTTCT |
| D2 (3) | ACTTCAACTCTGAAACCGGTAAATGCACCCCTTTCATCTACGGTGGTTGC |
| D3 (3) | GAAGGTAACGGTAACAACTTCGAAACCCTGCGTGCTTGCCGTGGTATC |
| Rev1 (2) | CGGTTTCAGAGTCGAAGTAGAAACGACGGAAGTAAG |
| Rev1 (3) | CGGTTTCAGAGTTGAAGTAGAAACGCGGGAAGTAAG |
| Rev2 (2, 3) | GTTGTTACCGTTACCTTCGCAACCACCGTAGATGAAA |
| L1 (2, 3) | GGAATTCC ATGGGTTCTATCTGCCTGGAACCGAAAGTTGTTG |
| R1 (2) | CTCTCGAGTCAAGCACGGCAGATAGCACGGCAAGCACGCAG |
| R1 (3) | CTCTCGAGTCAAGCACGGCAGATACCACGGCAAGCACGCAG |
Пример 9.
Получение рекомбинантных полипептидов
Наработка рекомбинантных полипептидов происходит в составе химерного белка с тиоредоксином, где последовательность тиоредоксина совместно с полигистидиновым тяжем предшествует целевым продуктам. Клетки BL21(DE3) трансформируют экспрессионным вектором рЕТ32b+АРНС2 или экспрессионным вектором рЕТ32b+АРНС3. После селекции на чашках с селективным антибиотиком (ампицилин) клетки пересеивают в 200 мл колбы и выращивают при перемешивании до оптической плотности ~0,6 единиц. Индукцию экспрессии проводят добавлением изопропил-β-D-1-тиогалактопиранозида до концентрации 0,2 мМ, после чего растят клетки еще 12 часов при 24°С. Клетки осаждают и ресуспендируют в буфере для дезинтеграции (20 мМ Трис-НСl рН 7,2, 150 мМ NaCl). Дезинтегрируют клетки ультразвуком, осаждают клеточный дебрис и тельца включения центрифугированием. Целевой химерный белок выделяют из растворимой фракции.
Металлоаффинную хроматографию на Со2+-сорбенте проводят в буфере (20 мМ Трис-НСl рН 7,2, 150 мМ NaCl), для элюирования химерного белка используют буфер (150 мМ имидазол, 300 мМ NaCl, 20 мМ Tris, рН 7,5). Собранный белок обессоливают на PD-10 картриджах (GE Healthcare), используя дистиллированную воду как элюент, и лиофилизируют.
Высушенный химерный белок растворяют в 0,1 М НСl до концентрации белка 2 мг/мл, расщепляют бромцианом 15 часов в темноте, используя 600-кратный молярный избыток бромциана к химерному белку. Растворитель и избыток бромциана удаляют на вакуумном концентраторе, далее смесь продуктов гидролиза растворяют в хроматографическом буфере А (0,1% трифторуксусной кислоты) и наносят на колонку с обращенной фазой Delta-Pak С 18-300 (Waters) 4,6×250 мм для выделения целевого полипептида (см. фиг.5). Фракционирование проводят в линейном градиенте концентрации ацетонитрила в 0,1%-ной (v/v) трифторуксусной кислоте от 0 до 15% (v/v) в течение 2 минут, далее от 15 до 40% (v/v) в течение 18 минут и от 40 до 60% (v/v) за 10 минут со скоростью элюции 2 мл/мин. Детекцию осуществляют спектрофотометрически по оптическому поглощению при 280 нм.
Контроль чистоты и правильности синтеза рекомбинантного АРНС2 или АРНС3 проверяют при помощи масс-спектрометрического анализа; сравнением хроматографических подвижностей природного и рекомбинантного полипептида на аналитической колонке Luna С 18 (Phenomenex) 2×150 мм, а также сравнением биологических свойств.
Пример 10.
Тестирование анальгетической активности АРНС2 и АРНС3 на мышах в тесте горячая пластина
Мышей делят на 2 группы (контрольную и экспериментальную) по 10 особей в каждой. Тесты проводят на самцах белых мышей линии CD-1 массой 20-30 г. Болевое раздражение моделируют, помещая мышь на металлическую поверхность, разогретую до 55°С. Для предотвращения ожогов лап время воздействия раздражения ограничивают 180 секундами. Тестируемые образцы растворяют в стерильном физиологическом растворе и вводят в дозе 0,1 мг/кг внутривенно. Полипептид АРНС1 применяют как один из стандартов для сравнения активности в той же концентрации и условиях. Контрольные животные получают эквивалентный объем стерильного физиологического раствора. Анальгетический эффект измеряют по увеличению времени, прошедшего от момента посадки животного на пластину до момента первого облизывания задней лапы (фиг.6). Измерение болевой чувствительности проводят через 15 минут после введения препарата. Результаты обрабатывают статистически, достоверность отличий результатов контрольной и экспериментальной групп определяют с помощью ANOVA и теста Тьюки.
Пример 11.
Тестирование анальгетической активности полипептидов АРНС2 и АРНСЗ в тесте тепловой гиперчувствительности
Тесты проводят на самцах белых мышей линии CD-1 массой 20-30 г. Мышей делят на 4 группы по 10 в каждой. Всем мышам, кроме контрольной группы, в подушечку задней лапы вводят воспалительный агент, представляющий собой 20 мкл смеси полного адъюванта Фрейда/физраствор 1:1 (v/v). Полипептид АРНС1 применяют как один из стандартов для сравнения активности в той же концентрации и условиях. Для контрольной группы животных вводят 20 мкл физиологического раствора. Через 24 часа внутривенно вводят 200 мкл физиологического раствора животным групп «контроль» и «физ. р-р», остальным группам внутривенно вводят 200 мкл растворов тестируемых образцов в стерильном физиологическом растворе в дозе 0,1 мг/кг. Измерение проводят через 15 мин после внутривенного введения. Фиксируют латентное время отдергивания лапы, подвергшейся действию воспалительного агента, от горячей пластины (t=53°С). Результаты обрабатывают статистически, достоверность отличий результатов контрольной и экспериментальной групп определяют с помощью ANOVA и теста Тьюки. Анальгетический эффект измеряют по увеличению времени, прошедшего от момента посадки животного на пластину до момента первого облизывания задней лапы (см. фиг.7).
Пример 12
Тестирование анальгетической активности полипептидов АРНС2 и АРНС3 в капсаициновом тест
Тесты проводят на самцах белых мышей линии CD-1 массой 20-30 г. Тестируемые образцы растворяют в стерильном физиологическом растворе и вводят в дозе 0,1 мг/кг внутривенно. Полипептид АРНС1 применяют как один из стандартов для сравнения активности в той же концентрации и условиях. Контрольные животные получают эквивалентный объем стерильного физиологического раствора. Через 15 минут всем мышам в подушечку задней лапы вводят 20 мкл смеси (соотношение 1:9 (v/v)) спиртового раствора капсаицина с физиологическим раствором. Количество капсаицина в 20 мкл смесевого раствора составляет 3 мкг. После инъекции мышь помещают в большой стеклянный стакан и регистрируют время лизания лапы в течение 15 минут. Результаты обрабатывают статистически, достоверность отличий результатов контрольной и экспериментальной групп определяют с помощью ANOVA и теста Тьюки. Анальгетический эффект определяют по разнице суммарного времени лизания/облизывания задней лапы (см. фиг.8).
Пример 13
Тестирование влияния полипептидов АРНС2 и АРНС3 на температуру тела
Тесты проводят на самцах белых мышей линии CD-1 массой 20-30 г. Тестируемые образцы растворяют в стерильном физиологическом растворе и вводят в дозе 0,1 мг/кг внутривенно. Полипептид АРНС1 применяют как один из стандартов для сравнения активности в той же концентрации и условиях. Контрольные животные получают эквивалентный объем стерильного физиологического раствора. Измерения температуры тела проводят с помощью электронного термометратермометра введенного ректально за 20 минут до введения анализируемой пробы, во время инъекции и далее еще 100 минут с одноминутными интервалами (см. фиг.9).
Результаты обрабатывают статистически, достоверность отличий результатов контрольной и экспериментальной групп определяют с помощью ANOVA и теста Тьюки.
Статистически значимое понижение температуры на 0.5-1°С наступает для АРНС1 на 40 минуте, для АРНСЗ на 80 минуте. При введении АРНС2 не наблюдается статистически значимого снижения температуры тела мышей.
Аминокислотные и нуклеотидные последовательности, представленные в тексте описания:
Полипептид, проявляющий анальгетическую активность, аминокислотная последовательность которого выражается формулой:H2N-Gly1-Ser2-Ile3-Cys4-Leu5-Glu6-Pro7-Lys8-Val9-Val10-Gly11-Pro12-Cys13-Thr14-Ala15-Tyr16-Phe17-Xl18-Arg19-Phe20-Tyr21-Phe22-X223-Ser24-Glu25-Thr26-Gly27-Lys28-Cys29-Thr30-Pro31-Phe32-Ile33-Tyr34-Gly35-Gly36-Cys37-Glu38-Gly39-Asn40-Gly41-Asn42-Asn43-Phe44-Glu45-Thr46-Leu47-Arg48-Ala49-Cys50-Arg51-X352-Ile53-Cys54-Arg55-Ala56-COOH,где аминокислотный остаток X1 соответствует Arg, аминокислотный остаток Х2 соответствует Asp и аминокислотный остаток Х3 соответствует А1а;или аминокислотный остаток XI соответствует Pro, аминокислотный остаток Х2 соответствует Asn и аминокислотный остаток Х3 соответствует Gly.