Рекомбинантная плазмидная днк pet22b(+)/вд-линкс1, кодирующая белок со свойствами линкс1, и штамм бактерий escherichia coli bl21(de3)/pet22b(+)/вд-линкс1-продуцент белка со свойствами линкс1 человека
Иллюстрации
Показать всеИзобретение относится к биотехнологии, в частности к получению водорастворимого домена белка Линкс1 человека, и может быть использовано в медицине. Конструируют рекомбинантную плазмидную ДНК рЕТ22b(+)/вд-Линкс1, кодирующую белок, которая содержит NdeI/BamHI-фрагмент ДНК плазмиды рЕТ22b(+) и искусственную последовательность ДНК, кодирующую NdeI/BamHI фрагмент, включающий синтетический ген водорастворимого домена Линкс1 человека, содержащая уникальные сайты узнавания рестрикционными эндонуклеазами, имеющие следующие координаты: XhoI - 158, HindIII - 173, EcoRI - 192, BamHI - 198, Ndel - 430, BglII - 534, MluI - 1256, PstI - 4495. Получают штамм-продуцент белка путем трансформации компетентных клеток Escherichia coli BL21(DE3) рекомбинантной плазмидой рЕТ22b(+)/вд-Линкс1. Изобретение позволяет получить белок со структурой и свойствами, идентичными структуре и свойствам природного водорастворимого домена белка Линкс 1 человека в достаточном количестве, измеряемом в миллиграммах, с уровнем экспрессии не ниже 10% от суммарного клеточного белка. 2 н.п. ф-лы, 1 табл., 4 ил.
Реферат
Изобретение относится к биотехнологии, в частности к генетической инженерии, конкретно к получению белка вд-Линкс1, который может быть использован в медицине в качестве лекарственного препарата.
Известны регуляторные белки семейства Lynx - эндогенные модуляторы работы никотинового ацетилхолинового рецептора (нАХР), обнаруженные в центральной нервной системе мышей в 1999 г. [J.M.Miwa, I.Ibanez-Tallon, G.W.Crabtree, R.Sanchez, A.Sali, L.W.Role, N.Heintz (1999) Neuron 23(1):105-14]. Эти белки состоят из мембраноассоциированного домена (связанного с клеточной мембраной посредством гликофосфатидилинозитольного якоря) и водорастворимого домена (вдЛинкс), обладающего всеми характерными структурными особенностями нейротоксинов яда змей: он содержит остаток лейцина на N-конце молекулы и 10 остатков цистеинов, образующих токсин-подобную систему из пяти дисульфидных связей. Белки семейства Линкс обладают очень интересными с фармакологической точки зрения функционально-биологические свойствами. В отличие от альфа-нейротоксинов эти белки в присутствии агонистов (ацетилхолина или никотина) не блокируют, а наоборот, активируют канал нАХР [J.M.Miwa, T.R.Stevens, S.L.King, B.J.Caldarone, I.Ibanez-Tallon, C.Xiao, R.M.Fitzsimonds, C.Pavlides, H.A.Lester, M.R.Picciotto, N.Heintz. (2006) Neuron. 51(5):587-600].
В 2008 году был обнаружен еще один представитель семейства Линкс, Линкс 1 насекомых [Y.M.Choo, B.H.Lee, K.S.Lee, B.Y.Kim, J.Li, J.G.Kirn, J.H.Lee, H.D.Sohn, S.Y.Nah, B.R.Jin (2008) Mol Cell Neurosci. 38(2):224-35]. Присутствие этого белка было обнаружено в таких тканях, как ганглии, мозг, нижнечелюстная мышца, преджелудок, ножная мышца, эпидермис, что также указывает на определенную роль этого белка в функционировании нервной системы насекомых.
Известны способы получения вд-Линкс 1 мышей и насекомых, основанные на экспрессии в трансформированных клетках млекопитающих НЕК 293Т [J.M.Miwa, I.Ibanez-Tallon, G.W.Crabtree, R.Sanchez, A.Sali, L.W.Role, N.Heintz (1999) Neuron 23(1):105-14] и насекомых Sf9 [Y.M.Choo, B.H.Lee, K.S.Lee, B.Y.Kim, J.Li, J.G.Kim, J.H.Lee, H.D.Sohn, S.Y.Nah, B.R.Jin (2008) Mol Cell Neurosci. 38(2):224-35]. Недостатком этих методов является крайне низкий выход целевого продукта (50 мкг белка из 1 л среды).
Известен наиболее близкий к заявленному белок Линкс1 человека, выделенный из поджелудочной железы [Southan С., Simms M., Narjis S. (2000) EMBL/GenBank/DDBJ databases]. Однако этот белок не может быть использован в качестве лекарственного препарата.
Изобретение решает задачу получения рекомбинантного водорастворимого белка со свойствами Линкс1 человека, - вд-Линкс1.
Поставленная задача решается за счет конструирования рекомбинантной плазмидной ДНК рЕТ22b(+)/вд-Линкс1, кодирующей белок со свойствами Линкс 1 человека (5635 п.о.), и штамма бактерий Escherichia coli ВL21(DE3)/рЕТ22b(+)/вд-Линкс1 - продуцента белка со свойствами Линкс1 человека, обеспечивающего синтез этого белка с уровнем экспрессии не ниже 10% суммарного клеточного белка.
Рекомбинантная плазмидная ДНК рЕТ22b(+)/вд-Линкс1, кодирующая белок со структурой водорастворимого домена Линкс1 человека, характеризуется следующими признаками:
имеет молекулярную массу 5635 п.о.;
кодирует аминокислотную последовательность искусственного водорастворимого домена Линкс1 человека;
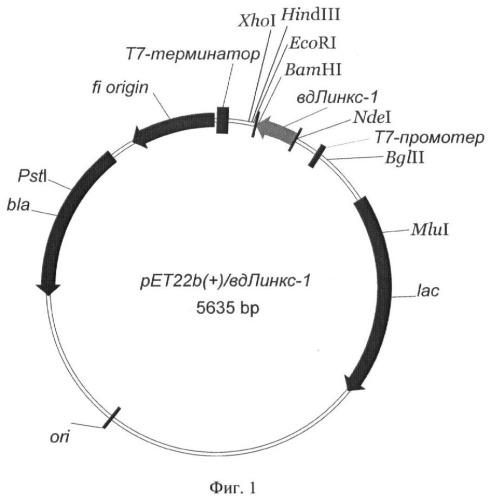
содержит: lac-промотор Е.coli, ген bla β-лактамазы, определяющий устойчивость трансформированных плазмидой рЕТ22b(+)/вд-Линкс1 клеток к ампициллину, участок ori инициации репликации; уникальные сайты узнавания рестрикционными эндонуклеазами, имеющие следующие координаты: XhoI - 158, HindIII - 173, EcoRI - 192, ВаmIII - 198, NdeI - 430, BglII - 534, MluI - 1256, PstI - 4495.
Экспрессия гена вд-Линкс1 человека в клетках Е.coli сопровождается накоплением искусственного нейромодулятора в бактериальной цитоплазме в виде нерастворимых телец включения. Для его выделения необходимо использование денатурирующих агентов.
Для получения штамма-продуцента полипептида со структурой водорастворимого домена Линкс1 человека компетентные клетки Escherichia coli BL21(DE3) трансформируют рекомбинантной плазмидой рЕТ22b(+)/вд-Линкс1.
Полученный штамм Escherichia coli ВL21(DE3)/рЕТ22b(+)/вд-Линкс1 характеризуется следующими признаками.
Морфологические признаки. Клетки мелкие палочковидной формы, грамотрицательные, неспороносные, 1×3-5 мкм, подвижные.
Культуральные признаки. При росте на плотной среде LA колонии круглые, гладкие, полупрозрачные, блестящие, серые, край ровный, диаметр колоний 1-3 мм; консистенция пастообразная. Рост в жидкой среде LB характеризуется ровным помутнением с образованием легкого осадка.
Физико-биохимические признаки. Клетки растут при температуре 4-42°С при оптимуме рН 6,8-7,2. В качестве источника азота используют как минеральные соли в аммонийной форме, так и органические соединения в виде пептона, триптона, дрожжевого экстракта, аминокислот. В качестве источника углерода используют аминокислоты, глицерин, углеводы.
Устойчивость к антибиотикам. Клетки проявляют устойчивость к ампициллину (до 200 мкг/мл), обусловленную наличием в плазмиде гена бета-лактамазы.
Штамм Е. coli ВL21(DE3)/рЕТ22b(+)/вд-Линкс1 обеспечивает индуцибельный синтез белка со свойствами Линкс1 человека в количестве не менее 10% от суммарного клеточного белка.
Полученный рекомбинантный белок вд-Линкс1 может быть использован для лечения псориаза, онкологических заболеваний, болезни Альцгеймера, паркинсонизма, некоторых форм эпилепсии.
Изобретение иллюстрируют графические материалы:
На фиг.1 представлена физическая карта рекомбинантной плазмиды рЕТ22b(+)/вд-Линкс1;
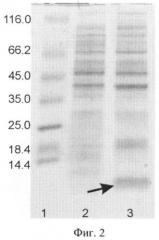
на фиг.2 - электрофореграмма лизатов клеток штамма-реципиента Е. coli BL21(DE3) (дорожка 2), штамма-продуцента Е.coli ВL21(DE3)/рЕТ22b(+)/вд-Линкс1 (дорожка 3) в 13%-ном полиакриламидном геле, дорожка 1 - белковые маркеры молекулярной массы; стрелкой указан полипептид вд-Линкс1;
на фиг.3 - очистка рекомбинантного вдЛинкс 1 после ренатурации методом ВЭЖХ на колонке JupiterC4 (2×150, мм, Phenomenex, США) в линейном градиенте концентрации ацетонитрила от 10% до 45% за 30 мин в присутствии 0,1%-ной ТФУ, скорость элюции - 0,3 мл/мин. Регистрация оптической плотности элюата при 210 нм;
на фиг.4 - спектр кругового дихроизма в воде рекомбинантного вд-Линкс1 после ренатурации.
Изобретение иллюстрируют следующие примеры.
Пример 1. Конструирование гена водорастворимого домена Линкс1 человека.
Ген вдЛинкс 1, фрагмент 1-73 Линкс-1 человека, содержащий на N-конце дополнительный остаток метионина, конструируют из 6 синтетических перекрывающихся олигонуклеотидов с использованием трехстадийной ПЦР. На первой стадии в результате последовательной амплификации праймеров 1 (SEQ №1) и 2 (SEQ №2), 3 (SEQ №3) и 4 (SEQ №4), 5 (SEQ №5) и 6 (SEQ №6) нарабатывают ПЦР фрагменты А, Б и В, соответственно. На второй стадии фрагменты А и Б аплифицируют с использованием праймеров 1 и 4 для получения ПЦР продукта, содержащего фрагмент Г. Фрагменты Б и В аплифицируют с использованием праймеров 3 и 6 для получения ПЦР продукта, содержащего фрагмент Д. На заключительной стадии фрагменты Г и Д аплифицируют с использованием праймеров 1 и 6 для получения фрагмента, содержащего ген вдЛинкс 1. Во всех ПЦР реакционная смесь в объеме 50 мкл содержит по 140 нг праймеров, по 10 нмоль каждого из четырех дезоксинуклеозидтрифосфатов и 1 ед. акт. Pfu ДНК-полимеразы в буфере для Pfu-полимеразы: 20 мМ Трис-HCl, 2 мМ MgSO4, 10 мМ КСl, 10 мМ (NH4)2SO4, 0.1 % тритон X-100, 200 мкг/мл бычьего сывороточного альбумина (БСА), рН 8.75. Цикл амплификации включает в себя денатурацию ДНК при 95°С (1 мин), отжиг при 52°С (1 мин) и элонгацию при 68°С (1 мин). Всего проводят 30 циклов реакции. Реакционную смесь наносят на агарозный гель для разделения электрофорезом и нужные фрагменты вырезают из геля скальпелем, затем ДНК выделяют из геля с помощью Wizard SV Gel Clean Up System (Promega).
Пример 2. Конструирование рекомбинантной плазмидной рЕТ22b(+)/вд-Линкс1.
50 нг ПЦР-фрагмента ДНК, содержащего ген вдЛинкс 1 (SEQ №7), обрабатывают последовательно рестриктазами NdeI и BamHI (Fermentas, Литва) и из полученного гидролизата выделяют в 2%-ном геле легкоплавкой агарозы фрагмент длиной 231 п.о., содержащий ген вдЛинкс 1.
2 мкг плазмидной ДНК pET22b(+) обрабатывают последовательно рестриктазами NdeI и ВаmHI и из полученного гидролизата выделяют в 1%-ном геле легкоплавкой агарозы векторную ДНК длиной 5403 п.о.
Полученный фрагмент и векторную ДНК соединяют при помощи лигазной реакции в 10 мкл буфера для лигирования (Fermentas), содержащего 1 ед. Т4 ДНК-лигазы. 1 мкл реакционной смеси используют для трансформации 100 мкл компетентных клеток XL-1 Blue. 1/10 клеток, использованных для трансформации, высевают на LB-агар, содержащий 100 мкг/мл ампициллина. Из выросших клонов выделяют целевую плазмидную ДНК рЕТ22b(+)/вд-Линкс1 и анализируют ее путем обработки набором эндонуклеаз рестрикции NdeI и BamHI с последующим электрофоретическим анализом длин рестрикционных фрагментов в 2% полиакриламидном геле.
Окончательно структуру рекомбинантной ДНК рЕТ22b(+)/вд-Линкс1 подтверждают определением нуклеотидной последовательности в области встроенного фрагмента, содержащего синтетический ген водорастворимого домена Линкс1 человека.
Пример 3. Получение и определение продуктивности штамма-продуцента белка со свойствами Линкс1 человека.
Рекомбинантной плазмидной ДНК рЕТ22b(+)/вд-Линкс1 трансформируют компетентные клетки Escherichia coli BL21(DE3) (Novagen) и получают штамм-продуцент белка со свойствами Линкс1 человека. Клетки Е. coli ВL21(DE3)/рЕТ22b(+)/вд-Линкс1 выращивают в 50 мл жидкой среды Terrific Brouth (ТВ), содержащей ампициллин (100 мкг/мл). Культивирование проводят при 37°С с умеренным перемешиванием (250 об./мин) до достижения клеточной плотности в культуре, соответствующей величине поглощения при 600 нм 0.6. Далее клеточную культуру переносят в 1 л ТВ и продолжают выращивание в ферментере (Bioflow 3000, New Brunswick Scientific, США). Культивирование осуществляют при 37°С в условиях автоматического поддержания относительного содержания кислорода в системе не менее 30% от максимально достижимого. Регулируемыми параметрами являются обороты мешалки и скорость подачи воздуха. Экспрессию гена вд-Линкс1 индуцируют добавлением изопропилтио-β-D-галактопиранозида до конечной концентрации 0.025 мМ при клеточной плотности в культуре, соответствующей величине поглощения при 600 нм 1.0. После индукции культивирование клеток осуществляют в течение 18 часов.
Отбирают пробу 1 мл и центрифугируют 5 мин при скорости 6000 об/мин, после чего клетки суспендируют в 100 мкл буфера, содержащего 125 мМ трис-HCl, рН 6,8, 20% глицерин, 3% додецилсульфат натрия, 3% меркаптоэтанол, 0,005% бромфеноловый синий, инкубируют 10 мин в кипящей водяной бане, образцы объемом 5 мкл анализируют электрофорезом в 13% полиакриламидном геле с додецилсульфатом натрия. Гель окрашивают Кумасси G-250 (фиг.2), сканируют и рассчитывают процентное содержание рекомбинантного белка в лизатах с использованием программы Scion Image (Scion Corp., США). По данным сканирования белок вд-Линкс1 составляет 10% от общего клеточного белка (фиг.2).
Пример 4. Выделение рекомбинантного белка со свойствами Линкс1 человека.
Клетки собирают центрифугированием (10000 g, 20 мин, 4°С) и ресуспендируют в холодном буфере 20 мМ Tris/HCl, 100 мМ NaCl, 1 мМ EDTA, рН 8.0 в соотношении 10 мл буфера на 1 г осадка. Далее суспензию клеток дезинтегрируют ультразвуком (Branson Digital Sonifier, США) при выходной мощности 50 Вт и 4°С в течение 5 минут. Полученную взвесь центрифугируют при 36000 g в течение 20 мин. Образовавшийся осадок ресуспендируют в исходном буфере с добавлением 2 М мочевины. Суспензию переносят в охлажденный стакан, дезинтегрируют 10 секунд и центрифугируют в тех же условиях, что и ранее. Процедуру повторяют дважды. После отмывания 2 М мочевиной осадок два раза промывают исходным буфером, содержащим 1% Тритон Х-100, и затем два раза деионизованной водой (MilliQ, Millipore, США). Отмытые тельца включения хранят при - 20°С.
Отмытые тела включения ресуспендируют в 30 мМ Tris-HCl, рН 9.0, содержащем 8 М мочевину (Carl Roth, Германия), из расчета 10 мл буфера на 1 г тел включения. Суспензию дезинтегрируют при выходной мощности прибора 50 Вт и 4°С в течение 30 сек. Затем суспензию тел включения сульфируют добавлением 0,4 М сульфита натрия и 0,15 М тетратионата натрия. В таком виде тела оставляют на 10 часов при перемешивании и 25°С. Затем смесь центрифугируют при 36000 g 1 час и супернатант разводят в 10 раз 4 М мочевиной. После этого сульфированный вд-Линкс1 наносят на колонку с ДЕАП-Сферонит-ОН, предварительно уравновешенную 30 мМ Tris-HCl, рН 8.0 (буфер А). ВдЛинкс 1 элюируют буфером А, содержащим 300 мМ NaCl и 8 М мочевину.
Во фракцию белка, содержащую вд-Линкс1, добавляют дитиотреитол до конечной концентрации 50 мМ и дополнительно чистят с помощью обратнофазной ВЭЖХ с помощью хроматографической колонки Jupiter C4, A300, 10×250 мм (Phenomenex, США) на приборе "Smartline" (Knauer, Германия). Элюцию вд-Линкс1 проводят градиентом ацетонитрила от 10% до 45% за 30 мин в присутствии 0,1% трифторуксусной кислоты. Полученный препарат вд-Линкс1 с восстановленными дисульфидными связями лиофилизуют.
Пример 5. Ренатурация рекомбинантного белка вд-Линкс1 человека.
Лиофилизованный и восстановленный вдЛинкс 1 растворяют в буфере для ренатурации, содержащем 50 мМ Tris/HCl, 1.5 М мочевину, 0.5 М L-аргинин, 3 мМ восстановленного глутатиона и 0.3 мМ окисленного глутатиона, рН 11.0, до конечной концентрации белка 0.1 мг/мл. После растворения вд-Линкс1 рН раствора понижают до 9,5 и инкубируют при 4°С в течение 4 суток.
Раствор вд-Линкс1 концентрируют в 4 раза на концентрационной ячейке с размером пор мембраны 1 кДа (Millipore, США). Очистку ренатурированного вд-Линкс-1 проводят с помощью обратнофазной ВЭЖХ на колонке Jupiter C4, А300, 4,6×250 мм (Phenomenex, США). Элюцию вдЛинкс-1 проводят градиентом ацетонитрила от 20% до 45% за 30 мин в присутствии 0,1% трифторуксусной кислоты (Фиг.3). Полученный препарат ренатурированного вдЛинкс 1 лиофилизуют.
Описываемый способ выделения позволяет получить 0.85 мг ренатурированного вд-Линкс1 из 1 г влажной биомассы, что соответствует 0.85 мг белка из 100 мг лиофилизированной биомассы.
Спектры, измеренные на времяпролетном масс-спектрометре UltraFlex TOF/TOF фирмы Bruker Daltonics (Германия), оснащенном источником ионизации MALDI, показали соответствие молекулярной массы рекомбинантного вд-Линкс1 расчетным данным, полученным для аминокислотной последовательности SEQ №8.
Пример 6. Получение спектра кругового дихроизма рекомбинантного вдЛинкс 1.
Спектр КД (фиг.4) измеряют с помощью спектрополяриметра J-810 (Jasco, Япония) в кювете с длиной оптического пути 0,01 см в диапазоне длин волн 190-250 нм с шагом 1 нм. Исследуют конформацию вд-Линкс1 в водном растворе (рН~4,0). Концентрация вд-Линкс 1 в воде составляет 0,09 мМ. Оценку содержания элементов вторичной структуры (см. табл.) проводят по программе CONTINLL [Provencher, S.W., Glocker, J. Estimation of globular protein secondary structure from circular dichroism. //Biochemistry. - 1982. - Vol.20. - P.33-37].
Анализ полученного спектра показывает, что в водной среде вд-Линкс1 обладает упорядоченной структурой типа β-складок (таблица). Содержание β-структуры близко к структуре, наблюдаемой у структурных гомологов Линкс1, змеиных нейротоксинов.
| Таблица | ||||
| Данные о вторичной структуре рекомбинантного вд-Линкс1 человека, полученные с помощью кругового дихроизма. | ||||
| Содержание α-структуры | Содержание β-слоев | Содержание β-поворотов | Содержание неупорядоченной структуры | |
| Вд-Линкс1 | 5,7% | 39,4% | 21,9% | 33,0% |
Таким образом, заявляемое техническое решение позволяет получить белок со структурой и свойствами, идентичными структуре и свойствам природного водорастворимого домена Линкс1 человека, и при этом уровень его бактериального синтеза составляет не менее 10% от суммарного клеточного белка. Это позволяет получать в миллиграммовых количествах рекомбинантный вд-Линкс1, который может быть использован в медицине в качестве нейромодулятора для лечения заболеваний нервной системы, а также для лечения псориаза и онкологических заболеваний.
1. Рекомбинантная плазмидная ДНК рЕТ22b(+)/вд-Линкс1, кодирующая водорастворимый домен белка Линкс1 человека, имеющий 5635 п.о. с физической картой, приведенной на фиг.1, и состоящая из NdeI/BamHI - фрагмента ДНК плазмиды рЕТ22b(+) длиной 5403 п.о., содержащего 1ас-промотор Е. coli, ген bla β-лактамазы, фрагмент гена lacI Е. соli, участок ori инициации репликации и искусственную последовательность ДНК, кодирующую NdeI/BamHI фрагмент длиной 232 п.о., включающий синтетический ген водорастворимого домена Линкс1 человека с нуклеотидной последовательностью SEQ ID NO: №7; содержащая уникальные сайты узнавания рестрикционными эндонуклеазами, имеющие следующие координаты: XhoI - 158, HindIII - 173, EcoRI - 192, BamHI - 198, NdeI - 430, BglII - 534, МluI - 1256, PstI - 4495.
2. Штамм бактерий Escherichia coli ВL.21(DЕ3)/рЕТ22b(+)/вд-Линкс1 - продуцент водорастворимого домена белка Линкс1 человека.