Препарат иммуноглобулина человека против цитомегаловируса для внутривенного введения и способ его получения
Иллюстрации
Показать всеИзобретение относится к области биотехнологии, конкретно к получению препарата иммуноглобулина человека против цитомегаловируса для внутривенного введения, и может быть использовано в медицине. В качестве исходного сырья для фракционирования используют антицитомегаловирусную плазму с индексом авидности не менее 70%. Производственный процесс включает: ультрафильтрацию иммуноглобулина при ионной силе не более 0,02 и значении рН 4,0-5,7 с последующей диафильтрацией против воды дистиллированной с величиной рН 3,5-6,0. Проводят инкубацию иммуноглобулина с мальтозой концентрации 2-11% при температуре 32-40°С и значении рН 4,0-4,8 в течение 10-36 ч либо с пепсином в дозе 1:10-6-1:10-5 в присутствии 2-11% мальтозы. Далее проводят инактивацию/удаление вирусов путем инкубации иммуноглобулина при значении рН 4,0-4,4 и/или с использованием глубинной фильтрации, и/или нанофильтрации. Доочистку иммуноглобулина осуществляют методами: ультрафильтрации, и/или глубинной фильтрации, и/или нанофильтрации, и/или анионообменной хроматографии, и/или диализа. Стабилизацию иммуноглобулина проводят с использованием натрия хлорида, и/или мальтозы, и/или пролина, и/или глюкозы, и/или глицина, содержание которых обеспечивает осмолярность препарата в пределах 270-400 мОсм/кг. В полученном препарате иммуноглобулина устанавливают значение рН 5,0-7,5 и содержание белка 4,5-10,5%. Изобретение позволяет получить высокоавидный препарат иммуноглобулина против цитомегаловируса для внутривенного введения с улучшенными и стабильными качественными характеристиками. 2 н. и 5 з.п. ф-лы, 5 табл.
Реферат
Изобретение относится к медицинской биотехнологии, в частности к способу получения специфического препарата иммуноглобулина (ИГ) человека против цитомегаловируса (ЦМВ) для внутривенного введения (ВВ).
Для лечения и профилактики цитомегаловирусной инфекции используются внутривенные иммуноглобулины (ВВИГ) как неспецифические (нормальные), так и специфические [1, 2]. К основным показателям качества ВВИГ относится не только эффективность их применения, т.е. величина титров специфических антител (АТ), но и безопасность препарата, обусловленная низкой антикомплементарной активностью (АКА), отсутствием или минимальным содержанием агрегатов, димеров и фрагментов, а также нежелательных примесей, таких как иммуноглобулин A (IgA) и изогемагглютинины. Необходимость контроля IgA и изогемагглютининов во ВВИГ обусловлена возможностью возникновения у пациентов побочных реакций при их высоком содержании в препарате.
Согласно рекомендациям Всемирной Организации Здравоохранения и требованиям Европейской фармакопеи технология получения иммуноглобулина для внутривенного введения должна обеспечивать стабильность качественных характеристик препарата при хранении и транспортировке и максимально сохранять интактную структуру молекулы и распределение субклассов иммуноглобулина G (IgG), соответствующее нормальной донорской плазме крови человека [3]. Используемые стабилизаторы должны не только обеспечивать стабильность препарата ВВИГ, но и не вносить новой биологической активности. Согласно требованиям Европейской фармакопеи, технология получения ВВИГ обязательно должна содержать стадию вирусной инактивации. При этом используемые способы инактивации/удаления вирусов не должны оказывать неблагоприятного влияния на активность и биологические свойства препарата ВВИГ: белок, электрофоретическую чистоту, примеси - IgA, IgM и IgE, молекулярные параметры, распределение субклассов IgG, титр специфических антител и кратность их концентрирования. Специфическая активность ВВИГ зависит как от исходной активности антител в источнике сырья - донорской плазме, так и от технологии получения препарата. При этом некоторые стадии технологического процесса производства ВВИГ оказывают негативное влияние на функциональную активность специфических AT и вызывают потерю или снижение содержания отдельных подклассов иммуноглобулина G [4]. Известно, что антитела к возбудителю ЦМВ инфекции в основном содержатся в IgG1 и IgG3 субклассах иммуноглобулина G [5, 6].
Препараты неспецифических ВВИГ характеризуются вариабельностью и невысоким содержанием титра антицитомегаловирусных AT, что не позволяет получать постоянные положительные результаты в процессе лечения заболеваний, обусловленных цитомегаловирусом [1]. В связи с чем для профилактики и лечения ЦМВ инфекции в основном используются специфические ВВИГ, которые отличаются стабильно высоким титром антицитомегаловирусных антител и скоростью наступления терапевтического эффекта [2]. Кроме того, применение специфического ВВИГ позволяет снизить объем введения препарата, что увеличивает безопасность его применения.
Известен немодифицированный антицитомегаловирусный внутривенный ИГ CytoGam® (Medimmune, Англия), который получают фракционированием высокотитражной плазмы по Кону методом 6 и 9. Для вирусной инактивации используют сольвент-детергентную обработку, в качестве стабилизаторов - 5% сахарозу и 1% альбумин. Известно, что инактивация вирусов сольвент-детергентной обработкой вызывает денатурацию белков и значительно снижает выход иммуноглобулина [7]. Используемый для стабилизации альбумин несет новую биологическую активность, возможность контаминации ВВИГ прионами [8] и практически не используется мировыми производителями. Сахароза в составе препарата ВВИГ может вызвать у людей острую почечную недостаточность [9].
Внутривенный иммуноглобулин против цитомегаловируса Ivegam-CMVR (Biotest, Германия) с активностью не менее 50 РЕ/мл получают этанольным фракционированием по Кону. Технологический процесс предусматривает удаление вирусов обработкой β-пропиолактоном и нанофильтрацией. Однако обработка иммуноглобулина β-пропиолактоном вызывает разрушение субкласса IgG3, что приводит к значительному снижению содержания иммуноглобулина G3-субкласса в препарате ВВИГ и его противовирусной активности [6]. Кроме того, β-пропиолактон значительно снижает Fc-функции иммуноглобулина, понижает антиген-связывание и антиген-зависимое комплемент-связывание, что в конечном итоге отражается на активности иммуноглобулинового препарата [10].
Другой антицитомегаловирусный ВВИГ препарат HUMAGLOBIN-CMV (M/S Human Serums Production & Medicine MFG Co Ltd., Венгрия) содержит в своем составе до 0,5% полиэтиленгликоля и проходит стадию пастеризации. В отношении стадии пастеризации положительным моментом можно считать некоторое снижение частоты и выраженности побочных реакций на иммуноглобулин (боль, краснота, раздражение) по сравнению с аналогичными непастеризованными препаратами. Однако способ пастеризации препарата ВВИГ входит в абсолютное противоречие с требованием Федерального регистра США: «Никогда в процессе производства продукт не должен подвергаться воздействию температуры выше 45°C, и после стерилизации продукт не должен экспонироваться при температуре выше 32°C более 72 часов» [11]. Вероятно, пастеризация может негативно отразиться на параметрах специфической активности, стабильности и безопасности иммуноглобулиновых препаратов. Содержащийся в препарате ВВИГ полиэтиленгликоль является малометаболизируемым соединением и может вызывать побочные эффекты из-за возможности перегрузки ретикуло-эндотелиальной системы.
Жидкий антицитомегаловирусный ВВИГ препарат «CMV-Polyglobin» (Bayer, Германия) с титром антицитомегаловирусных антител 1:150000-1:1225000 получают фракционированием по методу Кона, с последующим алкилированием и стабилизацией мальтозой [12]. Недостатком данного способа является то, что для снижения АКА препарата используют стадию алкилирования. Модификация ИГ с помощью алкилирования значительно снижает титр антицитомегаловирусных антител [13] и значительно повышает нежелательную ревматоидную активность препарата [14]. Кроме того, в данном случае титр антицитомегаловирусных антител, в отличие от концентрации, не является постоянной величиной и зависит от чувствительности и точности метода анализа.
Также известен способ получения препарата специфического гипериммунного антицитомегаловирусного ИГ для внутривенного введения [15]. Известный способ предусматривает отбор высокотитражной антицитомегаловирусной плазмы от нативных невакцинированных доноров и фракционирование этанольным способом по методу Кона. Для обеспечения возможности внутривенного введения полуфабрикат выдерживают при нейтральном значении рН и температуре (4-30)°C в течение 2-30 суток. В качестве стабилизатора используют олигосахариды в количестве от 75 до 200 г/л, выбранные из глюкозы, мальтозы и сахарозы. Препарат антицитомегаловирусного иммуноглобулина для внутривенного введения обладает специфической активностью не менее 60 РЕ/мл и электрофоретической однородностью - не менее 90%.
Способ получения известного препарата предусматривает инкубацию ИГ с углеводами при условиях, которые являются неоптимальными как для снижения антикомплементарной активности, так и обеспечения стабильности антицитомегаловирусных антител. Так инкубация препарата происходит при значении рН 6,4-7,0, которое соответствует изоэлектроэлектрической точке иммуноглобулина (значение рН 5,8-7,3) и способствует спонтанному увеличению антикомплементарной активности и агрегации. Выдерживание иммуноглобулина при температуре 4-30°C может приводить (по полученным нами экспериментальным данным) или к высокой АКА, или нестабильности специфической активности готового препарата - отклонение титров антицитомегаловирусных AT в тестах на стабильность превышает 20%. Продолжительность инкубации иммуноглобулина до 30 суток существенно удлиняет технологический процесс производства.
Недостатком данного препарата является низкая электрофоретическая чистота иммуноглобулина G, которая не соответствует требованиям Европейской фармакопеи (2008) на иммуноглобулин человеческий нормальный для внутривенного введения (не менее 95%) [16]. К недостаткам препарата относятся довольно высокое содержание агрегатов - до 1,4% и димеров - до 14,3%, а также относительно невысокая специфическая активность - минимум 60 РЕ/мл и степень концентрирования специфических антител (в 4-5 раз), принятая для всех ранее выпускаемых нативных антицитомегаловирусных иммуноглобулинов. Кроме того, время растворения ВВИГ после теста на ускоренное старение (по данным самих авторов) увеличилось в 3 раза, что указывает на нестабильность препарата по показателю качества - растворимости. Высокие концентрации олигосахаридов (200 г/л) в составе препарата придают ВВИГ высокую осмолярность, с которой могут быть связаны серьезные побочные реакции. Сахароза и глюкоза, используемые в качестве стабилизаторов, при внутривенном введении высоких доз иммуноглобулина могут вызвать у людей острую почечную недостаточность.
Прототипом настоящего изобретения выбран наиболее высокоактивный препарат - НеоЦитотект фирмы «Biotest Pharma» (Германия), который представляет собой 5% раствор для внутривенного введения со специфической активностью не менее 100 Е/мл [17]. В 1 мл раствора содержится: белки плазмы человека - 50 мг; из них иммуноглобулин G - не менее 95%; антитела против цитомегаловируса - не менее 100 РЕ/мл; иммуноглобулин А - не более 2,5 мг/мл, гемагглютинины: анти-А-титр - менее 1:64, анти-В-титр - менее 1:64 (после разведения до 30 г белка/л); стабилизатор глицин - 300 мкмоль/мл, величина рН препарата 5,0-5,6. Распределение субклассов иммуноглобулина G составляет: IgG1 - 59%, IgG2 - 36%, IgG3 - 3% и IgG4 - 2%. Производственный процесс включает фракционирование антицитомегаловирусной плазмы этанолом на холоду до получения фракции II и обработку иммуноглобулина октановой кислотой. Инактивацию/элиминирование вирусов осуществляют обработкой октановой кислотой и сольвентом/детергентом при помощи три-(н-бутил)-фосфата (ТНБФ) и полисорбата 80 (Твин 80). Продукт очищают катонообменной хроматографией на SP-сферодексе М-геле в системе жидкостной хроматографии высокого давления и высокопроизводительной фильтрации [18, 19].
Известный способ предусматривает обработку иммуноглобулина октановой (каприловой) кислотой. Внутривенный иммуноглобулин из плазмы крови человека, полученный каприлатным способом, имеет более высокий титр анти-А и анти-В антител и соответственно большую опасность гемолитических реакций [20]. Так, в нормативно-технической документации на известный препарат предельно допустимый титр изогемагглютининов соответствует максимально разрешенному титру, предусмотренному Европейской фармакопеей (2008). Применение ВВИГ с высоким титром изогемагглютитинов может приводить к интраваскулярному гемолизу, характеризующемуся быстрым снижением гемоглобина, развитию гемоглобинемии, гипербилирубинемии, гемоглобинурии, возникновению потребности в переливании эритроцитарной массы [21]. Поэтому М. Haase и Н. Mengel (1983) предложили ужесточить требования к препаратам ВВИГ по содержанию гемагглютининов, снизив критический титр анти-А и анти-В антител с 1:32 до 1:16 [22].
Недостатком известного способа является использование сольвент-детергента для инактивации вирусов. Со стадией сольвент-детергентной обработки в технологическом процессе получения ВВИГ связывают нестабильность специфических антител [23]. Так, в известном антицитомегаловирусном препарате ВВИГ содержание субкласса IgG3, нейтрализующая активность которого по отношению к ЦМВ инфекции в десятки раз превосходит другие субклассы [5], составляет меньше, чем в нормальной плазме крови человека. Следовательно, в препарате нарушено нормальное распределение субклассов иммуноглобулина G.
Кроме того, обработка ИГ сольвент-детергентом приводит к более высокому содержанию в препаратах ВВИГ антител к ДНК человека (аутоантител) [23]. Однако для предупреждения возможных побочных реакций, связанных с высоким содержанием антител к ДНК человека, известный препарат не контролируется на содержание аутоантител.
Высокий предел содержания иммуноглобулина А в препарате НеоЦитотект (до 2500 мкг/мл) ограничивает его применение для IgA-дефицитных пациентов, частота которых в популяции составляет от 1/200 до 1/800 случаев [24].
Все вышеупомянутые производители при получении специфического препарата ВВИГ против цитомегаловируса в качестве основного принципа использовали только один критерий - отбор плазмы крови человека с высоким титром суммарных антицитомегаловирусных антител с использованием иммуноферментных тест-систем, направленных на выявление всех антител к лизату цитомегаловируса. Однако известно, что между величиной общего (суммарного) титра антицитомегаловирусных антител и нейтрализующим титром AT, т.е. протективной активностью, корреляция более слабая, чем между нейтрализующим титром антицитомегаловирусных антител и индексом авидности, где имеется сильная корреляционная связь [25]. Низкая авидность различных серий препаратов иммуноглобулина против ЦМВ может привести к вариабельности результатов клинических испытаний [26]. Поэтому использование в качестве сырья низкоавидной антицитомегаловирусной плазмы может привести к снижению нейтрализующей активности конечного антицитомегаловирусного ВВИГ, несмотря на достаточный титр специфических антител в препарате. Кроме того, известные препараты ВВИГ против цитомегаловируса получают по стандартной технологии нормальных внутривенных иммуноглобулинов без учета влияния основных технологических этапов (ионная сила, значения рН, условия снижения АКА, содержание вспомогательных веществ и др.) на титр антицитомегаловирусных AT при получении препарата и их стабильности в процессе хранения. То есть в известных способах не предусмотрены оптимальные условия получения специфического антицитомегаловирусного иммуноглобулина для внутривенного введения. Следовательно, не разработана специальная сохраняющая титр антицитомегаловирусных антител технология. Полностью отсутствуют данные, касающиеся стабильности специфической активности жидкого препарата антицитомегаловирусного ВВИГ в тестах на ускоренное старение и перемешивание, что очень важно и обязательно для специфических иммуноглобулиновых препаратов в жидких формах. Кроме того, существуют данные о том, что повышенное содержание иммуноглобулина Е в препаратах ВВИГ может вызывать побочные реакции немедленного типа, в том числе анафилактические [27]. В связи с чем в препаратах ВВИГ следует определять содержание иммуноглобулина Е. Тем более что в последнее время во всем мире наблюдается ухудшение общего аллергического статуса и увеличение числа IgE-опосредованных аллергических заболеваний [28].
Таким образом, проблема получения высокоэффективного, безопасного и стабильного препарата иммуноглобулина против ЦМВ для внутривенного введения не разрешена до сих пор.
Задачей, на решение которой направленно изобретение, является получение высокоэффективного и безопасного препарата иммуноглобулина человека против цитомегаловируса для внутривенного введения и повышение стабильности целевого продукта.
Технический результат предлагаемого изобретения заключается в разработке способа, способствующего сохранению титров антицитомегаловирусных антител, и получение высокоавидного препарата иммуноглобулина против цитомегаловируса для внутривенного введения с улучшенными и стабильными качественными характеристиками, с содержанием высокоавидных антицитомегаловирусных антител не менее 70 РЕ/мл.
Сущность изобретения заключается в следующем: в качестве исходного сырья для получения иммуноглобулина против ЦМВ используют высокотитражную антицитомегаловирусную плазму крови человека, в которой индекс авидности антицитомегаловирусных антител составляет не менее 70%. Отбор высокоавидной и высокотитражной антицитомегаловирусной плазмы осуществляют как титрацией донорской плазмы иммуноферментным одноточечным методом, так и без подтверждения данными иммуноферментного анализа от паспортизированных (сертифицированных) доноров с заведомо известным высоким титром антицитомегаловирусных антител (не менее 13 РЕ/мл) и индексом авидности не менее 70%. Выделение иммуноглобулина проводят этанольным методом фракционирования на холоду по методу Кона 6. Полученный фильтрат Б (III по Кону) подвергают ультрафильтрации при ионной силе не более 0,02 и значении рН 4,0-5,7, с последующей диафильтрацией против воды дистиллированной с величиной рН 3,5-6,0. Затем в полуфабрикат антицитомегаловирусного иммуноглобулина вводят мальтозу концентрации 2-11% и проводят инкубацию при температуре 32-40°C и значении рН 4,0-4,8 в течение 10-36 ч. Как один из вариантов получения ВВИГ против цитомегаловируса полуфабрикат обрабатывают пепсином в дозе 1:10-6-1:10-5 в присутствии 2-11% мальтозы. С целью инактивации/удаления вирусов иммуноглобулин выдерживают при кислом значении рН 4,0-4,4 в течение трех недель при температуре 21-27°C и/или подвергают глубинной фильтрации и/или нанофильтрации. Доочистку специфического иммуноглобулина осуществляют методами: ультрафильтрации, и/или глубинной фильтрации, и/или нанофильтрации, и/или анионообменной хроматографии, и/или диализа. После чего осмолярность ВВИГ доводят до значения 270-400 мОсм/кг с использованием вспомогательных веществ: 0,0-0,7% натрия хлорида, и/или мальтозы, и/или пролина, и/или глюкозы, и/или глицина. В готовом препарате устанавливают значение рН 5,0-7,5, содержание белка 4,5-10,5%. Конечный препарат ВВИГ получают в жидкой или сухой форме.
Заявленный способ позволяет получить высокоавидный и безопасный препарат иммуноглобулина против ЦМВ для внутривенного введения, стабильный при хранении и транспортировке, который представляет собой иммуноглобулин G с электрофоретической однородностью не менее 97%, индексом авидности не менее 70%, со специфической активностью не менее 100 РЕ/мл, в котором содержание высокоавидных антицитомегаловирусных антител составляет не менее 70 РЕ/мл; концентрация белка в растворе 4,5-10,5%; титр анти-А и анти-В гемагглютининов - не более 1:16; содержание иммуноглобулина А - не более 250 мкг/мл; иммуноглобулина Е - не более 50 МЕ/мл; аутоантител к неденатурированной ДНК человека - не более 40 АЕ/мл; распределение субклассов иммуноглобулина G: IgG1 - не менее 60%, lgG2 - не менее 20%, IgG3 -не менее 5%, IgG4 - не менее 2%; значение рН 5,0-7,5.
В отличие от прототипа в заявленном способе в качестве сырья для получения специфического ВВИГ используют высокоавидную антицитомегаловирусную плазму, в которой индекс авидности составляет не менее 70%. Осуществляют скрининг и паспортизацию постоянных доноров с высоким титром антицитомегаловирусных антител и высокой авидностью. Повторный отбор специфической плазмы проводят от паспортизированных доноров без подтверждения данными иммуноферментного анализа. Производственный процесс включает ультрафильтрацию антицитомегаловирусного иммуноглобулина при ионной силе не более 0,02 и значении рН 4,0-5,7, с последующей диафильтрацией с использованием воды дистиллированной с величиной рН 3,5-6,0. Для снижения антикомплементарной активности и сохранности титров антицитомегаловирусных антител иммуноглобулин инкубируют с 2-11% мальтозой при температуре 32-40°C и значении рН 4,0-4,8 в течение 10-36 ч. Как один из вариантов препарат ВВИГ против цитомегаловируса получают обработкой пепсином в дозе 1:10-6-1:10-5 в присутствии 2-10% мальтозы. Для инактивации/удаления вирусов иммуноглобулин выдерживают при кислом значении рН 4,0-4,4 и/или подвергают глубинной фильтрации, и/или нанофильтрации. Способ получения препарата ВВИГ против цитомегаловируса включает доочистку иммуноглобулина методами: ультрафильтрации, и/или глубинной фильтрации, и/или нанофильтрации, и/или анионообменной хроматографии, и/или диализа. Физиологичную осмолярность (270-400 мОсм/кг) ВВИГ устанавливают с использованием различных комбинаций вспомогательных веществ: 0,0-0,7% натрия хлорида, и/или мальтозы, и/или пролина, и/или глюкозы и глицина. Конечный препарат ВВИГ может быть получен в сухой форме с нейтральным значением рН (6,0-7,5).
Совокупность отличительных признаков заявляемого способа позволяет получить высокоэффективный иммуноглобулин против ЦМВ для внутривенного введения с улучшенными и стабильными качественными характеристиками. В заявленном препарате ВВИГ содержание иммуноглобулина G составляет не менее 97%, высокоавидных антицитомегаловирусных AT - не менее 70 РЕ/мл, концентрация белка в растворе - до 10,5%. В разработанном препарате определяется индекс авидности, который составляет не менее 70%. Кроме того, заявленный специфический ВВИГ контролируется на содержание иммуноглобулина Е и аутоантител к ДНК человека. По сравнению с прототипом в препарате снижен предел содержания иммуноглобулина А и изогеммаглютининов. К тому же в нем увеличено содержание антицитомегаловирусных антител субкласса IgG3.
Совокупность отличительных признаков заявленного способа позволяет получить следующие преимущества.
Стабильность высокоавидных титров антицитомегаловирусных антител у доноров высокотитражной плазмы во времени (независимо от цикличности и сезонности отклонение антицитомегаловирусных титров AT составило не более 15% в течение срока наблюдения 3 года) позволяет проводить не только скрининг специфической плазмы, но и отбор доноров и осуществлять паспортизацию (сертификацию) постоянных доноров с высоким титром антицитомегаловирусных антител с высокой авидностью. Скрининг доноров и отбор плазмы у паспортизированных доноров без подтверждения данными иммуноферментного анализа позволяют сократить потребность в тест-системах, снизить трудоемкость производства и стоимость высокоавидного препарата иммуноглобулина против цитомегаловируса для внутривенного введения.
Ультрафильтрация полуфабриката при ионной силе не более 0,02 и значении рН 4,0-5,7 с последующей диафильтрацией против воды дистиллированной с величиной рН 3,5-6,0 способствует максимальной сохранности титров антицитомегаловирусных антител и выходу иммуноглобулина. При повышении указанного значения рН происходит понижение специфической активности препарата и выхода антицитомегаловирусного иммуноглобулина. Снижение значения рН и/или повышение ионной силы приводит к реактивности (аутореактивности) ВВИГ к контрольному антигену (диплоидным фибробластам эмбриона человека) по данным иммуноферментного анализа на тест-системе «ЦМВ-скрин» (Биосервис, Москва) - увеличение титра примерно в 2,1 раза (р<0,000; n=10), а также возрастанию титра антиДНК антител, содержание которых является индикатором денатурации иммуноглобулина в процессе получения препарата и отражает сохранение нативности антител [29].
Инкубация иммуноглобулина с мальтозой концентрации 2-11% при значении рН 4,0-4,8 в течение 10-36 ч позволяет снизить антикомплементарную активность препарата и обеспечить возможность его внутривенного введения. Следует отметить, что температура инкубации оказывает существенное влияние на стабильность титра антицитомегаловирусных антител. Сравнение титров антицитомегаловирусных AT при разной температуре выдерживания иммуноглобулина с мальтозой показало, что после теста на ускоренное старение в препарате, инкубированном при температуре 23°C, снижение титра специфических антител достигло 53,6%. Кроме того, после воспроизведения условий хранения в течение 2 лет (4 недели при температуре 37°C) данный препарат содержал максимальное количество агрегатов. При этом была отмечена сильная корреляционная связь между уровнем снижения титров антицитомегаловирусных антител и содержанием агрегатов во ВВИГ в процессе хранения (коэффициент корреляции µ=0,832; Р<0,05; n=10). Наиболее стабильными в отношении титров антицитомегаловирусных AT оказались препараты, инкубированные с мальтозой при температуре 4 и 37°C (таблица 1). Однако при инкубации иммуноглобулина с мальтозой при температуре 4°C антикомплементарная активность препарата превышала 1СН50/1 мг белка и не соответствовала требованиям Европейской фармакопеи (2008). Таким образом, при производстве специфического ВВИГ против цитомегаловируса инкубацию иммуноглобулина с мальтозой следует проводить при температуре 32-40°C и значении рН 4,0-4,8 в течение 10-36 ч, так как данные условия способствуют лучшей стабильности титров антицитомегаловирусных антител, низкой антикомплементарной активности и минимальному содержанию агрегатов в препарате ВВИГ при хранении.
Возможность использования следовых количеств пепсина в дозах 1:10-6-1:10-5 в присутствии 2-11% мальтозы позволяет предотвратить: возрастание антикомплементарной активности препарата, помутнение раствора ВВИГ, появление агрегатов и увеличение содержания димеров. Следует отметить, что указанная концентрация пепсина обеспечивает стабильность титра антицитомегаловирусных антител при хранении и транспортировке.
Инактивация/удаление вирусов путем выдерживания полуфабриката ИГ при кислом значении рН (4,0-4,4), с последующей нано- и/или глубинной фильтрацией отличается высокой эффективностью и позволяет получить вирусологически безопасный внутривенный иммуноглобулин. Данный способ инактивации/удаления вирусов отличается простотой выполнения, не требует введения дополнительных реагентов и контроля их остаточного содержания в готовом препарате. Сравнительный анализ экспериментальных серий ВВИГ, полученных из одного полуфабриката с использованием и без использования данных стадий инактивации и удаления вирусов, не выявил существенных различий в их качественных характеристиках.
Доочистка специфического иммуноглобулина методами ультрафильтрации, и/или глубинной фильтрации, и/или нанофильтрации, и/или анионообменной хроматографии, и/или диализа позволяет получить высокоочищенный и вирусобезопасный препарат ВВИГ против цитомегаловируса с улучшенными качественными характеристиками, стабильными при хранении и транспортировке. Совокупность используемых методов очистки позволяет снизить количество иммуноглобулина А в препарате, удалить остаточное содержание пепсина, фрагментов, димеров и агрегированных форм иммуноглобулина.
Форма применения заявленного препарата ВВИГ против цитомегаловируса может быть различной: от стандартного раствора с концентрацией белка 4,5% до более концентрированного - 10,5%. Увеличением концентрации иммунологически активной фракции достигается повышение эффективности и надежности ВВИГ, при этом существенно сокращаются время и объемы введения препарата. Чтобы предотвратить опасные для пациентов высокие осмолярность и вязкость раствора, связанные с высокой концентрацией белка в ВВИГ, препарат подвергается нано- и глубинной фильтрации. Кроме того, были подобраны специальные комбинации и концентрации вспомогательных веществ и значения рН препарата.
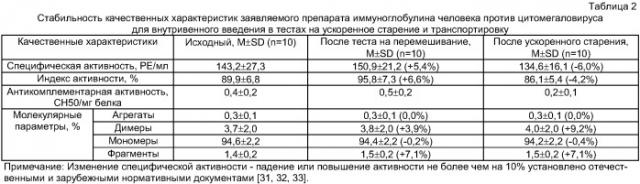
Физиологичную осмолярность (270-400 мОсм/кг) в антицитомегаловирусном ВВИГ достигают при совместном использовании нескольких вспомогательных веществ: натрия хлорида, мальтозы, пролина, глюкозы и глицина, при минимальном содержании в препарате каждого из стабилизаторов. Известно, что препараты ВВИГ с минимальным содержанием каждого из вспомогательных веществ наиболее благоприятно выглядят при учете индекса условной широты фармакологической безопасности стабилизаторов LD50/МДС. По индексу условной широты фармакологической безопасности стабилизаторов определяется риск внутривенных иммуноглобулинов. Совокупность концентраций используемых комбинаций вспомогательных веществ обеспечивают осмолярность заявленного препарата, соответствующую нормам Европейской Фармакопеи (2008) - не менее 240 мОсм/кг, и стабильность качественных характеристик ВВИГ (молекулярных параметров, АКА, специфической активности) во время хранения и транспортировки (таблица 2). Кроме того, при сублимационном высушивании использование стабилизаторов мальтозы и глюкозы способствует стабильности АКА препарата и позволяет предотвратить образование агрегированных форм иммуноглобулина. Используемые стабилизаторы имеют хорошую переносимость при внутривенном пути введения за счет способности почечных клеток метаболизировать эти вещества. С другой стороны, наличие единственного стабилизатора в составе препарата ВВИГ позволяет рекомендовать его исключительно при непереносимости других вспомогательных веществ.
Жидкая форма ВВИГ значительно снижает стоимость препарата и является более удобной для потребителя. Значение рН 5,0-6,0 в жидкой форме специфического иммуноглобулина для внутривенного введения способствует стабильности качественных характеристик препарата и наибольшей степени стабильности титра антицитомегаловирусных AT, т.е. его специфической активности во время хранения и транспортировки.
Лиофилизированная форма препарата позволяет получать ВВИГ с нейтральным значением рН (6,5-7,5), обеспечивает большую стабильность показателей во время хранения и транспортировки, увеличивает срок годности целевого продукта и безопасность применения из-за нейтрального значения рН.
Заявленный способ позволяет получать высокоавидный, безопасный и стабильный препарат иммуноглобулина против цитомегаловируса для внутривенного введения с улучшенными качественными характеристиками (таблица 3). Использование в качестве сырья высокоавидной плазмы доноров с высоким титром антител к ЦМВ позволяет получить антицитомегаловирусный препарат ВВИГ с высокой авидностью (не менее 70%), в котором содержание высокоавидных антицитомегаловирусных антител составляет не менее 70 РЕ/мл. Известно, что высокоавидные антитела значительно активней низкоавидных в ряде биологических реакций, таких как связывание комплемента и опсонизация, и обладают более высокой вируснейтрализующей активностью [30].
В заявленном препарате введен контроль содержания иммуноглобулина Е и аутоантител, которые являются показателями безопасности внутривенных иммуноглобулинов. Определение содержания иммуноглобулина Е делает препарат ВВИГ более безопасным при лечении пациентов, склонных к IgE-опосредованным аллергическим заболеваниям. Контроль ВВИГ на аутоантительную активность позволяет предупредить возможные побочные реакции [14].
Разработанный препарат относится к группе внутривенных иммуноглобулинов с низким содержанием иммуноглобулина А (не более 250 мкг/мл) и может быть использован с меньшим риском для лечения IgA-дефицитных больных.
Препарат имеет распределение субклассов IgG, подобное плазме крови человека (таблица 4). При этом по сравнению с прототипом содержание антицитомегаловирусных антител субкласса IgG3 увеличено более чем в 1,7 раза.
Согласно требованиям Европейской Фармакопеи на ВВИГ (2008) заявленный препарат контролируют на содержание всех веществ, добавленных в него и остающихся в нем после технологической обработки.
Препарат иммуноглобулина против цитомегаловируса для внутривенного введения контролировался по следующим методикам.
Электрофоретическая однородность методом электрофореза на пленках из ацетата целлюлозы (ФС 42-3874-99, с.20). Молекулярные параметры методом гельфильтрации (ФС 42-3874-99, с.28). Антикомплементарная активность - 1 мг белка иммуноглобулина не должен потреблять более 1 ед. (СН50) комплемента (МУК 3.3.2.1063-010). Титр антицитомегаловирусных антител к ЦМВ определялся относительно отраслевого стандартного образца противоцитомегаловирусных антител человека ОСО IgG анти-ЦМВ №42-28-371-03 и выражался в единицах активности института Пауля Эрлиха - РЕ/мл. В качестве калибратора цитомегаловирусных антител использовался международный стандарт CMV IgG+ с активностью 300 U/ml. Авидность антицитомегаловирусных антител определялась с помощью иммуноферментной тест-системы для выявления низкоавидных иммуноглобулинов G к цитомегаловирусной инфекции "ЦМВ-Диагност" (ТОО Биотехнологическая компания «Биосервис»), ДС-ИФА-анти-ЦМВ-G-Авидность (ООО «Научно производственное объединение «Диагностические системы»), ЦМВ-IgG-Авидность-ДС (ЗАО «МБС»). Титр высокоавидных антител (ТВАТ) вычислялся по формуле: ТВАТ=ТАТ×IA/100, где ТАТ - титр антител, IA - индекс авидности. Для определения концентрации иммуноглобулина Е (IgE) использовался иммуноферментный набор «IgE-ИФА-Бест-стрип» (ЗАО «Вектор-Бест», г.Новосибирск). Содержание анти-А и анти-В иммунных изогемагглютининов определялся модифицированным методом непрямой гемагглютинации (Европейская Фармакопея) с использованием тестовых эритроцитов А и В, приготовленных согласно «Инструкции по заготовке и консервированию эритроцитарной массы», утвержденной начальником Главного лечебно-профилактического управления МЗ РФ 30.09.1968 г. Содержание IgA определялся методом иммуноферментного анализа на тест-системе «IgA-ИФА-БЕСТ-стрип» (ЗАО «Вектор-Бест», Новосибирск). Определение концентраций субклассов иммуноглобулина G: IgG1, IgG2, IgG3 и IgG4 осуществлялось методом иммуноферментного анализа на тест-системе «Подклассы IgG-ИФА-БЕСТ» (ЗАО «Вектор-Бест», г. Новосибирск). Для определения аутоантител использовались тест-системы «ВектоДНК-IgG-стрип» для выявления аутоиммунных антител класса G к двухцепочечной неденатурированной ДНК. Протеолитическую активность определяли по Европейской Фармакопеи (Ph. Eu.r monograph 0682). Натрия хлорид по ФС 42-3874-99, с.59. Глицин по МУК 4.1/4.2.588-96, с.114. Количественное содержание мальтозы и глюкозы определяли специфическими ферментативными наборами: Maltose/Sucrose/D-Glucose («BOEHRINGER MANNHEIM/R-BIOPHARM AG», Германия) или ENZYTEC™ D-Glucose, Enzytec™ Maltose («SCIL Diagnostics GmbH, Германия). Остаточный этанол по МУК 4.1/4.2.588-96, с.107. Определение пирогенности проводили согласно требованиям Европейской Фармакопеи (2008, 6.0, монография 0918). Осмолярность определяли криоскопическим методом на миллиосмометре-криоскопе термоэлектрическом MT-4. Исследование стабильности препарата проводили в тестах на перемешивание и ускоренное старение. Тест на перемешивание, который является аналогом условий транспортировки препарата, осуществлялся путем перемешивания в течение 2 ч при частоте 80 горизонтальных осцилляций в минуту при температуре 20°C. Тест на ускоренное старение осуществлялся выдерживанием препарата в термостате при температуре 37°C в течение 4 недель и является аналогом условий хранения в течение 2 лет [Европейская Фармакопея. Изд. III-2000., V.2.6.20, монография №0918]. Статистическую обработку результатов проводили с использованием компьютерных программ «Excel 4.0» и «Statistica 5.7».
Примеры конкретного выполнения.
Пример 1. Для получения препарата иммуноглобулина человека против ЦМВ для внутривенного введения в качестве исходного сырья используют плазму невакцинированных цитомегаловирусом доноров в количестве 200 литров с высокими титром и авидностью антицитомегаловирусных антител. Вначале осуществляют скрининг и отбор донорской плазмы крови человека, в которой титр антицитомегаловирусных антител составляет не менее 13 РЕ/мл, индекс авидности - не менее 70%. Определение титра и индекса авидности антицитомегаловирусных антител осуществляют титрацией донорской плазмы иммуноферментным одноточечным методом на доступной иммуноферментной тест-системе. Затем проводят паспортизацию (сертификацию) постоянных доноров, обладающих титром антицитомегаловирусных антител не менее 13 РЕ/мл и индексом авидности - не менее 70%. Выделение специфического иммуноглобулина осуществляют классическим этанольным способом при отрицательных температурах по методу Кона 6 до получения фильтрата III. Полученный фильтрат Б (III по Кону), с величиной рН 5,1 и содержанием белка 0,3%, этанола - 17%, подвергают концентрированию на ультрафильтрационной установке с полиэфирсульфоновыми мембранами с пределом отсечения по молекулярной массе 10000-100000 Да. Ультрафильтрацию иммуноглобулина проводят при ионной силе 0,02 и значении рН 4,0. После чего полуфабрикат подвергают диафильтрации против воды дистиллированной с величиной рН 3,5. Затем в ИГ вводят мальтозу до концентрации 2% в растворе и инкубируют при значении рН 4,0 и температуре (33±1)°C в течение 36 ч. Далее иммуноглобулин подвергают доочистке методами глуби