Набор праймеров для использования при детекции дрожжей рода dekkera и дрожжей рода brettanomyces
Иллюстрации
Показать всеИзобретение относится к области биотехнологии. Способ детекции дрожжей Dekkera anomala, Dekkera bruxellensis, Dekkera custersiana и Brettanomyces naardenensis предусматривает проведение реакции амплификации нуклеиновой кислоты по LAMP-методу с использованием набора специфических праймеров. Наборы праймеров обладают высокой специфичностью и позволяют количественно определять дрожжи рода Dekkera и Brettanomyces. Изобретение может быть использовано в области пищевой промышленности для определения качества спиртных и безалкогольных напитков. 10 н. и 4 з.п. ф-лы, 8 ил., 4 табл.
Реферат
Область техники, к которой относится изобретение
Настоящее изобретение относится к набору праймеров для использования при детекции дрожжей рода Dekkera и дрожжей рода Brettanomyces, которые приводят к снижению качества спиртных напитков или безалкогольных напитков. Кроме того, настоящее изобретение относится к способу выявления и количественного определения дрожжей рода Dekkera и дрожжей рода Brettanomyces с использованием указанного набора праймеров.
Предпосылки создания изобретения
Ухудшение качества напитков в связи с загрязнением дрожжами и пролиферацией в них дрожжей создает определенные экономические проблемы. И такие проблемы, связанные с ухудшением качества напитков, имеют место во всем мире. Известно, что дрожжи рода Dekkera (вегетативное поколение которого известно как род Brettanomyces), которые рассматриваются в качестве причины такого снижения качества напитков, вызывают помутнение и неприятный запах пива, вина и безалкогольных напитков (Kurtzman C. P. & Fell J. W. The Yeasts, A taxonomic Study, 4th edition, 1998, Elsevier Science B. V., The Netherlands).
В пивоваренной промышленности дрожжи рода Dekkera вызывают образование уксусной кислоты или ацетатов при их пролиферации в пиве, что вызывает ухудшение качества пива (Back W.: Farbatlas und Handbuch der Geraenkebiologie, Teil I, 1994, Verlag Hans Carl, Nuernberg, European Brewery Convention: ANALYTICA-MICROBIOLOGICA-EBC, 2nd ed. 2005 Fachverlag Hans Carl, Nuernberg). В винодельческой промышленности дрожжи рода Dekkera образуют вещества с запахом фенола, такие как 4-этилфенол, амины, уксусная кислота и т.п. Запах вина, загрязненного такими дрожжами, описывается такими терминами как «запах животного» или «запах скотного двора» и соответственно коммерческая ценность такого вина снижается (Mitrakul et al.: Food Microbiology, 1999, Vol. 16, 3-14, Phister et al.: Applied and Environmental Microbiology, 2003, Vol. 69, 7430-7434, Silva et al.: Am. J. Enol. Vitic, 2004, Vol. 55, 65-72).
В безалкогольной промышленности дрожжи рода Dekkera также вызывают образование большого количества кислоты, такой как уксусная кислота, из глюкозы или других источников углерода, и такая кислота создает характерный запах, свойственный ацетату или аналогичным соединениям (Back W.: Farbatlas und Handbuch der Geraenkebiologie, Teil II, 1999, Verlag Hans Carl, Nuernberg).
Таким образом, когда дрожжи рода Dekkera размножаются в продукте или в ходе производственного процесса, это оказывает серьезное влияние на промышленность. Соответственно очень важна методика быстрого выявления и/или идентификации таких дрожжей для контроля качества.
Традиционным способом детекции дрожжей дикого типа является метод, основанный на культивировании. В случае культивирования дрожжей рода Dekkera используют селективную среду, к которой добавляют циклогексимид, и затем растят дрожжи в течение обычно 1-2 недель. Кроме того, метод биохимической идентификации этих дрожжей также требует 3-4 недель и при этом часто получают неопределенные результаты (Phister et al., Applied and Environmental Microbiology, 2003, Vol. 69, 7430-7434, Silva et al.: Am. J. Enol. Vitic, 2004, Vol. 55, 65-72).
Было опубликовано несколько методов детекции дрожжей рода Dekkera с использованием молекулярных биологических стратегий. Ибеас с соавт. (Ibeas et al., Applied and Environmental Microbiology, 1996, Vol. 62, 998-1003) сообщили, что примерно 10 клеток дрожжей рода Dekkera могут быть выявлены в загрязненном хересе с использованием метода двухступенчатой ПЦР. Хилдиг-Нильсен с соавт. (Hyldig-Nielsen et al., WO00/77259) и Стендер с соавт. (Stender et al., Applied and Environmental Microbiology, 2001, Vol. 67, 938-941) разработали зонд на основе пептидной нуклеиновой кислоты, который они использовали применительно к гену 26S рРНК Dekkera bruxellensis и разработали способ выявления и идентификации дрожжей вида Dekkera bruxellensis из вина по флуоресцентному методу с гибридизацией in situ. Делаэрш с соавт. (Delaherche et al., Journal of Applied Microbiology, 2004, Vol. 97, 910-915) и Фистер с соавт. (Phister et al., Applied and Environmental Microbiology, 2003, Vol. 69, 7430-7434) опубликовали методику идентификации Dekkera bruxellensis в вине с использованием методики ПЦР в реальном времени.
Кроме того, что касается идентификации дрожжей рода Dekkera на уровне вида, имеется несколько соответствующих работ. В частности, Митракул с соавт. (Mitrakul et al., Food Microbiology, 1999, Vol. 16, 3-14) сообщили, что дрожжи рода Dekkera могут быть идентифицированы на уровне вида или штамма с использованием методики RAPD-ПЦР. Кроме того, Коколин с соавт. (Cocolin et al., FEMS Microbiol. Lett., 2000, Vol. 189, 81-87) опубликовали метод, включающий непосредственную амплификацию генов дрожжей рода Dekkera, содержащихся в вине, по методу ПЦР с последующим выявлением их с помощью денатурирующего градиентного гель-электрофореза (DGGE).
Эгли с соавт. (Egli et al., Am. J. Enol. Vitic, 2001, Vol. 52, 241-247) провели амплификацию по процедуре ПЦР двух участков внутреннего транскрибированного спейсера (ITS), организованного в виде «сэндвича» за счет генов рибосомальной РНК в дрожжах рода Dekkera и гена 5,8S рРНК, локализованного между двумя участками, и далее дифференцировали их на основе различия в картинах фрагментов, полученных при обработке рестриктазой.
При исследовании представителей дрожжей рода Dekkera, используемых при сбраживании для получения традиционного ирландского сидра, Морриссей с соавт. (Morrissey et al., Journal of Applied Microbiology, 2004, Vol. 97, 647-655) провели реакцию амплификации ITS-участков и гена 5,8S рРНК по процедуре ПЦР и проанализировали полученные продукты с использованием расщепления рестриктазой.
Однако поскольку метод ПЦР, метод ПЦР в реальном времени и метод флуоресцентной гибридизации in situ требуют высокочувствительного температурного контроля и оценки флуоресценции, эти методы требуют дорогостоящей аппаратуры. Кроме того, метод двухстадийной ПЦР, метод RAPD-ПЦР, метод, основанный на рестриктазной обработке амплифицированного продукта, и метод DGGE требуют длительного периода времени для их проведения и достаточно сложных манипуляций. Таким образом, все эти методы являются проблематичными при их использовании в ежедневном тестировании микроорганизмов.
Метод амплификации нуклеиновой кислоты, известный как LAMP-метод (изотермальная петлевая амплификация (loop mediated isothermal amplification), характеризуется тем, что реакция проводится при постоянной температуре, а также высокой специфичностью реакции, обусловленной тем, что для ее проведения используются 4 типа праймеров, которые распознают 6 участков, высокой эффективностью амплификации, и, таким образом, данный метод позволяет осуществлять амплификацию за короткий период времени и, кроме того, данный метод обеспечивает получение продукта амплификации в большом количестве и пригоден для простой детекции (WO00/28082 and T. Notomi et al.: Nucleic Acids research, 2000, 28(12), е63). Цучия с соавт. (Tsuchiya et al.) разработали праймеры для использования в LAMP-методе с целью детекции дрожжей рода Brettanomyces и рода Dekkera из D2 участков генов рРНК дрожжей этих родов (WO2005/093059).
Однако набор праймеров, необходимый для использования в LAMP-методе, направленный на ITS-участки дрожжей рода Brettanomyces и дрожжей рода Dekkera, был до настоящего времени неизвестен.
Краткое описание сущности изобретения
Авторам настоящего изобретения удалось разработать набор праймеров для использования в LAMP-методе, который позволяет точно идентифицировать дрожжи рода Dekkera и дрожжи рода Brettanomyces и проводить их количественное определение.
Целью настоящего изобретения является создание набора праймеров для использования в LAMP-методе, который позволяет точно, быстро и просто идентифицировать дрожжи рода Dekkera и дрожжи рода Brettanomyces на уровне вида и также дает возможность точно определять их количество.
Далее в тексте идет описание относящееся: к детекции Dekkera anomala, в качестве первого варианта осуществления настоящего изобретения, к детекции Dekkera bruxellensis, в качестве второго варианта осуществления настоящего изобретения, к детекции Dekkera custersiana, в качестве третьего варианта осуществления настоящего изобретения, и к детекции Brettanomyces naardenensis, в качестве четвертого варианта осуществления настоящего изобретения.
Первый вариант осуществления настоящего изобретения
Согласно первому варианту осуществления настоящего изобретения предлагается набор LAMP-праймеров для использования с целью детекции Dekkera anomala (который далее называется как «набор праймеров согласно первому варианту»), который включает следующие полинуклеотиды:
полинуклеотид (FIP), имеющий последовательность оснований SEQ ID NO: 1, или полинуклеотид, состоящий, по меньшей мере, из 10 оснований, который гибридизуется с полинуклеотидом, имеющим последовательность, комплементарную данной последовательности оснований (полинуклеотид 1);
полинуклеотид (F3), имеющий последовательность оснований SEQ ID NO: 2, или полинуклеотид, состоящий, по меньшей мере, из 10 оснований, который гибридизуется с полинуклеотидом, имеющим последовательность, комплементарную данной последовательности оснований (полинуклеотид 2);
полинуклеотид (BIP), имеющий последовательность оснований SEQ ID NO: 3, или полинуклеотид, состоящий, по меньшей мере, из 10 оснований, который гибридизуется с полинуклеотидом, имеющим последовательность, комплементарную данной последовательности оснований (полинуклеотид 3); и
полинуклеотид (B3), имеющий последовательность оснований SEQ ID NO: 4, или полинуклеотид, состоящий, по меньшей мере, из 10 оснований, который гибридизуется с полинуклеотидом, имеющим последовательность, комплементарную данной последовательности оснований (полинуклеотид 4).
Согласно первому варианту осуществления настоящего изобретения предлагается способ детекции Dekkera anomala, который включает проведение реакции амплификации нуклеиновой кислоты по LAMP-методу с использованием набора праймеров, состоящего из полинуклеотидов 1, 2, 3 и 4.
Второй вариант осуществления настоящего изобретения
Согласно второму варианту осуществления настоящего изобретения предлагается набор LAMP-праймеров для использования с целью детекции Dekkera bruxellensis (который далее называется как «набор праймеров согласно второму варианту»), который включает следующие полинуклеотиды:
полинуклеотид (FIP), имеющий последовательность оснований SEQ ID NO: 7, или полинуклеотид, состоящий, по меньшей мере, из 10 оснований, который гибридизуется с полинуклеотидом, имеющим последовательность, комплементарную данной последовательности оснований (полинуклеотид 7);
полинуклеотид (F3), имеющий последовательность оснований SEQ ID NO: 8, или полинуклеотид, состоящий, по меньшей мере, из 10 оснований, который гибридизуется с полинуклеотидом, имеющим последовательность, комплементарную данной последовательности оснований (полинуклеотид 8);
полинуклеотид (BIP), имеющий последовательность оснований SEQ ID NO: 9, или полинуклеотид, состоящий, по меньшей мере, из 10 оснований, который гибридизуется с полинуклеотидом, имеющим последовательность, комплементарную данной последовательности оснований (полинуклеотид 9); и
полинуклеотид (B3), имеющий последовательность оснований SEQ ID NO: 10, или полинуклеотид, состоящий, по меньшей мере, из 10 оснований, который гибридизуется с полинуклеотидом, имеющим последовательность, комплементарную данной последовательности оснований (полинуклеотид 10).
Согласно второму варианту осуществления настоящего изобретения предлагается способ детекции Dekkera bruxellensis, который включает проведение реакции амплификации нуклеиновой кислоты по LAMP-методу с использованием набора праймеров, состоящего из полинуклеотидов 7, 8, 9 и 10.
Третий вариант осуществления настоящего изобретения
Согласно третьему варианту осуществления настоящего изобретения предлагается набор LAMP-праймеров для использования с целью детекции Dekkera custersiana (который далее называется как «набор праймеров согласно третьему варианту»), который включает следующие полинуклеотиды:
полинуклеотид (FIP), имеющий последовательность оснований SEQ ID NO: 12, или полинуклеотид, состоящий, по меньшей мере, из 10 оснований, который гибридизуется с полинуклеотидом, имеющим последовательность, комплементарную данной последовательности оснований (полинуклеотид 12);
полинуклеотид (F3), имеющий последовательность оснований SEQ ID NO: 13, или полинуклеотид, состоящий, по меньшей мере, из 10 оснований, который гибридизуется с полинуклеотидом, имеющим последовательность, комплементарную данной последовательности оснований (полинуклеотид 13);
полинуклеотид (BIP), имеющий последовательность оснований SEQ ID NO: 14, или полинуклеотид, состоящий, по меньшей мере, из 10 оснований, который гибридизуется с полинуклеотидом, имеющим последовательность, комплементарную данной последовательности оснований (полинуклеотид 14); и
полинуклеотид (B3), имеющий последовательность оснований SEQ ID NO: 15, или полинуклеотид, состоящий, по меньшей мере, из 10 оснований, который гибридизуется с полинуклеотидом, имеющим последовательность, комплементарную данной последовательности оснований (полинуклеотид 15).
Согласно третьему варианту осуществления настоящего изобретения предлагается способ детекции Dekkera custersiana, который включает проведение реакции амплификации нуклеиновой кислоты по LAMP-методу с использованием набора праймеров, состоящего из полинуклеотидов 12, 13, 14 и 15.
Четвертый вариант осуществления настоящего изобретения
Согласно четвертому варианту осуществления настоящего изобретения предлагается набор LAMP-праймеров для использования с целью детекции Brettanomyces naardenensis (который далее называется как «набор праймеров согласно четвертому варианту»), который включает следующие полинуклеотиды:
полинуклеотид (FIP), имеющий последовательность оснований SEQ ID NO: 17, или полинуклеотид, состоящий, по меньшей мере, из 10 оснований, который гибридизуется с полинуклеотидом, имеющим последовательность, комплементарную данной последовательности оснований (полинуклеотид 17);
полинуклеотид (F3), имеющий последовательность оснований SEQ ID NO: 18, или полинуклеотид, состоящий, по меньшей мере, из 10 оснований, который гибридизуется с полинуклеотидом, имеющим последовательность, комплементарную данной последовательности оснований (полинуклеотид 18);
полинуклеотид (BIP), имеющий последовательность оснований SEQ ID NO: 19, или полинуклеотид, состоящий, по меньшей мере, из 10 оснований, который гибридизуется с полинуклеотидом, имеющим последовательность, комплементарную данной последовательности оснований (полинуклеотид 19); и
полинуклеотид (B3), имеющий последовательность оснований SEQ ID NO: 20, или полинуклеотид, состоящий, по меньшей мере, из 10 оснований, который гибридизуется с полинуклеотидом, имеющим последовательность, комплементарную данной последовательности оснований (полинуклеотид 20).
Согласно четвертому варианту осуществления настоящего изобретения предлагается способ детекции Brettanomyces naardenensis, который включает проведение реакции амплификации нуклеиновой кислоты по LAMP-методу с использованием набора праймеров, состоящего из полинуклеотидов 17, 18, 19 и 20.
При использовании наборов праймеров согласно настоящему изобретению дрожжи рода Dekkera и дрожжи рода Brettanomyces могут быть точно идентифицированы на уровне вида с очень высокой чувствительностью, а также дрожжи рода Dekkera и дрожжи рода Brettanomyces могут быть выявлены с высокой чувствительностью. Дополнительно наборы праймеров согласно настоящему изобретению могут использоваться в реакции амплификации нуклеиновой кислоты по LAMP-методу и при детекции целевого вида, на основании данных о наличии или отсутствии амплифицированного продукта. Таким образом, на основе разработанных в рамках настоящего изобретения наборов праймеров, дрожжи рода Dekkera и дрожжи рода Brettanomyces могут быть точно, быстро и просто идентифицированы на уровне вида.
На основе наборов праймеров согласно настоящему изобретению может быть количественно определено количество клеток дрожжей рода Dekkera и клеток дрожжей рода Brettanomyces, которые содержатся в образце. Таким образом, в соответствии с разработанными в рамках настоящего изобретения наборами праймеров может быть проведено точное количественное определение уровня дрожжей рода Dekkera и дрожжей рода Brettanomyces.
Дрожжи рода Dekkera и дрожжи рода Brettanomyces представляют собой такие виды дрожжей, которые, в случае их присутствия, вызывают помутнение различных видов напитков, таких как спиртные напитки и безалкогольные напитки. Таким образом, наличие или отсутствие указанных видов дрожжей может использоваться в качестве определенного индикатора при контроле качества различных типов напитков. Соответственно наборы праймеров согласно настоящему изобретению применимы для контроля и оценки качества различных типов напитков (например, спиртных напитков и безалкогольных напитков, и в частности пива, слабосолодового пива (хаппошу) и вина), а также для оценки образцов окружающей среды.
Краткое описание чертежей
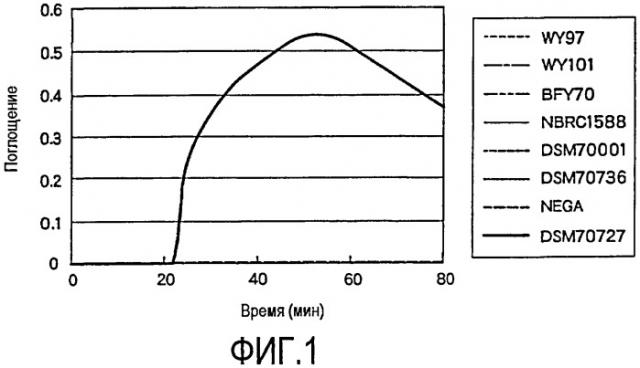
На фиг. 1 проиллюстрирована специфичность реакции с набором праймеров (DA1LF1LB1), используемым при детекции Dekkera anomala, в отношении детекции целевого вида. При этом используют указанные ниже штаммы: WY97: Dekkera bruxellensis, выделенный на пивоваренном заводе; WY101: Saccharomyces cerevisiae, выделенный на пивоваренном заводе; BFY70: дрожжи, используемые при сбраживании; NBRC1588: Brettanomyces naardenensis; DSM70001: Dekkera bruxellensis; DSM70736: Dekkera custersiana; Nega: без добавления геномной ДНК; DSM70727: Dekkera anomala.
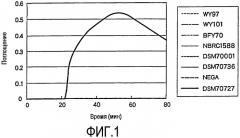
На фиг.2 проиллюстрированы результаты детекции по методу LAMP при использовании в качестве выявляемого образца серийно разбавленного раствора ДНК (WY97). DB1LF1 используют в качестве набора праймеров для LAMP.
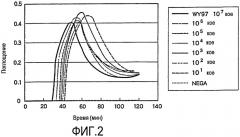
На фиг.3 проиллюстрированы результаты детекции по методу ПЦР, получаемые при использовании в качестве выявляемого образца раствора ДНК при ее серийном разбавлении (WY97). Последовательности ДНК SEQ ID NO: 22 и 23 используют в качестве набора праймеров в методе ПЦР. М.в.: маркер молекулярного веса; линия 1: 107 КОЕ (WY97); линия 2: 106 КОЕ; линия 3: 105 КОЕ; линия 4: 104 КОЕ; линия 5: 103 КОЕ; линия 6: 102 КОЕ; линия 7: 101 КОЕ.
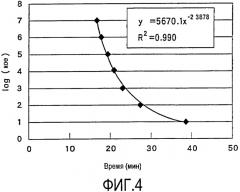
На фиг.4 приведена аппроксимированная кривая, описывающая процесс образования колоний Dekkera anomala (ATCC56868) применительно ко времени детекции по LAMP-методу с использованием DA1LF1LB1. Пороговые временные значения, приведенные на горизонтальной оси, указывают ту временную точку реакции, когда показатель мутности превышает 0,1.
На фиг. 5 продемонстрирована реакционная способность набора праймеров (DC2) с целью использования их при детекции применительно к Dekkera custersiana. При этом используют приведенные ниже штаммы. WY97: Dekkera bruxellensis, выделенный на пивоваренном заводе; WY101: Saccharomyces cerevisiae, выделенный на пивоваренном заводе; BFY70: дрожжи, используемые при пивоварении; NBRC1588: Brettanomyces naardenensis; DSM70727: Dekkera anomala; DSM70001: Dekkera bruxellensis; Nega: без добавления геномной ДНК; DSM70736: Dekkera custersiana.
На фиг.6 проиллюстрирована реакционная способность контрольного набора праймеров (DC1), применительно к детекции в качестве контроля для набора праймеров, используемого в случае Dekkera custersiana. Используют приведенные ниже штаммы. WY97: Dekkera bruxellensis, выделенный на пивоваренном заводе; WY101: Saccharomyces cerevisiae, выделенный на пивоваренном заводе; BFY70: дрожжи, используемые при сбраживании; NBRC1588: Brettanomyces naardenensis; DSM70727: Dekkera anomala; DSM70001: Dekkera bruxellensis; Nega: без добавления геномной ДНК; DSM70736: Dekkera custersiana.
На фиг.7 проиллюстрирована реакционная способность набора праймеров (DA1LF1LB1), применяемого при детекции Dekkera anomala. Используют приведенные ниже штаммы. WY126: дрожжи дикого типа, выделенные на пивоваренном заводе; WLY9·WLY10·WLY13·WLY15·WLY16·WLY17: дрожжи дикого типа, выделенные из вина; BFY84·TFY3·TFY23: дрожжи, используемые при сбраживании; Nega: без добавления геномной ДНК; DSM70727: Dekkera anomala.
На фиг.8 проиллюстрирована реакционная способность контрольного набора праймеров (DA2LF1LB1) применительно к детекции в качестве контроля для набора праймеров, используемого при детекции Dekkera anomala. Используют приведенные ниже штаммы. WY126: дрожжи дикого типа, выделенные на пивоваренном заводе; WLY9·WLY10·WLY13·WLY15·WLY16·WLY17: дрожжи дикого типа, выделенные из вина; BFY84·TFY3·TFY23: дрожжи, используемые при сбраживании; Nega: без добавления геномной ДНК; DSM70727: Dekkera anomala.
Подробное описание изобретения
Праймеры и наборы праймеров
Набор праймеров согласно настоящему изобретению состоит из 4 типов праймеров, а именно: FIP, F3, BIP и B3. Указанные праймеры соответствуют 6 участкам на целевой нуклеотидной последовательности. Конкретно, участки F3c, F2c, F1c, B1, B2 и B3 определяют в указанном порядке с 3-концевой части в направлении к 5'-концевой части целевой последовательности основания. Далее получают 4 типа праймеров, а именно: FIP, F3, BIP и B3, соответствующие 6 участкам. В контексте настоящего описания участки, соответствующие участкам F3c, F2c и F1c представляют собой F3, F2 и F1, соответственно. Дополнительно участки, комплементарные участкам B1, B2 и B3, представляют собой B1c, B2c и B3c соответственно.
FIP представляет собой праймер, получаемый таким образом, чтобы он содержал F2 участок, комплементарный к F2c участку целевой последовательности на 3'-концевой части и так, чтобы он имел такую же последовательность, что и F1c участок целевого гена на 5'-концевой части. При необходимости может быть введен сайт для фермента рестрикции на участке между F1c и F2 в FIP праймере.
F3 представляет собой праймер, получаемый таким образом, чтобы он содержал F3 участок, комплементарный F3c участку на целевом гене.
BIP представляет собой праймер, получаемый таким образом, чтобы он содержал B2 участок, комплементарный B2c участку целевой последовательности на 3'-концевой части и так, чтобы он имел ту же последовательность, что и B1c участок целевого гена на 5'-концевой части. При необходимости может быть введен сайт для фермента рестрикции на участке между B1c и B2 в BIP праймере.
B3 представляет собой праймер, получаемый таким образом, чтобы он содержал B3 участок, комплементарный B3c участку целевого гена.
В том случае, когда в FIP и BIP праймерах имеется сайт фермента рестрикции, амплифицированный продукт обрабатывают рестриктазами по завершении реакции амплификации нуклеиновой кислоты согласно LAMP-методу, так, чтобы наблюдалось образование одной полосы после электрофореза. В этом случае, если целевая последовательность содержит сайт рестриктазы, искусственное введение такого сайта рестриктазы может быть необязательным.
В случае использования набора праймеров согласно настоящему изобретению могут быть добавлены один или два типа петлевых праймера (LF праймер или LB праймер) с тем, чтобы ускорить реакцию амплификации нуклеиновой кислоты. Такой петлевой праймер разрабатывается таким образом, чтобы его можно было отжечь до участка между F1 и F2 или участка между B1 и B2, после чего его добавляют в реакционную систему для проведения LAMP-процедуры. Таким образом, указанные праймеры связываются с теми петлевыми частями, которые не используются в амплификации нуклеиновой кислоты, так что использование всех петлевых частей в качестве ориджинов будет способствовать реакционной способности нуклеиновой кислоты и соответственно реакция амплификации нуклеиновой кислоты может быть ускорена (см. публикацию по выложенной заявке на патент Японии No 2002-345499).
В конкретном случае набор праймеров согласно первому варианту осуществления настоящего изобретения может также включать в качестве одного или нескольких петлевых праймеров, любой из указанных полинуклеотидов, один или оба: полинуклеотид (LF), имеющий последовательность оснований SEQ ID NO: 5, или полинуклеотид, состоящий, по меньшей мере, из 10 оснований, который гибридизуется с полинуклеотидом, имеющим последовательность, комплементарную указанной последовательности оснований (полинуклеотид 5); и полинуклеотид (LB), имеющий последовательность SEQ 35 ID NO: 6, или полинуклеотид, состоящий, по меньшей мере, из 10 оснований, который гибридизуется с полинуклеотидом, имеющим последовательность, комплементарную указанной последовательности оснований (полинуклеотид 6).
Набор праймеров согласно второму варианту осуществления настоящего изобретения может также включать, в качестве петлевого праймера, полинуклеотид (LF), содержащий последовательность оснований SEQ ID NO: 11, или полинуклеотид, состоящий, по меньшей мере из 10 оснований, который гибридизуется с полинуклеотидом, имеющим последовательность, комплементарную указанной последовательности оснований (полинуклеотид 11).
Набор праймеров согласно третьему варианту осуществления настоящего изобретения может также включать, в качестве петлевого праймера, полинуклеотид (LB), содержащий последовательность оснований SEQ ID NO: 16 или полинуклеотид, состоящий, по меньшей мере, из 10 оснований, который гибридизуется с полинуклеотидом, имеющим последовательность, комплементарную указанной последовательности оснований (полинуклеотид 16).
Набор праймеров согласно четвертому варианту осуществления настоящего изобретения может также включать, в качестве петлевого праймера, полинуклеотид (LF), имеющий последовательность оснований SEQ ID NO: 21, или полинуклеотид, состоящий, по меньшей мере, из 10 оснований, который гибридизуется с полинуклеотидом, имеющим последовательность, комплементарную указанной последовательности оснований (полинуклеотид 21).
В рамках настоящего изобретения не только полинуклеотиды, имеющие последовательности оснований SEQ ID NO: 1-21, но также полинуклеотиды, гибридизующиеся с полинуклеотидами, имеющими последовательности, комплементарные данным последовательностям оснований SEQ ID NO: 1-21 (далее называемые как «гомологичные полинуклеотиды»), могут использоваться в качестве LAMP-праймеров.
Термин «гибридизуется» используется в контексте настоящего описания для обозначения того факта, что определенный полинуклеотид гибридизуется с целевым полинуклеотидом и что он, по существу, не гибридизуется с полинуклеотидами, отличными от целевого полинуклеотида. Такая гибридизация может быть проведена в жестких условиях. В данном контексте термин «жесткие условия» может быть определен относительно Т.пл. (°C) двойной цепи праймерной последовательности и ее комплементарной последовательности, необходимой концентрации соли и т.п. Методика отбора последовательности, используемой в качестве зонда, и затем на этой основе определения жестких условий, применимых в данном случае, известна специалистам в данной области (см., например, J. Sambrook, E.F. Frisch, T. Maniatis; Molecular Cloning 2nd edition, Cold Spring Harbor Laboratory (1989) и т.п.). В качестве таких жестких условий можно указать реакцию гибридизации, которую проводят при температуре несколько меньшей, чем значение Т.пл., определенное на основании нуклеотидной последовательности (например, при температуре, которая примерно на 0°C - 5°C ниже, чем Т.пл.) в соответствующем буферном растворе, который обычно используют при гибридизации. Кроме того, в качестве другого варианта жестких условий промывка после реакции гибридизации проводится при высокой концентрации раствора с низкой концентрацией соли. Примеры таких жестких условий включают условия промывки, где указанную промывку поводят в 6 × SSC/0,05% раствора пирофосфата натрия при температурах 37°C (в случае олигонуклеотида, состоящего примерно из 14 оснований), 48°C (в случае олигонуклеотида, состоящего примерно из 17 оснований), 55°C (в случае олигонуклеотида, состоящего примерно из 20 оснований) и 60°C (в случае олигонуклеотида, состоящего примерно из 23 оснований).
Длина нуклеотидной цепи гомологичного полинуклеотида составляет по, меньшей мере, 10 оснований.
Длина нуклеотидной цепи каждого из гомологичных полинуклеотидов, FIP и BIP, может предпочтительно составлять, по меньшей мере, 30 оснований (например, 30-60 оснований) и более предпочтительно, по меньшей мере, 39 оснований (например, 39-52 оснований). Длина нуклеотидной цепи гомологичного полинуклеотида FIP может особенно предпочтительно составлять, по меньшей мере, 39 оснований (например, 39-46 оснований). Длина нуклеотидной цепи гомологичного полинуклеотида BIP может особенно предпочтительно составлять, по меньшей мере, 46 оснований (например, 46-52 основания).
Кроме того, длина нуклеотидной цепи каждого из гомологичных полинуклеотидов F3, B3, LF и LB может предпочтительно составлять, по меньшей мере, 12 оснований (например, 12-30 оснований) и более предпочтительно, по меньшей мере, 16 оснований (например, 16-25 оснований). Длина нуклеотидной цепи гомологичного полинуклеотида F3 может особенно предпочтительно составлять, по меньшей мере, 16 оснований (например, 16-20 оснований и 16-25 оснований). Длина нуклеотидной цепи гомологичного полинуклеотида B3 может особенно предпочтительно составлять, по меньшей мере, 19 оснований (например, 19-22 оснований и 19-25 оснований). Длина нуклеотидной цепи каждого из гомологичных полинуклеотидов, LF и LB, особенно предпочтительно может составлять, по меньшей мере, 19 оснований (например, 19-22 основания и 19-25 оснований).
Такой гомологичный полинуклеотид может представлять собой полинуклеотид, включающий, по меньшей мере 10, предпочтительно, по меньшей мере, 15, более предпочтительно, по меньшей мере, 18, и особенно предпочтительно, по меньшей мере 20 последовательных нуклеотидов в соответствующей последовательности оснований.
Примеры полинуклеотидов, гомологичных полинуклеотидам, имеющим последовательность оснований SEQ ID NONO: 1-21, представлены ниже.
- Гомологичный полинуклеотид FIP, имеющий последовательность оснований SEQ ID NO: 1, полинуклеотид, включающий, по меньшей мере, 34 (34-42), более предпочтительно, по меньшей мере, 39 (39-42) последовательных нуклеотидов из SEQ ID NO: 1 (где может быть встроена одна или несколько мутаций) (и где длина нуклеотидной цепи может составлять максимум 60 оснований, предпочтительно, максимум 52 основания, и более предпочтительно, максимум 46 оснований).
- Гомологичный полинуклеотид F3, имеющий последовательность оснований SEQ ID NO: 2, полинуклеотид, включающий, по меньшей мере, 16 (16-20), более предпочтительно, по меньшей мере, 18 (18-20) последовательных нуклеотидов из SEQ ID NO: 2 (где может быть встроена одна или несколько мутаций) (и где длина нуклеотидной цепи может составлять максимум 30 оснований, предпочтительно, максимум 25 оснований, и более предпочтительно, максимум 22 основания).
- Гомологичный полинуклеотид BIP, имеющий последовательность оснований SEQ ID NO: 3, полинуклеотид, включающий, по меньшей мере, 42 (42-51), более предпочтительно, по меньшей мере, 46 (46-51) последовательных нуклеотидов из SEQ ID NO: 3 (где может быть встроена одна или несколько мутаций) (и где длина нуклеотидной цепи может составлять максимум 60 оснований и предпочтительно, максимум 52 основания).
- Гомологичный полинуклеотид B3, имеющий последовательность оснований SEQ ID NO: 4, полинуклеотид, включающий, по меньшей мере, 16 (16-21), более предпочтительно, 19 (19-21) последовательных нуклеотидов из SEQ ID NO: 4 (где может быть встроена одна или несколько мутаций) (и где длина нуклеотидной цепи может составлять максимум 30 оснований, предпочтительно, максимум 25 оснований, и более предпочтительно, максимум 22 основания).
- Гомологичный полинуклеотид LF, имеющий последовательность оснований SEQ ID NO: 5, полинуклеотид, включающий, по меньшей мере, 16 (16-22), более предпочтительно, 19 (19-22) последовательных нуклеотидов из SEQ ID NO: 5 (где может быть встроена одна или несколько мутаций) (и где длина нуклеотидной цепи может составлять максимум 30 оснований и предпочтительно, максимум 25 оснований).
- Гомологичный полинуклеотид LB, имеющий последовательность оснований SEQ ID NO: 6, полинуклеотид, включающий, по меньшей мере, 14 (14-19), более предпочтительно, 16 (16-19) последовательных нуклеотидов из SEQ ID NO: 6 (где может быть встроена одна или несколько мутаций) (и где длина нуклеотидной цепи может составлять максимум 30 оснований, предпочтительно, максимум 25 оснований, и более предпочтительно, максимум 22 основания).
- Гомологичный полинуклеотид FIP, имеющий последовательность оснований SEQ ID NO: 7, полинуклеотид, включающий, по меньшей мере, 39 (39-45), более предпочтительно, по меньшей мере, 41 (41-45) последовательных нуклеотидов из SEQ ID NO: 7 (где может быть встроена одна или несколько мутаций) (и где длина нуклеотидной цепи может составлять максимум 60 оснований, предпочтительно, максимум 52 основания, и более предпочтительно, максимум 46 оснований).
- Гомологичный полинуклеотид F3, имеющий последовательность оснований SEQ ID NO: 8, полинуклеотид, включающий, по меньшей мере, 12 (12-16), более предпочтительно, 14 (14-16) последовательных нуклеотидов из SEQ ID NO: 8 (где может быть встроена одна или несколько мутаций) (и где длина нуклеотидной цепи может составлять максимум 30 оснований, предпочтительно, максимум 25 оснований, более предпочтительно, максимум 22 основания и особенно предпочтительно, максимум 20 оснований).
- Гомологичный полинуклеотид для BIP, имеющий последовательность оснований SEQ ID NO: 9, полинуклеотид, включающий, по меньшей мере, 42 (42-51), более предпочтительно, по меньшей мере, 46 (46-51) последовательных нуклеотидов из SEQ ID NO: 9 (где может быть встроена одна или несколько мутаций) (и где длина нуклеотидной цепи может составлять максимум 60 оснований и предпочтительно, максимум 52 оснований).
- Гомологичный полинуклеотид B3, имеющий последовательность оснований SEQ ID NO: 10, полинуклеотид, включающий, по меньшей мере, 14 (14-19), более предпочтительно, 16 (16-19) последовательных нуклеотидов из SEQ ID NO: 10 (где может быть встроена одна или несколько мутаций) (и где длина нуклеотидной цепи может составлять максимум 30 оснований, предпочтительно, максимум 25 оснований, более предпочтительно, максимум 22 основания и наиболее предпочтительно, 20 оснований).
- Гомологичный полинуклеотид LF, имеющий последовательность оснований SEQ ID NO: 11, полинуклеотид, включающий, по меньшей мере, 14 (14-19), более предпочтительно, 16 (16-19) последовательных нуклеотидов из SEQ ID NO: 11 (где может быть встроена одна или несколько мутаций) (и где длина нуклеотидной цепи может составлять максимум 30 оснований, предпочтительно, максимум 25 оснований, более предпочтительно, максимум 22 основания и наиболее предпочтительно, 20 оснований).
- Гомологичный полинуклеотид FIP, имеющий последовательность оснований SEQ ID NO: 12, полинуклеотид, включающий, по меньшей мере, 33 (33-39), более предпочтительно, по меньшей мере, 36 (36-39) последовательных нуклеотидов из SEQ ID NO: 12 (где может быть встроена одна или несколько мутаций) (и где длина нуклеотидной цепи может составлять максимум 60 оснований, предпочтительно, максимум 52 оснований, более предпочтительно, максимум 46 основания и наиболее предпочтительно, 42 основания).
- Гомологичный полинуклеотид F3, имеющий последовательность оснований SEQ ID NO: 13, полинуклеотид, включающий, по меньшей мере, 16 (16-20), более предпочтительно, 18 (18-20) последовательных нуклеотидов из SEQ ID NO: 13 (где может быть встроена одна или несколько мутаций) (и где длина нуклеотидной цепи может составлять максимум 30 оснований, предпочтительно, максимум 25 оснований и более предпочтительно, максимум 22 основания).
- Гомологичный полинуклеотид BIP, имеющий последовательность оснований SEQ ID NO: 14, полинуклеотид, включающий, по меньшей мере, 39 (39-46), более предпочтительно, по меньшей мере, 42 (42-46) последовательных нуклеотидов из SEQ ID NO: 14 (где может быть встроена одна или несколько мутаций) (и где длина нуклеотидной цепи может составлять максимум 60 оснований и предпочтительно, максимум 52 основания).
- Гомологичный полинуклеотид B3, имеющий последовательность оснований SEQ ID NO: 15, полинуклеотид, включающий, по меньшей мере, 16 (16-21), более предпочтительно, 19 (19-21) последовательных нуклеотидов из SEQ ID NO: 15 (где может быть встроена одна или несколько мутаций) (и где длина нуклеотидной цепи может составлять максимум 30 оснований, предпочтительно, максимум 25 оснований и более предпочтительно, максимум 22 основания).
- Гомологичный полинуклеотид LB, имеющий последовательность оснований SEQ ID NO: 16, полинуклеотид, включающий, по меньшей мере, 16 (16-22), более предпочтительно, 19 (19-22) последовательных нуклеотидов из SEQ ID NO: 16 (где может быть встроена одна или несколько мутаций) (и где длина нуклеотидной цепи может составлять максимум 30 оснований и предпочтительно, максимум 25 оснований).
- Гомологичный полинуклеотид FIP, имеющий последовательность оснований SEQ ID NO: 17, полинуклеотид, включающий, по меньшей мере, 39 (39-46), более предпочтительно, по меньшей мере, 42 (42-46) последовательных нуклеотидов из SEQ ID NO: 17 (где может быть встроена одна или несколько мутаций) (и где длина нуклеотидной цепи может составлять максимум 60 оснований и предпочтительно, максимум 52 основания).
- Гомологичный полинуклеотид F3, имеющий последовательность оснований SEQ ID NO: 18, полинуклеотид, включающий, по меньшей мере, 16 (16-20), более предпочтительно, по меньшей мере, 18 (18-20) последовательных нуклеотидов из SEQ ID NO: 18 (где может быть встроена одна или несколько мутаций) (и где длина нуклеотидной цепи может составлят