Способы лечения почечно-клеточной карциномы
Иллюстрации
Показать всеИзобретение относится к области медицины, в частности к способу лечения и к способам лечения метастатической почечноклеточной карциномы у пациентов с нарушенной функцией почек и/или не переносящих терапию высокими дозами IL-2. Раскрытые в настоящем изобретении терапевтические схемы позволяют значительно ингибировать опухолевый рост при пониженной токсичности и ослабленных нежелательных побочных эффектах по сравнению с терапией высокими дозами IL-2. Человеку, страдающему почечноклеточной карциномой, проводят: а) во-первых, введение суточной дозы, составляющей 18 ММЕ мутеина IL-2, в течение 5 суток на протяжении одной недели; b) во-вторых, введение суточной дозы, составляющей 9 ММЕ мутеина IL-2, в течение 2 суток, с последующим введением суточной дозы, составляющей 18 ММЕ мутеина IL-2, в течение 3 суток каждой недели, повторяемые в течение 5 недель; с) в-третьих, отсутствие введения мутеина IL-2 в течение 3 недель; d) в-четвертых, введение суточной дозы, составляющей 9 ММЕ мутеина IL-2, в течение 5 суток каждой недели, повторяемое в течение 6 недель; и е) в-пятых, отсутствие введения мутеина IL-2, в течение 3 недель. 2 н. и 23 з.п. ф-лы, 5 ил., 9 табл.
Реферат
Область техники настоящего изобретения
Настоящее изобретение в основном относится к способам лечения почечноклеточной карциномы с помощью IL-2. В частности, изобретение относится к способам лечения почечноклеточной карциномы у пациентов с нарушенной функцией почек или не переносящих терапию высокими дозами IL-2.
Предшествующий уровень техники настоящего изобретения
Интерлейкин-2 (IL-2) является мощным стимулятором пролиферации и функции натуральных киллеров (NK) и Т-лимфоцитов (Morgan et al. (1976) Science 193:1007-1011). Было показано, что этот природный лимфокин обладает противоопухолевой активностью в отношении различных злокачественных новообразований как сам по себе, так и в сочетании с лимфокин-активированными киллерными (LAK) клетками или инфильтрующими опухоль лимфоцитами (TIL) (см., например, Rosenberg et al., N. Engl. J. Med. (1987) 316:889-897; Rosenberg, Aim. Surg. (1988) 208:121-135; Topalian et al., J. Clin. Oncol. (1988) 6:839-853; Rosenberg et al., N. Engl. J. Med. (1988) 319:1676-1680; и Weber et al., J. Clin. Oncol. (1992) 10:33-40). Противоопухолевая активность IL-2 была наилучшим образом описана у больных метастатической меланомой и почечноклеточной карциномой, получавших Proleukin®, коммерчески доступный состав на основе IL-2 производства Chiron Corporation, Emeryville, СА. Оказалось, что другие заболевания, включая лимфому, также реагируют на лечение IL-2 (Gisselbrecht et al., Blood (1994) 83:2020-2022). Однако высокие дозы IL-2, использующиеся для достижения положительных терапевтических результатов, касающихся опухолевого роста, зачастую вызывают тяжелые побочные эффекты, включая лихорадку и озноб, гипотензию и повышение проницаемости капилляров (синдром повышенной проницаемости капилляров, или VLS) и неврологические изменения (см., например, Duggan et al., J. Immunotherapy (1992) 12:115-122; Gisselbrecht et al., Blood (1994) 83:2081-2085; и Sznol and Parkinson, Blood (1994) 83:2020-2022). Метастатическая почечноклеточная карцинома (RCC), как правило, резистентна к химиотерапии как отдельными средствами, так и сочетанием множества средств. Больший успех наблюдался при использовании иммунотерапии, особенно при использовании IL-2. Внутривенная терапия высокими дозами IL-2 приводила к объективным опухолевым ответам приблизительно у 15% пациентов, причем некоторые из них характеризовались большой продолжительностью. Однако введение IL-2 в высоких дозах сопряжено с развитием синдрома повышенной проницаемости капилляров, что приводит к гипотензии и сниженному кровоснабжению органов, что может иметь тяжелые, а иногда фатальные, последствия. Такие уровни токсичности, как правило, ограничивали весьма выборочной группой пациентов применение IL-2, вводимого врачами, обладающими значительным опытом его применения. В попытке разработки более широко применимого способа терапии этого заболевания были проведены исследования использования схем введения более низких доз и подкожного введения одного IL-2 или его сочетаний с другими биологическими агентами, такими как α-интерферон (см., например, Nieken et al., Cancer Biother. Radiopharm. (1996) 11:289-295; Sleijfer et al., J. Clin. Oncol. (1992) 10:1119-1123; Lessoni et al., Anticancer Res. (2002) 22:1061-1-1064; Tourani et al., J. Clin. Oncol. (1998) 16:2505; и Schiller et al. Cancer Res. (1993) 53:1286-1292).
Остается потребность в усовершенствованном терапевтическом способе для лечения больных почечноклеточной карциномой, который способствовал бы снижению токсичности и повышению терапевтической эффективности.
Краткое изложение сущности настоящего изобретения
Настоящее изобретение относится к эффективному способу лечения почечноклеточной карциномы с помощью IL-2. Для снижения токсичности способ предусматривает использование относительно низкой дозы IL-2 по сравнению с дозами, ранее использовавшимися при терапии высокими дозами IL-2. Как показано в приведенных в настоящем описании примерах, такая терапевтическая схема позволяет значительно ингибировать опухолевый рост при ослабленных нежелательных побочных эффектах и обеспечивает альтернативное лечение для пациентов, не способных переносить терапию высокими дозами IL-2.
В одном аспекте изобретение относится к способу лечения человека, больного почечноклеточной карциномой. В некоторых вариантах выполнения функция почек пациента нарушена. В некоторых вариантах выполнения почечноклеточная карцинома является метастатической. В некоторых вариантах выполнения пациент не переносит лечение высокими дозами IL-2.
В одном варианте выполнения способ предусматривает а) введение суточной дозы, составляющей 1-52 ММЕ IL-2, 1-3 дозами в сутки в течение 3-6 суток в неделю, повторяемое в течение 1-24 недель; и b) отсутствие введения IL-2 в течение 1-4 недель.
В другом варианте выполнения способ предусматривает а) введение дозы, составляющей 1-52 ММЕ IL-2 через каждые 5 суток - 1 месяц, повторяемое в течение 1-24 недель, причем IL-2 ковалентно конъюгирован с полиэтиленгликолем или с полиоксиэтилированным многоатомным спиртом; и b) отсутствие введения IL-2 в течение 1-4 недель.
В другом варианте выполнения способ предусматривает а) введение суточной дозы, составляющей 9-18 ММЕ IL-2, 1-3 дозами в сутки в течение 3-6 суток в неделю, повторяемое в течение 1-24 недель; b) отсутствие введения IL-2 в течение 1-4 недель; с) введение суточной дозы, составляющей 9 ММЕ IL-2, 1-3 дозами в сутки в течение 3-6 суток в неделю, повторяемое в течение 1-24 недель; и d) отсутствие введения IL-2 в течение 1-4 недель.
В другом варианте выполнения способ предусматривает а) во-первых, введение суточной дозы, составляющей 18 ММЕ IL-2, в течение 5 суток на протяжении одной недели; b) во-вторых, введение суточной дозы, составляющей 9 ММЕ IL-2, в течение 2 суток с последующим введением суточной дозы, составляющей 18 ММЕ IL-2, в течение 3 суток каждой недели, повторяемые в течение 5 недель; с) в-третьих, отсутствие введения IL-2 в течение 3 недель; d) в-четвертых, введение суточной дозы, составляющей 9 ММЕ IL-2, в течение 5 суток каждой недели, повторяемое в течение 6 недель; и е) в-пятых, отсутствие введения IL-2 в течение 3 недель.
В каждом из раскрытых в настоящем описании способов IL-2 может представлять собой рекомбинантно продуцированный IL-2. IL-2 может включать в себя человеческий IL-2 или его варианты, содержащие последовательность, характеризующуюся, по меньшей мере, 70-100%-ной идентичностью последовательности с последовательностью человеческого IL-2 (SEQ ID NO: 1), включая любой процент идентичности в пределах этих диапазонов, такой как 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, 100% идентичность последовательности с ним. В некоторых вариантах выполнения IL-2 представляет собой мутеин IL-2, например, без ограничения, Аla104 Ser125 IL-2; дез-Ala1 дез-Pro2 дез-Thr3 дез-Ser4 Аla104, Ser125 IL-2; и дез-Ala1 дез-Pro2 дез-Thr3 дез-Ser4 дез-Ser5 дез-Ser6 IL-2. В предпочтительном варианте выполнения мутеин IL-2 представляет собой дез-аланил-1, серин-125 человеческий интерлейкин-2 (алдезлейкин).
В некоторых вариантах выполнения IL-2 конъюгирован с полиэтиленгликолем. Типичные полиэтиленгликоли включают в себя без ограничения полиэтиленгликоль, характеризующийся средней молекулярной массой от 1000 до 40000 Дальтон, полиэтиленгликоль, характеризующийся средней молекулярной массой от 2000 до 20000 Дальтон, и полиэтиленгликоль, характеризующийся средней молекулярной массой от 3000 до 12000 Дальтон.
В некоторых вариантах выполнения IL-2 ковалентно конъюгирован с полиоксиэтилированным многоатомным спиртом. Типичные полиоксиэтилированные многоатомные спирты включают в себя без ограничения полиоксиэтилированный сорбит, полиоксиэтилированную глюкозу и полиоксиэтилированный глицерин. В некоторых вариантах выполнения полиоксиэтилированный многоатомный спирт представляет собой полиоксиэтилированный глицерин, характеризующийся средней молекулярной массой от 1000 до 40000 Дальтон.
В соответствии с каждым из раскрытых в настоящем описании способов у субъекта может быть проведено множество циклов лечения в течение периода времени, достаточного для достижения, по меньшей мере, частичного опухолевого ответа. В некоторых вариантах выполнения период времени составляет, по меньшей мере, 6 месяцев. В некоторых вариантах выполнения период времени составляет, по меньшей мере, 12 месяцев. В некоторых вариантах выполнения период времени достаточен для достижения полного опухолевого ответа.
В некоторых вариантах выполнения способ лечения дополнительно предусматривает проведение множества циклов лечения, состоящих из а) введения суточной дозы, составляющей 9 ММЕ IL-2, 1-3 дозами в сутки в течение 3-6 суток в неделю, повторяемое в течение 1-24 недель; и b) отсутствия введения IL-2 в течение 1-4 недель; проводимых у указанного субъекта в течение периода времени, достаточного для достижения, по меньшей мере, частичного опухолевого ответа.
В соответствии с каждым из раскрытых в настоящем описании способов IL-2 может быть введен путем подкожного, внутрибрюшинного, внутримышечного, внутривенного, перорального, легочного, назального, местного или чрескожного введения или введения с помощью инфузии или суппозиториев. В предпочтительном варианте выполнения IL-2 вводят подкожно.
Эти и другие варианты выполнения настоящего изобретения будут вполне очевидны специалистам в данной области техники ввиду приведенного в настоящем описании раскрытия.
Краткое описание чертежей
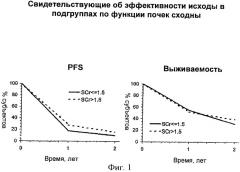
На фиг.1 приведено сравнение относительной эффективности низких доз IL-2 у больных метастатической почечноклеточной карциномой, характеризующихся нормальной (содержание креатинина в сыворотке (SCr)≤1,5 мг/дл) и нарушенной функцией почек (SCr>1,5 мг/дл), после использования схемы введения, описанной в примере 3. На фиг.1 приведен график процентной доли субъектов, отображающий выживаемость без прогрессии (PFS) по времени в годах и график процентной доли выживших субъектов по времени в годах.
На фиг.2 приведена столбчатая диаграмма, отражающая общие уровни ответа у больных метастатической почечноклеточной карциномой, характеризующихся нормальной (содержание креатинина в сыворотке (SCr≤1,5 мг/дл) и нарушенной функцией почек (SCr>1,5 мг/дл), получавших лечение низкими дозами IL-2, после использования схемы введения, описанной в примере 3. Процентная доля субъектов, у которых наблюдался полный ответ (CR), показана светлой заливкой. Процентная доля субъектов, у которых наблюдался частичный ответ (PR), показана темной заливкой.
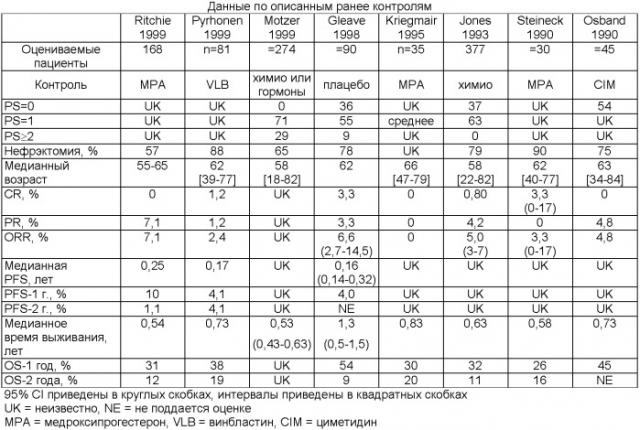
На фиг.3 приведено сравнение характеристик пациентов (PS, до удаления почки) из популяции, получавшей лечение низкими дозами IL-2 в ходе описанного здесь клинического испытания фазы IV, с ранее описанными контрольными группами. См. Pyrhonen et al. (1999) J. Clin. Oncol. 17:2859-2867; Motzer et al. (1999) J. Clin. Oncol. 17:2530-40; Ritchie et al. (1999) Lancet 353:14-17; Kriegmair et al. (1995) Urology 45:758-762; Jones et al. (1993) Cancer Biother. 8:275-288; Gleave et al. (1998) New Engl. J. Med. 338:1265-1271; Steineck et al. (1990) Acta Oncol. 29:155-162; и Osband et al. (1990) Lancet 335:994-998 для ознакомления с ранее описанными контрольными группами больных почечноклеточной карциномой, участвовавшими в клинических исследованиях.
На фиг.4 приведено сравнение исходов у пациентов (ORR, PFS, OS через 1 год, OS через 2 года) из популяции, получавшей лечение низкими дозами IL-2 в ходе описанного здесь клинического испытания фазы IV, с ранее описанными контрольными группами.
На фиг.5 приведено сравнение уровня выживаемости пациентов, получавших лечение низкими дозами IL-2, после использования схемы введения, описанной в примере 3, с таковым ранее описанной контрольной группы пациентов, получавших химиотерапию вместо IL-2 (Jones et al. (1993) J. Clin. Oncol. 12:2714-2722). Пациентов подразделяли на группы риска в соответствии с системой стратификации по факторам риска по Jones следующим образом: низкий риск (0-1 факторов риска), умеренный риск (2 фактора риска) и неблагоприятный прогноз (все 3 фактора риска). На фиг.5 приведены раздельные графики процентной доли выживших субъектов по времени в годах для каждой из групп риска. Данные для субъектов, получавших низкие дозы IL-2, показаны сплошной линией. Данные для субъектов, получавших химиотерапию, показаны пунктирной линией.
Подробное раскрытие настоящего изобретения
Если иное не указано особо, осуществление настоящего изобретения будет предусматривать использование стандартных методов фармакологии, химии, биохимии, методов рекомбинантных ДНК и иммунологии в пределах предшествующего уровня техники. Такие методики досконально описаны в литературе. См., например, Handbook of Experimental Immunology, Vols. I-IV (D.M. Weir and CC. Blackwell eds., Blackwell Scientific Publications); A.L. Lehninger, Biochemistry (Worth Publishers, Inc., current addition); Sambrook, et al., Molecular Cloning: A Laboratory Manual (2nd Edition, 1989); Methods In Enzymology (S. Colowick and N. Kaplan eds., Academic Press, Inc.).
Все процитированные выше или ниже в настоящем описании публикации, патенты и заявки на выдачу патента включены в настоящее описание во всей полноте посредством ссылки.
I. Определения
При описании настоящего изобретения использованы следующие термины в указанных ниже значениях.
Следует отметить, что использованные в настоящем описании и в приложенной формуле изобретения артикли единственного числа "a", "an" и "the" включают в себя и соответствующие объекты во множественном числе, если только иное очевидно не следует из контекста. Так, например, ссылка на "химиотерапевтическое средство" относится и к смеси двух или более таких средств и т.п.
Используемый здесь термин "IL-2" представляет собой белок, полученный из лимфокина, продуцируемого нормальными лимфоцитами периферической крови, и присутствует в организме в низких концентрациях. IL-2 был впервые описан в Morgan et al. (1976) Science 193:1007-1008 и первоначально назван фактором роста Т-лимфоцитов благодаря своей способности индуцировать пролиферацию стимулированных Т-лимфоцитов. Он представляет собой белок с опубликованной молекулярной массой в диапазоне от 13000 до 17000 Дальтон (Gillis and Watson (1980) J. Exp. Med. 159:1709) и характеризуется изоэлектрической точкой в диапазоне 6-8,5. Под определение подпадают как полноразмерные белки IL-2, так и их биологически активные фрагменты. Термин также охватывает постэкспрессионные модификации IL-2, например формы, претерпевшие гликозилирование, ацетилирование, фосфорилирование и т.п. Кроме того, для целей настоящего изобретения термин "IL-2" относится к белку, содержащему модификации нативной последовательности, такие как делеции, добавления и замены (как правило, консервативные по своей природе), при условии, что белок сохраняет биологическую активность, т.е. противоопухолевую активность. Эти модификации могут быть произвольными, такими как вызванные сайт-направленным мутагенезом, или могут быть случайными, такими как вызванные мутациями у хозяев, продуцирующих белки, или ошибками при PCR-амплификации.
Термин "полученный из" используется в настоящем описании для идентификации исходного источника молекулы, но он не должен пониматься как ограничивающий способ получения молекулы, который может осуществлен, например, с помощью химического синтеза или с использованием рекомбинантных методов. Термины "вариант", "аналог" и "мутеин" относятся к биологически активным производным исходной молекулы, сохраняющим желаемую активность, такую как раскрытая в настоящем описании противоопухолевая активность при лечении почечноклеточной карциномы. Как правило, термины "вариант" и "аналог" относятся к соединениям, характеризующимся нативной полипептидной последовательностью и структурой с одним или несколькими аминокислотными добавлениями, заменами (как правило, консервативными по своей природе) и/или делециями относительно нативной молекулы при условии, что модификации не нарушают биологическую активность, и являющимся "по существу гомологичными" по отношению к исходной молекуле, как определено ниже. Как правило, аминокислотные последовательности таких аналогов характеризуются высокой степенью гомологии последовательности по отношению к исходной последовательности, например гомологией аминокислотной последовательности, составляющей более 50%, как правило, более 60%-70%, еще более предпочтительно, 80%-85% или более, например по меньшей мере, 90%-95% или более по данным выравнивания двух последовательностей. Зачастую, аналоги включают в себя такое же количество аминокислот, но содержат замены, определенные в настоящем описании. Термин "мутеин" дополнительно относится к полипептидам, содержащим одну или несколько подобных аминокислотам молекул, включая без ограничения соединения, содержащие только амино- и/или иминомолекулы, полипептиды, содержащие один или несколько аналогов аминокислот (включая, например, неприродные аминокислоты и т.д.), полипептиды с замещенными связями, равно как и другие известные из предшествующего уровня техники модификации, как природные, так и неприродные (например, синтетические), циклизованные, разветвленные молекулы и т.п. Термин также охватывает молекулы, содержащие один или несколько N-замещенных глициновых остатков ("пептоиды"), и другие синтетические аминокислоты или пептиды (для ознакомления с описаниями пептоидов см., например, патенты США №№5,831,005; 5,877,278; и 5,977,301; Nguyen et al., Chem. Biol. (2000) 7:463-473; и Simon et al., Proc. Natl. Acad. Sci. USA (1992) 89:9367-9371). Предпочтительно, аналог или мутеин обладают, по меньшей мере, такой же противоопухолевой активностью, как и нативная молекула. Способы получения аналогов и мутеинов полипептидов известны из предшествующего уровня техники и более подробно описаны ниже.
Как указано выше, аналоги, как правило, содержат замены, которые по своей природе являются консервативными, т.е. замены, происходящие в пределах семейства аминокислот, сходных по строению боковой цепи. Конкретнее, аминокислоты, как правило, подразделяются на четыре семейства: (1) кислые - аспартат и глутамат; (2) основные - лизин, аргинин, гистидин; (3) неполярные - аланин, валин, лейцин, изолейцин, пролин, фенилаланин, метионин, триптофан; и (4) незаряженные полярные - глицин, аспарагин, глутамин, цистеин, серин, треонин, тирозин. Фенилаланин, триптофан и тирозин иногда классифицируют как ароматические аминокислоты. Например, разумно предположить, что отдельная замена лейцина изолейцином или валином, аспартата глутаматом, треонина серином или аналогичная консервативная замена аминокислоты структурно сходной аминокислотой не окажут существенного влияния на биологическую активность. Например, интересующий полипептид может содержать до около 5-10 консервативных или неконсервативных аминокислотных замен или даже до около 15-25 или замены в количестве целого числа от 5 до 25, при условии сохранности желаемой функции молекулы. Специалист в данной области техники может с легкостью определить области интересующей молекулы, которые могут претерпеть изменения в соответствии с шкалами Хоппа-Вудса и Кайта-Дулитла, хорошо известными из предшествующего уровня техники.
Под термином "производное" понимают любую подходящую модификацию интересующего нативного полипептида, фрагмента нативного полипептида или соответствующих им аналогов, такую как гликозилирование, фосфорилирование, конъюгирование с полимером (таким как полиэтиленгликоль) или иное добавление чужеродных фрагментов, при условии сохранности желаемой биологической активности нативного полипептида. Способы получения полипептидных фрагментов, аналогов и производных, главным образом, известны из предшествующего уровня техники.
Под термином "фрагмент" понимают молекулу, состоящую лишь из части интактной полноразмерной последовательности или структуры. Фрагмент может содержать С-концевую делецию, N-концевую делецию и/или внутреннюю делецию нативного полипептида. Активные фрагменты конкретного белка, как правило, содержат, по меньшей мере, около 5-10 смежных аминокислотных остатков из состава полноразмерной молекулы, предпочтительно, по меньшей мере, около 15-25 смежных аминокислотных остатков из состава полноразмерной молекулы, и наиболее предпочтительно, по меньшей мере, около 20-50 или более смежных аминокислотных остатков из состава полноразмерной молекулы, или любое целое число от 5 аминокислот до полноразмерной последовательности, при условии сохранности у обсуждаемого фрагмента биологической активности, такой как противоопухолевая активность, определенная в настоящем описании.
Термин "по существу очищенный", как правило, относится к выделению вещества (соединения, полинуклеотида, белка, полипептида, полипептидной композиции) таким образом, чтобы вещество составляло основную долю образца, в котором оно содержится. Как правило, по существу очищенный компонент составляет 50%, предпочтительно 80%-85%, более предпочтительно 90-95% образца. Методики очистки интересующих полинуклеотидов и полипептидов хорошо известны из предшествующего уровня техники и включают в себя, например, ионообменную хроматографию, аффинную хроматографию и осаждение в градиенте плотности.
Термин "выделенный" применительно к полипептиду означает, что указанная молекула отдельна и дискретна от целого организма, с которым молекула связана в естественных условиях, или существует по существу в отсутствие других биологических макромолекул того же типа. Термин "выделенный" применительно к полинуклеотиду относится к молекуле нуклеиновой кислоты, полностью или частично лишенной последовательностей, обычно связанных с ней в природе; или к последовательности в естественном виде, но связанной с гетерологичными последовательностями; или к молекуле, диссоциировавшей от хромосомы.
Термин "гомология" относится к процентной идентичности между двумя полинуклеотидными или двумя полипептидными фрагментами. Две нуклеотидные или две полипептидные последовательности являются "по существу гомологичными" по отношению друг к другу, если последовательности характеризуются значением идентичности последовательности определенной части молекулы, составляющей, по меньшей мере, около 50%, предпочтительно, по меньшей мере, около 75%, более предпочтительно, по меньшей мере, около 80%-85%, предпочтительно, по меньшей мере, около 90%, и наиболее предпочтительно, по меньшей мере, около 95%-98%. Используемый здесь термин "по существу гомологичный" также относится к последовательностям, характеризующимся полной идентичностью по отношению к указанной последовательности.
Как правило, термин "идентичность" относится к точному межнуклеотидному или межаминокислотному соответствию двух полинуклеотидных или полипептидных последовательностей соответственно. Процентная идентичность может быть определена путем прямого сопоставления информации о последовательностях двух молекул (референсной последовательности и последовательности с неизвестной процентной идентичностью по отношению к референсной последовательности) путем выравнивания последовательностей, подсчета точного количества совпадений между двумя выравниваемыми последовательностями, деления на длину референсной последовательности и умножения результата на 100. Для облегчения проведения анализа могут быть использованы легкодоступные компьютерные программы, такие как ALIGN, Dayhoff, М.О., описанная в Atlas of Protein Sequence and Structure, M.O. Dayhoff ed., 5 Suppl. 3:353-358, National Biomedical Research Foundation, Washington, DC, в которой алгоритм поиска локальной гомологии, описанный в Smith and Waterman, Advances in Appl. Math. 2:482-489, 1981, приспособлен для пептидного анализа. Программы для определения идентичности нуклеотидных последовательностей, например, программы BESTFIT, FASTA и GAP, также основанные на алгоритме Смита и Уотермана, входят в состав Wisconsin Sequence Analysis Package, версия 8 (поставляемого Genetics Computer Group, Madison, WI). Эти программы легко реализуются при параметрах по умолчанию, рекомендованных производителем и описанных в упомянутом выше Wisconsin Sequence Analysis Package. Например, процентная идентичность конкретной нуклеотидной последовательности по отношению к референсной последовательности может быть определена в соответствии с алгоритмом поиска гомологии Смита и Уотермана с использованием предлагаемых по умолчанию таблицы оценки и штрафа за пропуск шести нуклеотидных положений.
Другим способом оценки процентной идентичности в контексте настоящего изобретения является использование пакета программ MPSRCH, авторские права на который принадлежат University of Edinburgh, разработанного John F. Collins и Shane S. Sturrok и распространяемого IntelliGenetics, Inc. (Mountain View, CA). Из этого набора пакетов может быть использован алгоритм Смита-Уотермана, в котором для таблицы оценки использованы параметры по умолчанию (например, штраф за открытие пропуска 12, штраф за продление пропуска 1 и пропуск 6). В полученных данных значение "Match" отражает "идентичность последовательности". Другие подходящие программы для расчета процентной идентичности или сходства между последовательностями, главным образом, известны из предшествующего уровня техники, например, другой программой для выравнивания является BLAST, используемая с параметрами по умолчанию. Например, BLASTN и BLASTP могут быть использованы со следующими параметрами по умолчанию: genetic code=standard; filter=none; strand=both; cutoff=60; expect=10; Matrix=BLOSUM62; Descriptions=50 sequences; sort by=HIGH SCORE; Databases=non-redundant, GenBank+EMBL+DDBJ+PDB+GenBank CDS translations+Swiss protein+Spupdate+PIR. Подробные сведения об этих программах широко известны.
Альтернативно, гомология может быть определена путем гибридизации полинуклеотидов в условиях, при которых образуются стабильные дуплексные структуры между гомологичными областями, с последующими расщеплением специфичной(ыми) в отношении одноцепочечных молекул нуклеазой(ами) и определением размеров отщепленных фрагментов. По существу гомологичные последовательности ДНК могут быть идентифицированы в соответствии с экспериментом Саузерн-гибридизации, например, в жестких условиях, определенных для данной конкретной системы. Определение подходящих условий гибридизации находится в пределах квалификации специалиста в данной области техники. См., например, Sambrook et al., supra; DNA Cloning, supra; Nucleic Acid Hybridization, supra.
Используемый в настоящем описании применительно к молекуле нуклеиновой кислоты термин "рекомбинантный" означает полинуклеотид геномного, кДНК, вирусного, полусинтетического или синтетического происхождения, который в силу своего происхождения или проведенных над ним манипуляций полностью или частично не связан с полинуклеотидом, с которым он связан в естественных условиях. Термин "рекомбинантный" применительно к белку или полипептиду означает полипептид, продуцированный путем экспрессии рекомбинантного полинуклеотида. Как правило, интересующий ген клонируют и затем экспрессируют в трансформированных организмах, как описано ниже. Организм-хозяин экспрессирует чужеродный ген в способствующих экспрессии условиях с продукцией белка.
Используемый в настоящем описании термин "с нарушенной функцией почек" относится к пациенту, характеризующемуся недостаточной скоростью клубочковой фильтрации. Такой пациент характеризуется здесь содержанием креатинина в сыворотке (SCr), превышающим 1,5 мг/дл.
Под термином "противоопухолевая активность" понимают снижение скорости клеточной пролиферации и, следовательно, снижение скорости роста имеющейся опухоли или опухоли, возникающей в ходе лечения, и/или разрушение имеющихся клеток новообразования (опухоли) или вновь образующихся опухолевых клеток и, следовательно, снижение общего размера опухоли в ходе лечения. Такая активность может быть оценена на животных моделях, таких как модели ксенотрансплантатов почечноклеточной карциномы человека. Описание животных моделей см., например, в Pulkkanen et al., In Vivo (2000) 14:393-400 и Everitt et al., Toxicol. Lett. (1995) 82-83:621-625.
Под "терапевтически эффективными дозой или количеством" IL-2 или его варианта понимают количество, которое при описанном здесь введении приводит к положительному терапевтическому ответу, такому как противоопухолевая активность.
Используемый в настоящем описании термин "опухолевый ответ" означает уменьшение или исчезновение всех измеримых очагов. Критерии для оценки опухолевого ответа основаны на WHO Reporting Criteria [WHO Offset Publication, 48-World Health Organization, Geneva, Switzerland, (1979)]. В идеале, при каждой оценке должны быть измерены все измеримые в одном или двух измерениях очаги. Если в каком-либо органе имеются множественные очаги, такие измерения могут оказаться невозможными, и в таких обстоятельствах следует по возможности выбрать до 6 показательных очагов.
Используемый в настоящем описании термин "полный ответ" (CR) означает полное исчезновение всего клинически определяемого злокачественного заболевания по результатам 2 оценок, отстоящих друг от друга по времени, по меньшей мере, на 4 недели.
Используемый в настоящем описании термин "частичный ответ" (PR) означает 50%-ное или большее снижение по сравнению с фоновым значением суммы произведений наибольших перпендикулярных диаметров всех измеримых очагов без прогрессии оцениваемого заболевания и без признаков каких-либо новых очагов по результатам, по меньше мере, двух последовательных оценок, отстоящих друг от друга по времени, по меньшей мере, на четыре недели. Оценки должны свидетельствовать о частичном снижении размера очагов лизиса, рекальцификации очагов лизиса или снижении плотности очагов роста. Вполне обычным для IL-2 является индукция кратковременного воспаления в метастатических очагах. Отдельные увеличивающиеся в размере очаги необязательно свидетельствуют об отсутствии PR до тех пор, пока увеличение не будет зарегистрировано в ходе двух последовательных измерений, отстоящих друг от друга по времени, по меньшей мере, на 28 суток. Используемый в настоящем описании термин "прогрессирующее заболевание" (PD) означает 25%-ное или большее увеличение размера, по меньшей мере, одного очага, измеримого в двух измерениях (как произведение наибольших перпендикулярных диаметров) или в одном измерении; явное ухудшение состояния любых оцениваемых очагов; повторное возникновение любых ранее исчезавших очагов; или возникновение новых очагов; по результатам, по меньшей мере, двух последовательных оценок, отстоящих друг от друга по времени, по меньшей мере, на 28 суток.
Используемый в настоящем описании термин "стабильное заболевание" (SD) или "без динамики" применительно (а) к измеримому в двух измерениях очагу означает снижение менее чем на около 50% или увеличение менее чем на около 25% суммы произведений наибольших перпендикулярных диаметров всех измеримых очагов и (b) к измеримому в одном измерении очагу означает снижение менее чем на около 50% или увеличение менее чем на около 25% суммы диаметров всех очагов. Новых очагов возникать не должно. Это свидетельствует об отсутствии полного ответа, частичного ответа или прогрессии. Поскольку костные очаги медленно отвечают на лечение, обозначение "без динамики" не следует применять до прошествия, по меньшей мере, восьми недель с начала терапии.
Используемый в настоящем описании термин "не отвечающий на лечение субъект" относится к пациентам, у которых наблюдается стабильное заболевание или незначительные ответы (снижение опухолевой нагрузки более 25%, но менее 50%).
Используемый в настоящем описании термин "прогрессия" означает 25%-ное увеличение суммы произведений диаметров всех измеримых очагов по сравнению с наименьшей наблюдаемой суммой или по сравнению с исходным уровнем, если отсутствует снижение по сравнению с исходным уровнем; явное ухудшение состояния любых оцениваемых очагов; повторное возникновение любых ранее исчезавших очагов; возникновение любых новых очагов или участков, включая новые участки неоцениваемого заболевания; и/или в случаях, когда может возникнуть первичный опухолевый симптомокомплекс (гиперкальциемия, боль в костях, эритема кожных очагов), симптомы должны либо персистировать в течение более четырех недель, либо должен существовать дополнительный симптом прогрессии.
Используемый в настоящем описании термин "общий ответ" означает ответ, определенный в результате изучения всех очагов злокачественного заболевания. У субъектов с измеримым заболеванием наихудшим ответом будет общий ответ. Отсутствие динамики неизмеримых очагов не будет уменьшать "частичности" ответа в измеримых очагах; т.е. общий ответ будет представлять собой частичный ответ. Отсутствие динамики неизмеримых очагов будет уменьшать "полноту" ответа в измеримых очагах; т.е. общий ответ будет представлять собой частичный ответ.
Используемый в настоящем описании термин "продолжительность ответа" означает время с первого зарегистрированного лучшего объективного опухолевого ответа до времени начала прогрессии.
Используемый в настоящем описании термин "выживаемость" означает время с введения первой дозы IL-2 до времени смерти.
Используемый в настоящем описании термин "выживаемость без прогрессии" (PFS) относится к восприимчивым к лечению субъектам и означает время с введения первой дозы IL-2 до времени начала опухолевой прогрессии, времени смерти или времени последнего визита пациента в клинику, если ответ все еще продолжается.
II. Способы осуществления настоящего изобретения
Перед тем, как приступать к подробному раскрытию настоящего изобретения, следует отметить, что настоящее изобретение не ограничено конкретными составами, или параметры способов как таковые, разумеется, могут варьироваться. Также следует понимать, что использованная в настоящем описании терминология использована исключительно для целей описания конкретных вариантов выполнения изобретения и не предназначена для ограничения.
Хотя для осуществления настоящего изобретения может быть использован ряд способов и веществ, сходных или эквивалентных описанным здесь, предпочтительные вещества и способы раскрыты в настоящем описании.
Настоящее изобретение основано на открытии нового терапевтического способа для безопасного и эффективного лечения почечноклеточной карциномы путем введения низких доз IL-2. Раскрытая в настоящем описании схема лечения позволяет значительно ингибировать опухолевый рост при пониженной токсичности и ослабленных нежелательных побочных эффектах по сравнению со схемами лечения высокими дозами IL-2.
Тогда как способы согласно изобретению предназначены для лечения существующей опухоли, подразумевается, что способы могут быть применимы для профилактики метастазирования опухоли, происходящего в ходе терапии. Способы согласно изобретению особенно применимы для лечения субъектов, страдающих метастатической почечноклеточной карциномой, с нарушенной функцией почек и/или не способных переносить лечение высокими дозами IL-2.
IL-2, применимый для использования в соответствии со способами согласно изобретению, может быть нативным или полученным в соответствии с рекомбинантными методами и может происходить из любого источника, включая источники-млекопитающие, такие как, например, мышь, крыса, кролик, примат, свинья и человек. Последовательности IL-2 ряда видов хорошо известны из предшествующего уровня техники и включают в себя без ограничения следующие последовательности: IL-2 человека (Homo sapiens; последовательность-предшественник, каталожный № GenBank AAH66254; зрелая последовательность представлена остатками 211-153 последовательности каталожный № GenBank AAH66254); IL-2 макака-резуса (Macaco mulatto; последовательность-предшественник, каталожный № GenBank P51498; зрелая последовательность представлена остатками 21-154 последовательности каталожный № GenBank P51498); IL-2 павиана анубиса (Papio anubis; последовательность-предшественник, каталожный № GenBank Q865Y1; зрелая последовательность представлена остатками 21-154 последовательности каталожный № GenBank Q865Y1); IL-2 дымчатого мангабея (Cercocebus torquatus atys; последовательность-предшественник, каталожный № GenBank Р46649; зрелая последовательность представлена остатками 21-154 последовательности каталожный № GenBank Р46649); IL-2 макака-крабоеда (Масаса fascicularis; последовательность-предшественник, каталожный № GenBank Q29615; зрелая последовательность представлена остатками 21-154 последовательности каталожный № GenBank Q29615); IL-2 белорукого гиббона (Hylobates lar; последовательность-предшественник, каталожный № GenBank ICGI2; зрелая последовательность представлена остатками 21-153 последовательности каталожный № GenBank ICGI2); IL-2 беличьего саймири (Saimiri sciureus; последовательность-предшественник, каталожный № GenBank Q8MKH2; зрелая последовательность представлена остатками 21-154 последовательности каталожный № GenBank Q8MKH2); IL-2 коровы (Bos taurus; последовательность-предшественник, каталожный № GenBank P05016; зрелая последовательность представлена остатками 21-155 последовательности каталожный № GenBank P05016; см. также вариант последовательности-предшественника, приведенный в последовательности каталожный № GenBank NP-851340; зрелая последовательность представлена остатками 24-158 последовательности каталожный № GenBan