Антитела против рецептора ccr7 для лечения рака
Иллюстрации
Показать всеИзобретение относится к биотехнологии. Описана фармацевтическая композиция для уничтожения опухолевых клеток, экспрессирующих рецептор CCR7, которая содержит антитело, которое связывается с рецептором CCR7, и фармацевтически приемлемый носитель. Предложены варианты способа уничтожения опухолевых клеток, экспрессирующих рецептор CCR7, включающие либо контактирование указанных клеток с антителом, которое связывается с указанным рецептором CCR7, либо введение субъекту терапевтически эффективного количества антитела, которое связывается с указанным рецептором CCR7. Изобретение расширяет арсенал средств для лечения рака. 3 н. и 3 з.п. ф-лы, 8 ил.
Реферат
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
В целом настоящее изобретение относится к лечению рака. Более конкретно, данное изобретение затрагивает лечение злокачественных опухолей, опухолевые клетки которых представляют собой клетки, экспрессирующие рецептор CCR7, посредством применения антител к рецептору CCR7, которые способны селективно уничтожать, уменьшать миграцию и/или блокировать диссеминацию указанных опухолевых клеток.
УРОВЕНЬ ТЕХНИКИ ИЗОБРЕТЕНИЯ
Рак представляет собой группу заболеваний, характеризующихся неконтролируемым клеточным делением (или возрастанием выживаемости или устойчивости к апоптозу) и способностью указанных клеток поражать другие соседние ткани (инвазия) и распространяться на другие области тела, где в норме данные клетки не обнаруживаются (метастазирование), через лимфатические и кровеносные сосуды, циркулировать в кровотоке и затем поражать здоровые ткани где-либо еще в организме. В зависимости от того, могут ли (или нет) они распространяться посредством инвазии и метастазирования, опухоли классифицируются как доброкачественные или злокачественные: доброкачественные опухоли - это опухоли, которые не могут распространяться посредством инвазии или метастазирования, то есть они растут только в определенном месте; тогда как злокачественные опухоли - это опухоли, которые способны распространяться посредством инвазии и метастазирования.
Существует несколько типов злокачественных опухолей, которые можно классифицировать по типу клетки, в которой они возникают, и по локализации данной клетки, то есть карциномы, которые происходят из клеток, которые выстилают внешнюю и внутреннюю поверхность организма, например кожу, желудочно-кишечный тракт или гланды; лейкемия, которая берет начало в кроветворной ткани, такой как костный мозг, и служит причиной большого количества аномальных клеток крови, которые продуцируются и проникают в кровоток; лимфома, которая представляет собой злокачественную опухоль, образующуюся в лимфатических узлах и тканях иммунной системы организма; меланома, которая возникает в меланоцитах; саркома, которая берет начало в соединительной ткани кости или мышцы; и тератома, которая берет начало в зародышевых клетках.
Рак может лечиться посредством хирургического вмешательства, химиотерапии, радиационной терапии, иммунотерапии или другими способами. Выбор лечения зависит от расположения и степени злокачественности опухоли и от стадии заболевания.
Существенную проблему, требующую рассмотрения, в схемах лечения опухоли составляет желание «полного уничтожения клеток». Это означает, что схемы более эффективного лечения близки к полному уничтожению всех так называемых «клоногенных» злокачественных клеток, то есть клеток, которые имеют способность расти бесконтрольно и приводить к образованию опухолевой массы, которая могла бы быть удалена посредством лечения.
Другой стратегией лечения опухоли является применение «иммунотоксина», в котором антитело против опухолевой клетки используется для доставки токсина к опухолевым клеткам. Однако, наряду с химиотерапевтическими подходами, описанными выше, терапия иммунотоксином также страдает значительными недостатками. Например, антиген-негативные или лишенные антигена клетки могут выжить и восстановить популяцию опухоли или привести к последующим метастазам. Даже если первичный рак удален полностью, злокачественная опухоль очень часто бывает метастатической. Образование метастазов злокачественных опухолей, происходящих из первичной опухоли в более или менее удаленных местах организма, представляет собой одно из наиболее серьезных последствий рака и является тем последствием, для которого в настоящее время не существует удовлетворительного протокола лечения. Доступные в настоящее время способы лечения рака либо имеют ограниченный успех в предотвращении метастазов, либо вызывают серьезные и нежелательные побочные эффекты.
Хотя специальная доставка терапевтических средств, таких как антиклеточные агенты, токсины и коагулирующие факторы для опухолевой массы, отражает значительный успех в протоколах лечения рака, до сих пор существует место для дополнительных или даже альтернативных способов лечения. Определение дополнительных мишеней, с целью сделать возможным специфическое разрушение опухоли in vivo, естественно, принесло бы пользу в увеличении количества возможностей нацеливания (таргетинга).
В настоящее время новые терапевтические стратегии лечения рака движутся по направлению к применению специфических способов лечения, включая моноклональные антитела (mAb) против различных антигенов, экспрессируемых опухолевыми клетками, которые, как надеются, могут излечить заболевание.
При выборе антигена для иммунотерапии должны учитываться или опухолевая специфичность антигена, антигенная плотность на поверхности опухолевых клеток и антигенное модулирование, или интернализация комплекса антиген-антитело, что может уменьшать способность вызывать гибель клеток. Считается, что в большинстве случаев комплементзависимый клеточный лизис (CDC) и антителозависимая клеточно-опосредованная цитотоксичность (ADCC) отвечают за клиническую ценность неконъюгированных mAb, хотя индукция апоптоза или блокирование клеточного цикла также могли бы играть немаловажную роль в прочих случаях.
Раковые клетки могут экспрессировать некоторые молекулярные рецепторы. Различные исследования демонстрируют, что хемокиновый рецептор CCR7 (CC chemokine receptor 7, CCR7) экспрессируется в различных опухолевых клетках, например B-клеточной хронической лимфоцитарной лейкемии, неходжкинской лимфомы, в клетках рака молочной железы, злокачественных опухолей молочной железы и т.д. Более того, ясно, что рецептор CCR7 играет роль в метастазировании лимфатического узла различными злокачественными опухолями, например клетками карциномы желудка, меланомы, немелкоклеточного рака легкого, T-клеточной лейкемии и т.д. Таким образом, указанный хемокиновый рецептор (CCR7) может быть выбран в качестве возможной мишени для mAb-терапии рака.
CCR7 представляет собой рецептор из семи трансмембранных доменов, связанный с G-белком (GPCR). Семейство рецепторов, сопряженных с G-белком (GPCR), охватывает рецепторы к гормонам, нейромедиаторам, факторам роста и вирусам [Yoshie O, Imai T, Nomiyama H. Novel lymphocyte-specific CC chemokines and their receptors. J Leukoc Biol. 1997; 62:634-644; Kim CH, Pelus LM, White JR, Applebaum E, Johanson K, Broxmeyer HE. CK beta-11/macrophage inflammatory protein-3 beta/EBIl-ligand chemokine is an efficacious chemoattractant for T and B cells. J Immunol. 1998; 160:2418-2424; Dieu MC, Vanbervliet B, Vicari A, et al., Selective recruitment of immature and mature dendritic cells by distinct chemokines expressed in different anatomic sites. J Exp Med. 1998; 188:373-386; Willimann K, Legler DF, Loetscher M, et al., The chemokine SLC is expressed in T cell areas of lymph nodes and mucosal lymphoid tissues and attracts activated T cells via CCR7. Eur J Immunol. 1998; 28:2025-2034; Yoshida R, Nagira M, Imai T, et al., EBIl-ligand chemokine (ELC) attracts a broad spectrum of lymphocytes: activated T cells strongly up-regulate CCR7 and efficiently migrate toward ELC. Int Immunol. 1998; 10:901-910; Sallusto F, Schaerli P, Loetscher P, et al., Rapid and coordinated switch in chemokine receptor expression during dendritic cell maturation. Eur J Immunol. 1998; 28:2760-2769].
Частным случаем лейкемии, опухолевые клетки которой экспрессируют рецептор CCR7, является хроническая лимфоцитарная лейкемия (CLL), наиболее общий тип лейкемии у взрослых людей. Указанная лейкемия представляет собой B-клеточную лейкемию, характеризующуюся накоплением единственного клона CD5+ B-клеток с высокой устойчивостью к апоптозу вследствие нарушения регуляции внеклеточных или внутриклеточных сигнальных событий, вовлеченных в программируемую гибель клетки. Несмотря на ее очень низкий индекс пролиферации, при подсчете лимфоцитов периферической крови достигаются значения более чем 5×103/мкл, и клетки лейкемии демонстрируют заметную тенденцию к проникновению в лимфатические узлы, селезенку и костный мозг.
Лечение CLL основано на применении аналогов пурина, в частности флударабина, одного или совместно, в качестве схемы лечения первой линии. К настоящему времени единственной терапевтической комбинацией, приводящей к более высокой степени полной ремиссии, чем та, что получена с флударабином, было применение ритуксимаба, моноклонального антитела против CD20, совместно либо с флударабином, либо с флударабином и циклофосфамидом. Более того, были достигнуты молекулярные ремиссии в пунктатах костного мозга у пациентов с CLL при вышеописанных комбинациях, повышая возможность того, что CLL потенциально может быть излечена без пересадки стволовых клеток. Достижение наилучшего первичного ответа совместно с уничтожением клеток CLL в инокуляте пациентов, подвергающихся аутологичной трансплантации, составляет некоторые из основных терапевтических перспектив для CLL.
Лимфома клеток мантийной зоны (MCL) является агрессивным подтипом B-клеточной неходжкинской лимфомы. Данные клетки характеризуются как CD20+ CD5+ CD23- со сверхэкспрессией t(11;14) и циклина D1. Обычно пациентов лечат либо по схеме ритуксимаб-CHOP (циклофосфамид, гидроксилдаунорубицин, онковин и преднизон) с последующей трансплантацией стволовых клеток, либо по схеме ритуксимаб-HyperCVAD (циклофосфамид, винкристин, адриамицин и дексаметазон). Однако в большинстве случаев MCL остается неизлечимой, указывая на четкую потребность в новых подходах к лечению.
В последнее время было показано, что пациенты с CLL, обнаруживающие клиническую лимфаденопатию, имеют более высокий миграционный ответ CLL-клеток к лигандам CCR7, гомеостатическим хемокинам CCL19 (MIP3-β) и CCL21 (6Ckine) in vitro. Поэтому блокирование вторжения CLL-клеток во вторичную лимфоидную ткань с помощью mAb против CCR7 могло бы быть еще одним преимуществом. Также в этом смысле нелимфоидные опухоли, экспрессирующие эктопический CCR7, обладают способностью метастазировать во вторичные лимфоидные органы, тогда как опухоли без этой молекулы или других хемокиновых рецепторов, вовлеченных в хоминг к вторичным лимфоидным органам, обнаруживают минимальную узловую диссеминацию.
Следовательно, существует необходимость в дополнительных способах лечения рака, в частности раковых и опухолевых клеток, экспрессирующих рецептор CCR7. Указанная терапия должна допускать преимущественно специфическое разрушение опухоли in vivo посредством, например, уничтожения опухолевых клеток, уменьшения миграции и/или блокирования диссеминации опухолевых клеток.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Данное изобретение основано на обнаружении того, что рецептор CCR7 сильно экспрессируется в некоторых опухолевых клетках, он играет основную роль в проникновении лимфоидных клеток во вторичные лимфоидные органы, включая лимфатические узлы (LN), и его экспрессия ограничена наивными T- и B-лимфоцитами и зрелыми дендритными клетками (DC), таким образом, делая указанный рецептор CCR7 любопытной мишенью для mAb-терапии при раке, особенно при злокачественных опухолях, опухолевые клетки которых экспрессируют рецептор CCR7. Авторы изобретения неожиданно заметили, что mAb к CCR7, то есть антитела, которые распознают эпитоп в рецепторе CCR7 и которые способны связывать указанный рецептор CCR7, способны к уничтожению клеток CLL и MCL in vitro, то есть опухолевых клеток, экспрессирующих рецептор CCR7, несмотря на то, что они неспособны к значительному уничтожению неопухолевых клеток, экспрессирующих рецептор CCR7, таких как T-клеточные лимфоциты.
Следовательно, в основном изобретение относится к применению антитела или его антигенсвязывающего фрагмента, которые связываются с рецептором CCR7, для уничтожения или для индукции апоптоза опухолевых клеток, экспрессирующих рецептор CCR7, в производстве фармацевтической композиции для лечения рака; в конкретном варианте осуществления рак, который подлежит лечению, характеризуется опухолевыми клетками, экспрессирующими рецептор CCR7.
Таким образом, в одном аспекте данное изобретение относится к применению антитела или его антигенсвязывающего фрагмента, которые связываются с рецептором CCR7, в производстве фармацевтической композиции для уничтожения или индукции апоптоза опухолевых клеток, экспрессирующих рецептор CCR7.
В другом аспекте изобретение относится к способу уничтожения или индукции апоптоза опухолевых клеток, экспрессирующих рецептор CCR7, который включает контактирование указанных клеток с антителом или его антигенсвязывающим фрагментом, которые связываются с указанным рецептором CCR7.
В другом аспекте изобретение относится к способу уничтожения или индукции апоптоза опухолевых клеток, экспрессирующих рецептор CCR7, у субъекта, нуждающегося в указанном лечении, который включает введение указанному субъекту терапевтически эффективного количества антитела или его антигенсвязывающего фрагмента, которые связываются с указанным рецептором CCR7.
В другом аспекте изобретение относится к способу уменьшения миграции опухолевых клеток, экспрессирующих рецептор CCR7, к вторичной лимфоидной ткани и/или блокирования диссеминации опухолевых клеток во вторичной лимфоидной ткани, который включает контактирование указанных опухолевых клеток с антителом или его антигенсвязывающим фрагментом, которые связываются с рецептором CCR7.
В другом аспекте изобретение относится к способу уменьшения миграции опухолевых клеток, экспрессирующих рецептор CCR7, к вторичной лимфоидной ткани и/или блокирования диссеминации опухолевых клеток во вторичной лимфоидной ткани у субъекта, нуждающегося в указанном лечении, который включает введение указанному субъекту терапевтически эффективного количества антитела или его антигенсвязывающего фрагмента, которые связываются с рецептором CCR7.
В другом аспекте данное изобретение относится к способу идентификации соединения для уничтожения или индукции апоптоза опухолевых клеток, экспрессирующих рецептор CCR7, который включает
a) контактирование клетки, экспрессирующей рецептор CCR7, с соединением-кандидатом, соединенным с антителом против CCR7 или его фрагментом, и
b) определение, уничтожает ли соединение-кандидат указанные клетки, экспрессирующие рецептор CCR7,
в котором соединение, которое уничтожает указанную клетку, экспрессирующую рецептор CCR7, представляет собой соединение, потенциально пригодное для уничтожения или для индукции апоптоза опухолевых клеток, экспрессирующих рецептор CCR7.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
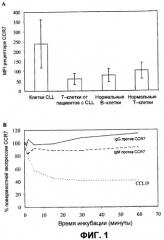
Фиг.1(A) демонстрирует, что поверхностная экспрессия CCR7 больше в опухолевых клетках CLL, чем в нормальных B- и T-лимфоцитах. Образцы периферической крови от 11 пациентов с CLL и 6 здоровых доноров анализировали посредством проточной цитометрии (FCM), чтобы различить разные лимфоидные популяции и соответствующую им плотность CCR7 на поверхности, измеренную как средняя интенсивность флуоресценции (MFI). Полосы представляют среднее ± SD; и (B) демонстрирует, что mAb против CCR7 не вызывают эндоцитоза рецептора. Мононуклеарные клетки периферической крови (PBMC) пациентов с CLL инкубировали в течение различных периодов времени между 30 секундами и 60 минутами с используемыми mAb против CCR7 (2 мкг/мл), mAb класса IgM (клон 2H4) и IgG2a mAb (клон 150503), или с CCL19 (1 мкг/мл), одним из физиологических лигандов CCR7 в качестве положительного контроля. Затем определяли MFI рецептора CCR7 посредством FCM в CD19+CD5+ клетках CLL, дающих электронный сигнал выше порогового значения. Линии представляют экспрессию CCR7, относительно спонтанной MFI рецептора CCR7. Показан иллюстративный случай.
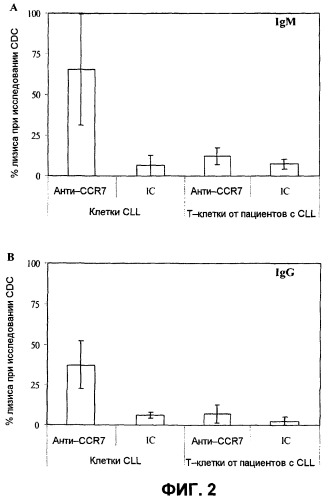
Фиг.2 демонстрирует, что оба mAb против CCR7 опосредуют сильный и специфический комплементзависимый клеточный лизис (CDC) клеток CLL. PBMC пациентов с CLL инкубировали с mAb против CCR7 или с их соответствующими изотипическими контролями (IC) и затем подвергали воздействию кроличьего комплемента в течение часа. Клеточный лизис определяли посредством включения 7-AAD и FCM-исследования на дающих электронный сигнал выше порогового значения клетках CLL и нормальных T-клетках. Полосы отражают среднее значение 11 случаев ±SD. (A) mAb против CCR7 класса IgM (2 мкг/мл), (B) mAb против CCR7 класса IgG (2 мкг/мл).
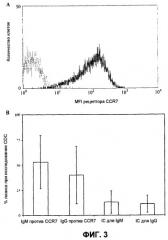
Фиг.3A демонстрирует поверхностную экспрессию CCR7 (черная линия) в опухолевых клетках типичного пациента с лимфомой клеток мантийной зоны (MCL), измеренную посредством проточной цитометрии, включая соответствующие IC (серая линия), а фиг.3B демонстрирует CDC клеток MCL в присутствии mAb против CCR7 или их соответствующие IC. Для четырех случаев показано среднее значение ±SD.
Фиг.4 описывает кривые дозовой зависимости для CDC. Исследования CDC с PBMC от пациентов с CLL (n=5) и здоровых доноров (n=2) проводили с концентрациями mAb против CCR7 от 0,5 до 16 мкг/мл. Процентное отношение клеточного лизиса вследствие CDC определяли посредством включения 7-AAD и FCM-анализа на дающих электронный сигнал выше порогового значения клетках CLL, T-лимфоцитах пациентов с CLL и нормальных B- и T-клетках здоровых доноров. Линии представляют среднее значение клеточного лизиса. (A) mAb против CCR7 класса IgM, (B) mAb против CCR7 класса IgG.
Фиг.5 демонстрирует, что сила CDC коррелирует с уровнями экспрессии CCR7. Поверхностная плотность CCR7 клеток CLL коррелировала (r=0,602, P=0,025, n=11) с процентом лизиса вследствие CDC, опосредованного 2 мкг/мл mAb против CCR7 класса IgM после часа инкубации с кроличьим комплементом.
Фиг.6 демонстрирует, что мышиное mAb против CCR7 класса IgG не опосредует ADCC клеток CLL. Клетки CLL, предварительно проинкубированные либо с mAb против CCR7 класса IgG (2 мкг/мл), IC или ритуксимабом (в качестве положительного контроля), обрабатывали человеческими естественными клетками-киллерами (NK) в течение 4 часов. Затем определяли мертвые клетки посредством включения 7-AAD и FCM-анализа на дающих электронный сигнал выше порогового значения клетках CLL. Полосы показывают среднее значение ±SD из 6 экспериментов.
Фиг.7 демонстрирует, что mAb против CCR7 не вызывают пролиферации лимфоцитов. PBMC от здоровых доноров культивировали в течение 72 часов с mAb против CCR7, изотипическими контролями (IC), mAb против CD3 с IL2 или с одной средой. Синтез ДНК в завершающие 16 часов культивирования определяли по включению [3H]-тимидина. Полосы представляют среднее значение ±SD для 6 случаев, выполненных в трех повторах.
Фиг.8 демонстрирует, что mAb против CCR7 блокируют миграцию клеток CLL и MCL в ответ на CCL19 или CCL21. Исследования хемотаксиса осуществляли, как описано в "Методах", после предварительной инкубации клеток в течение 30 минут с 2 мкг/мл IgG против CCR7 (черные полосы), mAb класса IgM (серые полосы) или без mAb (белые полосы). (A) Миграцию клеток CLL в ответ на CCL19 (1 мкг/мл) сравнивали со спонтанной миграцией и миграцией в присутствии CXCL12 (100 нг/мл), лиганда хемокинового рецептора CXCR4, который не обрабатывался mAb против CCR7. Показан характерный случай. (B) Миграцию клеток MCL в ответ на оба лиганда CCR7, CCL19 (1 мкг/мл) и CCL21 (1 мкг/мл) сравнивали со спонтанной миграцией. Показан иллюстративный случай.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение в целом относится к применению антитела или его антигенсвязывающего фрагмента, которые связываются с рецептором CCR7, при производстве фармацевтической композиции для лечения рака, в частности рака, опухолевые клетки которого экспрессируют рецептор CCR7, посредством уничтожения или индукции апоптоза указанных опухолевых клеток.
Таким образом, в одном аспекте изобретение относится к применению антитела или его антигенсвязывающего фрагмента, которые связываются с рецептором CCR7, при производстве фармацевтической композиции для уничтожения или для индукции апоптоза опухолевых клеток, экспрессирующих рецептор CCR7.
Опухолевые клетки, подлежащие лечению, представляют собой опухолевые клетки, экспрессирующие рецептор CCR7. Иллюстративные неограничивающие примеры указанного типа рака, опухолевые клетки которого экспрессируют рецептор CCR7, охватывают хроническую лимфоцитарную лейкемию (CLL), лимфому клеток мантийной зоны (MCL), фолликулярную лимфому, крупноклеточную B-клеточную лимфому, СПИД-ассоциированную лимфому, лимфоплазмоцитарную лимфому, лимфому Беркитта, острую В-клеточную лимфобластную лейкемию, болезнь Ходжкина, T-клеточную лейкемию/лимфому взрослых, фунгоидный микоз, бластный кризис при хронических миелопролиферативных синдромах, бластный кризис при миелодиспластических синдромах, злокачественные опухоли, такие как рак молочной железы, немелкоклеточный рак молочной железы, меланому, рак желудка или плоскоклеточную карциному головы и шеи и карциному толстой кишки.
Опухолевые клетки, экспрессирующие рецептор CCR7, могут быть идентифицированы посредством стандартных способов; например, поверхностная экспрессия рецептора CCR7 может быть исследована посредством проточной цитометрии в соответствии с методом, раскрытым Lόpez-Giral S. et al. (Journal of Leukocyte Biology, Vol. 76, Aug. 2004, 462-471).
В настоящем изобретении «лечение рака» означает подавление или контроль пролиферации опухолевых клеток, где указанные опухолевые клетки являются опухолевыми клетками, экспрессирующими рецептор CCR7. Термин включает, среди прочего, уничтожение указанных опухолевых клеток, индукцию апоптоза указанных опухолевых клеток, снижение миграции указанных опухолевых клеток к вторичной лимфоидной ткани и/или блокирование диссеминации указанных опухолевых клеток во вторичной лимфоидной ткани.
В соответствии с данным изобретением антитело или его антигенсвязывающий фрагмент к рецептору CCR7 (или специфичные для него), то есть которые связываются с рецептором CCR7, иногда называемые здесь как антитело согласно изобретению, могут применяться для уничтожения или индукции апоптоза опухолевых клеток, экспрессирующих рецептор CCR7. Следовательно, антитело согласно изобретению может применяться при производстве фармацевтической композиции для уничтожения или индукции апоптоза указанных опухолевых клеток. Поэтому данное изобретение предоставляет альтернативный подход к лечению рака, особенно рака, опухолевые клетки которого экспрессируют рецептор CCR7.
Используемый здесь термин «уничтожение опухолевых клеток» касается механизма уничтожения опухолевых клеток, таких как опухолевые клетки, экспрессирующие рецептор CCR7, посредством специфического лизиса указанных клеток. Указанный лизис или цитотоксичность обычно опосредуются пополнением либо белков комплемента (CDC), либо клеток-эффекторов, таких как NK-клетки (ADCC), указанные белки и NK-клетки способны специфически нацеливать и вызывать лизис соответственно указанных опухолевых клеток после воздействия антител против CCR7.
Используемый здесь термин «индукция апоптоза опухолевых клеток» относится к механизму, посредством которого опухолевые клетки, экспрессирующие рецептор CCR7, претерпевают апоптоз, то есть запрограммированную гибель клетки, после обработки антителами против CCR7.
Используемый здесь термин «антитело согласно изобретению» относится к гамма-глобулину или его фрагменту, который проявляет специфическую связывающую активность к молекуле-мишени, а именно к рецептору CCR7 (антиген). Поэтому антитело согласно изобретению способно связывать эпитоп CCR7; обычно по меньшей мере 6, 8, 10 или 12 непрерывных аминокислот необходимо для образования эпитопа, однако эпитопы, которые включают в себя незаменимые аминокислоты, могут требовать больше, например по меньшей мере 15, 25 или 50, аминокислот. Термин «антитело согласно изобретению» охватывает, например, поликлональные антитела, моноклональные антитела, сконструированные или модифицированные антитела, химерные антитела, гуманизированные антитела, приматизированные антитела, человеческие антитела, фрагменты антитела, такие как Fab, F(ab')2, Fab', одноцепочечные фрагменты Fv (scFv), димерные антитела, биспецифичные антитела и гетероконъюгатные антитела. Кроме того, антитело согласно изобретению также может быть конъюгировано с дополнительным соединением, таким как терапевтический агент, токсин и тому подобное. Такие антитела могут быть получены различными способами, включая культуры гибридом, рекомбинантную экспрессию в бактериях или культурах клеток млекопитающих и рекомбинантную экспрессию в трансгенных животных. Также антитела могут быть получены посредством отбора последовательности из библиотеки последовательностей, экспрессированных в дисплейных системах, таких как система нитевидного фага, бактериальная, дрожжевая или рибосомальная. В литературе существует множество инструкций по выбору конкретной методики получения, например Chadd and Chamow, Curr. Opin. Biotechnol., 12: 188-194 (2001). Выбор производственной методологии зависит от нескольких факторов, включая желаемую структуру антитела, значение углеводных частей антитела, простоту культивирования и очистки и стоимость. При использовании общепринятой экспрессионной технологии может быть создано множество различных структур антитела, включая полноразмерные антитела, фрагменты антитела, такие как фрагменты Fab и Fv, а также химерные антитела, содержащие компоненты от различных видов. Фрагменты антитела небольшого размера, такие как фрагменты Fab и Fv, не имеющие эффекторных функций и ограниченной фармакокинетической активности, могут быть получены в бактериальной экспрессионной системе. Одноцепочечные Fv-фрагменты проявляют низкую иммуногенность, и они быстро очищаются из крови.
Антитело согласно изобретению, которое специфически связывается с эпитопом рецептора CCR7, может применяться в терапевтических целях, а также в иммунохимических исследованиях, таких как иммунофлуоресцентные исследования, проточная цитометрия, вестерн-блоты, ELISA, радиоиммунологические исследования, иммуногистохимические исследования, иммунопреципитации или другие иммунохимические исследования, известные в данной области. Для идентификации антител, имеющих желаемую специфичность, могут применяться различные иммунологические исследования. В данной области хорошо известны многочисленные протоколы по конкурентному связыванию или иммунорадиометрическим исследованиям. Такие иммунологические исследования обычно затрагивают измерение комплексообразования между иммуногеном и антителом, которое специфически связывается с иммуногеном рецептора CCR7.
Антитела согласно изобретению могут быть поликлональными антителами. Такие поликлональные антитела могут быть получены в млекопитающих, таких как млекопитающие, не являющиеся человеком, например, после одной или нескольких инъекций иммунизирующего вещества и предпочтительно адъюванта. Обычно иммунизирующее вещество и/или адъювант будут вводить млекопитающему посредством серий подкожных или внутрибрюшинных инъекций. Иммунизирующий агент может включать рецептор CCR7, или его фрагмент, или его слитый белок, или клетку, экспрессирующую рецептор CCR7. В ином случае для получения антител может использоваться препарат неочищенного белка, который был обогащен рецептором CCR7 или его фрагментом. Такие белки, фрагменты или препараты вводят млекопитающему, не являющемуся человеком, в присутствии соответствующего адъюванта. Другой способ введения иммуногена представляет собой, например, трансмембранный белок на поверхности клетки (методы описаны, например, у Spiller et al., J. Immunol. Methods, 224: 51-60 (1999)). Эти клетки могут быть любыми клетками, которые от природы экспрессируют антиген в их клеточной мембране или в которых эта экспрессия может быть получена после трансфекции клетки ДНК-конструкцией, которая содержит среди прочих ДНК-последовательностей те, что кодируют данный антиген, те, что необходимы для его достаточной экспрессии в клетке. Этот подход возможен, не только когда клеточная мембрана представляет собой природный сайт, в котором экспрессируется данный антиген, даже антиген, синтезированный однократно в клетке, направляется в это место при помощи сигнального пептида, который добавляется к последовательности, кодирующей антиген. Если сыворотка содержит поликлональные антитела к нежелательным эпитопам, поликлональные антитела могут быть очищены посредством иммуноаффинной хроматографии.
Альтернативно, указанные антитела могут быть моноклональными антителами. Моноклональные антитела могут быть получены при помощи гибридом, в которых мышь, хомяк или другое подходящее животное-хозяин, иммунизируется иммунизирующим агентом, чтобы получить лимфоциты, которые продуцируют или способны продуцировать антитела, которые будут специфически связываться с иммунизирующим веществом, например, как описано у Kohler и Milstein, Nature 256:495 (1975). Иммунизирующий агент обычно будет включать рецептор CCR7, или его фрагмент, или его слитый белок, и при желании носитель или препарат неочищенного белка, который был обогащен рецептором CCR7 или его фрагментом, или клетку, экспрессирующую рецептор CCR7. Такие белки, фрагменты или препараты вводят млекопитающему, не являющемуся человеком, в присутствии соответствующего адъюванта. Другая форма введения иммуногена представляет собой трансмембранный белок на поверхности клетки (методы описаны, например, у Spiller et al., J. Immunol. Methods, 224: 51-60 (1999)). Эти клетки могут быть любыми клетками, которые от природы экспрессируют антиген в их клеточной мембране или в которых может быть получена эта экспрессия после трансфекции клетки ДНК-конструкцией, которая содержит среди прочих ДНК-последовательностей те, что кодируют данный антиген, те, что необходимы для его достаточной экспрессии в клетке. Этот подход возможен, не только когда клеточная мембрана представляет собой природный сайт, в котором экспрессируется данный антиген, даже антиген, синтезированный однократно в клетке, направляется в это место при помощи сигнального пептида, который добавляется к последовательности, кодирующей антиген. В ином случае лимфоциты могут быть иммунизированы in vitro. Как правило, если желательным источником является млекопитающее, не являющееся человеком, используют клетки селезенки или клетки лимфатического узла либо, если желательными являются клетки человеческого происхождения, используются лимфоциты периферической крови («PBL»). Чтобы получить гибридомную клетку, лимфоциты сливают с иммортализованной клеточной линией, используя подходящий агент слияния, такой как полиэтиленгликоль. В большинстве случаев иммортализованные клеточные линии являются клетками миеломы крысы, мыши, коровы или имеют человеческое происхождение. Гибридомные клетки культивируют в подходящей культуральной среде, которая предпочтительно содержит одно или несколько веществ, которые ингибируют рост или выживаемость неслитых иммортализованных клеток. Клоны выделяют, применяя метод серийных разведений, а культуральную среду (супернатант), в которой культивируют гибридомные клетки, можно исследовать на присутствие моноклональных антител, направленных против рецептора CCR7, с помощью обычных технологических приемов, таких как проточная цитометрия или иммунопреципитация, или с помощью другого метода связывания in vitro, такого как RIA или ELISA. Также клоны можно культивировать in vivo, как и асцитные опухоли у животных.
Предпочтительно, чтобы связывающая специфичность моноклональных антител, продуцируемых клоном гибридомных клеток, определялась с помощью иммунопреципитации или посредством исследования связывания in vitro, такого как радиоиммунологическое исследование (RIA) или твердофазный иммуноферментный анализ (ELISA), или посредством иммунофлуоресцентных технологических приемов, таких как флуоресцентная микроскопия или проточная цитометрия.
Моноклональные антитела, секретируемые субклонами, отделяют надлежащим образом от культуральной среды, асцитной жидкости или сыворотки при помощи обычных процедур очистки иммуноглобулина, таких как, например, белок A-Сефароза, хроматография с гидроксилапатитом, гель-электрофорез, диализ или аффинная хроматография.
Также моноклональные антитела могут быть получены с помощью методов рекомбинантной ДНК, таких как те, что описаны в патенте США 4816567. ДНК, кодирующая моноклональные антитела согласно изобретению, может быть отделена от гибридомных клеток, характеризующихся рецептором CCR7, и секвенирована посредством общепринятых методов, например при применении олигонуклеотидных зондов, которые способны специфически связываться с генами, кодирующими тяжелую и легкую цепи мышиных антител. Гибридомные клетки служат предпочтительным источником такой ДНК. Чтобы добиться синтеза моноклональных антител в рекомбинантных клетках-хозяевах, выделенная однократно ДНК может быть встроена в экспрессионный вектор, который затем трансфицируют в клетки-хозяева, такие как COS-клетки обезьяны, клетки яичника китайского хомячка (CHO) или клетки миеломы, которые без него не продуцируют иммуноглобулиновый белок.
Еще один способ получения специфических антител или фрагментов антитела, реактивных против молекулы-мишени, - это скринирование экспрессионных библиотек, кодирующих иммуноглобулиновые гены или их части, экспрессирующиеся в дисплейных системах бактерий, дрожжей, нитевидных фагов, рибосом или рибосомных субъединиц и в других. Обычно эти способы используют большие библиотеки последовательностей антител или последовательностей фрагментов антител, полученных из различных источников, таких как здоровые доноры, пациенты или здоровые или больные животные. Эти последовательности клонируют и экспрессируют в соответствующей системе и отбирают по их связывающей аффинности к антигену. Были описаны различные подходы для отбора антител или фрагментов с желаемыми свойствами, например нейтрализация, агонист и т.д. (Fernandez, Curr. Op. Biotech., 15: 364-373 (2004); Schmidt, Eur. J. Biochem., 268: 1730-1738 (2001)). В одном варианте осуществления антитела и фрагменты антитела, характерные для гибридом согласно изобретению, также могут быть получены с помощью рекомбинантных способов посредством выделения информационной РНК, построения библиотеки cDNA и отбора клонов, которые кодируют части молекулы антител.
Сконструированные или модифицированные антитела
Чтобы создавать различные модификации молекулы иммуноглобулина с целью улучшения его свойств для клинического или иного применения, используются многочисленные подходы молекулярной биологии и генетические приемы, такие как хорошее знание генетики и структуры иммуноглобулинов. Некоторые из них направлены на уменьшение иммуногенности молекулы у видов, в которых их следует использовать, и образующаяся молекула имеет последовательность, более гомологичную этим видам. Для получения mAb человеческого происхождения применяли различные способы, избегая этически недопустимых действий на здоровых людях. При других подходах уменьшают молекулярную массу и размер, например, чтобы улучшить распределение молекулы в солидных опухолях. Другие возможности представляют собой соединение в молекуле связывающих доменов более чем одной молекулы-мишени (биспецифичное антитело или также триспецифичное и т.д.) или соединение антитела или фрагмента с еще одной молекулой с желаемой функцией, например с токсическим агентом, гормоном, фактором роста, иммуномодулирующим агентом (иммуносупрессором или иммуностимулятором), ингибитором клеточного роста и т.д. В большинстве случаев все получающиеся молекулы сохраняют по меньшей мере один вариабельный домен антитела, который дает высокую специфичность и характеристику аффинности связывания антиген-антитело. Некоторыми примерами этих конструкций являются следующие.
Химерные антитела
Это относится к антителам, сконструированным на основе вариабельных областей из антитела некоторых видов (обычно - млекопитающего, в котором вырабатывали mAb) и константных областей других видов (тот самый вид, в котором применяется химерное антитело). Цель такой конструкции - получение антитела на основе исходного mAb, но менее иммуногенного и лучше переносимого субъектом, который подлежит лечению, с улучшенным временем полужизни в сыворотке и которое может быть распознано эффекторными иммунологическими механизмами, то есть комплементом, Fc-рецептором цитотоксических клеток или другими специфическими рецепторами к иммуноглобулинам, что свидетельствует о видовой специфичности.
Гуманизированные антитела
Под «гуманизированным антителом» подразумевается антитело, полученное из антитела, не являющегося человеческим, обычно из мышиного антитела, которое сохраняет антигенсвязывающие свойства исходного антитела, но которое является менее иммуногенным у людей. Это может быть достигнуто при помощи различных способов, включая (a) прививание целых вариабельных доменов, не являющихся человеческими, на человеческие константные области для создания химерных антител, (b) привива