2,3; 4,5-ди-о-изопропилиден-l-сорбопираноза
Иллюстрации
Показать всеИзобретение относится к 2,3; 4,5-ди-O-изопропилиден-L-сорбопиранозе, синтезируемой из α,β-L-сорбопиранозы и ацетона в присутствии концентрированной серной кислоты в качестве катализатора, в соответствии со следующей последовательностью технологических операций: перемешивание смеси реагентов при охлаждении, нейтрализация реакционной массы, выделение смеси продуктов реакции, выделение целевого и промежуточного продуктов, очистка целевого продукта.
Реферат
Изобретение относится к области органической химии и предназначено для использования при синтезе ди-O-изопропилиден-производных моносахаридов посредством их конденсации с ацетоном с применением в качестве катализатора реакции серной кислоты. Данные материалы описывают 2,3;4,5-Ди-O-изопропилиден-L-сорбопиранозу и способ ее получения.
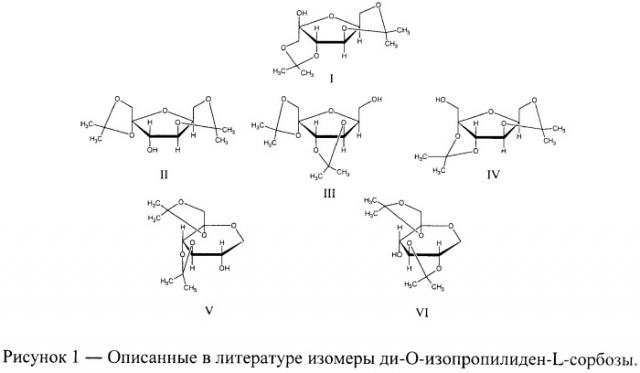
В настоящее время в литературе описаны следующие изомеры ди-O-изопропилиден-L-сорбозы: 1,3; 4,6-ди-O-изопропилиден-β-L-сорбофураноза (I), 1,2; 4,6-ди-O-изопропилиден-α-L-сорбофураноза (II), 1,2; 3,4-ди-О-изопропилиден-α-L-сорбофураноза (III), 2,3; 4,6-ди-O-изопропилиден-α-L-сорбофураноза (IV), 1,2; 3,4-ди-O-изопропилиден-α-L-сорбопираноза (V), 1,2; 4,5-ди-O-изопропилиден-α-L-сорбопираноза (VI) [Beilstein. 4 Edition, 5 Supplementary Series. - Vol.19. - Pt. 12. - P. 354-356, 358-359, 362-363], изображенные на рисунке 1:
При этом известно несколько принципиальных методов синтеза указанных изомеров ди-О-изопропилиден-L-сорбозы (ДИПС) из L-сорбозы: обработка 2,2-диметоксипропаном с применением n-толуолсульфокислоты в качестве катализатора [2], конденсация с ацетоном в присутствии минеральных кислот [3-6], конденсация с ацетоном в присутствии водоотнимающих средств [7] и реакция с ацетоном с применением смешанных конденсирующих систем [7-9].
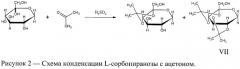
В литературе отсутствуют данные, касающиеся 2,3; 4,5-ди-О-изопропилиден-L-сорбопиранозы и методов синтеза этого изомера. Структурная формула и уравнение синтеза 2,3; 4,5-ди-O-изопропилиден-L-сорбопиранозы (VII) представлены ниже:
Заявляемые структурный изомер (VII) и метод его синтеза открывают путь к синтезу С6 - производных 2,3; 4,5-Ди-O-изопропилиден-L-сорбопиранозы, имеющих шестичленный гетероцикл с одним атомом (О). Например, 2,3; 4,5-ди-О-изопропилиден-L-сорбопираноза используется (ИВС РАН) для создания синтетических высокомолекулярных биологически активных веществ, содержащих остатки L-сорбопиранозы, связанные по положению 6, что определяет адъювантность препаратов и вызывает появление у них сильной иммуностимулирующей активности, более выраженной, чем при наличии в ВМС остатков других моносахаридов или таутомеров L-сорбозы или в случае замещения по другому положению. Кроме того, 2,3; 4,5-Ди-O-изопропилиден-L-сорбопираноза расширяет сырьевой ассортимент при синтезе аскорбиновой кислоты и может применяться для этой цели наряду с 2,3, 4,6-O-диизопропилиден-L-сорбофуранозой или взамен таковой.
Технической задачей и технологическим эффектом является разработка метода синтеза 2,3; 4,5-ди-O-изопропилиден-L-сорбопиранозы из α,β-L-сорбопиранозы и ацетона с использованием в качестве катализатора концентрированной серной кислоты, что гарантирует получение продукта, представленного с высшей степенью чистоты одним структурным изомером с эффективным выходом.
Указанная задача и эффективность достигается за счет предлагаемого способа получения 2,3; 4,5-ди-O-изопропилиден-L-сорбопиранозы, включающего: 1) предварительную подготовку реагентов: а) определение физико-химических показателей и выбор реагентов со следующими характеристиками: L-сорбоза - не менее 99.0% чистоты; ацетон - с температурой кипения 56.3°С (760 мм рт.ст.), без органических и минеральных примесей; серная кислота - с плотностью d4 20≥1.829 г/см3; б) измельчение кристаллов L-сорбозы до состояния тонкого порошка, при этом устраняются агломераты и повышается поверхность моносахарида; 2) смешение реагентов и проведение реакции: а) при интенсивном перемешивании посредством лопастной мешалки или мешалки другой конструкции с электроприводом (имеется возможность изменения числа оборотов вала) и охлаждении до -5-0°С к суспензии α,β-L-сорбозы по каплям из капельной воронки с автовыравниванием давления прибавляют концентрированную серную кислоту в течение 30-35 минут; перемешивание реакционной массы в течение 15 минут при охлаждении до 0-10°С и затем в течение 15 минут при 15-25°С или перемешивание реакционной массы после добавления всего количества катализатора в течение 15 минут при температуре 0-25°С, после чего раствор передают на стадию нейтрализации; б) при интенсивном перемешивании посредством лопастной мешалки или мешалки другой конструкции с электроприводом (имеется возможность изменения числа оборотов вала) и охлаждении до -5-0°С к ацетону добавляют в два приема концентрированную серную кислоту и затем при перемешивании и температуре - 1-10°С к полученному раствору в течение 20-30 минут небольшими порциями добавляют α,β-L-сорбозу; добавление очередной порции производят после растворения предыдущей или растворения большей части предыдущей порции, затем раствор перемешивают в течение 10-15 минут при температуре 10-20°С и передают на стадию нейтрализации; 3) контроль кинетики реакции: степень конверсии L-сорбозы оценивается по ее содержанию в реакционной массе, предварительно - визуально, затем используется отбор и анализ проб; содержание продуктов реакции - с помощью ТСХ, для количественного определения используют денситометр «ДенСкан» с компьютерным интерфейсом и программным обеспечением или аналогичный; 4) нейтрализацию реакционной массы - проводят при перемешивании и охлаждении в том же сосуде, в котором проводилась конденсация, добавляя порциями избыток твердого безводного Na2CO3, не допуская повышения температуры смеси выше 35°С. Также температуру реакционной массы контролируют, варьируя скорость добавления соды; 5) выделение продуктов реакции: большую часть раствора, имеющего щелочную реакцию, декантируют с осадка минеральных солей и фильтруют через пористый стеклянный фильтр типа Шота №3 или №2 над вакуумом водоструйного насоса; оставшуюся часть раствора отделяют фильтрованием минерального осадка через пористый стеклянный фильтр Шота №1, фильтрат объединяют с основным количеством раствора, а всю массу осадка многократно экстрагируют ацетоном при интенсивном перемешивании в сосуде, в котором проводили реакцию; все ацетоновые растворы объединяют, отгоняют ацетон на роторном вакуумном испарителе, из остатка экстрагируют 2,3; 4,5-ди-O-изопропилиден-L-сорбопиранозу эфиром или хлороформом, экстракт промывают дважды 20-30%-ным раствором Na2CO3 порциями по 50-75 мл, отгоняют растворитель на роторном вакуумном испарителе, окончательно удаляют остатки растворителя и воды на установке для перегонки в вакууме при 1-2 мм рт.ст. и 60-65°С, кристаллизуют остаток, определяют чистоту продукта и его выход; из жидкости, оставшейся после экстракции целевого продукта, выделяют 2,3-O-изопропилиден-L-сорбопиранозу, для чего отгоняют все летучие примеси при 20-30°С и 1-2 мм рт.ст.; 6) очистку 2,3; 4,5-ди-O-изопропилиден-L-сорбопиранозы: соединение очищают перегонкой в вакууме при остаточном давлении 0.1-0.3 мм рт.ст. и при 130-135°С соответственно или очищают дробной кристаллизацией из алифатических углеводородов С5-C7 (лучше из гексана) и их смесей; 7) выполняют сопоставление физических констант целевого продукта с таковыми для образца сравнения (ТСХ, ЯМР спектроскопия, пресс-порошковые дифрактограммы при λ=1.54 нм (Cu Кα)), элементный анализ и др.).
Выделенную 2,3-O-изопропилиден-L-сорбопиранозу используют для превращения в 2,3; 4,5-ди-O-изопропилиден-L-сорбопиранозу или для синтеза других соединений.
Способ синтеза 2,3; 4,5-ди-O-изопропилиден-L-сорбопиранозы раскрывается далее на примерах.
Пример 1. В трехгорлую круглодонную колбу емкостью 2 л, снабженную мешалкой с электроприводом, обратным холодильником и капельной воронкой, помещают 50.5 г (0.2775 моль) тонкоизмельченной 99.0%-ной α,β-L-(-)-сорбопиранозы и 1 л ацетона, затем к суспензии при интенсивном перемешивании и охлаждении реакционной массы (- 5-0°С) смесью льда и NaCl, по каплям в течение 30 мин прибавляют 40 мл серной кислоты (d4 20=1.831 г/см3). При этом почти все количество L-сорбозы растворяется. Смесь перемешивают при охлаждении в течение 15 мин, после чего бесцветный раствор перемешивают при 22°С еще в течение 15 мин. Реакционную массу нейтрализуют при перемешивании избытком Na2CO3, не допуская повышения температуры смеси выше 35°С. Раствор, имеющий щелочную реакцию, декантируют с осадка минеральных солей и затем удаляют остатки последних фильтрованием. Оставшийся в колбе осадок, содержащий еще некоторое количество раствора продуктов реакции в ацетоне, отфильтровывают над вакуумом и затем многократно экстрагируют ацетоном при интенсивном перемешивании, тщательно отфильтровывая смесь после каждой экстракции. Экстракты объединяют с основным количеством раствора, отгоняют ацетон в вакууме на роторном испарителе и получают смесь моно- и ди-O-изопропилиден-производных в виде слабо окрашенной сиропообразной жидкости, из которой экстрагируют ДИПС хлороформом. Нерастворимую часть промывают небольшим количеством хлороформа, экстракты объединяют, промывают два раза по 75 мл 20%-ного раствора Na2CO3 и удаляют основное количество хлороформа в вакууме на роторном испарителе, затем остатки при 65°С и 1-2 мм рт.ст. Получают 35 г (48%, считая на массу взятой для реакции α,β-L-(-)-сорбозы) 2,3; 4,5-ди-O-изопропилиден-L-сорбопиранозы (II) в виде очень вязкой массы, которая после внесения затравки закристаллизовывается в виде длинных игл. Спектр 13С-ЯМР в D2O: 18.81 м. д., 26.41 м. д., 27.11 м. д., 28.66 м. д. (4 Me); 60.60 м. д. (С6); 62.58 м. д. (С1); 73.13 м. д. (С5); 73.68 м. д. (С4); 84.43 м. д. (С3); 99.37 м. д. (>С4,5<); 113.94 м. д. (С2); 115.01 м. д. (>С2,3<).
Для очистки ДИПС перекристаллизовывают из гексана, при этом получаются различные кристаллические модификации, поликристаллы и монокристаллы различной геометрии и массы и имеющие различные т.пл.: 71.5-72°С (пластинки); 76.0°С, 76.0-76.5°С (иглы, призмы); 81°С (призмы); или получаются только плоские иглы и мелкокристаллический порошок, имеющие одинаковую темп. пл. 77-78°С. Все образцы ДИПС имеют общую структурную формулу 2,3; 4,5-ди-O-изопропилиден-L-сорбопиранозы, что доказано посредством 1H-, 13С-ЯМР и методов: COSY, HSQC, HMBC, ROESY и др. двумерной ЯМР - спектроскопии в D2O, DMSO - 6 D, DMFA - 7 D с применением спектрометров AVANCE 400 и AVANCE 500.
Для выделения моноизопропилиденпроизводного из жидкости, оставшейся после экстракции ДИПС, удаляют основное количество растворителя на роторном вакуумном испарителе при 8 мм рт.ст., затем остатки при 20-30°С и 2 мм рт.ст. Получают 25 г 2,3-O-изопропилиден-L-сорбопиранозы (I) в виде желтоватого сиропа, вполне пригодной для дальнейшего превращения в ДИПС.
Выходы целевого продукта составляют 48-50%.
Пример 2. В условиях примера 1 после добавления всего количества катализатора за время, равное 30 минут, полученную смесь перемешивают в течение 15 минут при температуре 0-10°С и передают далее на стадию нейтрализации. Это позволяет дополнительно сократить время всего процесса и прибавить нейтрализующий агент за меньшее время.
Пример 3. При интенсивном перемешивании и охлаждении до -5-0°С к ацетону добавляют в два приема концентрированную серную кислоту и затем при перемешивании и температуре - 1-10°С к полученному раствору в течение 20-30 минут небольшими порциями добавляют α,β-L-сорбозу; добавление очередной порции производят после растворения предыдущей или растворения большей части предыдущей порции, затем раствор перемешивают в течение 10-15 минут при температуре 10-20°С и передают на стадию нейтрализации;
Пример 4. В условиях примеров 1-3 хлороформный экстракт для удаления примесей, в основном 2,3-O-изопропилиден-L-сорбопиранозы, интенсивно встряхивают два раза с порциями по 50 мл 30%-ного раствора Na2CO3, всего 100 мл раствора соды. Это уменьшает потери 2,3; 4,5-ди-O-изопропилиден-L-сорбопиранозы в водную фазу и повышает ее выход.
Таким образом, предложен новый продукт процесса конденсации L-сорбопиранозы с ацетоном, а именно - 2,3; 4,5-ди-O-изопропилиден-L-сорбопираноза и разработан способ его синтеза, гарантирующий получение целевого продукта, представленного на 100% указанным структурным изомером, с эффективным выходом.
Выделенная в чистом виде 2,3-O-изопропилиден-L-сорбопираноза может быть использована для дальнейшего повышения выхода 2,3; 4,5-ди-О-изопропилиден-L-сорбопиранозы или для синтеза других соединений.
Список источников информации
1. Beilstein. 4 Edition, 5 Supplementary Series. - Vol.19. - Pt. 12. - P. 354-356, 358-359, 362-363.
2. Maeda T. Acetonation of L-Sorbose by Ketal Interchange // Bull. Chem. Soc. Jpn. - 1967. - Vol.40. - N. 9. - P. 2122-2128.
3. Reichstein Т., Grüssner A. Eine ergiebige Synthese der 1-Ascorbinsäure (С -Vitamin) // Helv. Chim. Acta. - 1934. - Vol.7. - Fas. 2. - S. 311-328.
4. Ohle H. Über die Aceton-Verbindungen der Zucker und ihre Derivate, XX. Mitteil.: Eine neue Mono-aceton-1-sorbose // Ber. - 1938. - Jg. 71. - S. 562-568.
5. Jose M., Romero Romero. Synthesis of ascorbic acid. // An. Farm. Hosp.- 1967. - Vol.10. - N. 21. - P. 127-131. // С.А. - 1968. - Vol.68. - P.1287. - § 13298g.
6. RU 2 121 479.
7. Levi S., Pencheva E. Study of the process of acid-catalyzed acetonation of L-sorbose to 2,3, 4,6-diacetone-L-sorbose // Chem. Pharm. J. - 1978. - Vol.12. -Iss. 9. - P. 1183-1186. //Хим.-фарм. ж. - 1978. - №9. - С.78-81.
8. О синтезе 1-аскорбиновой кислоты (витамина С) / В.И.Максимов, В.В.Никонова, А.Ф.Лазарев, Л.А.Зверева // ЖОХ. - 1939. - Т. 9. - Вып.10. - С.936-943.
9. Grünenberg, Bredt С., Freidenberg W. The Preparation of Diaceton Sugars // J. Am. Chem. Soc. - 1938. - V. 60. - N. 6. - P. 1507.
2,3; 4,5-ди-O-изопропилиден-L-сорбопираноза синтезируемая из α,β-L-сорбопиранозы и ацетона в присутствии концентрированной серной кислоты в качестве катализатора, в соответствии со следующей последовательностью технологических операций: перемешивание смеси реагентов при охлаждении, нейтрализация реакционной массы, выделение смеси продуктов реакции, выделение целевого и промежуточного продуктов, очистка целевого продукта.