Ангиопоэтин-2-специфические связывающие агенты
Иллюстрации
Показать всеИзобретение относится к иммунологии и биотехнологии. Предложены варианты антитела, специфичного к ангиопоэтину 2 (Ang-2), и фармацевтическая композиция на основе антител для лечения различных заболеваний, связанных с повышенной экспрессией ангиопоэтина-2. Описаны также способы ингибирования, модулирования и лечения различных заболеваний, опосредованных активностью ангиопоэтина-2. Предложены: кодирующая нуклеиновая кислота, вектор для экспрессии и клетка, трансформированная вектором, а также способ получения антител. Использование изобретения обеспечивает новые антитела с высокой цитотоксичностью (в анализе ELISA IC50=0,35 нМ), сопоставимой с известным антителом Ab536, что может найти дальнейшее применение в медицине. 13 н. и 9 з.п. ф-лы, 2 ил., 11 табл.
Реферат
Эта заявка является частичным продолжением Заявки на патент США с номером 10/269805, поданной 10 октября 2002 года, и РСТ Заявки с номером РСТ/US02/32613, поданной 11 октября 2002 года, по которой испрашивается приоритет Предварительной заявки на патент США с регистрационным номером 60/328604, поданной 11 октября 2001 года, все из которых включены здесь в качестве ссылки. По этой заявке также испрашивается приоритет Предварительной заявки на патент США с регистрационным номером 60/620161, поданной 19 октября 2004 года, и Заявки США с номером 10/982440, поданной 4 ноября 2004 года, которые включены здесь в качестве ссылки.
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Данное изобретение относится к специфическим связывающим агентам, которые распознают ангиопоэтин-2 (Ang-2) и связываются с ним. Более конкретно, данное изобретение относится к получению, диагностическому применению и терапевтическому применению моноклональных и поликлональных антител и их фрагментов, которые специфически связывают Ang-2.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Ангиогенез, образование новых кровеносных сосудов из существующих сосудов, является важным для многих физиологических и патологических процессов. Обычно, ангиогенез жестко регулируется про- и антиангиогенными факторами, но в случае таких заболеваний, как рак, глазные неоваскулярные заболевания, артрит и псориаз, этот процесс может проходить в искаженном виде. Folkman, J. Nat. Med., 1:27-31 (1995).
Имеется ряд заболеваний, о которых известно, что они связаны с неправильно регулируемым или нежелательным ангиогенезом. Такие заболевания включают, но не ограничиваются ими, глазную неоваскуляризацию, такую как ретинопатии (в том числе диабетическую ретинопатию), связанную с возрастом дегенерацию желтого пятна, псориаз, геманглиобластому, гемангиому, артериосклероз, воспалительное заболевание, такое как ревматоидное или ревматическое воспалительное заболевание, в частности, артрит (в том числе ревматоидный артрит) или другие хронические воспалительные нарушения, такие как хроническая астма, артериальный или пост-трансплантационный атеросклероз, эндометриоз, и неопластические заболевания, например, так называемые солидные опухоли и жидкостные (или гемопоэтические) опухоли (такие как лейкозы и лимфомы). Специалистам в данной области будут известны другие заболевания, связанные с нежелательным ангиогенезом.
Хотя предполагалось, что многие системы трансдукции сигналов участвуют в регуляции ангиогенеза, одна из наиболее хорошо охарактеризованных и наиболее селективных систем эндотелиальных клеток включает рецепторную тирозинкиназу Tie-2 (обозначаемую “Tie-2” или “Tie-2R” (также обозначаемую “ORK”); мышиную Tie-2 также обозначаемую “tek”) и ее лиганды, ангиопоэтины (Gale, N.W. and Yancopoulos, G.D., Genes Dev. 13:1055-1066 (1999)). Имеются 4 известных ангиопоэтина: ангиопоэтин-1 (“Ang-1”) - ангиопоэтин-4 (“Ang-4”). Эти ангиопоэтины обозначают также «Tie-2-лигандами». (Davis, S., et al., Cell, 87:1161-1169 (1996); Grosios, K., et al., Cytogenet Cell Genet, 84:118-120 (1999); Holash, J., et al., Investigative Ophthalmology & Visual Science, 42:1617-1625 (1999); Koblizek, T. I., et al., Current Biology, 8:529-532 (1998); Lin, P., et al., Proc Natl Acad Sci USA, 95:8829-8834 (1998); Maisonpierre, P. C., et al., Science, 277:55-60 (1997); Papapetropoulos, A., et al., Lab Invest, 79:213-223 (1999); Sato, T. N., et al., Nature, 375:70-74 (1998); Shyu, K. G., et al., Circulation, 98:2081-2087 (1998); Suri, C., et al., Cell, 87:1171-1180 (1996); Suri, C., et al., Science, 282:468-471 (1998); Valenzuela, D. M., et al., Proceedings of the National Academy of Sciences of the USA, 96:1904-1909 (1999); Witzenbichler, B., et al., J Biol Chem, 273:18514-18521 (1998)). В то время как связывание Ang-1 с Tie-2 стимулирует фосфорилирование рецептора в культивируемых эндотелиальных клетках, наблюдали, что Ang-2 является как агонистом, так и антагонистом фосфорилирования рецептора Tie-2 (Davis, S., et al., (1996), выше; Maisonpierre, P.C. et al., (1997), выше; Kim, I., J.H. Kim, et al., Oncogene 19(39): 4549-4552 (2000); Teichert-Kuliszewska, K., P.C. Maisonpierre, et al., Cardiovascular research 49(3): 659-70 (2001)).
Фенотипы мышей с нокаутом Tie-2 и Ang-1 являются сходными и предполагают, что Ang-1-стимулируемое фосфорилирование Tie-2 опосредует ремоделирование и стабилизацию сосудов in utero посредством поддержания адгезии эндотелиальных клеток - поддерживающих клеток (Dumont, D.J., et al., Genes & Development, 8:1897-1909 (1994); Sato, T.N., et al., Nature, 376:70-74 (1995); Suri, C., et al., (1996), выше). Считается, что роль Ang-1 в стабилизации сосудов сохраняется у взрослых людей, где он экспрессируется широко и конститутивно (Hanahan, D., Science, 277:48-50 (1997); Zagzag, D., et al., Experimental Neurology, 159:391-400 (1999)). В противоположность этому, экспрессия Ang-2 прежде всего ограничивается местами ремоделирования сосудов, где он, как считают, блокирует функцию Ang-1, индуцируя посредством этого состояние васкулярной пластичности, благоприятной для ангиогенеза (Hanahan, D., выше; Holash, J., et al., Science, 284:1994-1998 (1999); Maisonpierre, P.C., et al., (1997), выше).
Многочисленные опубликованные исследования целенаправленно демонстрировали сосудоселективную экспрессию Ang-2 в патологических состояниях, связанных с ангиогенезом. Эти патологические состояния включают, например, псориаз, дегенерацию желтого пятна и рак (Bunone, G., et al., American Journal of Pathology, 155:1967-1976 (1999); Etoh, T., et al., Cancer Research, 61:2145-2153 (2001); Hangai, M., et al., Investigative Ophthalmology & Visual Science, 42:1617-1625 (2001); Holash, J., et al., (1999) supra; Kuroda, K., et al., Journal of Investigative Dermatology, 116:713-720 (2001); Otani, A., et al., Investigative Ophthalmology & Visual Science, 40:1912-1920 (1999); Stratmann, A., et al., American Journal of Pathology, 153:1459-1466 (1998); Tanaka, S., et al., J Clin Invest, 103:34-345 (1999); Yoshida, Y., et al., International Journal of Oncology, 15:1221-1225 (1999); Yuan, K., et al., Journal of Periodontal Research, 35:165-171 (2000); Zagzag, D., et al., (1999), выше). Большинство из этих исследований фокусировались на раке, причем многие типы опухолей, по-видимому, обнаруживают васкулярную экспрессию Ang-2. В противоположность его экспрессии в патологическом ангиогенезе, экспрессия Ang-2 в нормальных тканях является чрезвычайно ограниченной (Maisonpierre, P.C., et al., (1997), выше, Mezquita, J., et al., Biochemical and Biophysical Research Communications, 260:492-498 (1999)). У здорового взрослого человека этими тремя основными участками ангиогенеза являются яичник, плацента и матка; они являются первичными тканями в нормальных (т.е. не в раковых) тканях, в которых была детектирована мРНК Ang-2.
Некоторые функциональные исследования предполагают, что Ang-2 может участвовать в опухолевом ангиогенезе. Ahmad et al. (Cancer Res., 61:1255-1259 (2001)) описывают сверхэкспрессию Ang-2 и показывают, что она, предположительно, связана с увеличением роста опухоли в мышиной модели ксенотрансплантата. См. также Etoh et al., выше, и Tanaka et al., выше, где представлен результат, предположительно, связывающий сверхэкспрессию Ang-2 с гиперваскулярностью опухоли. Однако, в противоположность этому, Yu et al., (Am. J. Path., 158:563-570 (2001)) сообщают данные, показывающие, что сверхэкспрессия Ang-2 в клетках карциномы легких Lewis и карциномы молочной железы ТА3, по-видимому, пролонгировали выживание мышей, инъецированных соответствующими трансфектантами.
В последние несколько лет различные публикации предлагали Ang-1, Ang-2 и/или Tie-2 в качестве возможной мишени для противораковой терапии. Например, каждый из Патентов США с номерами 6166185, 5650490 и 5814464 описывает концепцию антител против Tie-2-лигандов и антител против Tie-2-рецепторов. Lin et al., (Proc. Natl. Acad. Sci. USA, 95:8829-8834 (1998)) мышам инъецировали аденовирус, экспрессирующий растворимый Tie-2; этот растворимый Tie-2 предположительно уменьшал количество и размер опухолей, развитых у мышей. В родственном исследовании Lin et al. (J. Clin. Invest., 100:2072-2078 (1997)) крысам инъецировали растворимую форму Tie-2; это соединение предположительно уменьшало размер опухоли у крыс. Siemeister et al. (Cancer Res., 59:3185-3189 (1999)) генерировали клеточные линии меланомы человека, экспрессирующие внеклеточный домен Tie-2, инъецировали эти клеточные линии голым мышам и сделали вывод, что растворимый Tie-2 предположительно приводил к «значимому ингибированию» роста опухолей и ангиогенеза опухолей. Ввиду этой информации и вследствие того, что как Ang-1, так и Ang-2 связываются с Tie-2, из этих исследований неясно, может ли Ang-1, Ang-2 или Tie-2 быть привлекательной мишенью для противораковой терапии.
Слияние некоторых пептидов со стабильным белком плазмы, таким как константная область Ig, для улучшения полупериода существования в организме этих молекул было описано, например, в Публикации РСТ WO 00/24782, опубликованной 4 мая 2000 года.
Это слияние белка или его фрагмента со стабильным белком плазмы, таким как константная область Ig, для улучшения полупериода существования в организме этих молекул было много раз описано (см., например, Патент США 5480981; Zheng et al., J. Immunol., 154:5590-5600, (1995); Fisher et al., N. Engl. J. Med., 334:1697-1702, (1996); Van Zee, K. et al., J. Immunol., 156:2221-2230, (1996); Патент США 5808029, выданный 15 сентября 1998; Capon et al., Nature, 337:525-531, (1989); Harvill et al., Immunotech., 1:95-105, (1995); WO 97/23614, опубликованный 3 июля 1997 года; РСТ/US 97/23183, поданный 11 декабря 1997 года; Linsley, J. Exp. Med., 174:561-569, (1991); WO 95/21258, опубликованный 10 августа 1995 года).
Эффективная анти-Ang-2-терапия может быть полезной для огромного числа раковых пациентов, так как большинству солидных опухолей требуется неоваскуляризация для роста за пределы 1-2 миллиметров в диаметре. Такая терапия может иметь широкую применимость также и в других связанных с ангиогенезом заболеваниях, таких как ретинопатии, артрит и псориаз.
Имеется не получившая развития потребность в идентификации новых агентов, которые специфически распознают и связывают Ang-2. Такие агенты могли бы быть применимы для диагностического скрининга и терапевтического вмешательства в патологические состояния, которые связаны с активностью Ang-2.
Таким образом, целью данного изобретения является обеспечение специфических связывающих Ang-2 агентов, которые модулируют активность Ang-2.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Данное изобретение обеспечивает антитело, содержащее тяжелую цепь и легкую цепь, где указанная тяжелая цепь содержит вариабельный район тяжелой цепи, выбранный из группы, состоящей из: 526 HC (SEQ ID NO: 1); 528 HC (SEQ ID NO: 3); 531 HC (SEQ ID NO: 5); 533 HC (SEQ ID NO: 7); 535 HC (SEQ ID NO: 9); 536 HC (SEQ ID NO: 11); 537 HC (SEQ ID NO: 13); 540 HC (SEQ ID NO: 15); 543 HC (SEQ ID NO: 17); 544 HC (SEQ ID NO: 19); 545 HC (SEQ ID NO: 21); 546 HC (SEQ ID NO: 23); 551 HC (SEQ ID NO: 25); 553 HC (SEQ ID NO: 27); 555 HC (SEQ ID NO: 29); 558 HC (SEQ ID NO: 31); 559 HC (SEQ ID NO: 33); 565 HC (SEQ ID NO: 35); F1-C6 HC (SEQ ID NO: 37); FB1-A7 HC (SEQ ID NO: 39); FD-B2 HC (SEQ ID NO: 41); FE-B7 HC (SEQ ID NO: 43); FJ-G11 HC (SEQ ID NO: 45); FK-E3 HC (SEQ ID NO: 47); G1D4 HC (SEQ ID NO: 49); GC1E8 HC (SEQ ID NO: 51); H1C12 HC (SEQ ID NO: 53); IA1-1E7 HC (SEQ ID NO: 55); IF-1C10 HC (SEQ ID NO: 57); IK-2E2 HC (SEQ ID NO: 59); IP-2C11 HC (SEQ ID NO: 61); и его антигенсвязывающие фрагменты; а указанная легкая цепь содержит вариабельный район легкой цепи, выбранный из группы, состоящей из: 526 каппа (SEQ ID NO: 2); 536 (THW) каппа (SEQ ID NO: 12); 536 (LQT) каппа (SEQ ID NO: 210); 543 каппа (SEQ ID NO: 18); 544 каппа (SEQ ID NO: 20); 551 каппа (SEQ ID NO: 26); 553 каппа (SEQ ID NO: 28); 555 каппа (SEQ ID NO: 30); 558 каппа (SEQ ID NO: 32); 565 каппа (SEQ ID NO: 36); FE-B7 каппа (SEQ ID NO: 44); FJ-G11 каппа (SEQ ID NO: 46); FK-E3 каппа (SEQ ID NO: 48); IA1-1E7 каппа (SEQ ID NO: 56); IP-2C11 каппа (SEQ ID NO: 62); 528 лямбда (SEQ ID NO: 4); 531 лямбда (SEQ ID NO: 6); 533 лямбда (SEQ ID NO: 8); 535 лямбда (SEQ ID NO: 10); 537 лямбда (SEQ ID NO: 14); 540 лямбда (SEQ ID NO: 16); 545 лямбда (SEQ ID NO: 22); 546 лямбда (SEQ ID NO: 24); 559 лямбда (SEQ ID NO: 34); F1-C6 лямбда (SEQ ID NO: 38); FB1-A7 лямбда (SEQ ID NO: 40); FD-B2 лямбда (SEQ ID NO: 42); G1D4 лямбда (SEQ ID NO: 50); GC1E8 лямбда (SEQ ID NO: 52); H1C12 лямбда (SEQ ID NO: 54); IF-1C10 лямбда (SEQ ID NO: 58); IK-2E2 лямбда (SEQ ID NO: 60); и его антигенсвязывающие фрагменты.
Данное изобретение обеспечивает также специфический агент связывания, содержащий по меньшей мере один пептид, выбранный из группы, состоящей из: SEQ ID NO: 1; SEQ ID NO: 3; SEQ ID NO: 5; SEQ ID NO: 7; SEQ ID NO: 9; SEQ ID NO: 11; SEQ ID NO: 13; SEQ ID NO: 15; SEQ ID NO: 17; SEQ ID NO: 19; SEQ ID NO: 21; SEQ ID NO: 23; SEQ ID NO: 25; SEQ ID NO: 27; SEQ ID NO: 29; SEQ ID NO: 31; SEQ ID NO: 33; SEQ ID NO: 35; SEQ ID NO: 37; SEQ ID NO: 39; SEQ ID NO: 41; SEQ ID NO: 43; SEQ ID NO: 45; SEQ ID NO: 47; SEQ ID NO: 49; SEQ ID NO: 51; SEQ ID NO: 53; SEQ ID NO: 55; SEQ ID NO: 57; SEQ ID NO: 59; SEQ ID NO: 61; SEQ ID NO: 2; SEQ ID NO: 12; SEQ ID NO: 18; SEQ ID NO: 20; SEQ ID NO: 26; SEQ ID NO: 28; SEQ ID NO: 30; SEQ ID NO: 32; SEQ ID NO: 36; SEQ ID NO: 44; SEQ ID NO: 46; SEQ ID NO: 48; SEQ ID NO: 56; SEQ ID NO: 62; SEQ ID NO: 4; SEQ ID NO: 6; SEQ ID NO: 8; SEQ ID NO: 10; SEQ ID NO: 14; SEQ ID NO: 16; SEQ ID NO: 22; SEQ ID NO: 24; SEQ ID NO: 34; SEQ ID NO: 38; SEQ ID NO: 40; SEQ ID NO: 42; SEQ ID NO: 50; SEQ ID NO: 52; SEQ ID NO: 54; SEQ ID NO: 58 и SEQ ID NO: 60, и его фрагменты.
Должно быть понятно, что специфическим связывающим агентом может быть, например, антитело, такое как поликлональное, моноклональное, химерное, гуманизированное или полностью человеческое антитело. Антителом может быть также одноцепочечное антитело. Кроме того, данное изобретение относится к гибридоме, которая продуцирует моноклональное антитело по данному изобретению.
Должно быть понятно, что данное изобретение относится к конъюгатам, описанным здесь. Конъюгатом может быть, например, специфический связывающий агент (такой как антитело) согласно изобретению.
Кроме того, данное изобретение относится также к молекулам нуклеиновых кислот, кодирующим специфические связывающие агенты (такие как антитело) согласно изобретению, а также к вектору, содержащему такую молекулу нуклеиновой кислоты, а также к клетке-хозяину, содержащей вектор.
Кроме того, данное изобретение обеспечивает способ получения специфического связывающего агента, предусматривающий: (а) трансформацию клетки-хозяина по меньшей мере одной молекулой нуклеиновой кислоты, кодирующей специфический связывающий агент по п. 1; (b) экспрессию молекулы нуклеиновой кислоты в указанной клетке-хозяине и (с) выделение указанного специфического связывающего агента. Кроме того, данное изобретение обеспечивает способ получения антитела, предусматривающий: (а) трансформацию клетки-хозяина по меньшей мере одной молекулой нуклеиновой кислоты, кодирующей антитело в соответствии с данным изобретением; (b) экспрессию молекулы нуклеиновой кислоты в указанной клетке-хозяине и (с) выделение указанного связывающего агента.
Кроме того, данное изобретение относится к способу ингибирования нежелательного ангиогенеза у млекопитающего введением терапевтически эффективного количества специфического связывающего агента в соответствии с данным изобретением. Данное изобретение обеспечивает также способ лечения рака у млекопитающего введением терапевтически эффективного количества специфического связывающего агента в соответствии с данным изобретением.
Данное изобретение относится также к способу ингибирования нежелательного ангиогенеза у млекопитающего, предусматривающему введение терапевтически эффективного количества антитела в соответствии с данным изобретением. Кроме того, обеспечивает также способ лечения рака у млекопитающего, предусматривающий введение терапевтически эффективного количества антитела в соответствии с данным изобретением.
Должно быть понятно, что данное изобретение относится, кроме того, к фармацевтическим композициям, содержащим специфический связывающий агент в соответствии с данным изобретением и фармацевтически приемлемый агент для приготовления композиции. Фармацевтическая композиция может содержать антитело в соответствии с данным изобретением и фармацевтически приемлемый агент для приготовления композиции.
Данное изобретение обеспечивает способ модуляции или ингибирования активности ангиопоэтина-2 введением одного или нескольких специфических связывающих агентов данного изобретения. Данное изобретение обеспечивает также способ модуляции или ингибирования активности ангиопоэтина-2 введением антитела согласно изобретению.
Кроме того, данное изобретение относится к способу модуляции по меньшей мере одного свойства из васкулярной проницаемости или утечки плазмы у млекопитающего, предусматривающему введение терапевтически эффективного количества специфического связывающего агента в соответствии с данным изобретением. Данное изобретение относится также к способу лечения по меньшей мере одного заболевания из глазного неоваскулярного заболевания, ожирения, гемангиобластомы, гемангиомы, артериосклероза, воспалительного заболевания, воспалительных нарушений, атеросклероза, эндометриоза, неопластического заболевания, связанного с костями заболевания или псориаза у млекопитающего, предусматривающему введение терапевтически эффективного количества специфического связывающего агента в соответствии с данным изобретением.
Кроме того, данное изобретение обеспечивает способ модуляции по меньшей мере одного свойства из васкулярной проницаемости или утечки плазмы у млекопитающего, предусматривающий введение терапевтически эффективного количества антитела в соответствии с данным изобретением. Данное изобретение относится также к способу лечения по меньшей мере одного заболевания из глазного неоваскулярного заболевания, ожирения, гемангиобластомы, гемангиомы, артериосклероза, воспалительного заболевания, воспалительных нарушений, атеросклероза, эндометриоза, неопластического заболевания, связанного с костями заболевания или псориаза у млекопитающего, предусматривающему введение терапевтически эффективного количества антитела в соответствии с данным изобретением.
Кроме того, данное изобретение относится к способу лечения рака у млекопитающего, предусматривающему введение терапевтически эффективного количества специфического связывающего агента в соответствии с данным изобретением и химиотерапевтического агента. Специалистам в данной области должно быть понятно, что специфический связывающий агент и химиотерапевтический агент не должны обязательно вводиться одновременно.
Данное изобретение относится также к способу лечения рака у млекопитающего, предусматривающему введение терапевтически эффективного количества антитела в соответствии с данным изобретением и химиотерапевтического агента. Антитело и химиотерапевтический агент не должны обязательно вводиться одновременно.
Данное изобретение обеспечивает также специфический связывающий агент, содержащий определяющий комплементарность район 1 (CDR 1) любой из следующих последовательностей: 526 HC (SEQ ID NO: 1); 528 HC (SEQ ID NO: 3); 531 HC (SEQ ID NO: 5); 533 HC (SEQ ID NO: 7); 535 HC (SEQ ID NO: 9); 536 HC (SEQ ID NO: 11); 537 HC (SEQ ID NO: 13); 540 HC (SEQ ID NO: 15); 543 HC (SEQ ID NO: 17); 544 HC (SEQ ID NO: 19); 545 HC (SEQ ID NO: 21); 546 HC (SEQ ID NO: 23); 551 HC (SEQ ID NO: 25); 553 HC (SEQ ID NO: 27); 555 HC (SEQ ID NO: 29); 558 HC (SEQ ID NO: 31); 559 HC (SEQ ID NO: 33); 565 HC (SEQ ID NO: 35); F1-C6 HC (SEQ ID NO: 37); FB1-A7 HC (SEQ ID NO: 39); FD-B2 HC (SEQ ID NO: 41); FE-B7 HC (SEQ ID NO: 43); FJ-G11 HC (SEQ ID NO: 45); FK-E3 HC (SEQ ID NO: 47); G1D4 HC (SEQ ID NO: 49); GC1E8 HC (SEQ ID NO: 51); H1C12 HC (SEQ ID NO: 53); IA1-1E7 HC (SEQ ID NO: 55); IF-1C10 HC (SEQ ID NO: 57); IK-2E2 HC (SEQ ID NO: 59); IP-2C11 HC (SEQ ID NO: 61); 526 каппа (SEQ ID NO: 2); 536 (THW) каппа (SEQ ID NO: 12); 536 (LQT) каппа (SEQ ID NO: 210); 543 каппа (SEQ ID NO: 18); 544 каппа (SEQ ID NO: 20); 551 каппа (SEQ ID NO: 26); 553 каппа (SEQ ID NO: 28); 555 каппа (SEQ ID NO: 30); 558 каппа (SEQ ID NO: 32); 565 каппа (SEQ ID NO: 36); FE-B7 каппа (SEQ ID NO: 44); FJ-G11 каппа (SEQ ID NO: 46); FK-E3 каппа (SEQ ID NO: 48); IA1-1E7 каппа (SEQ ID NO: 56); IP-2C11 каппа (SEQ ID NO: 62); 528 лямбда (SEQ ID NO: 4); 531 лямбда (SEQ ID NO: 6); 533 лямбда (SEQ ID NO: 8); 535 лямбда (SEQ ID NO: 10); 537 лямбда (SEQ ID NO: 14); 540 лямбда (SEQ ID NO: 16); 545 лямбда (SEQ ID NO: 22); 546 лямбда (SEQ ID NO: 24); 559 лямбда (SEQ ID NO: 34); F1-C6 лямбда (SEQ ID NO: 38); FB1-A7 лямбда (SEQ ID NO: 40); FD-B2 лямбда (SEQ ID NO: 42); G1D4 лямбда (SEQ ID NO: 50); GC1E8 лямбда (SEQ ID NO: 52); H1C12 лямбда (SEQ ID NO: 54); IF-1C10 лямбда (SEQ ID NO: 58) и IK-2E2 лямбда (SEQ ID NO: 60).
Данное изобретение обеспечивает также специфический связывающий агент, содержащий определяющий комплементарность район 2 (CDR 2) любой из следующих последовательностей: 526 HC (SEQ ID NO: 1); 528 HC (SEQ ID NO: 3); 531 HC (SEQ ID NO: 5); 533 HC (SEQ ID NO: 7); 535 HC (SEQ ID NO: 9); 536 HC (SEQ ID NO: 11); 537 HC (SEQ ID NO: 13); 540 HC (SEQ ID NO: 15); 543 HC (SEQ ID NO: 17); 544 HC (SEQ ID NO: 19); 545 HC (SEQ ID NO: 21); 546 HC (SEQ ID NO: 23); 551 HC (SEQ ID NO: 25); 553 HC (SEQ ID NO: 27); 555 HC (SEQ ID NO: 29); 558 HC (SEQ ID NO: 31); 559 HC (SEQ ID NO: 33); 565 HC (SEQ ID NO: 35); F1-C6 HC (SEQ ID NO: 37); FB1-A7 HC (SEQ ID NO: 39); FD-B2 HC (SEQ ID NO: 41); FE-B7 HC (SEQ ID NO: 43); FJ-G11 HC (SEQ ID NO: 45); FK-E3 HC (SEQ ID NO: 47); G1D4 HC (SEQ ID NO: 49); GC1E8 HC (SEQ ID NO: 51); H1C12 HC (SEQ ID NO: 53); IA1-1E7 HC (SEQ ID NO: 55); IF-1C10 HC (SEQ ID NO: 57); IK-2E2 HC (SEQ ID NO: 59); IP-2C11 HC (SEQ ID NO: 61); 526 каппа (SEQ ID NO: 2); 536 (THW) каппа (SEQ ID NO: 12); 536 (LQT) каппа (SEQ ID NO: 210); 543 каппа (SEQ ID NO: 18); 544 каппа (SEQ ID NO: 20); 551 каппа (SEQ ID NO: 26); 553 каппа (SEQ ID NO: 28); 555 каппа (SEQ ID NO: 30); 558 каппа (SEQ ID NO: 32); 565 каппа (SEQ ID NO: 36); FE-B7 каппа (SEQ ID NO: 44); FJ-G11 каппа (SEQ ID NO: 46); FK-E3 каппа (SEQ ID NO: 48); IA1-1E7 каппа (SEQ ID NO: 56); IP-2C11 каппа (SEQ ID NO: 62); 528 лямбда (SEQ ID NO: 4); 531 лямбда (SEQ ID NO: 6); 533 лямбда (SEQ ID NO: 8); 535 лямбда (SEQ ID NO: 10); 537 лямбда (SEQ ID NO: 14); 540 лямбда (SEQ ID NO: 16); 545 лямбда (SEQ ID NO: 22); 546 лямбда (SEQ ID NO: 24); 559 лямбда (SEQ ID NO: 34); F1-C6 лямбда (SEQ ID NO: 38); FB1-A7 лямбда (SEQ ID NO: 40); FD-B2 лямбда (SEQ ID NO: 42); G1D4 лямбда (SEQ ID NO: 50); GC1E8 лямбда (SEQ ID NO: 52); H1C12 лямбда (SEQ ID NO: 54); IF-1C10 лямбда (SEQ ID NO: 58) и IK-2E2 лямбда (SEQ ID NO: 60).
Данное изобретение обеспечивает также специфический связывающий агент, содержащий определяющий комплементарность район 3 (CDR 3) любой из следующих последовательностей: 526 HC (SEQ ID NO: 1); 528 HC (SEQ ID NO: 3); 531 HC (SEQ ID NO: 5); 533 HC (SEQ ID NO: 7); 535 HC (SEQ ID NO: 9); 536 HC (SEQ ID NO: 11); 537 HC (SEQ ID NO: 13); 540 HC (SEQ ID NO: 15); 543 HC (SEQ ID NO: 17); 544 HC (SEQ ID NO: 19); 545 HC (SEQ ID NO: 21); 546 HC (SEQ ID NO: 23); 551 HC (SEQ ID NO: 25); 553 HC (SEQ ID NO: 27); 555 HC (SEQ ID NO: 29); 558 HC (SEQ ID NO: 31); 559 HC (SEQ ID NO: 33); 565 HC (SEQ ID NO: 35); F1-C6 HC (SEQ ID NO: 37); FB1-A7 HC (SEQ ID NO: 39); FD-B2 HC (SEQ ID NO: 41); FE-B7 HC (SEQ ID NO: 43); FJ-G11 HC (SEQ ID NO: 45); FK-E3 HC (SEQ ID NO: 47); G1D4 HC (SEQ ID NO: 49); GC1E8 HC (SEQ ID NO: 51); H1C12 HC (SEQ ID NO: 53); IA1-1E7 HC (SEQ ID NO: 55); IF-1C10 HC (SEQ ID NO: 57); IK-2E2 HC (SEQ ID NO: 59); IP-2C11 HC (SEQ ID NO: 61); 526 каппа (SEQ ID NO: 2); 536 (THW) каппа (SEQ ID NO: 12); 536 (LQT) каппа (SEQ ID NO: 210) 543 каппа (SEQ ID NO: 18); 544 каппа (SEQ ID NO: 20); 551 каппа (SEQ ID NO: 26); 553 каппа (SEQ ID NO: 28); 555 каппа (SEQ ID NO: 30); 558 каппа (SEQ ID NO: 32); 565 каппа (SEQ ID NO: 36); FE-B7 каппа (SEQ ID NO: 44); FJ-G11 каппа (SEQ ID NO: 46); FK-E3 каппа (SEQ ID NO: 48); IA1-1E7 каппа (SEQ ID NO: 56); IP-2C11 каппа (SEQ ID NO: 62); 528 лямбда (SEQ ID NO: 4); 531 лямбда (SEQ ID NO: 6); 533 лямбда (SEQ ID NO: 8); 535 лямбда (SEQ ID NO: 10); 537 лямбда (SEQ ID NO: 14); 540 лямбда (SEQ ID NO: 16); 545 лямбда (SEQ ID NO: 22); 546 лямбда (SEQ ID NO: 24); 559 лямбда (SEQ ID NO: 34); F1-C6 лямбда (SEQ ID NO: 38); FB1-A7 лямбда (SEQ ID NO: 40); FD-B2 лямбда (SEQ ID NO: 42); G1D4 лямбда (SEQ ID NO: 50); GC1E8 лямбда (SEQ ID NO: 52); H1C12 лямбда (SEQ ID NO: 54); IF-1C10 лямбда (SEQ ID NO: 58) и IK-2E2 лямбда (SEQ ID NO: 60).
Кроме того, данное изобретение обеспечивает молекулу нуклеиновой кислоты, кодирующую специфический связывающий агент в соответствии с данным изобретением.
Кроме того, данное изобретение относится к способу детектирования уровня ангиопоэтина-2 в биологической пробе (а) контактированием специфического связывающего агента согласно изобретению с пробой и (b) определением степени связывания специфического связывающего агента с пробой. Данное изобретение относится также к способу детектирования уровня ангиопоэтина-2 в биологической пробе (а) контактированием антитела согласно изобретению с пробой и (b) определением степени связывания антитела с пробой.
Данное изобретение относится также к способу ингибирования нежелательного ангиогенеза у млекопитающего, предусматривающему введение терапевтически эффективного количества полипептида или композиции, описанных здесь. Данное изобретение относится также к способу модуляции ангиогенеза у млекопитающего, предусматривающему введение терапевтически эффективного количества полипептида или композиции, описанных здесь. Данное изобретение относится также к способу ингибирования роста опухоли, характеризующейся нежелательным ангиогенезом, у млекопитающего, предусматривающему введение терапевтически эффективного количества полипептида или композиции, описанных здесь. Кроме того, данное изобретение относится к способу лечения рака у млекопитающего, предусматривающему введение терапевтически эффективного количества полипептида или композиции, описанных здесь, и химиотерапевтического агента. В предпочтительном варианте осуществления, этим химиотерапевтическим агентом является по меньшей мере один из 5-FU, СРТ-11 и Таксотер. Однако должно быть понятно, что могут быть использованы и другие подходящие химиотерапевтические агенты и другие противораковые терапии.
Будет понятно, что специфические связывающие агенты данного изобретения могут быть использованы для лечения ряда заболеваний, связанных с нерегулируемым или нежелательным ангиогенезом. Такие заболевания включают, но не ограничиваются ими, глазную неоваскуляризацию, такую как ретинопатия (в том числе диабетическую ретинопатию и связанную с возрастом дегенерацию желтого пятна), псориаз, гемангиобластому, гемангиому, артериосклероз, воспалительное заболевание, такое как ревматоидное или ревматическое воспалительное заболевание, в частности, артрит (в том числе ревматоидный артрит), или другие хронические воспалительные нарушения, такие как хроническая астма, артериальный или посттрансплантационный атеросклероз, эндометриоз, и неопластические заболевания, например, так называемые солидные опухоли и жидкостные опухоли (такие как лейкозы). Специалистам в данной области будут очевидными дополнительные заболевания, которые можно лечить введением специфических связывающих агентов. Такие дополнительные заболевания включают, но не ограничиваются ими, ожирение, васкулярную проницаемость, утечку плазмы и связанные с костями нарушения, в том числе остеопороз. Таким образом, кроме того, данное изобретение относится к способам лечения этих заболеваний, связанных с нерегулируемым или нежелательным ангиогенезом.
Другие варианты осуществления этого изобретения будут очевидными из представленного здесь описания.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Фигура 1 изображает график размера опухоли (y-ось) в зависимости от времени (х-ось) в несущих опухоль мышах, которых обрабатывали либо анти-Ang-2-антителом (клон 533, 537 или 544) согласно изобретению, либо контрольным антителом, либо забуференным фосфатом солевым раствором (PBS). Подробности описаны в Примерах.
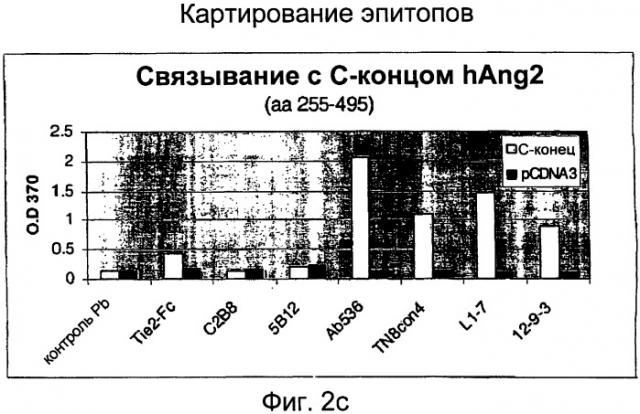
Фигуры 2а, 2в и 2с изображают результаты картирования эпитопов (OD 370) для полноразмерного Ang-2 человека (hAng-2), относительно N-конца hAng-2 и С-конца hAng-2, соответственно, для пептидных антител TN8-Con4-C, L1-7-N и 12-9-3-С в соответствии с данным изобретением, а также для контрольного пептидного антитела, Tie2-Fc, С2В8 или 5В12. Подробности описаны в Примерах.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Заголовки разделов используют здесь только для организационных целей, и они не должны пониматься как ограничивающие каким-либо образом описанный предмет изобретения.
Для получения рекомбинантной молекулы ДНК, белка и антитела, а также для культуры ткани и трансформации клеток могут быть использованы стандартные способы. Ферментативные реакции и способы очистки обычно выполняют в соответствии с описаниями изготовителя или, как обычно выполняют в данной области с использованием общепринятых процедур, таких как процедуры, описанные в Sambrook et al. (Molecular Cloning: A Laboratory Manual. Cold Spring Harbor, Laboratory Press, Cold Spring Harbor, NY (1989)), или как описано здесь. Если нет особых определений, используемая номенклатура и лабораторные процедуры и способы аналитической химии, синтетической органической химии и медицинской и фармацевтической химии, описанные здесь, являются хорошо известными и обычно используемыми в данной области. Стандартные способы могут быть использованы для химических синтезов, химических анализов, фармацевтического приготовления, получения готовых форм и доставки, а также лечения пациентов.
Определения
В контексте данного изобретения, следующие термины, если нет других указаний, должны пониматься, как имеющие следующие значения.
Термин «Ang-2» относится к полипептиду, представленному на фигуре 6 Патента США № 6166185 (“Tie-2-лиганд-2”), или его фрагментам, а также родственным полипептидам, которые включают аллельные варианты, сплайсинговые варианты, производные, варианты, имеющие замены, делеции и/или инсерции, слитые пептиды и полипептиды и межвидовые гомологи. Полипептид Ang-2 может включать или может не включать дополнительные концевые остатки, например, лидерные последовательности, нацеливающие последовательности, аминоконцевой метионин, аминоконцевые остатки метионина и лизина и/или метку или последовательности слитых белков, в зависимости от способа их приготовления.
Термин «биологически активный» в применении относительно Ang-2 или Ang-2-специфического связывающего агента относится к пептиду или полипептиду, имеющему по меньшей мере одну характеристику активности Ang-2 или Ang-2-специфического связывающего агента. Специфический связывающий Ang-2 агент может иметь агонистическую, антагонистическую или нейтрализующую или блокирующую активность в отношении по меньшей мере одной биологической активности Ang-2.
Термин «специфический связывающий агент» относится к молекуле, предпочтительно белковой молекуле, которая связывает Ang-2 (и его варианты и производные, определенные здесь) с более высокой аффинностью, чем другие ангиопоэтины. Специфическим связывающим агентом может быть белок, пептид, нуклеиновая кислота, углевод, липид или соединение с малой молекулярной массой, которое связывается преимущественно с Ang-2. В предпочтительном варианте осуществления, специфическим связывающим агентом в соответствии с данным изобретением является антитело, такое как поликлональное антитело, моноклональное антитело (mAb), химерное антитело, CDR-трансплантированное антитело, мультиспецифическое антитело, биспецифическое антитело, каталитическое антитело, гуманизированное антитело, антитело человека, идиотипическое (анти-Id) антитело и антитела, которые могут быть мечеными, в растворимой или связанной форме, а также их фрагменты, варианты или производные, либо по отдельности, либо в комбинации с другими аминокислотными последовательностями, обеспеченные известными способами. Такие способы включают, но не ограничиваются ими, ферментативное расщепление, химическое расщепление, пептидный синтез или рекомбинантные способы. Анти-Ang-2-специфические связывающие агенты данного изобретения способны связывать части Ang-2, которые модулируют, например, ингибируют или стимулируют, биологическую активность Ang-2 и/или другие Ang-2-ассоциированные активности.
Термин «поликлональное антитело» относится к гетерогенной смеси антител, которые распознают различные эпитопы на одном и том же антигене и связываются с ними. Поликлональные антитела могут быть получены из неочищенных препаратов сыворотки или могут быть очищены с использованием, например, антиген-аффинной хроматографии или Белок А/Белок G-аффинной хроматографии.
Термин «моноклональные антитела» относится к скоплению антител, кодируемых одной и той же молекулой нуклеиновой кислоты, которые необязательно продуцируются единственной гибридомой или другой клеточной линией или трансгенным животным, так что каждое моноклональное антитело будет обычно распознавать один и тот же эпитоп на антигене. Термин «моноклональное» не ограничивается каким-либо конкретным способом для получения антитела и не является термином, ограничивающимся антителами, продуцируемыми в конкретном виде, например, мыши, крысе и т.д.
Термин «химерные антитела» относится к антителам, в которых часть тяжелой и/или легкой цепи является идентичной или гомологичной соответствующей последовательности в антителе, полученном из конкретного вида или принадлежащем к конкретному классу или подклассу антител, тогда как остаток этой цепи (этих цепей) является идентичным или гомологичным соответствующей последовательности в антителах, полученных из другого вида или принадлежащих к другому классу или подклассу антител. Включены также фрагменты таких антител, которые проявляют желаемую биологическую активность (т.е. способность специфически связывать Ang-2). См. Патент США № 4816567 и Morrison et al., Proc Natl Acad Sci (USA), 81:6851-6855 (1985).
Термин «CDR-трансплантированное антитело» относится к антителу, в котором CDR из одного антитела конкретного вида или изотипа рекомбинантно встроено в каркас другого антитела того же самого или другого вида или изотипа.
Термин «мультиспецифическое антитело» относится к антителу, имеющему вариабельные области, которые распознают более чем один эпитоп на одном или нескольких антигенах. Подклассом этого типа антитела является «биспецифическое антитело», которое узнает два разных эпитопа на одном и том же или различных антигенах.
«Каталитические антитела» обозначают антитела, в которых одна или несколько цитотоксических или более часто одна или несколько биологически активных частей молекул присоединены к нацеливающему связывающему агенту.
Термин «гуманизированное антитело» относится к конкретному типу CDR-трансплантированного антитела, в котором каркасная область антитела получена из человека, но каждый CDR заменен CDR, полученным из другого вида, например, мышиным CDR. Термин «CDR» определен ниже.
Термин «полностью человеческое» антитело обозначает антитело, в котором как CDR, так и каркасная область происходят из одной или нескольких ДНК-молекул человека.
Термин «антиидиотипическое» антитело обозначает любое антитело, которое специфически связывается с другим антителом, которое распознает антиген. Получение антиидиотипических антител может выполняться любым из описанных здесь способов получения Ang-2-специфических антител, за исключением того, что эти антитела получают, например, иммунизацией животного Ang-2-специфическим антителом или его Ang-2-связывающим фрагментом, а не самим Ang-2-полипептидом или его фрагментом.
Термин «варианты» включает в данном контексте те полипептиды, в которых аминокислотные остатки встроены в природную (или по меньшей мере известную) аминокислотную последовательность связывающего агента, делетированы из этой аминокислотной последовательности или заменены в этой аминокислотной последовательности. Варианты данного изобретения включают слитые белки, описанные ниже.
«Производные» включают связывающие агенты, которые были химически модифицированы некоторым образом, отличающиеся от вариантов с инсерцией, делецией или заменой.
«Специфически связывает Ang-2» обозначает способность специфического связывающего агента (такого как антитело или его фрагмент) согласно изобретению распознавать и связывать зрелый, полноразмерный или имеющий частичную длину полипептид Ang-2, или его ортолог, так что его аффинность (определенная, например, при помощи анализов ELISA или BIAcore, описанных здесь) или способность нейтрализации (определенная, например, анализами нейтрализации ELISA, описанными здесь, или сходными анализами) является по меньшей мере в 10 раз более высокой, но необязательно в 50 раз более высокой, в 100, 250 или 500 раз более высокой, или даже по меньшей мере в 1000 раз более высокой, чем аффинность или способность нейтрализации специфического связывающего агента в отношении любого другого ангиопоэтина или другого пептида или полипептида.
Термин «антигенсвязывающий домен» или «антигенсвязывающая область» относится к той части специфического связывающего агента (такого как молекула антитела), которая содержит аминокислотные остатки (или другие части молекулы) специфического связывающего агента, которые взаимодействуют с антигеном и придают этому связывающему агенту его специфичность и аффинность в отношении этого антигена. В антителе антигенсвязывающий домен обычно называют «определяющей комплементарность областью, или CDR».
Термин «эпитоп» обозначает часть любой молекулы, способной быть распознаваемой и быть связанной специфическим связывающим агентом, например, антителом, в одной или нескольких антигенсвязывающих областях агента. Эпитопы обычно состоят из химически активных поверхностных группировок молекул, таких как, например, боковые цепи аминокислот или углеводов, и имеют специфические трехмерные структурные характеристики, а также специфические характеристики зарядов. Эпитопы в данном контексте могут быть смежными или несмежными. Кроме того, эпитопы могут быть миметическими в том смысле, что они содержат трехмерную структуру, которая идентична эпитопу, использованному для генерирования антитела, но все-таки не содержит ни один из аминокислотных остатков или содержит только некоторые из аминокислотных остатков, обнаруживаемых в Ang-2, используемом для стимуляции иммунной реакции в виде антител.
Термин «ингибирующий и/или нейтрализующий эпитоп» обозначает эпитоп, который при связывании специфическим связывающим агентом, таким как антитело, приводит к потере (или по меньшей мере уменьшению) биологической активности молекулы, клетки или организма, содержащих такой эпитоп, in vivo, in vitro или in situ. В контексте данного изобретения, нейтрализующий эпитоп локализован на биологически активном районе Ang-2 или связан с биологически активным районом Ang-2. Альтернативно, термин «активирующий эпитоп» обозначает эпитоп, который при связывании специфическим связывающим агентом, таким как антитело, приводит к активации или по меньшей мере поддержанию биологически активной конформации Ang-2.
Термин «фрагмент антитела» относится к пептиду или полипептиду, который содержит меньше, чем полное, интактное антитело. Полные антитела содержат две функционально независимые части или два фрагмента: антигенсвязывающий фрагмент, известный как «Fab», и карбокси-концевой кристаллизуемый фрагмент, известный как «Fc»-фрагмент. Fab-фрагмент включает первый константный домен, состоящий как из тяжелой, так и из легкой цепи (СН1 и CL1) вместе с вариабельными районами как из тяжелой, так и из легкой цепи, которые связывают специфический антиген. Каждый и