Штамм вируса гепатита а для приготовления вакцинных и диагностических препаратов
Иллюстрации
Показать всеИзобретение относится к биотехнологии и касается получения быстрорастущего штамма вируса гепатита А (ВГА). Этот штамм может быть использован в профилактических и диагностических целях в медицине. Техническим результатом предлагаемого изобретения является создание штамма-продуцента с более высокой продуктивностью антигена ВГА и с более короткими сроками культивирования ВГА. Указанный технический результат достигается созданием штамма № ВБА-07 для приготовления вакцинных и диагностических препаратов. Штамм № ВБА-07 превосходит штамм-прототип как по продуктивности (количеству инфекционного вируса и вируспецифического антигена) и по кинетике накопления антигена ВГА, так и по времени культивирования. Штамм депонирован в Коллекции культур микроорганизмов ЗАО «Вектор-БиАльгам» и зарегистрирован под № VВ-17. 4 ил., 6 табл.
Реферат
Изобретение относится к медицинской вирусологии и касается получения быстрорастущего штамма вируса гепатита А (ВГА). Этот штамм может быть использован в профилактических и диагностических целях в медицине.
Известно получение штамма ВГА из клинического материала с последующим выращиванием на культуре клеток AGMK (первичные клетки почки африканской зеленой обезьяны). Такой штамм НМ-175 получен Deamer и соавт (патент США №4532215, МПК А61К 39/29, опубл. 30.07.1985). Штамм прошел несколько серийных пассажей.
Однако такой штамм обеспечивает получение заметного количества антигена только после 21 дня культивирования на культуре клеток AGMK при отсутствии цитопатического эффекта. Отсутствие цитопатического эффекта затрудняет технологический контроль за процессом культивирования и предполагает использование трудоемких методов определения концентрации вируса в материале.
Известен штамм ВГА № YN5, адаптированный к клеткам Vero, рекомендуемый для приготовления инактивированных вакцин против ВГА (патент Китая №1443844, МПК C12N 7/01, опубл. 24.09.2003 г.).
Известен отечественный штамм ВГА ГКВ-801 (авторское свид. СССР №1606533, МПК C12N 7/00, опубл.15.11.1990 г.), нарабатываемый на культуре клеток FRhK-4.
Недостатком указанных штаммов является также отсутствие цитопатического эффекта при их культивировании и длительность культивирования (более 8 суток).
Известен штамм virus hepatitis A hominis № Ген А-293 для приготовления вакцинных и диагностических препаратов, который получен путем адаптации штамма ВГА МБ-7 к культуре клеток почки эмбриона человека №293. В результате адаптации указанного штамма он приобрел новые свойства, обеспечивающие сокращение сроков культивирования ВГА на 5-6 дней и повышение выхода антигена (патент РФ №2306336, МПК C12N 7/00, опубл. 20.03.2007 г.).
Недостатком данного штамма ВГА является то, что он адаптирован к культуре клеток 293 - трансформированные ДНК аденовируса (Ад5) клетки почки эмбриона человека, которые содержат и экспрессируют трансформирующие гены аденовируса пятого типа, недостаточно изучены органами стандартизации Минздрава Российской Федерации при производстве вирусных вакцин, что затрудняет использование этих клеток в указанных целях. Кроме того, культура клеток 293 (по данным некоторых исследований) может оказывать онкогенное действие, что ограничивает сферу ее применения, в частности, при производстве вакцин.
Наиболее близким аналогом (прототипом) является штамм ВГА МБ-7, который депонирован под №213 в коллекции Государственного института стандартизации и контроля медицинских и биологических препаратов им. Л.А.Тарасевича (патент РФ №1806190, МПК C12N 7/00, опубл. 30.03.93 г.). Штамм получен из фекалий больного с клинически выраженными признаками гепатита А в 1988 г. Приготовленную 10% суспензию фекалий на 0,1 М Na-фосфатном буфере (рН 7,4) ресуспендируют, центрифугируют в течение 10 мин при 1500-2000 об/мин. Супернатант фильтруют через фильтр 0,22 мкм (производство Millipore), фасуют по 0,5 мл в стерильные флаконы и хранят при температуре (минус 7,0±0.5)°С. Полученный супернатант используют в качестве инокулята для получения штамма ВГА на клетках FRhK-4. На сформированный монослой клеток FRhK-4 наносят инокулят. После адсорбции в сосуд добавляют ростовую поддерживающую среду. Через неделю после заражения культуральную жидкость сливают, клетки промывают раствором трипсина-версена и отслоившиеся клетки собирают в натрий-солевом фосфатном буфере. Собранные клетки трижды промораживают и клеточный лизат используют в качестве инокулята для следующего пассажа. Уже на втором пассаже в клетках FRhK-4 выявляется антиген. Антиген также выявляется в процессе адаптации полученного штамма к перевиваемой культуре клеток почки зеленой мартышки 4647 и диплоидной культуре клеток легкого человека Л-68.
Недостатком штамма-прототипа является то, что он имеет недостаточную продукцию антигена на тех культурах клеток, к которым он адаптирован, в частности к клеткам 4647, а также достаточно длительное время культивирования (11-12 суток) при наработке вирусного антигена.
Техническим результатом предлагаемого изобретения является создание штамма-продуцента с более высокой продуктивностью антигена ВГА и с более короткими сроками культивирования ВГА, нарабатываемого на культуре клеток почки зеленой мартышки 4647, аттестованной и лицензированной для производства вакцин, т.е. разрешенной для использования в производстве иммунопрофилактических средств.
Указанный технический результат достигается получением нового штамма ВГА № ВБА-07, обладающего более высокой продуктивностью антигена ВГА и с более короткими сроками культивирования ВГА, нарабатываемого на культуре клеток почки зеленой мартышки 4647.
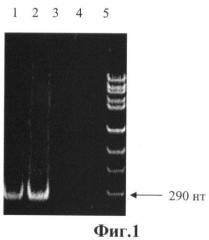
На фиг.1 приведены данные ПНР-анализа геномных РНК шт. ВБА-07 и МБ-7, где: дорожка 1 - в качестве матрицы при проведении ПНР использовали кДНК, синтезированную с вирусной РНК, выделенной из инфицированных шт. МБ-7 клеток 46-47; дорожка 2 - в качестве матрицы использовали кДНК, синтезированную с вирусной РНК, выделенной из инфицированных шт. ГепА293 клеток 293; дорожки 3 и 4 - в качестве матрицы использовали кДНК, синтезированные с клеточной РНК неинфицированных клеток 4647 (отрицательный контроль); дорожка 5 - маркер молекулярной массы.
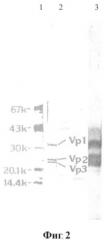
На Фиг.2 - данные SDS-PAG электрофореза очищенного шт. ВБА-07 и иммуноблоттинг со специфичными к ВГА иммуноглобулинами, где: 1 - стандарты молекулярной массы: альбумин (67000 [67k]), овальбумин (43000), карбоангидраза (30000), ингибитор трипсина (20100) и лактаальбумин (14400); 2 - SDS-PAG электрофорез очищенного шт. ВБА-07; 3 - иммуноблоттинг со специфичными к ВГА иммуноглобулинами (вирусные антигены выявляли мышиной антисывороткой в разведении 1/200).
На фиг.3а, б, в приведена нуклеотидная последовательность генов VP1, 2А, 2В и 2С шт. ВБА-07 в сравнении с последовательностями соответствующей области генома штаммов МБ-7 и ЛВА-86.
На фиг.4а, б приведена аминокислотная последовательность белков VP1, 2А, 2В и 2С шт. ВБА-07 в сравнении с последовательностями соответствующих белков штаммов МБ-7, ЛВА-86 и НМ-175.
Характеристика клеточной культуры 4647
Клетки 4647 (перевиваемые клетки почек зеленой мартышки) получены путем серийных пассажей из клеток посевного банка, хранящегося в ИПВЭ РАМН и аттестованы во ФГУН ГНЦ ВБ «Вектор» Роспотребнадзора и ГИСК им. Л.А.Тарасевича для производства вакцинных препаратов. Линия клеток 4647 адаптирована к среде Игла MEM с добавлением 10% сыворотки крупного рогатого скота и представляет собой монослойную культуру, состоящую в основном из эпителиоподобных с небольшим количеством фибробластоподобных клеток. После сформирования монослоя на 3-4 сутки клетки перевиваются 1:3-1:4. Сохраняется культура обычным замораживанием, после восстановления жизнеспособность определяется на уровне 82-85%. Рабочий банк клеток 4647 приготовлен на уровне 101 пассажа в количестве 150 ампул по 4 млн клеток в каждой ампуле. Видовая принадлежность клеток (клетки зеленой мартышки) подтверждена кариологической характеристикой, присутствием маркерных хромосом и изучением изоферментов, электрофоретическая подвижность которых в полиакриламидном геле относится к "быстрому" типу, характерному для клеток приматов. В ГИСК проведено изучение рабочего банка клеток на отсутствие посторонних агентов и онкогенность. Культуральная жидкость после культивирования клеток в течение 14 дней была внесена в культуру диплоидных клеток человека и первично-трипсинизированную культуру почек зеленой мартышки, клетки были инокулированы животным (кроликам, морским свинкам, новорожденным и взрослым белым мышам) и куриным эмбрионам. Посторонние вирусы обнаружены не были. При изучении клеток в органной культуре кожи куриного эмбриона туморогенных потенций выявлено не было. Изучение клеток в течение 5 пассажей без антибиотиков цитохимическим методом (окраска ДНК флиорохромом) выявило единичные светящиеся гранулы в межклеточных пространствах и на мембране цитоплазмы, по размеру и форме и локализации напоминающие микоплазмы. Однако при посеве клеток на полужидкую среду (микробиологический метод) микоплазмы выявить не удалось. Такое же исследование клеток 4647 проведено в контрольной международной лаборатории Великобритании (Лондон) микробиологическим методом и с помощью генной пробы и получено заключение об отсутствии в них микоплазм. На основании проведенных исследований установлено, что рабочий банк клеток 4647, приготовленный на уровне 101 пассажа из посевных клеток ИПВЭ РАМН, может быть использован для производства вакцины против гепатита А, учитывая, что препарат в процессе производства проходит очистку и подвергается инактивации.
Штамм ВГА № ВБА-07 депонирован под регистрационным № VB-07 в коллекции культур микроорганизмов ЗАО «Вектор-БиАльгам» (справка №27 от 17 июля 2007 г. о депонировании штамма прилагается).
Первый этап работы со штаммом. Для получения нового быстрорастущего штамма ВБА-07 были проведены дополнительные работы по пассированию исходного штамма МБ-7 на культуре клеток линии 4647. Инокулят наносили на сформированный монослой клеток почек зеленой мартышки 4647, адсорбцию проводили в течение 2-х часов, при 37°С, после чего зараженную культуру помещали в поддерживающую питательную среду Игла MEM с добавлением 5% сыворотки крови плода коров.
Через неделю после заражения клетки обмывали раствором Версена, содержащим 0,02% трипсина, отслоившиеся клетки собирали в ФСБ, разрушали трехкратным замораживанием-оттаиванием. Клеточный лизат использовали в качестве инокулята для следующего пассажа в культуре клеток. Вируспродукция ВГА обнаруживалась методом ИФА уже на 3-м пассаже. Количество выращенного антигена в культуре клеток возрастало с каждым пассажем, и к 8-му пассажу титр АГА в ИФА составлял 1:32 на 7-й день культивирования. На 10-12 день (в зависимости от множественности заражения) после заражения клеток наблюдалось отслоение и в последующем разрушение монослоя клеток.
В процессе размножения выделенного штамма ВГА в культуре перевиваемых клеток 4647 было установлено, что при заражении их данным штаммом наблюдается цитопатический эффект (ЦПЭ). Для подтверждения ЦПЭ клетки 4647, зараженные выделенным штаммом, покрывали агаром и начиная с 9-х суток после заражения окрашивали кристаллвиолетом. Бляшки, образовывающиеся в клеточном монослое, наблюдали на 11-14 сутки после заражения. Размер их варьировал. После последующего трехкратного клонирования вируса из бляшек методом предельных разведений была выделена чистая линия штамма, которая на 10-12 сутки культивирования образовывала однородные бляшки диаметром до 3 мм.
Динамика накопления вирусспецифического антигена и инфекционного титра в различные сроки после инфицирования клеток 4647 оценивали путем определения АГ ВГА в ИФА с помощью тест-системы "Вектогеп А-антиген" (производства ЗАО «Вектор-БиАльгам»).
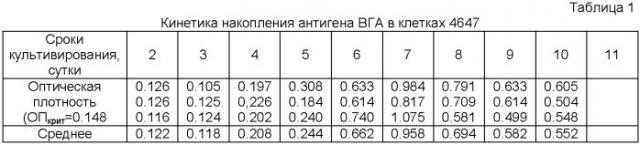
Для определения содержания антигена клетки зараженные клетки собирали 2, 3, 4, 5, 6, 7, 8, 9, 10, 11 сутки после инфицирования. Собранные клетки ресуспендировали в 1 мл 0,01 М ФСБ, разрушали трехкратным замораживанием-оттаиванием и проводили ИФА. Результаты представлены в таблице 1.
Как видно из приведенных данных, максимальная концентрация антигена определяется на 7 сутки, при дальнейшей инкубации происходит постепенное ее снижение. Инфекционный титр штамма выражали через 50% инфекционную дозу - ИДзо. Титр рассчитывали по методу Кербера. Результаты представлены в табл.2.
| Таблица 2 | ||||||||||
| Кинетика накопления инфекционного вируса в клетках 4647 | ||||||||||
| Сроки культивирования, сутки | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 |
| Титр инфекционной активности в Тк ИД50 | 3.8 | 4.5 | 5.4 | 5.9 | 6.0 | 6.3 | 6.3 | 6.1 | 5.8 | 5.5 |
Как видно из приведенной таблицы, максимальное накопление инфекционного вируса происходит на 6-8 сутки культивирования.
Второй этап работы по получению штамма ВБА-07
Далее для получения нового быстрорастущего штамма ВБА-07 были проведены дополнительные работы по пассированию штамма МБ-7 вируса гепатита А на культуре клеток линии 4647 и питательной среде Игла MEM с добавлением 5% сыворотки крови плода коров.
Было выполнено 5 последовательных пассажей МБ-7 с постепенным снижением множественности заражения и времени инкубации (пассажи проводили на культуральных флаконах, 25 см2):
1-й пассаж - 1.0 ИД50/кл., 12 суток;
2-й - 1.0 ИД50/кл., 10 суток;
3-й - 0.1 ИД50/кл., 10 суток;
4-й - 0.1 ИД50/кл., 7 суток;
5-й - 0.1 ИД50/кл., 7 суток.
После этого вируссодержащая жидкость, содержащая МБ-7 пятого пассажа, была выровнена по инфекционному титру и титру антигена с исходным МБ-7 и проведено параллельное исследование кинетики накопления антигена на клетках 4647. На данном этапе работ прослеживается тенденция к ускорению репродуктивного цикла штамма МБ-7.
Для повышения продуктивности был сделан еще один пассаж, такой же, как пятый. После чего для отбора из вирусной популяции вариантов с максимальными ростовыми свойствами инфицировали клетки с той же множественностью вируссодержащей суспензией 6-го пассажа и сделали два последовательных «быстрых» пассажа, клетки отбирали на 5-е сутки после инфицирования. При проведении второго быстрого пассажа клетки инфицировали тем же разведением лизата клеток, что и на предыдущем пассаже, в то же время реальная множественность заражения была значительно меньше, т.к. клетки отбирали раньше. На первом «быстром» пассаже (7-й последовательный) антиген в клетках в незначительных количествах определялся, на втором (8-й последовательный) уже нет. Затем для наработки вируса, прошедшего «быстрые» пассажи (успевших прореплицироваться), клеточными лизатами первого и второго «быстрых» пассажей вновь инфицировали клетки 4647 (культуральные флаконы, 25 см2) и выдержали 8 суток. Титр антигена ВГА в полученных вируссодержащих суспензиях составил 1:128, инфекционный титр 6.5 lg.
Штамм МБ-7, прошедший цикл адаптационных пассажей с постепенным снижением множественности заражения и времени инкубации (в том числе так называемые «быстрые пассажи», см. выше), в дальнейшем получил обозначение как ВБА-07.
Антигенная специфичность штамма ВГА была подтверждена в трех разновидностях реакции нейтрализации с помощью ОСО сывороток, содержащих и не содержащих анти-ВГА антител. Нейтрализация АГ ВГА в конкурентном ИФА (блок-вариант), нейтрализация репродукции ВГА in vitro с последующим выявлением АГ ВГА методом ИФА и нейтрализация бляшкооброзования в культуре клеток. Нейтрализация стандартными образцами анти-ВГА антителами проявлялась в подавлении их антигенной активности в блок-варианте ИФА на 90% (при установленных для отечественных тест-систем не менее 50%), в то время как применение стандартной ОСО, не содержащей анти-ВГА антител, не вызывало снижения вирусной активности. В таблице 3 представлены данные о нейтрализации репродукции штамма в культуре клеток 4647 стандартными антителами.
| Таблица 3 | |||||
| Данные о нейтрализации репродукции штамма в культуре клеток 4647 стандартными антителами | |||||
| Условия обработки | Разведения клеточных лизатов | ОП490 В ИФА | |||
| 1-й день | 2-й день | 3-й день | 4-й день | ||
| Штамм + ФСБ | Цельный | 0.164±0.01 | 0.450±0.03 | 0.771±0.1 | 1.031±0.1 |
| 1:2 | - | - | 0.419±0.05 | 0.741±0.05 | |
| 1:4 | - | - | 0.287±0.04 | 0.645±0.03 | |
| 1:8 | - | - | 0.156±0.05 | 0.408±0.03 | |
| Штамм + ОСО | Цельный | 0.15U0.1 | 0.143±0.03 | 0.198±0.01 | 0.385±0.08 |
| Штамм + МСО ВОЗ | Цельный | 0.151±0.1 | 0.143±0.03 | 0.198±0.01 | 0.385±0.08 |
| Клетки 4647 | Цельный | 0.113±0.05 | 0.163±0.01 | 0.107±0.01 | 0.154±0.05 |
Как видно из таблицы 3, репродукция штамма ВГА, обработанного специфическими сыворотками анти-ВГА, на 3-4 сутки была на 50% ниже относительно положительного контроля. В таблице 4 представлены данные по нейтрализации бляшкообразования анти-ВГА сыворотками.
| Таблица 4 | |||
| Данные по нейтрализации бляшкообразования анти-ВГА сыворотками. | |||
| Разведение штамма ВГА | Среднее количество бляшек на флакон | ||
| Штамм | Штамм + ОСО | Штамм + МСО ВОЗ | |
| 101 | сливные | сливные | сливные |
| 102 | сливные | сливные | сливные |
| 103 | сливные | сливные | сливные |
| 104 | 98 | 17 | 17 |
| 105 | 13 | - | 1 |
Как видно из таблицы 4, ОСО анти-ВГА и МСО ВОЗ анти-ВГА подавляют бляшкообразование штамма по сравнению с контролем более чем на 80%.
На основании этих исследований можно сделать вывод, что ОСО анти-ВГА и МСО ВОЗ анти-ВГА существенно нейтрализовали штамм в конкурентном ИФА, репродукцию и бляшкообразование его в культуре клеток 4647, подтверждает идентичность штамма.
Изучение иммунобиологических свойств штамма ВБА-07
Для сравнения динамики продуктивности штамма ВБА-07 с продуктивностью шт. МБ-7 был выполнен эксперимент по инфицированию клеток 4647. С этой целью 12 культуральных флаконов (25 см2) с полностью сформированным монослоем клеток инфицировали шт. ВБА-07, аналогичное количество использовали для заражения шт. МБ-7. Множественность заражения для обоих штаммов соответствовала 0,01-0,1 ТкИД50/клетку. Клетки отбирали с двух флаконов одновременно на 4, 6, 8, 10 и 12 сутки культивирования. Для определения оптический плотности и титров антигена использовали тест-системы «Вектогеп А-антиген» (производство ЗАО Вектор-БиАльгам»). Результаты представлены в таблице 5.
| Таблица 5 | ||||||
| Кинетика накопления антигена ВГА в клетках 4647 инфицированных штаммов МБ-7 и ВБА-07 | ||||||
| Штамм | Срок культивирования, сутки | |||||
| 0 | 4 | 6 | 8 | 10 | 12 | |
| Оптическая плотность | ||||||
| МБ-7 | 0.008 | 0.020 | 0.735 | 1.080 | 0.810 | 0.690 |
| ВБА-07 | 0.005 | 0.155 | 0.850 | 1.145 | 0.920 | 0.755 |
| Титры инфекционности (ИД50/мл) | ||||||
| МБ-7 | н.о.* | н.о. | 2×106 | 4×106 | 8×105 | 2×105 |
| ВБА-07 | н.о. | н.о. | 1×107 | 5×107 | 2×107 | 0,5×106 |
| Титры антигена ВГА | ||||||
| МБ-7 | н.о. | н.о. | 1:64 | 1:128 | 1:64 | 1:16 |
| ВБА-07 | н.о. | н.о. | 1:320 | 1:640 | 1:320 | 1:32 |
| Примечание: (*) - не определялись; оптическая плотность клеток в контрольных флаконах (без вируса) демонстрировали фоновые показатели. |
Как видно из данных таблицы 5, титры антигена ВГА (шт. ВБА-07) составили 1:320 и 1:640 на 6-8 сутки, для шт. МБ-7 - 1:64 и 1:128 соответственно. Инфекционные титры на те же сроки равнялись 1×107 ИД50/мл и 5×107 ИД50/мл (шт. ВБА-07) и 2×106 4×106 (шт. МБ-7).
Таким образом, штамм ВБА-07, прошедший оригинальные адаптационные пассажи на клетках 4647, показывает значительно лучшие результаты, чем исходный шт. МБ-7, как по продуктивности, так и по срокам максимального накопления.
Физико-химические свойства нового штамма ВБА-07
Для определения физико-химических свойств исследуемого штамма использовали препарат очищенных вирионов шт. ВБА-07. Применяли стандартные методики и способы расчета, получены следующие результаты:
коэффициент седиментации в градиенте нейтральной сахарозы - 155S;
плавучая плотность в градиенте хлористого цезия - 1.34 г/см-3;
молекулярная масса РНК - 2492667;
масса вириона - 7832667.
Эти данные полностью соответствуют физическим показателям прототипного штамма МБ-7 и других ранее описанных штаммов ВГА.
Резистентность шт. ВБА-07 к физико-химическим факторам
Для исследования использовали препарат очищенного шт. ВБА-07 в PBS с инфекционным титром 6.8 lgИД50/мл. Определение устойчивости к термической обработке проводили при различных режимах. Инфекционность вируса после обработки выявляли последующим титрованием на культуре клеток 4647. Термическая обработка при 56°C и 60°C в течение 18 ч не привела к полной инактивации исследуемых проб вируса, остаточная инфекционность составила 2.0 и 1.4 lg соответственно. Обработка при 85°C в течение 0.5 мин приводила к снижению титра на 5 lg, а в течение 1 мин к полной инактивации исследуемой пробы. Обработка при 80°C в течение 1 мин приводила к снижению инфекционности в 5 lg. В присутствии 1 М MgCl2 термическая резистентность препарата шт. ВБА-07 увеличивалась, остаточная инфекционность сохранялась даже после обработки при 80°C в течение 1 ч.
При изучении влияния на инфекционность шт. ВБА-07 к химическим воздействиям получены следующие результаты: резистентен к низким рН (отмечено незначительное снижение инфекционности при рН 1.0. Время обработки - 2 ч при комнатной температуре); устойчив к обработке 20% эфиром и хлороформом (время - 2 ч при комнатной температуре); практически не теряет инфекционную активность при инкубации при 37°C (30 мин) в присутствии 1% SDS, 1% NP40 или 1% лаурилсаркозилата натрия.
Полученные результаты, иллюстрирующие высокую устойчивость шт. ВБА-07 к термическим и химическим воздействиям, полностью согласуются с литературными данными по резистентности к физико-химическим факторам различных ранее описанных штаммов ВГА и подтверждают принадлежность шт. ВБА-07 к ВГА.
ПЦР-анализ геномной РНК штамма ВБА-07
С целью молекулярно-биологического подтверждения принадлежности штамма ВБА-07 к ВГА проводили ПЦР-анализ кДНК, полученной на матрице вирусной РНК. Вирусную РНК выделяли обработкой протеиназой К в концентрации 500 мг/мл при 37°C в течение 30 мин с последующей депротеинизацией фенолом. кДНК синтезировали с помощью статистических гексануклеотидов 5'-N6-3'. Методом ПЦР с использованием соответствующей пары олигонуклеотидных праймеров амплифицировали фрагмент 2229-2519 нт. гена белка VP1 ВГА. Параллельно проводили ПЦР-анализ геномной РНК прототипного шт. МБ-7. Из результатов, представленных на фиг.1, видно, что при проведении ПЦР с использованием в качестве матрицы кДНК шт. ВБА-07 и шт. МБ-7 амплифицируются фрагменты ожидаемой длины 290 нт. Эти данные подтверждают происхождение шт. ВБА-07 от шт. МБ-7 и его принадлежность к ВГА.
Нейтрализация шт. ВБА-07 специфичными к ВГА иммуноглобулинами и иммуноблоттинг
С целью исследования иммуногенных свойств адаптированного к клеткам 4647 шт. ВБА-07 была проведена иммунизация мышей, шт. ВБА-07 вводили внутрибрюшинно, трехкратно (на 0, 14 и 21 сутки, первая иммунизация с полным адъювантом Фрейнда), в дозе 5×106 ЕД50. Кровь забирали на 7 сутки после последнего введения, наличие специфичных к ВГА антител в сыворотке крови определяли в ИФА и реакции нейтрализации. При постановке ИФА в качестве антигена использовали как ВБА-07, так и исходный шт. МБ-7. Титр анти ВГА антител в обоих случаях составил 1:100000. Результаты реакции нейтрализации выражали через индекс нейтрализации (ИН), сыворотки крови мышей, иммунизированных ВБА-07 в разведении 1:50, нейтрализовали исходный шт. МБ-7 и шт. ВБА-07 с lgИН, равным - 4.0. Полученные данные свидетельствуют, что шт. ВБА-07 является высокоиммуногенным и что он сохранил антигенные свойства шт. МБ-7.
Для выявления структурных белков ВГА в препарате очищенного шт. ВБА-07 и их взаимодействия со специфичными к ВГА иммуноглобулинами, а также для оценки степени чистоты был выполнен гель-электрофорез с последующим иммуноблоттингом вирусных белков со специфичными к ВГА мышиными иммуноглобулинами. Результаты представлены на фиг.2. Как видно, при проведении электрофореза и иммуноблоттинга выявляются 3 доминантных белка, соответствующие по молекулярной массе белкам ВГА VP1 (33000), VP2 (25500) и VP3 (23000). Это свидетельствует о том, что препарат очищенного ВБА-07 содержит все структурные белки ВГА и что они эффективно взаимодействуют с иммуноглобулинами, специфичными к ВГА. На основании того, что при проведении анализа не выявляются интенсивные дополнительные полосы, можно говорить о достаточно высокой степени очистки.
Определение нуклеотидной последовательности генов VP1, 2А, 2В и 2С штамма ВБА-07
Ниже представлены результаты секвенирования наиболее важных генов ВГА: VP1, 2А, 2В и 2С. Проведен анализ нуклеотидных последовательностей и выведенных аминокислотных последовательностей шт. ВБА-07 в сравнении в соответствующими областями генома прототипного шт. МБ-7 и других штаммов ВГА: HAS-15/4647 (ЛБА-86) и НМ-175. На фиг.3а, б, в приведены нуклеотидные последовательности генов VP1, 2А, 2В и 2С шт. ВБА-07, МБ-7 и ЛБА-86 (с 2208 по 5000 нуклеотид). На фиг.4а, б представлены выведенные аминокислотные последовательности белков VP1, 2А, 2В и 2С шт. ВБА-07, МБ-7, НМ-175 и ЛБА-86 (с 492 по 1422 аминокислотный остаток). Анализ нуклеотидной последовательности гена VP1 шт. ВБА-07 выявил наличие 2 нуклеотидных замен по отношению к последовательности прототипного шт. МБ-7, одна из которых приводит к аминокислотной замене Leu→Met в позиции 586 (здесь и далее указаны позиции сначала полипротеина) белка VP1 (фиг.3 и 4). В остальном последовательность анализируемого гена VP1 шт. ВБА-07 полностью идентична последовательности соответствующей области генома шт. МБ-7, включая наличие 18 нуклеотидов, отсутствующих в последовательности шт. HAS-15. При анализе нуклеотидной последовательности генов 2А, 2В и 2С шт. ВБА-07 выявлено наличие 3 нуклеотидных замен по отношению к последовательности прототипного шт. МБ-7, две из которых приводят к аминокислотным заменам в белке 2А: К (Lys)→N (Asn) в позиции 838 и Y (Tyr)→C (Cys) в позиции 843. Данное исследование выявило наличие точечных замен в генах VP1 и 2А шт. ВБА-07, приобретенных в процессе дополнительной адаптации к культуре клеток 4647, и однозначно доказывает его принадлежность к ВГА.
В таблице 6 приведены отличия в аминокислотных последовательностях белков VP1, 2А, 2В и 2С шт. ВБА-07 от штамма-прототипа МБ-7 и других ранее описанных штаммов ВГА: ЛВА-86 и НМ-175.
При сравнительном анализе аминокислотной последовательности белков VP1, 2А, 2В и 2С шт. ВБА-07 с другими ранее описанными штаммами ВГА: шт. МБ-7, шт. ЛБА-86 (используется для производства отечественной вакцины «ГЕП-А-ин-ВАК») и шт. НМ-175 (используется для производства вакцины HAVRIX) выявлена высокая степень идентичности последовательностей всех вышеуказанных белков (табл.6). По последовательности белка VP1 шт. ВБА-07 (и соответственно шт. МБ-7) ближе к штамму НМ-175 (идентичность - 98.4%). Более низкий процент идентичности (96.7) по белку VP1 штаммов ВБА-07 и HAS-15/4647 обусловлен делецией в гене VP1 шт. HAS-15 18 нуклеотидов (и соответственно 6 аминокислотных остатков). По последовательности неструктурного белка 2А шт. ВБА-07 имеет одинаковый процент идентичности со шт. ЛБА-86 и НМ-175 (97.9). По последовательностям двух других неструктурных белков 2В и 2С шт. ВБА-07 ближе к штамму ЛБА-86. На основании приведенных данных можно утверждать, что штамм вируса гепатита А ВБА-07 является родственным для штаммов, используемых в настоящее время для производства инактивированных вакцин ЛБА-86 и НМ-175. В этой связи можно отметить, что по последовательности белка VP-1 процент идентичности шт. ЛБА-86 по отношению к шт. НМ-175 и другому штамму CR-326 (используется для производства вакцины VAQTA) составляет 95.
| Таблица 6 | |||
| Сравнение аминокислотных последовательностей белков VP1, 2А, 2В и 2С шт. ВБА-07 от штамма-прототипа МБ-7 и других ранее описанных штаммов ВГА: ЛВА-86 и НМ-175 | |||
| Белок | МБ-7 | ЛВА-86 | НМ-175 |
| Количество замен/количество амикислотных остатков в белке (% идентичности) | |||
| VP1 | 1/300 (99.7) | 10/300 (96.7) | 5/300 (98.4) |
| 2А | 2/189 (99.0) | 4/189 (97.9) | 4/189 (97.9). |
| 2В | 0/107 (100) | 2/107 (98.2) | 4/107 (96.7) |
| 2С | 0/335 (100) | 5/335 (98.5) | 14/335 (95.9) |
Таким образом, штамм ВБА-07, прошедший оригинальные адаптационные пассажи на клетках 4647, показывает значительно лучшие результаты, чем исходный шт. МБ-7 (прототип), как по продуктивности, так и по срокам максимального накопления.
Штамм virus hepatitis A hominis № ВБА-07 для приготовления вакцинных и диагностических препаратов, депонированный в Коллекции культур микроорганизмов ЗАО «Вектор-БиАльгам» и зарегистрированный под № VB-17.