Лекарственный препарат для лечения гипоксических и токсических митохондриальных нарушений и способ его получения
Иллюстрации
Показать всеИзобретение относится к области медицины, а именно к фармакологии, биохимии, и касается создания нового эффективного средства для лечения гипоксических состояний, интоксикаций, комбинированных поражений тканей и митохондриальных дисфункций различной степени выраженности. Предлагаемое средство характеризуется наличием специфического набора пептидов с молекулярной массой 250-7000 Да и ряда доминирующих аминокислот: глутаминовая кислота, аспарагиновая кислота, глицина, аланина, серина и валина. Получают данный препарат из органов и тканей суточных поросят, подвергшихся воздействию жесткой гипоксии во время родов и родившихся в помете начиная со 2 и до последней особи. Органы гомогенизируют при рН 7,3-7,6, отделяют от гомогената нерастворимые фрагменты, получают митохондриальную фракцию, а затем содержимое митохондрий, экстрагируют гексаном из полученной смеси липидные компоненты, после чего проводят осветляющую и стерилизирующую фильтрацию липидной смеси и лиофилизацию конечного продукта, замороженного при температуре -28…-30°С. Изобретение обеспечивает специфичность фармакологического действия, в частности, нейропротекторное и гепатопротекторное, мембраностабилизирующее и антиишемическое и значительную активность средства. 2 н. и 1 з.п. ф-лы, 5 табл.
Реферат
Изобретение относится к области медицины, а именно к фармакологии, биохимии.
Гипоксические и токсические митохондриальные дисфункции являются актуальной проблемой различных областей медицины. Известен ряд фармакологических препаратов для коррекции таких состояний. Для этого используются антигипоксанты, антиоксиданты, ноотропные препараты, ГАМК-ергические средства, ганглиозиды. Однако их недостатком является сравнительно низкая эффективность.
Наиболее близким к предлагаемому препарату по механизму фармакологического действия и способу получения является средство для коррекции гипоксических состояний «Цитохром С» фармацевтической компании «Самсон-Мед» (Россия), выделяемый из ткани сердца крупного рогатого скота и свиней (М.Д. Машковский. Лекарственные средства, 14-ое изд., т.2, Москва, 2001, с.118) и экспериментальное средство «митохондрин» (Макаренко А.Н., Клебанский Е.О., Широбокова Л.П. Антигипоксическая активность нового интраорганоидного фармакологического средства митохондрина, Экспериментальная и клиническая фармакология, 2002, Том 65 №1. С.68-72; Широбокова Л.П., Макаренко А.Н., Шаяхметова A.M. Фармакопротекторное действие церебрала и митохондрина при гемической гипоксии, вызванной острым отравлением нитробензолом. Токсикологический вестник, №4, июль - август 2002, С.14-16). Действующим началом «Цитохрома С» является молекула вещества дыхательной цепи интактных митохондрий, локализованная в ее кристах. Антигипоксическое действие «Цитохрома С» осуществляется в результате восстановления внутриклеточного пула молекул данного вещества, предназначенного для эффективного процессинга окислительного фосфорилирования. Данный препарат предназначен для парентерального (внутримышечного) введения (Справочник по клинической фармакологии. Под ред. И.С.Чекмана, А.П.Пелещука, О.А.Пятака. - Киев. - Здоров'я. - 1987. - 226 с.). Одним из основных его недостатков является быстрая трансформация базисных молекул «Цитохрома С» и элиминация продуктов гидролиза. В связи с тем, что при гипоксии основной задачей терапевтического воздействия является быстрое накопление и длительное поддержание в тканях организма терапевтических концентраций антигипоксантов, поставленная задача достигается в результате введения в организм пациентов значительных доз «Цитохрома С» в течение продолжительного периода времени (Н.И.Карпикова, А.А.Петрюхина. - БЭБИМ - 2006. - Прил.1. - 32-33 с.). Известны и другие недостатки «Цитохрома С». Так длительный курс лечения этим фармакологическим средством гипоксических и ишемических нарушений головного мозга или их последствий завершается непродолжительным периодом ремиссии. Данный препарат, в частности, не препятствует развитию рецидивов и характеризуется средней или низкой лечебной эффективностью. Средство «Митохондрин» представляет собой комплекс низкомолекулярных нейропептидов и аминокислот, с молекулярной массой от 10000 до 15000 Да, полученный из коры головного мозга новорожденных крольчат в первые часы после рождения и обладающий антигипоксической активностью. Данное средство разработано заявителями и получено по оригинальному способу получения веществ, носящих название трофинотропины (О.М.Макаренко, С.В.Карпенко, Патент РФ №1839727 от 10.08.1993, Изобретения, Москва, №11 (10.08.1993) с.116). В ходе проведения экспериментальных исследований показано, что «Митохондрин» обладает антигипоксической активностью на моделях гемической и гипоксически-гиперкапнической гипоксии (Макаренко А.Н., Клебанский Е.О., Широбокова Л.П. Антигипоксическая активность нового интраорганоидного фармакологического средства митохондрина, Экспериментальная и клиническая фармакология, 2002, Том 65 №1. С.68-72; Широбокова Л.П., Макаренко А.Н., Шаяхметова A.M. Фармакопротекторное действие церебрала и митохондрина при гемической гипоксии, вызванной острым отравлением нитробензолом. Токсикологический вестник, №4, июль - август 2002, С.14-16). Однако существенными недостатками «Митохондрина» является то, что данное средство получено только из коры головного мозга, а не из других паренхиматозных органов, в которых также вырабатываются трофические и адаптогенные вещества, невозможность производить в промышленных объемах, поскольку очень мало лекарственного сырья (кора головного мозга новорожденных крольчат, родившихся в первые часы), а также способ его получения, который заключается в приготовлении средства «Митохондрин» по способу приготовления трофинотропинов, и в итоге в его состав входят нейропептиды и аминокислоты со сравнительно высокой молекулярной массой (10000 до 15000 Да), молекулы которой плохо проникают через гематоэнцефалический барьер.
Техническим результатом данного изобретения явилось создание нового эффективного средства для лечения тяжелых гипоксических состояний и митохондриальных дисфункций. К ним относятся болезни, обусловленные острой или хронической интоксикацией (алкоголь, опиаты, лекарственные препараты, соли тяжелых металлов, отравления грибами, передозировка общими анестетиками и любые органические или неорганические токсины), заболевания, сопровождающиеся гипоксическим состоянием (острое нарушение мозгового кровообращения, синдром полиорганной недостаточности, любые виды коматозных состояний, ранний послеоперационный период, при длительных оперативных вмешательствах, краш-синдром, асфиксия новорожденных, нейроинфекции, токсические и дисметаболические энцефалопатии), митохондриальные болезни, обусловленные мутацией митохондриальной ДНК (синдром Кернса-Сейра, синдром Пирсона, наследственная атрофия зрительных нервов Лебера, синдром NAPR, синдром MERRF, синдром MELAS). Технический результат достигается благодаря тому, что средство для лечения гипоксии выделяют из содержимого митохондрий, полученных из тканей и органов новорожденных поросят, родившихся вторыми и далее до последнего в помете, т.е. тех, которые перенесли внутриутробную гипоксию.
Способ получения средства для лечения гипоксических и токсических митохондриальных нарушений состоит в следующем. Проводят дробление и гомогенизацию (в трис-HCl буфере с добавлением 0,32 М сахарозы, pH 7,4, не менее чем 1:10) органов и тканей новорожденных поросят, родившихся вторыми и далее в помете, т.е. подпадающих под влияние многократного воздействия на организм плода жесткой гипоксии, развившейся во время родов и оказывающей наиболее выраженное действие на особей, родившихся в помете последними. Затем из полученного гомогената тканей различных органов получают общий гомогенат (рН 7,3-7,6), отделяют нерастворимые фрагменты разрушенных тканей центрифугированием при 500 g. Полученную жидкую смесь (супернатант) лишают ядер клеток, подвергая градуальному центрифугированию. Из полученного супернатанта получают неочищенную митохондриальную фракцию (Р2) (Whittaker P. Et al., 1964) с помощью центрифугирования. Осадок ресуспендируют в среде гомогенизации. Полученную взвесь замораживают при температуре -20°С и ускоренно размораживают, добиваясь повреждения мембран митохондрий, крист и выхода в среду для гомогенизации содержимого митохондрий. Полученную жидкую смесь после отделения ультраструктурных фрагментов (в процессе очередного центрифугирования) смешивают с гексаном в соотношении 1:(3-5), которое позволяет достичь максимально возможной экстракции липидных компонентов. Кроме того, выбор гексана мотивировался тем, что как экстрагент он характеризуется следующими свойствами: малой токсичностью, оказанием консервирующего действия на биомолекулы, противомикробной активностью, удобством в использовании и экономичностью.
После отделения липидных компонентов супернатанта проводят просветляющую фильтрацию оставшегося объема безлипидной жидкости, которая предназначена для удаления крупных молекул, частиц микроорганизмов, оставшихся фрагментов клеток. Затем проводится т.н. стерилизующая фильтрация, необходимая для удаления микроорганизмов, вирусных частиц и крупных молекул для получения лечебного средства в максимально очищенном виде.
Полученный фильтрат подвергают замораживанию при температуре -28…-30°С и лиофилизуют.
При получении заявленного препарата следует учесть, что в качестве исходного сырья используют ткани и цельные органы новорожденных молозивных поросят, которые за 18-20 ч до забоя подвергались в естественных условиях родового акта многократному воздействию на организм жесткой гипоксии, часто оказывающей наиболее выраженное влияние на тех поросят, которые родились последними в помете. Из организма поросят брали ткани и цельные органы (головной мозг, печень, поджелудочную железу, сердце, легкие, почки, кишечник, желудок, жировую ткань, кожу, поперечно-полосатые мышцы, селезенку), а также плаценту.
Очень эффективный препарат получается из головного мозга, печени и поджелудочной железы, поскольку их функционирование обеспечивает в значительной мере выживание новорожденных особей в первые часы и сутки постнатального периода.
Выбор указанных тканей и органов поросят в качестве исходного сырья был обусловлен, в первую очередь, эволюционной близостью этих животных к организму человека, повышенной выживаемостью новорожденных в раннем послеродовом периоде и большой устойчивостью к гипоксии, а также рождением в помете большого количества поросят, что позволяет их выбрать в качестве доноров тканей. Известно, что препараты, полученные из печени, оказывают детоксицирующее, мембраностабилизирующее и гепатопротекторное действие «Гепатосан» (Медминпром, Россия) (www.rlsnet.ru/tn_index_id_10763.htm), а митохондриальная фракция печени, входящая в состав заявляемого средства, играет важную роль в его фармакологической активности. Также в состав заявляемого средства входят и ткани поджелудочной железы, что увеличивает его фармакологическую активность. Во время родов стремительно нарастает гипоксия, вследствие чего в митохондриях развивается адаптационная реакция, при которой продуцируются и накапливаются ростовые, трофические и протекторные факторы, оказывающие мембраностабилизирующее и цитопротекторное действие, которое лежит в основе нейро- и гепатопротекторного, а также антитоксического эффекта в условиях острой гипоксии.
Предлагаемый препарат содержит спектр аминокислот, среди которых есть доминирующие (глутаминовая и аспарагиновая кислоты, глицин, аланин, серин, лейцин, валин), группу олигопептидов (молекулярная масса 250-500 Да) и полипептидов (молекулярная масса до 7000 Да). Эти данные были получены с помощью тестирования различных фракций из тканей и органов контрольных и опытных животных на биологических моделях, описанных в примерах, а также с помощью аминокислотного анализа. Следовательно, полученное из содержимого митохондрий средство является сложным аминокислотно-пептидным комплексом. Сравнительная характеристика аминокислотного состава заявляемого средства, ближайшего прототипа «митохондрина» и стандартного препарата «церебролизина» ("EBEWE", Австрия) приведены в таблице 1. Как видно из приведенных данных в таблице 1, аминокислотный состав «митохондрина» существенно отличается от состава заявляемого средства, что отражается на различных механизмах действия данных средств и на различную фармакологическую активность.
Особенность получения средства определяет специфичность его фармакологического действия и значительную активность даже при однократном назначении. Фармакологически особо активными факторами, выделенными из содержимого митохондрий, являются олигопептиды и пептиды с молекулярной массой в диапазоне 250-7000 Да, а также аминокислоты заявляемого средства.
| Таблица 1 | ||||
| Аминокислотный состав заявляемого средства «Митохондрина» и «Церебролизина», (% ммоль) | ||||
| № п/п | Аминокислоты | Заявляемое средство | Митохондрин | Церебролизин |
| 1 | Аргинин | 0,37 | 0,78 | 0,91 |
| 2 | Аспарагиновая кислота | 13,94 | 7,45 | 8,94 |
| 3 | Аланин | 10,97 | 11,34 | 12,34 |
| 4 | Волин | 5,19 | 8,93 | 7,51 |
| 5 | Гистидин | 2,13 | 0,98 | 1,45 |
| 6 | Глутаминовая кислота | 18,25 | 10,34 | 13,12 |
| 7 | Глицин | 11,17 | 7,69 | 8,81 |
| 8 | Изолейцин | 4,11 | 5,21 | 5,70 |
| 9 | Лейцин | 6,29 | 8,72 | 14,08 |
| 10 | Лизин | 4,78 | 6,96 | 14,63 |
| 11 | Метионин | 0,57 | 0,52 | 0,54 |
| 12 | Пролин | 3,93 | 3,10 | 3,60 |
| 13 | Серин | 6,80 | 3,76 | 2,00 |
| 14 | Тирозин | 0,37 | 0,32 | 0,43 |
| 15 | Тиронин | 4,61 | 2,39 | 1,64 |
| 16 | Фенилаланин | 2,92 | 3,27 | 4,25 |
| 17 | Цистеин | 0,22 | 0,11 | 0,00 |
| 18 | ГАМК | 0,19 | 0,12 | 0,00 |
Предлагаемое средство возможно вводить парентерально. Это обеспечивает быстрое достижение антигипоксического лечебного эффекта благодаря ускоренному поступлению его компонентов во все ткани и органы организма в условиях острой гипоксии, при которой резко возрастает гематотканевая проницаемость.
Проведенные опыты на мелких лабораторных животных позволяют сделать вывод о том, что заявляемое средство имеет выраженную антигипоксическую и антитоксическую активность по сравнению с препаратом-прототипом «Цитохром С» и средством-прототипом «митохондрин». Оно способно оказывать выраженное фармакологическое действие при различных заболеваниях, например, при травматической болезни и интоксикациях на фоне гипоксии в острейшем и в остром периодах ее развития. Данное средство может применяться у пациентов различного возраста, при заболеваниях, связанных с поражением центральной нервной системы, сердечно-сосудистой и других систем организма, в основе которых лежат отчетливо выраженные митохондриальные дисфункции.
Данное средство проявляет отчетливое цитопротекторное (нейропротекторное и гепатопротекторное), мембраностабилизирующее и антиишемическое действие. Оказывает антитоксический эффект и терморегулирующее влияние в условиях острой интоксикации.
Способ получения предлагаемого средства является простым в выполнении и пригодным для внедрения в различные области медицины.
ПРИМЕРЫ ПРИМЕНЕНИЯ ЗАЯВЛЯЕМОГО ПРЕПАРАТА НА ЭКСПЕРИМЕНТАЛЬНЫХ МОДЕЛЯХ
Пример 1.
С целью определения активности и эффективности заявляемого средства по сравнению с прототипами - «Цитохром С» и «Митохондрин» были проведены две серии экспериментов на 60 половозрелых лабораторных животных - белых крысах, самцах Вистар с массой тела 178-300 г. Все работы с животными проводились согласно международным этическим правилам работы с экспериментальными животными (Guide for the Care and Use of Laboratory Animals, National Academy Press, Washington DC, 1996). Статистическую обработку полученных данных обеих серий опытов выполняли с помощью программ «BIOSTAT» и «STATISTICA-6.0». Достоверность различий средних значений устанавливали с помощью t-критерия Стьюдента. Все значения настоящего исследования представлены в виде: М±m.
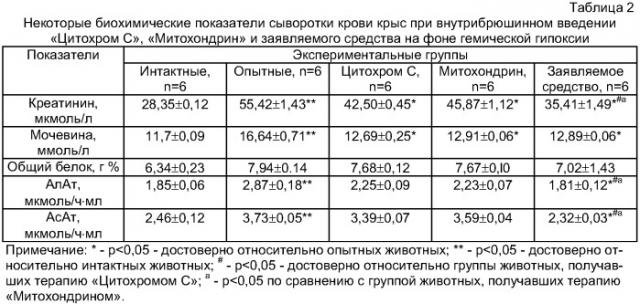
Первая серия экспериментов проводилась на 30 половозрелых лабораторных животных - белых крысах, самцах Вистар с массой тела 178-300 г. Для изучения и оценки антигипоксического защитного действия средства заявляемого средства большое значение имело исследование активности ряда ферментных систем экспериментальных животных, которым принадлежит решающая роль в обеспечении нормального обмена веществ и поддержании гомеостаза организма (Марри Р., Греннер Д., Мейес П., Родуэлл В. Биохимия человека (пер. с англ.), - М.: Мир. - 1993. - Т.2. - 414 с.; Beauchamp R.O., Irons R.D., Rickert D.E. et al. A critical review of the literature on nitrobenzene toxicity // CRC Crit. Rev. Toxicol, II (11), 33-84 (1982). Для углубленного изучения и сравнения фармакопротекторных свойств лекарственных средств «Цитохром С», «Митохондрин» и заявляемого средства была проведена данная серия экспериментов по исследованию ферментативных аспектов цитолиза клеток печени и интоксикации организма на модели гемической гипоксии при остром отравлении подопытных крыс нитробензолом. Для оценки степени защитного действия «Цитохрома С», «Митохондрина» и заявляемого средства при остром отравлении нитробензолом использовали методы изучения критериальных показателей поражения печени и почек. Изучали: активность маркеров гепатоцитолиза аланинаминотрансферазы (АлАТ) и аспартатаминотрансферазы (АсАТ) с использованием биотестов производства НПП "Филисит Диагностика» (Украина); содержание мочевины в сыворотке крови, количество креатинина в сыворотке крови (Руководство по клинической лабораторной диагностике, ч.3. - К.: Выща школа, - С.37 (1990)). Белок сыворотки крови определяли по биуретовой реакции (Досон Р., Эллиот Д., Эллиот У., Джонс К., Справочник биохимика (пер. с англ.), - М.: Мир, - 543 с. (1991).
В эксперименте использовано 4 группы крыс. В первую группу входили интактные животные, 2-ю составили крысы, отравленные водным раствором нитробензола (МБ) в экспериментально подобранной нами дозе 341 мг/кг массы тела животного при внутрижелудочном, однократном введении. В 3-й и 4-й и 5-й группах для коррекции острого отравления нитробензолом применяли изучаемые препарат «Цитохром С», средство «Митохондрин» и заявляемое средство, соответственно. Средство «Митохондрин» и заявляемое средство разводили физиологическим раствором и вводили животным внутрибрюшинно одноразово через 30 минут после отравления нитробензолом по 0,1 мг активного вещества на 1 кг массы тела. Забор крови для биохимических исследований проводили из паховой вены животных под легким эфирным наркозом через 3 часа после отравления.
При изучении активности АлАТ и АсАТ сыворотки крови были получены данные, свидетельствующие о повреждающем действии НБ на состояние мембран гепатоцитов. В группе животных, отравленных НБ, активность АлАТ и АсАТ сыворотки крови повышалась соответственно на 62% и 51% по сравнению с интактной группой. Применение заявляемого средства в лечебных целях при изучаемой патологии приводило к нормализации активности трансаминаз (р<0,05). Снижение активности трансаминаз отмечено при использовании «Митохондрина», однако менее выраженное, чем при использовании заявляемого средства (р<0,05). При этом использование препарата «Цитохрома С» приводило к снижению уровня активности трансаминаз, но не нормализации. Данные, приведенные в таблице 2, свидетельствуют также о том, что при остром отравлении НБ содержание общего белка в сыворотке крови крыс достоверно не изменяется. Это может быть обусловлено активацией эндогенно-компенсаторных механизмов организма животных на ранних стадиях отравления. Для оценки одного из конечных продуктов метаболизма белков - мочевины, экскретирующейся почками, изучался ее уровень в сыворотке крови. Повышение уровня мочевины свидетельствует о почечной недостаточности, повышении метаболизма азота на фоне уменьшения почечного кровотока или недостаточности функции надпочечников, а в некоторых случаях - о сердечной недостаточности. Нами установлено, что повышение исследуемого показателя в группе отравленных НБ животных на 43% по сравнению с интактной группой (р<0,05). Применение заявляемого средства способствовало снижению уровня мочевины в сыворотке крови отравленных крыс, что свидетельствует об определенной нормализации функционального состояния клеток почек и печени подопытных животных, получавших НБ. Использование «Митохондрина» также способствовало снижению уровня мочевины, причем достоверной разницы между группами «Митохондрина» и заявляемого средства не отмечено. Определение креатинина также было использовано для диагностики функциональных нарушений почек и печени крыс. Повышение его содержания свидетельствует о развитии острой или хронической почечной недостаточности.
Как видно из полученных данных (Табл.2), в группе отравленных крыс регистрировали достоверное повышение содержания креатинина более чем в 2 раза по сравнению с интактными животными (р<0,05). Применение в опытной группе животных «Митокорректина» сопровождалось снижением количества креатинина у отравленных НБ животных на 35% (р<0,05 по отношению к группе животных, получавших «Цитохром С»; р<0,05 по отношению к группе животных, получавших «Митохондрин»), в то время как «Цитохром С» снизил уровень креатинина у отравленных НБ животных на 22% (p<0,05 по сравнению с животными, отравленными НБ). Использование «Митохондрина» также сопровождалось снижением содержания креатинина, но менее выраженное, чем использование заявляемого средства.
Вышеприведенные данные свидетельствуют о нефро- и гепатопротекторном действии регулятора синтеза нейротрофических факторов заявляемого средства на ранней стадии острого отравления животных нитробензолом. Что же касается механизма лечебного действия специфических регуляторов синтеза нейротрофических факторов в условиях данной интоксикации, то нейротрофины из семейства фактора роста нервной ткани помимо нейротрофических и стрессомодулирующих свойств вызывают репаративную регенерацию клеток печени у млекопитающих с различными формами токсических гепатопатологий (Выпова Н.Л., Хидоятова С.Ш., Исанбаем Ч.И. Влияние фактора роста нервов на состав периферической крови животных в норме и при токсическом гепатите // Акт, Вопр. Экспер. и клин. Фармакол.: Тес. докл. Всероссийск. Научн. Конф., Санкт-Петербург, С.43 (1999).
Патологии гепатобилиарной системы сопровождаются развитием нарушений иммунитета и снижением неспецифической резистентности организма, различными церебральными токсическими эффектами. Изложенное служит подтверждением необходимости использования в эксперименте экстроцеребральных эффектов нейротрофинов и эндогенных регуляторов синтеза и секреции нейротрофинов - трофинотропинов, которые включают усиление иммунного ответа организма и профилактику развития реактивно-токсического гепатита при поступлении в организм ксенобиотиков и токсических агентов. Данный терапевтический эффект может быть достигнут в результате использования различных цитокинов, нейротрофинов и ростовых факторов, а также регуляторов их синтеза, характеризующихся эффективным иммунотропным действием, к которым относятся NGF, BDNF, ELMF и др. (Xiong Н., Baskys A., Woitowicz J.M. Brain-derived peptides are inhibited transynaptic transmission by GABA-B receptors in CAI region of rat hyppocampal slices. - Brain Res., 737 (7), 188-194 (1996); Benowitz L. Novel treatment in stroke. Endogenous low molecular weight factors support extensive CNS axon growth. Eur. J. Neuropsychopharm., 10 (4 - S12) 23 (2000).
Вторая серия экспериментов проводилась на 30 половозрелых лабораторных животных - белых крысах, самцах Вистар с массой тела 250-300 г. Для изучения и оценки антигипоксического защитного действия заявляемого средства использовали метод определения осмотической резистентности эритроцитов на модели гемической гипоксии, вызванной острым отравлением нитробензолом. В экспериментах были использованы 4 группы крыс: 1-я группа - интактные животные, 2-я - крысы, отравленные нитробензолом, в 3-й и 4-й и 5-й группах отравленным нитробензолом животным вводили соответственно препарат сравнения «Цитохром С», «Митохондрин» и заявляемое средство. Гемическую гипоксию моделировали одноразовым внутрижелудочным введением водного раствора нитробензола в дозе 341 мг/кг массы тела. «Цитохром С», «Митохондрин» и заявляемое средство разводили 0,9% раствором NaCl и вводили животным внутрибрюшинно одноразово через 30 минут после отравления нитробензолом в одинаковых дозах - по 0,1 мг активного вещества на 1 кг массы тела крыс. Забор крови проводили из паховой вены через 3 часа и 7 суток после отравления и определяли осмотическую резистентность эритроцитов. С целью определения влияния «Митохондрина» и заявляемого средства на общие метаболические процессы регистрировали прирост массы тела и температуру всех экспериментальных животных.
Анализ полученных результатов по влиянию «Митокорректина» и заявляемого средства на осмотическую резистентность эритроцитов крыс свидетельствует о позитивном действии препарата на мембраны эритроцитов через 3 часа после отравления нитробензолом (Табл.3). Было отмечено уменьшение гемолиза в группе «Митохондрина» и заявляемого средства через 3 часа после отравления нитробензолом (р<0,05). В отличие от «Митохондрина», защитное действие заявляемого средства проявлялось и в более поздний период, что отражалось в повышении осмотической резистентности эритроцитов крови, незначительным увеличением массы тела животных и нормализацией температурного гомеостаза на 7-е сутки наблюдений (р<0,05).
| Таблица 3 | |||
| Оценка влияния «Цитохрома С», «Митохондрина» и заявляемого средства на осмотическую резистентность эритроцитов крыс при отравлении нитробензолом | |||
| Группа / Концентрация NaCl, % | Гемолиз, % | ||
| Через 3 часа | Через 7 суток | ||
| Интактные, n=6 | 0,25 | 100,0 | 100,0 |
| 0,30 | 100,0 | 100,0 | |
| 0,35 | 100,0 | 100,0 | |
| 0,40 | 58,1 | 58,1 | |
| 0,45 | 12,9 | 12,9 | |
| 0,50 | 9,4 | 9,4 | |
| Нитробензол 1/2 ЛД50, n=6 | 0,25 | 100,0 | 100,0 |
| 0,30 | 100,0 | 100,0 | |
| 0,35 | 86,6 | 75,3 | |
| 0,40 | 63,5 | 39,2 | |
| 0,45 | 33,1 | 14,7 | |
| 0,50 | 15,1 | 7,3 | |
| Цитохром С, n=6 | 0,25 | 100,0 | 100,0 |
| 0,30 | 100,0 | 100,0 | |
| 0,35 | 100,0 | 78,5 | |
| 0,40 | 51,4 | 53,5 | |
| 0,45 | 23,1* | 25,7 | |
| 0,50 | 11,9 | 9,1 | |
| Митохондрин, n=6 | 0,25 | 100 | 100 |
| 0,30 | 100 | 100 | |
| 0,35 | 81,3 | 76,9 | |
| 0,40 | 51,9* | 53,3 | |
| 0,45 | 14,7* | 25,6 | |
| 0,50 | 5,6* | 9,2 | |
| Заявляемое средство n=6 | 0,25 | 100,0 | 100,0 |
| 0,30 | 100,0 | 100,0 | |
| 0,35 | 81,2 | 76,4 | |
| 0,40 | 51,8* | 17,3*a | |
| 0,45 | 14,7* | 7,4*a | |
| 0.50 | 5,1* | 5,3*a | |
| Примечание: * - р<0,05 -достоверно относительно опытных животных, не получавших терапию; а - р<0,05 по отношению к группе животных, получавших «Митохондрин». |
Следует отметить, что у группы крыс, получавших заявляемое средство и «Митохондрин», наблюдали стабильную температуру тела в пределах видовой нормы и незначительное уменьшение массы по сравнению с контрольной группой отравленных крыс, у которых через 3 часа после отравления регистрировали падение температуры до 34,55±0,20°С и уменьшение массы тела на 5,6 г по сравнению с исходными данными через 7 суток после отравления (р<0,05) (Табл.4).
Все вышесказанное свидетельствует, что при гемической форме гипоксии, вызванной одноразовым внутрижелудочным введением нитробензола в дозе 341 мг/кг, защитное действие заявляемого средства проявляется в более ранний период отравления (через 3 часа), в отличие от наиболее близкого прототипа «Митохондрина». По-видимому, такой эффект заявляемого средства связан с тем, что в состав данного препарата входят не только митохондриальная фракция, полученная из головного мозга, но и из печени и поджелудочной железы. Фармакологическое действие заявляемого средства связано с его цитомембранным нейропротекторным действием. Эндогенно-фармакологическое действие заявляемого средства в применяемых дозах не проявляло побочных и токсических эффектов.
Пример 2.
В начале разработки заявляемого средства нами проведена еще одна очень важная серия опытов, которая указывает на то, почему для приготовления заявляемого средства мы берем суточных поросят, начиная со второго. Итак, для доказательства данной гипотезы, мы проверили активность заявляемого средства, причем его готовили отдельно из тканей поросят, начиная с первого и так далее. То есть, мы брали заявляемое средство, приготовленное из тканей поросят, родившихся первыми, вторыми, третьими и т.д. до седьмых поросенка. Далее в эксперименте на модели гемической гипоксии мы испытывали активность заявляемого средства, полученного из мозга первых родившихся поросят №1, вторых родившихся поросят - №2 и т.д. до седьмых. В эксперименте использовано 9 групп крыс. В первую группу входили интактные животные, 2-ю составили крысы, отравленные водным раствором нитробензола (НБ) в экспериментально подобранной нами дозе 341 мг/кг массы тела животного при внутрижелудочном, однократном введении. С 3-й до 9-й группы для коррекции острого отравления нитробензолом применяли изучаемые средства №1, №2, и т.д. до №7, соответственно. Оба средства разводили физиологическим раствором и вводили животным внутрибрюшинно одноразово через 30 минут после отравления нитробензолом по 0,1 мг активного вещества на 1 кг массы тела. Забор крови для биохимических исследований проводили из паховой вены животных под легким эфирным наркозом через 3 часа после отравления. Изучали: активность маркеров гепатоцитолиза АлАТ и АсАТ с использованием биотестов производства НПП "Филисит Диагностика» (Украина); содержание мочевины в сыворотке крови, количество креатинина в сыворотке крови. При изучении активности АлАТ и АсАТ сыворотки крови были получены данные, свидетельствующие об повреждающем действии НБ на состояние мембран гепатоцитов. Данные о фармакологической активности различных серий заявляемого средства представлены в таблице 5.
| Таблица 5 | |||||
| Некоторые биохимические показатели сыворотки крови крыс при внутрибрюшинном введении различных серий заявляемого средства на фоне гемической гипоксии | |||||
| Показатели | Экспериментальные группы | ||||
| Креатинин, мкмоль/л | Мочевина, ммоль/л | Общий белок, г % | АлАт, мкмоль/ч·мл | АсАт, мкмоль/ч·мл | |
| Интактные, n=6 | 26,21±0,21 | 11,31±0,06 | 6,45±0,43 | 1,93±0,09 | 2,49±0,11 |
| Опытные, n=6 | 57,76±1,11** | 17,69±0,12** | 6,98±0,39 | 2,96±0,08** | 3,87±0,15** |
| №1, n=6 | 52,98±1,45 | 15,98±0,19 | 6,33±0,54 | 2,85±0,04 | 3,85±0,17 |
| №-2, n=6 | 41,67±1,25* | 12,31±0,31* | 6,87±0,32 | 1,87±0,07* | 2,41±0,18* |
| №-3, n=6 | 38,76±1,19* | 12,83±0,42* | 7,43±0,19 | 1,87±0,06* | 2,39±0,12* |
| №-4, n=6 | 38,43±1,02* | 12,76±0,55* | 7,21±0,76 | 1,82±0,07* | 2,44±0,15* |
| №-5, n-=6 | 35,11±1,65* | 12,32±0,21* | 6,74±0,43 | 1,85±0,06* | 2,41±0,11* |
| №-6, n=6 | 34,27+1,28* | 12,21±0,19* | 7,35±0,94 | 1,81±0,07* | 2,31±0,09* |
| №-7, n=6 | 34,03±1,98* | 12,11±0,18* | 6,59±0,31 | 1,82±0,06* | 2,32±0,07* |
| Примечание: * - р<0.05 - достоверно относительно опытных животных; | |||||
| ** - р<0,05 - достоверно относительно интактных животных. |
Исходя из результатов исследования, показано, что №1 не оказывает фармакологической активности, а использование №2 и т.д. оказывает выраженный фармакологический эффект, причем, фармакологическая активность каждого последующего увеличивается (р<0,05). Значит, чем больше новорожденные поросята испытывают гипоксической нагрузки во время родов, тем больше в их тканях образуются молекул-адаптогенов и тем больше активность заявляемого средства. Что касается №1, полученного из тканей новорожденных поросят, родившихся первыми, то практически отсутствие у данного средства антигипоксической активности, по-видимому, связана с тем, что поросята, родившиеся первыми, испытывают недостаточно гипоксической нагрузки, и следовательно в их тканях синтезируется значительно меньше молекул-адаптогенов. Именно, поэтому при разработке заявляемого средства, предложено использовать ткани новорожденных поросят, родившихся начиная со второго и позже.
На основании проведенных исследований был сделан вывод, что сочетанная противоишемическая и противогипоксическая эффективность заявляемого средства существенно превышает таковую у препарата «Цитохрома С» и средства «Митохондрин». Следовательно, заявляемое средство обладает низкой токсичностью, не индуцирует аллергических реакций - значит является безопасным и эффективным. Данное средство проявляет отчетливое цитопротекторное (нейропротекторное и гепатопротекторное), мембраностабилизирующее, антигипоксическое и антиишемическое действие. Оказывает антитоксический эффект и терморегулирующее влияние в условиях острой интоксикации нитробензолом.
1. Средство для лечения гипоксических и токсических митохондриальных нарушений, получаемое из органов и тканей свиней, отличающееся тем, что оно выделено из митохондрий клеток органов и тканей суточных поросят, родившихся в помете, начиная с 2-й и до последней особи, попавших под влияние выраженной гипоксии, развившейся во время родов, и характеризуется наличием олигопептидов и полипептидов с молекулярной массой в диапазоне 250-7000 Да и ряда доминирующих аминокислот, который представлен: глутаминовой кислотой, аспарагиновой кислотой, глицином, аланином, серином и валином.
2. Средство для лечения гипоксических и токсических митохондриальных нарушений по п.1 получают из головного мозга, печени и поджелудочной железы поросят.
3. Способ получения средства по п.1, характеризующийся тем, что органы и ткани, полученные от суточных молозивных поросят, подвергшихся воздействию жесткой гипоксии при развитии регулярной родовой активности и родившихся в помете, начиная со второй и до последней особи, гомогенизируют в буфере при рН 7,3-7,6, отделяют нерастворимые фрагменты, затем получают митохондриальную фракцию, из которой путем ускоренного замораживания-размораживания получают содержимое митохондрий, удаляют ультраструктурные мембранные фрагменты, после чего полученную жидкую смесь смешивают с гексаном в соотношении 1:(3-5) для экстракции липидных компонентов, которые отделяют, затем осуществляют фильтрацию оставшегося объема безлипидной жидкости до достижения ее осветления, после чего осуществляют стерилизующую фильтрацию, а замороженный при температуре -28…-30°С полученный фильтрат лиофилизуют.