Способ селективного разрушения раковых клеток с помощью магнитных микроконтейнеров с фотодинамическими или фототермическими красителями
Иллюстрации
Показать всеИзобретение относится к медицине, онкологии, и может быть использовано для селективного разрушения опухолей. Для этого фотосенсибилизатор капсулируют в полимерные микроконтейнеры, оболочка которых содержит наночастицы магнетита (Fе2O4) и вводят в окружающую опухоль биоткань. В объеме опухоли создают внешнее постоянное магнитное поле, пространственная конфигурация которого совпадает с формой опухоли. Лазерное облучение производят через время соответствующее максимальному накоплению микроконтейнеров в опухоли при плотности энергии излучения достаточной для фотодинамического или фототермического разрушения оболочек микроконтейнеров внутри опухоли и последующего фотодинамического или фототермического разрушения клеток раковой опухоли. При этом фотосенсибилизатор выбирают с полосой поглощения в красной и ближней ИК спектральной области 650-1200 нм. Способ позволяет увеличить эффективность разрушения раковых клеток за счет повышения степени накопления в опухоли фотосенсибилизатора при минимальном разрушении окружающих здоровых клеток и при проведении операции без общей анестезии. 3 з.п. ф-лы, 9 ил.
Реферат
Изобретение относится к области биомедицинских технологий, в частности к созданию селективного лазерного фотодинамического или фототермического разрушения злокачественных раковых клеток на основе векторной магнитной доставки микрокапсул с фотосенсибилизаторами и последующего резонансного лазерного облучения опухоли.
Лечение злокачественных новообразований у теплокровных животных или людей традиционными способами хирургии не всегда возможно из-за особенностей локализации опухоли (например, в области твердого неба или глотки). Кроме того, при использовании технологии, когда иссекается более трех сантиметров здоровой ткани от границы опухоли, в большинстве случаев возникают метастазы, а при технологии химиотерапии возникает много осложнений из-за неселективности воздействия (см. Руководство по химиотерапии опухолевых заболеваний. / Под. ред. Н.И.Переводчиковой. - М.: Практическая медицина, 2005, с.581-657).
Известен способ близкофокусной рентгенотерапии с суммарной очаговой дозой 100-120 Гр и дистанционной гамма терапии при лучевом разрушения злокачественных клеток, таких как меланома с суммарной очаговой дозой 30-40 Гр (Ш.Х.Ганцев. Онкология. - М.:Медицинское информационное агентство, 2004, с.190-204).
Однако данный способ, несмотря на распространенность, обладает следующими недостатками. При лечении таких злокачественных новообразований, как меланома, с помощью дистанционной гамма-терапии даже в сочетании с иммунотерапией, как показывает опыт, приводит к 75-90% рецидиву опухолей, а через 2-6 месяцев возникают метастазы.
Известен нейтрон-захватный способ селективного разрушения меланомы (В.Н.Митин, Н.Г.Козловская, А.М.Арнопольская. Нейтрон-захватная терапия опухолей ротовой полости у собак. Всероссийский ветеринарный журнал, 2006, №1, с.9-10). Способ включает введение в кровь внутривенно L-борфенилаланина, который селективно накапливается в определенной опухоли-меланоме, так как L-фенилаланин является незаменимой аминокислотой, из которой вырабатывается меланин, образующий меланоциты, содержащиеся в клетках меланомы. Таким образом, происходит селективное накопление L-борфенилаланина в клетках меланомы. При облучении пространственной зоны, соизмеримой с опухолью, содержащей L-борфенилалан пучком медленных нейтронов, получаемых по нейтроноводу из ядерного реактора, происходит разрушение клеток меланомы вследствие индуцированного вторичного локального излучения бора.
Однако данный способ обладает следующими недостатками: радиационное облучение пациентов, которое лишь частично уменьшается при использовании литиевого защитного фартука; сложная и очень дорогая установка, включающая компактный ядерный реактор, требующий для обслуживания квалифицированных специалистов немедицинского профиля, в частности физиков-ядерщиков; длительное время облучения пациентов в течение часа при мониторинге сердечно-сосудистой системы; применение общей анестезии.
Известен способ лазерного фототермолиза опухолей на основе плазмонно-резонансных золотых наночастиц (см. P.K.Jain, I.H.El-Sayed, M.A.El-Sayed. Au nanoparticles target cancer. Nanotoday, 2007, v.2, №1, p.18-29). Способ включает локальное введение золотых плазмонно-резонансных наночастиц в венозную кровь и облучение лазерным излучением с длиной волны, совпадающей с полосой поглощения наночастицами и вызывающей локальный нагрев наночастиц и соответственно некроз раковых клеток.
Однако данный способ имеет ряд недостатков, связанных малой контрастностью накопления золотых наночастиц в опухоли.
Наиболее близким к предлагаемому способу является способ фотодинамического разрушения опухолей, включающий внутривенное введение фотосенсибилизатора и облучение опухоли непрерывным лазерным излучением с длиной волны, совпадающей с полосой поглощения фотосенсибилизатора (Photodynamic therapy /Ed. T.J.Dougherty/ J.Clin.Laser Med. Surg. 1996, Vol.14, P.219-348; Патент РФ №2184578, МПК A61N 5/06).
При поглощении лазерного излучения молекулы фотосенсибилизатора переходят в возбужденное электронное состояние, при столкновении возбужденных молекул фотосенсибилизатора с молекулами кислорода последний переходит в возбужденное синглетное состояние, а активные молекулы кислорода в течении времени жизни в синглетном состоянии (с типичным временем жизни несколько микросекунд) при взаимодействии с плазматической мембраной клетки повреждают ее и клетка гибнет вследствие некроза. Таким образом, разрушение клеток происходит лишь во время воздействия лазерного излучения в пространственной области облучения лазерным пучком.
Селективный фотодинамический механизм разрушения раковых опухолей основан на более высокой плотности (контрастности) накопления фотосенсибилизатора в опухолевых клетках по сравнению с нормальными, что связано с большей плотностью кровеносных сосудов и их финестрированностью в опухоли по сравнению со здоровой биотканью.
Однако этот контраст для различных типов опухолей не превышает двух-трех раз, что является основным недостатком данного метода.
Используемые в медицинской практике фотосенсибилизаторы - фталационины, порфирины, хлорины, имеют полосы поглощения фотосенсибилизаторов в ультрафиолетовой или видимой области спектра и используемые лазеры не могут эффективно проникать в опухоль вследствие сильного поглощения оптического излучения биотканью. Кроме того, фотодинамический способ обладает малой контрастностью накопления фотосенсибилизаторов в раковых клетках.
Задачей изобретения является увеличения эффективности разрушения объемных раковых клеток за счет повышения степени накопления в опухоли (контрастности) фотосенсибилизатора при минимальном разрушении окружающих здоровых клеток.
Технический результат заключается в эффективности и селективности повреждения злокачественных клеток при проведении операции без общей анестезии.
Поставленная задача решается тем, что способе селективного разрушения опухолей, включающем введение раствора фотосенсибилизатора и облучение опухоли лазерным излучением, совпадающим с максимумом полосы поглощения фотосенсибилизатора, согласно решению, для локального разрушения опухоли фотосенсибилизатор капсулируют в полимерные микроконтейнеры, оболочка которых содержит наночастицы магнетита (Fе3O4) и вводят в биоткань, окружающую опухоль, в объеме опухоли создают внешнее постоянное магнитное поле, пространственная конфигурация которого совпадает с геометрическими размерами опухоли, а лазерное облучение производят через время соответствующее максимальному накоплению микроконтейнеров в опухоли, при плотности энергии излучения, достаточной для фотодинамического или фототермического разрушения оболочек микроконтейнеров внутри опухоли и последующего фотодинамического или фототермического разрушения клеток раковой опухоли, при этом фотосенсибилизатор выбирают с полосой поглощения в красной и ближней ИК-спектральной области 650-1200 нм.
Оболочка микроконтейнеров дополнительно содержит золотые наночастицы с плазменным резонансом, совпадающим с максимумом поглощения фотосенсибилизатора при концентрации золотых наночастиц не менее 108 в см3.
Оболочка микроконтейнеров дополнительно содержит наночастицы золота с плазменным резонансом в видимой и ближней ИК-области 500-1200 нм, а для локального раскрытия микроконтейнеров их дополнительно облучают лазерным излучением, совпадающим с максимумом поглощения плазмонно-резонансных золотых наночастиц.
Для локального разрушения оболочки микроконтейнеров дополнительно используют переменное высокочастотное магнитное поле в диапазоне частот десятки кГц - сотни МГц.
Изобретение поясняется чертежами.
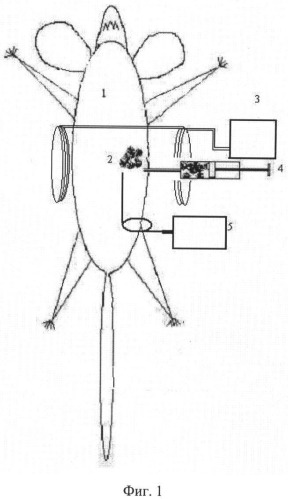
На фиг.1 показана блок-схема эксперимента по разрушению опухолей лабораторной крысы in vivo на основе селективной фотодинамической или фототермической терапии при облучении микроконтейнеров оболочка которых содержит наночастицы магнетита (Fе3O4), содержащих внутри фотосенсибилизатор, резонансным излучением лазера, где: 1 -лабораторная крыса (пациент); 2 - злокачественная опухоль; 3 - электромагнит, создающий пространственное распределение магнитного поля, совпадающего с формой опухоли; 4 - микроконтейнеры, полимерная оболочка которых содержит наночастицы магнетита (Fе2O4), а внутреняя полость микроконтейнера заполнена фотосенсибилизатором; 5 - полупроводниковый лазер с волоконно-оптическим световодом, излучающим в красной или ближней инфракрасный спектральной области (650-1200 нм) с длиной волны, совпадающей с полосой поглощения фотосенсибилизатора.
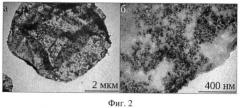
На фиг.2 представлено изображение микроконтейнера, оболочка которого содержит наночастицы магнетита (Fе3O4), полученное с помощью ТЕМ электронного микроскопа при различном увеличении.
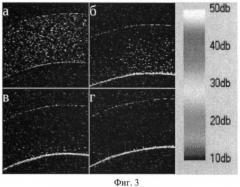
На фиг.3 представлены двумерные томограф ические сканы при зондировании кюветы толщиной 1 мм, заполненной суспензией микроконтейнера в 50% водном растворе глицерина при отсутствии и наличии магнитного поля в различные моменты времени. Магнитное поле напряженностью 0.02 тесла, создавалось постоянным магнитом, приложенным к внешней стенке кюветы, толщиной 3 мм (внутренняя стенка на фиг.4 изображена снизу): а - без магнитного поля, б - состояние суспензии через 72 с после воздействия магнитного поля, в - через 120 с, г - через 186 с. Измерения проводились с помощью низкокогерентного оптического томографа типа ОСТ 3000 фирмы Carl Zeiss.
На фиг.4 представлен процесс разрушения микроконтейнера, содержащего в оболочке магнитные и золотые частицы без воздействия лазерного излучения (а), и при облучении лазером с длиной волны, совпадающей с плазменным резонансом золотых наночастиц (б, в).
На фиг.5 представлены изображения золотых наносфер (а), наностержней (б) и нанооболочек (в), полученные с помощью электронного микроскопа.
На фиг.6 представлены спектральные зависимости оптической плотности плазмонно-резонансных наночастицв видимой и ближней инфракрасной области: (а) - наносферы, (б) -наностержни, (в) - нанооболочки при различных геометрических параметрах.
На фиг.7 представлены термограмма при облучении пробирки типа Эппендорф с водным раствором золотых нанооболочек (ядро из SiO2 диаметром 140 нм и золотой оболочкой толщиной 15 нм с максимумом плазменного резонанса на длине волны 800 нм при концентрации наночастиц 109 в мл) излучением полупроводникового лазера с длиной волны (810 нм) мощностью 1 Вт в течении 3-х минут с энергией 180 Дж.
На фиг.8 представлены термограмма при облучении пробирки типа Эппендорф с водным раствором фотосенсибилизатора (индоцианин зеленый-IGG) излучением полупроводникового лазера с длиной волны (810 нм), совпадающей с полосой поглощения фотосенсибилизатора и мощностью 1 Вт в течении 3-х минут с энергией 180 Дж.
На фиг.9 представлены термограмма спонтанной опухоли кошки при введении 0.1 мл фотосенсибилизатора (индоцианин зеленый-IGG), вызывающий фототермолиз опухоли при воздействии излучения полупроводникового лазера с длиной волны (810 нм), совпадающей с полосой поглощения фотосенсибилизатора (IGG) с мощностью 2 Вт в течении 2-х минут.
В прототипе селективность повреждения опухоли определяется селективностью накопления красителя в опухоли, который вводится в кровь. Время оборота крови в организме человека составляет 21 секунду. В зависимости от типа опухоли в различных органах существует различное время максимального накопления красителя, при этом характерной время может составлять от получаса до десятков часов. Максимальная контрастность накопления фотодинамических красителей, применяемых в онкологии для злокачественных опухолей, в 2-3 раза превышает контрастность накопления красителя в нормальной биоткани и связывается, в основном, с фенестрированностью новых капилляров, прорастающих в опухоли.
Нами предлагается диффузионная доставка и удержание красителя, помещенного в микроконтейнеры с магнитной оболочкой, с помощью управляемого магнитного поля. Предварительные эксперименты, выполненные в средах с различной вязкостью, показали принципиальную возможность управления пространственной локализацией таких магнитных микроконтейнеров.
Способ осуществляется следующим образом.
Полимерные микроконтейнеры 4, оболочка которых содержит наночастицы магнетита (Fе3O4), с заключенным внутри микроконтейнеров фотосенсибилизатором, вводятся в биоткань, окружающую опухоль 2 пациента 1. Включается внешнее постоянное магнитное поле 3 с пространственной конфигурацией, соизмеримой с опухолью 2. Через время, соответствующее максимальному накоплению магнитных наночастиц в опухоли 2 (оценки показывают, что в зависимости от типа опухоли типичное время накопления наночастиц составляет не более часа), опухоль 2 облучают лазерным пучком 5 при плотности энергии излучения, достаточной для фотодинамического или фототермического разрушения оболочек микроконтейнеров внутри опухоли 2 и последующего фотодинамического или фототермического разрушения клеток раковой опухоли 2. При этом длина волны лазера должна совпадать с полосой поглощения фотосенсибилизатора, а фотосенсибилизатор выбирают с полосой поглощения в красной и ближней ИК-спектральной области 650-1200 нм.
В Саратовском государственном университете авторами заявки разработана технология получения полимерных микроконтейнеров, оболочка которых содержит наночастицы магнетита (Fе3O4), а также золотые наночастицы (Dmitry A. Gorin, Sergey A. Portnov, Olga A. Inozemtseva, Zofia Luklinska, Alexey M. Yashchenok, Anton M. Pavlov, Andre G. Skirtach, Helmuth Mohwaldb and Gleb B. Sukhorukov. Magnetic/gold nanoparticle functionalized biocompatible microcapsuleswith sensitivity to laser irradiation. Phys. Chem. Chem. Phys., 2008, 10, 6899-6905).
Размеры и форма полимерных микроконтейнеров 4, оболочка которых содержит наночастицы магнетита (Fе3О4), контролировалась с помощью электронной микроскопии, которая позволяет определить пространственное распределение магнитных наночастиц в полимерной оболочке микроконтейнеров 4 (фиг.2). Управление движением микроконтейнеров 4, оболочка которых содержит наночастицы магнетита (Fе3О4), осуществлялось с помощью постоянного магнитного поля 3, что показано на фиг.3. Используя бесконтактный оптический метод диагностики на основе низко-когерентного оптического томографа типа ОСТ 3000 фирмы Carl Zeiss, авторы исследовали пространственную динамику движения микроконтейнеров в водно-глицериновой смеси с помощью постоянного магнитного поля 3, что позволило определять время накопления магнитных микроконтейнеров в биотканях раковых клеток. На фиг.3 представлены двумерные томографические сканы при зондировании кюветы толщиной 1 мм, заполненной суспензией микроконтейнеров в 50% водном растворе глицерина при отсутствии и наличии магнитного поля в различные моменты времени. Магнитное поле напряженностью 0.02 тесла, создавалось постоянным магнитом, приложенным к внешней стенке кюветы, толщиной 3 мм: (а) - без магнитного поля, (б) - состояние суспензии через 72 с после воздействия магнитного поля, (в) - через 120 с, (г) - через 186 с.
При пространственной конфигурации внешнего магнитного поля, совпадающей с пространственной конфигурацией раковых клеток, за определенное время происходит накопление микроконтейнеров 4 в опухоли 2.
Процесс разрушения микроконтейнера 4, содержащего в оболочке магнитные и золотые частицы при облучении лазером 5 с длиной волны, совпадающей с плазменным резонансом золотых наночастиц, представлен на фиг.4. Концентрация золотых и магнитных наночастиц составляет 108 в см3.
Микроконтейнеры, содержащие в оболочке золотые наночастицы (наносферы), имеющие плазменный резонанс 520-560 нм, не совпадающий с максимумом поглощения красителя, находящегося внутри микроконтейнера, дополнительно облучают лазером. В результате такого облучения происходит терморазрыв оболочки микроконтейнера, как показано на фиг.5, а потом необходимо резонансное лазерное воздействие на краситель.
В лаборатории размерных наносенсоров института биофизики физиологии растений и микроорганизмов РАН авторами заявки разработана технология изготовления золотых плазмонно-резонансных наночастиц с возможностью управлением спектральным положением плазменного резонанса при изменении геометрических параметров наночастиц представляющих собой золотые наносферы, наностержни и нанооболочки, как показано на фиг.5, 6 (Н.Г.Хлебцов, В.А.Богатырев, Л.А.Дыкман, Б.Н.Хлебцов. Золотые наноструктуры с плазменным резонансом для биомедицинских исследований. // Российские нанотехнологии. 2007, Т.2, №3-4, С.69-86). Технология изготовления плазмонно-резонансных золотых наночастиц типа нанооболочек и наностежней позволяют получить максимум поглощения наночастиц в спектральной области соответствующей области прозрачности биотканей (650-1200 нм).
Лазерный фототермолиз плазмонно-резонансных золотых наночастиц при воздействии лазерного излучения представлен на фиг.7. Создание золотых нанооболочек с ядром оксида кремния (SiO2) диаметром 140 нм с золотой нанооболочкой толщиной 15 нм позволяет получить максимум плазменного резонанса на длине волны 800 нм. Как показали эксперименты (фиг.7), при концентрации золотых нанооболочек 109 в мл воды при воздействии ИК-излучения полупроводникового лазера с длиной волны (810 нм), мощностью 1 Вт в течение 3-х минут с энергией 180 Дж позволяет достигнуть температуры раствора более 70°С, что позволяет управлять разрушением микроконтейнеров, в оболочку которых внедрены золотые наночастицы.
Внутри микроконтейнеров находится ИК-фотосенсибилизатор, при лазерном облучении с длиной волны, совпадающей с полосой поглощения красителя, может происходить нагрев молекул красителя, раскрытие микроконтейнеров и локальный фототермолиз раковых клеток при нагреве с температурой более 43-57°С, либо при соответствующем фотосенсибилизаторе происходит фотодинамическое разрушение опухолей.
Проведенные эксперименты позволили установить необходимые уровни лазерной энергии для технологии фототермолиза. На фиг.8 представлены термограмма при облучении пробирки типа Эппендорф с водным раствором фотосенсибилизатора (индоцианин зеленый-IGG) излучением полупроводникового лазера с длиной волны (810 нм), совпадающей с полосой поглощения фотосенсибилизатора и мощностью 1 Вт в течении 3-х минут с энергией 180 Дж при достижении температуры более 70°С.
Нижний предел плотности энергии используемых лазеров определяется температурой нагрева оболочки микроконтейнера, необходимой для ее разрушения, а верхний предел определяется уровнем плотности лазерной энергии, не вызывающей патологических изменений биоткани, в которой не содержатся плазмонно-резонансные наночастицы и фотосенсибилизатор. Концентрация плазмонно-резонансных золотых наночастиц в оболочке в микроконтейнерах должна находиться в определенном диапазоне. Максимальное значение концентрации плазмонно-резонансных золотых наночастиц определяется процессами образования кластеров, приводящих и к уширению плазменного резонанса, и смещению его максимума. Нижняя граница концентрации плазмонно-резонансных золотых наночастиц определяется эффективностью лазерного нагрева оболочки микроконтейнеров, вызавающих ее разрыв.
Динамика нагрева плазмонно-резонансных золотых наночастиц и фотосенсибилизаторов, а также пространственного распределения температуры исследовалась авторами как в эксперименте, так и моделировалось (Лазерный фототермолиз биотканей с использованием плазмонно - резонансных наночастиц. Максимова И.Л., Акчурин Г.Г. Терентюк Г.С., Хлебцов Б.Н., Акчурин Г.Г.мл., Ермолаев И.А., Скапцов А.А., Ревзина Е.М., Тучин В.В, Хлебцов Н.Г. Квантовая электроника, 2008, т.38, №6, с.536-542). Эксперименты, проведенные по облучению биотканей лабораторных крыс с введенными в опухоль золотыми плазмонно-резонансными наночастицами и последующим гистологическим анализом, были определены режимы лазерного облучения, вызывающий при фототермолизе биотканей локальный некроз клеток (см. статью I.L.Maksimova, G.G.Akchurin, B.N.Khiebtsov, G.S.Terentyuk, G.G.Akchurin, I.A.Ermolaev, A.A.Skaptsov, E.P.Soboleva, N.G.Khiebtsov and V.V. Tuchin. Near-infrared laser photothermal therapy of cancer by using gold nanoparticles: computer simulations and experiment. Medical Laser Application 2007, Vol.22, P.95-105-112).
Процесс фототермолиза опухолей лабораторных животных на основе ИК-фотосенсибилизатора типа Индоцианина - зеленого (IGG) и золотых нанооболочек исследован в Ргос.SPIE, 2007, vol.6645, G.G.AkchurinJr V.A.Bogatyrev, I.L.Maksimova, G.A.Seleverstov, G.S.Terentyuk, B.N.Khiebtsov, N.G.Khiebtsov, V.V.Tuchin. Near-infrared laser photothermal therapy and photodynamic inactivation of cells by using gold nanoparticles and dyes; а также представлен на Европейской международной конференции (19-20 ноября Брюссель) Photonics Life 2008, Georgy G. Akchurin, Garif G. Akchurin, Irina M. Maksimova, Boris N. Khiebtsov, Nikolay G. Khiebtsov, Georgy S. Terentyuk, Valery V. Tuchin. Technology ofNIR laser photothermal tissue treatment based on gold plasmon-resonant nanoparticles and ICG dye.
1. Способ селективного разрушения опухолей, включающий введение раствора фотосенсибилизатора и облучение опухоли лазерным излучением, совпадающим с максимумом полосы поглощения фотосенсибилизатора, отличающийся тем, что для локального разрушения опухоли фотосенсибилизатор капсулируют в полимерные микроконтейнеры, оболочка которых содержит наночастицы магнетита (Fе2O4), и вводят в биоткань, окружающую опухоль, в объеме опухоли создают внешнее постоянное магнитное поле, пространственная конфигурация которого совпадает с формой опухоли, а лазерное облучение производят через время, соответствующее максимальному накоплению микроконтейнеров в опухоли, при плотности энергии излучения, достаточной для фотодинамического или фототермического разрушения оболочек микроконтейнеров внутри опухоли и последующего фотодинамического или фототермического разрушения клеток раковой опухоли, при этом фотосенсибилизатор выбирают с полосой поглощения в красной и ближней ИК спектральной области 650-1200 нм.
2. Способ по п.1, отличающийся тем, что оболочка микроконтейнеров дополнительно содержит золотые наночастицы с плазмонным резонансом, совпадающим с максимумом поглощения фотосенсибилизатора при концентрации золотых наночастиц не менее 108 в см3.
3. Способ по п.1, отличающийся тем, что оболочка микроконтейнеров дополнительно содержит наночастицы золота с плазмонным резонансом в видимой и ближней ИК области 500-1200 нм, а для локального раскрытия микрокапсул их дополнительно облучают лазерным излучением.
4. Способ по п.1, отличающийся тем, что для локального разрушения оболочки микроконтейнеров дополнительно используют переменное высокочастотное магнитное поле в диапазоне частот десятки кГц - сотни мГц.