Способ получения 2-(бензилтио)пиримидин-4,6(1н,5н)диона
Иллюстрации
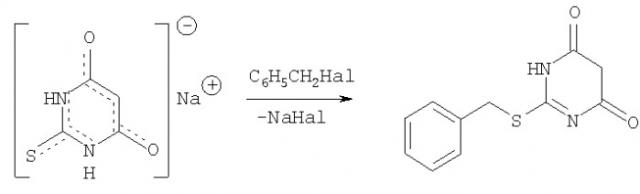
Показать всеИзобретение относится к улучшенному способу получения 2-(бензилтио)пиримидин-4,6(1Н,5Н)диона формулы
Данное соединение может быть использовано в качестве полупродукта для синтеза лекарственных препаратов. Способ заключается во взаимодействии натриевой соли, полученной после реакции конденсации тиомочевины с малоновым эфиром в присутствии метилата натрия, которую затем растворяют в водном диоксане, предпочтительно 50%, с последующим ее взаимодействием с бензилхлоридом при мольном соотношении 1:1,1 при комнатной температуре, предпочтительно 25°С, в течение 2 часов. Способ позволяет упростить процесс и получить целевой продукт с хорошим выходом.
Реферат
Предлагаемое изобретение относится к области синтеза гетероциклических соединений, конкретно к способу получения 2-(бензилтио)пиримидин-4,6(1H,5H)диона формулы
который может найти применение как полупродукт для синтеза лекарственных препаратов.
Наиболее близким является способ получения 2-(бензилтио)пиримидин-4,6(7H,5H)диона, полученного при взаимодействии 1 моля натриевой соли тиобарбитуровой кислоты (получают из тиомочевины, малонового эфира, метилата натрия) с 1 молем бензилгалогенида в среде водного спирта при 78°C в течение 2 ч (Giulina Biagi, Irene Giorgi, Oreste Livi, Federica Pacchini, Valerio Scartoni, Oreste LeRoy Salerni. New N6-Substituted 8-Alkyl-2-Phenylmethylsulfanyl-Adenines. J. Heterocyclic Chem., 2004, 41, 581, p.581).
Недостатками этого метода являются нетехнологичность способа, а именно многостадийность получения натриевой соли тиобарбитуровой кислоты, заключающегося в выделении тиобарбитуровой кислоты нейтрализацией натриевой соли, а затем вновь получение Na-соли нейтрализацией тиобарбитуровой кислоты NaOH, а также высокая температура синтеза 2-(бензилтио)пиримидин-4,6(1H,5H)диона (температура кипения спирта), что приводит к распаду исходного реагента, низкий выход продукта, который составляет 54%, причем целевой продукт загрязнен побочными продуктами и необходим сложный процесс очистки.
Задачей предлагаемого технического решения является разработка нового технологичного способа получения 2-(бензилтио)пиримидин-4,6(1H,5H)диона, позволяющего проводить синтез в среде водного диоксана при комнатной температуре.
Техническим результатом является получение 2-(бензилтио)пиримидин-4,6(7H,5H)диона с выходом 70%.
Предлагаемый технический результат достигается в способе получения 2-(бензилтио)пиримидин-4,6(1H,5H)диона формулы
заключающемся во взаимодействии натриевой соли тиобарбитуровой кислоты с бензилгалогенидом с последующим выделением целевого продукта, причем натриевую соль, полученную путем конденсации тиомочевины с малоновым эфиром в присутствии метилата натрия, растворяют в 50% водном диоксане с последующим ее взаимодействием с бензилхлоридом при мольном соотношении 1:1,1 при температуре 25°C в течение 2 часов.
Сущностью предлагаемого способа является нуклеофильное замещение атомов галогена в бензилгалогениде анионом 2-тиобарбитуровой кислоты с образованием целевого продукта с выходом 70%.
Выбранное мольное соотношение реагентов 1:1,1, температура синтеза 25°C, время 2 часа являются оптимальными, так как обусловлены максимальным выходом целевого продукта (70%).
Предлагаемый способ получения 2-(бензилтио)пиримидин-4,6(1H,5H)диона является технологичным, так как натриевую соль тиобарбитуровой кислоты непосредственно получают из тиомочевины, малонового эфира и метилата натрия, минуя стадию выделения тиобарбитуровой кислоты, достигается более высокий выход конечного продукта (70%), синтез ведут при комнатной температуре, при этом целевой продукт не загрязнен побочными продуктами.
Пример 1. Способ получения натриевой соли тиобарбитуровой кислоты.
В 4-горлый реактор, снабженный мешалкой, термометром, обратным холодильником и капельной воронкой, помещают 250 мл абсолютного метанола. Затем постепенно, небольшими кусочками, в течение 2 часов в реактор добавляют 15,3 г (0.665 моль) металлического натрия до его полного растворения. При этом наблюдается значительное повышение температуры.
Затем в реактор добавляют 50.55 г (0,665 моль) тиомочевины и перемешивают при температуре ~50°C в течение 1 часа. Затем прикапывают 101 мл (0,665 моль) малонового эфира и кипятят реакционную массу в течение 9 часов. Затем содержимое реактора охлаждают, Na-соль фильтруют, промывают водой, абсолютным этанолом, сушат. Выход 95,6 г (87%). Tпл>300°C.
Спектр ЯМР 1H, м.д.: 7.04 с (1H, CH), 10.04 с (2H, HN). Найдено, %: N 16.44.
C4H3N2O2SNa. Вычислено, %: N 16.86.
Предлагаемый способ осуществляется следующим образом.
В водно-диоксаном растворе растворяют натриевую соль, полученную после реакции конденсации тиомочевины с малоновым эфиром в присутствии метилата натрия, и подвергают взаимодействию с бензилгалогенидом при мольном соотношении 1:1,1 при температуре 25°C в течение 2 ч.
Пример 2. Способ получения 2-(бензилтио)пиримидин-4,6 (1H, 5H) диона.
К раствору 5 г (30,1 ммоль) Na-соли тиобарбитуровой кислоты в 100 мл водно-диоксанового раствора (50 мл воды и 50 мл диоксана) добавляют 3,8 мл (33,1 ммоль) бензилхлорида и перемешивают в течение 2 часов. Затем реакционную массу упаривают в вакууме, выпавшую твердую фазу фильтруют и кристаллизуют из абсолютного этанола. Выход 5,0 г (70%), т.пл. 230°C (с разл).
Спектр ЯМР 1H, м.д.: 4.78 с (2H, CH2-C=O), 5.15 с (2H, CH2-C6H5), 6.93-7.11 м (5H, Наром), 11.8 с (1H, NH). Найдено, %: N 11.63. C11H10N2O2S. Вычислено, %: N 11.96.
Таким образом, предложенный способ получения 2-(бензилтио)пиримидин-4,6(1H,5H)диона является технологичным, позволяет получать указанное соединение с хорошим выходом.
Способ получения 2-(бензилтио)пиримидин-4,6(1Н,5Н)диона формулы с использованием тиобарбитуровой кислоты и бензилгалогенида с последующим выделением целевого продукта, отличающийся тем, что получают натриевую соль тиобарбитуровой кислоты путем конденсации тиомочевины с малоновым эфиром в присутствии метилата натрия, которую затем растворяют в водном диоксане, предпочтительно 50%, с последующим ее взаимодействием с бензилхлоридом при мольном соотношении 1:1,1 при комнатной температуре, предпочтительно 25°С, в течение 2 ч.