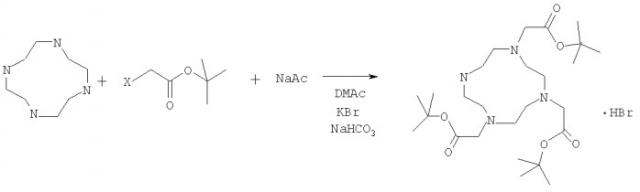
Синтез производных циклена
Иллюстрации
Показать всеОписывается усовершенствованный способ получения защищенного DO3A, такого как DO3A-три-трет-бутиловый эфир (три-трет-бутиловый эфир 1,4,7,10-тетраазациклододекан-1,4,7-триуксусной кислоты) формулы (I).
где R означает трет-бутил; Х- анион хлора, брома или иода; у означает 1, путем взаимодействия циклена и активированного эфира уксусной кислоты формулы (IV)
в присутствии смешиваемого с водой полярного растворителя, с последующим добавлением KBr при рН 9,0±0,5. Целевой продукт получают высокой степени чистоты. 7 з.п. ф-лы.
Реферат
Область техники
Данное изобретение относится к способу получения солей защищенного DO3A, таких как соли DO3A-три-трет-бутилового эфира.
Уровень техники
Магнитно-резонансная визуализация (МРВ) является хорошо известным и имеющим большие возможности методом исследования внутреннего строения человеческого тела. В качестве контрастных агентов для МРВ были предложены различные хелатные соединения лантаноидов с хелатообразующими агентами - макроциклическими соединениями на основе циклена. Такие макроциклические хелатообразующие агенты образуют особенно стабильные хелатные комплексы с создающими контраст парамагнитными ионами металлов, такими как гадолиний или диспрозий, и таким образом их можно применять в качестве носителей для этих ионов металлов, чтобы обеспечить соответствующее биологическое распределение и выведение.
Циклен (1,4,7,10-тетраазациклододекан) является ключевым соединением в получении многих из этих макроциклических хелатообразующих веществ. Группа три-N-алкилированных цикленов составляет другую важную группу соединений для получения таких макроциклических хелатообразующих соединений. DO3A (1,4,7,10-тетраазациклододекан-N,N',N”-триуксусная кислота) является одним из таких три-N-алкилированных цикленовых соединений, которые образуют основу для магнитно-резонансных (МР) контрастных агентов. Группой связанных с ним веществ являются защищенные формы соединения DO3A, такие как DO3A-три-трет-бутиловый эфир (три-трет-бутиловый эфир 1,4,7,10-тетраазациклододекан-1,4,7-триуксусной кислоты), в котором защищены все три карбоксильные группы.
Защищенные соединения DO3A, такие как DO3A-три-трет-бутиловый эфир и его соли, являются ценными промежуточными продуктами при получении МР контрастных агентов на основе DO3A, таких как, например, Gd(HP-DO3A) (ProHanceTM) и Gd(DO3A-бутрол) (GadovistTM).
DO3A-три-трет-бутиловый эфир представляет собой коммерчески доступный продукт, но помимо дороговизны эти коммерчески доступные продукты содержат примеси как ди-алкилированного, так и тетра-алкилированного циклена. Из уровня техники известны несколько способов получения этого соединения.
В US 5419893 описаны хелатообразующие агенты, такие как соединения на основе циклена, и их получение. Представлено получение DO3A-три-трет-бутилового эфира из циклена и трет-бутилбромацетата. Получение включает очистку с помощью флэш-хроматографии. Продукты получают в виде свободных оснований.
В WO 2005/003105 представлен способ получения триалкилированных 1,4,7,10-тетраазациклододеканов с помощью реакции циклена и соответствующих электрофильных компонентов. Эта реакция происходит в апротонном растворителе, например в хлороформе. Продукт очищают с помощью колоночной хроматографии. Продукты получают в виде свободных оснований.
Как указано выше, DO3A-три-трет-бутиловый эфир является важным исходным материалом для получения макроциклических хелатообразующих агентов и МР-контрастных агентов. Имеющийся в продаже DO3A-три-трет-бутиловый эфир дорог и содержит примеси. Существующие способы синтеза требуют дорогостоящей очистки, занимающей много времени, например хроматографической, что является особенным недостатком при крупномасштабном производстве. Таким образом, имеется необходимость в новом способе получения DO3A-три-трет-бутилового эфира, менее дорогостоящем и обеспечивающем продукт более высокой чистоты.
Сущность изобретения
В соответствии с указанной необходимостью, в данном изобретении предложен усовершенствованный способ получения защищенного DO3A, например DO3A-три-трет-бутилового эфира (три-трет-бутиловый эфир 1,4,7,10-тетраазациклододекан-1,4,7-триуксусной кислоты). Эти соединения получают в виде солей. Способ включает процедуру обработки, обеспечивающую DO3A-три-трет-бутиловый эфир в виде соли повышенной чистоты.
Подробное описание изобретения
С точки зрения одного из аспектов данного изобретения предложен способ получения защищенной соли DO3A формулы I,
где R представляет собой карбоксильную защитную группу, например, выбранную из группы алкилов, таких как C1-С6 алкилы, арилов и замещенных арилов. Предпочтительными группами R являются метил, пропил, бензил и трет-бутил. Наиболее предпочтительной группой R является трет-бутил. Х представляет собой анион хлора, брома или иода или группу, содержащую сульфонат или фосфат; у представляет собой целое число от 1 до 4, и предпочтительно является 1.
Если Х содержит фосфатную группу, то получается соль на основе фосфорной кислоты (H3PO4), фосфоновой кислоты (R'PO3H2) или фосфиновой кислоты (R'R”PO2H), где R' и R” представляют собой низшие алкильные группы, например C1-С6 алкилы. Если Х содержит сульфонатную группу, то эта группа может дополнительно включать низшую алкильную группу, такую как C1-С6 алкил, например, образуя соль с метил-SO3H.
С точки зрения предпочтительного варианта реализации данного изобретения предложен способ получения DO3A-три-трет-бутилового эфира формулы II в виде соли.
Более предпочтительно, в данном изобретении предложен способ получения моно-соли соединений формулы I, такой как HBr соли DO3A-три-трет-бутилового эфира (гидробромид трет-бутилового эфира 4,7-бис-трет-бутоксикарбонилметил-(1,4,7,10-тетрааза-циклододец-1-ил)-уксусной кислоты).
Способ получения соединений формулы (I) согласно изобретению обеспечивает новую процедуру обработки, включающую оптимизированное осаждение, обеспечивающее материал высокой чистоты с высокими выходами. Эта новая процедура обработки селективно обеспечивает высокие выходы три-N-алкилированного продукта в виде соли. Обнаружено, что получать защищенный DO3A формулы I, такой как DO3A-три-трет-бутиловый эфир, высокой чистоты намного проще, если получать его в виде соли, по сравнению с его получением в виде свободного основания. Обнаружено, что получение три-N-алкилированного продукта в чистом виде значительно возрастает при осаждении этого продукта в виде его соли. Большим преимуществом способа по данному изобретению является то, что соль три-алкилированного продукта можно отделить от побочных продуктов осаждением и нет необходимости в дальнейшей очистке осажденного конечного продукта в виде соли (или она минимальна). Этот простой способ является особенно выгодным при получении продукта в больших количествах.
Все исходные материалы, растворители и вспомогательные реагенты, например основания, имеются в продаже. Процедуру легко осуществить и не требуется каких-либо специальных реагентов или жестких условий реакции.
В первом варианте реализации данного изобретения предложен способ получения соединений формулы I, включающий стадии:
(1) взаимодействия циклена и алкилирующего агента, который представляет собой активированный эфир уксусной кислоты, с образованием смеси, при этом смесь содержит защищенный DO3A;
(2) регулирования рН этой смеси до 9,0±0,5;
(3) добавления соли к этой смеси;
(4) сбора осажденного продукта.
Эти стадии можно проводить в указанном порядке или же, в альтернативном случае, можно менять порядок стадий (2) и (3), так что добавление соли (3) проводят перед регулированием рН (2). Предпочтительно эти стадии проводят в приведенном порядке. Все стадии дополнительно описаны ниже.
После регулирования рН и добавления соли начинает выпадать осадок кристаллического вещества. Процесс дополнительно включает возможные стадии, ускоряющие образование осадка и обеспечивающие полноту его образования, в дополнение к сбору и сушке осадка, с получением соли защищенного DO3A формулы (I) высокой чистоты и с высоким выходом. Селективное осаждение три-алкилированного продукта формулы (I) является результатом сочетания оптимизации алкилирования на стадии (I) и регулирования рН на стадии (2).
Стадия (1) включает реакцию 1,4,7,10-тетраазациклододекана (циклена) формулы (III)
с активированным эфиром уксусной кислоты формулы (IV), действующим как алкилирующий агент,
где X' представляет собой легко замещаемую группу, выбранную из группы хлора, брома, иода, сульфонатов и фосфатов. Предпочтительно X' представляет собой бром. R представляет собой карбоксильную защитную группу, выбранную из группы алкилов, таких как C2-С6 алкилы, арилы и замещенные арилы. Предпочтительными R-группами являются метил, пропил, бензил и трет-бутил. Более предпочтительно, R представляет собой трет-бутил. Наиболее предпочтительно, алкилирующий агент формулы IV представляет собой трет-бутилбромацетат формулы (V).
Реакцию стадии (1) проводят в присутствии растворителя. Для оптимизации стадии алкилирования алкилирующий агент растворяют в смешиваемом с водой полярном растворителе, например, включающем группы амида, нитрила, кетона или спирта. Предпочтительно растворитель представляет собой N,N-диметилацетамид. Получают суспензию циклена и вспомогательного слабого основания в смешиваемом с водой полярном растворителе. Растворитель для циклена предпочтительно является тем же самым растворителем, который используют для алкилирующего агента, то есть предпочтительно N,N-диметилацетамидом. Слабым основанием является, например, триэтиламин или ацетат натрия. Задачей этого основания является удаление протонов циклена. Раствор алкилирующего агента добавляют к суспензии циклена, предпочтительно по каплям, при перемешивании.
Количества компонентов выбирают в количестве, достаточном для получения трехзамещенного алкилпроизводного циклена. Соотношение между компонентами реакции на стадии (1) предпочтительно составляет около 3 мольных эквивалентов алкилирующего агента, 3 мольных эквивалентов слабого основания на один мольный эквивалент циклена. Чтобы более подробно узнать соответствующие количества реагентов, растворителей и вспомогательных реагентов, следует обратиться к примерам 1 и 2.
После добавления алкилирующего агента реакционный сосуд, содержащий реакционную смесь стадии (1), герметизируют и суспензию предпочтительно оставляют до тех пор, пока реакция не завершится, обычно на несколько суток, например 1-8 суток, например 3-5 суток. Было обнаружено, что 3 суток достаточно для получения соли DO3A-три-трет-бутилового эфира. В течение этого периода реакционную суспензию выдерживают при перемешивании.
Реакцию стадии (1) можно провести в широком интервале температур, например при температуре от 0 до 30°С. В ходе добавления алкилирующего агента к циклену температуру практически поддерживают от 0 до 10°С, например от 0 до 5°С. После завершения добавления алкилирующего агента температуру реакционной суспензии предпочтительно повышают примерно до температуры окружающей среды, например до температуры от 18 до 30°С, более предпочтительно до температуры 20-25°С, и поддерживают на этом уровне температуры до тех пор, пока реакция не будет завершена. Если температуру повышают значительно выше этого уровня, чаще происходит чрезмерное алкилирование и более вероятно образование примесей, таких как тетраалкилированные продукты. При использовании способа согласно изобретению количество тетра-алкилированных продуктов, образующихся на стадии (1), поддерживают на минимальном уровне. Рекомендуется, особенно при крупномасштабном производстве, снижать температуру при проведении начального добавления алкилирующего агента во избежание образования примесей тетра-алкилированного продукта. Основным продуктом стадии алкилирования (1) является триалкилированный циклен формулы (I) в его несолевой форме. Основным побочным продуктом является диалкилированный продукт. Однако этот побочный продукт является более растворимым в смеси стадии (1), чем триалкилированный продукт, и не осаждается при регулировании рН и добавлении соли на следующих стадиях.
Смесь стадии (1), которая представляет собой суспензию или пульпу, можно получить при других условиях, используя другие растворители и вспомогательные вещества, чем описанные выше, в зависимости от того, какой получают продукт формулы (I) в несолевой форме. Альтернативные растворители можно выбрать, например, в зависимости от используемых карбоксильных защитных групп.
После проведения стадии (1) реакционную смесь стадии (1) можно вылить в воду. Добавление воды является предпочтительным, поскольку это обеспечивает гомогенный прозрачный раствор. Количество воды является, например, 1-10-кратным относительно объема реакционной суспензии или более предпочтительно 3-8-кратным относительно объема реакционной суспензии. При крупномасштабном производстве количество воды лучше поддерживать в нижней части предложенного диапазона, поскольку основной задачей является получение гомогенного раствора. Температура воды примерно равна комнатной температуре, например 18-30°С, или же между 20 и 25°С.
На стадии (2) величину рН регулируют посредством добавления основания до 9,0±0,5, предпочтительно до 8,7-9,3, более предпочтительно до 8,9-9,1 и наиболее предпочтительно примерно до 9,0. Значения рКа азотсодержащих молекул моно-, ди-, три- и тетра-алкилированных продуктов различаются. Установлено, что оптимизация рН в указанном диапазоне гарантирует отделение три-алкилированного продукта от любых низко- и высокоалкилированных побочных продуктов, присутствующих в реакционной смеси стадии (1), так как моно-, ди-, три- и тетра-алкилированные продукты осаждаются при данном рН в различной степени. В результате любые примеси более растворимого ди-алкилированного продукта, который является вероятным основным побочным продуктом, сохраняются в растворе при предпочтительном значении рН и не осаждаются при получении конечного солевого продукта. Используемое основание предпочтительно добавляют в твердой форме и выбирают из группы, включающей карбонат натрия, бикарбонат натрия, карбонат калия, бикарбонат калия, гидроксиды щелочных металлов и фосфат натрия. Более предпочтительным является добавление NaHCO3 в твердой форме.
На стадии (3) к смеси, например к раствору стадии (2), добавляют соль, содержащую анион X, где Х выбирают из группы, включающей анионы хлора, брома и йода или группу, содержащую сульфонат или фосфат; предпочтительным является анион брома. Группы сульфоната и фосфата могут содержать низшую алкильную группу, например алкильную цепь C1-C6. X предпочтительно является такой же группировкой, как и X' в активированном эфире уксусной кислоты формулы IV. Добавленная соль представляет собой, например, соль калия (то есть КХ), поскольку соли калия обычно имеют хорошую стабильность. Наиболее предпочтительно на стадии (3) добавляют KBr, а на стадии (1) предпочтительно используют трет-бутилбромацетат.
В одном из вариантов реализации данного изобретения стадия (3) включает добавление соли к смеси, полученной на стадии (1), перед регулированием рН (стадия (2)). В этом варианте реализации реакционную смесь стадии (1) предпочтительно выливают в воду, содержащую указанную соль. Вода имеет температуру, которая позволяет растворить эту соль или которая позволяет провести созревание по Оствальду. Температура воды составляет, например, 26-100°С, более предпочтительно 40-100°С и наиболее предпочтительно 45-55°С. Предпочтительно получают прозрачный раствор. Преимуществами процесса согласно данному варианту реализации является то, что стадия (4), включающая сбор продукта, ускорена, поскольку процесс фильтрации упрощается благодаря получению более крупных частиц.
Количество указанной соли, добавленной на стадии (3), составляет, например, 0,3-4-кратное количество от мольного количества алкилирующего агента на стадии (1) и предпочтительно составляет 0,6-3-кратное количество от мольного количества алкилирующего агента.
Соль добавляют к смеси предпочтительно при перемешивании. В том случае, когда и отрегулирован рН, и добавлена соль, начинает образовываться кристаллический осадок. Для достижения быстрого и полного осаждения стадия (4) предпочтительно должна включать возможную дополнительную стадию добавления к раствору соли стадии (3) неполярного растворителя, например простого эфира. Этот простой эфир предпочтительно добавляют после полного растворения соли, добавленной на стадии (3). Простой эфир выбирают, например, из стандартных простых эфиров, таких как низшие алкиловые эфиры, диметоксиэтан, диглим, триглим, ТГФ, t-BuOMe, изопропиловый эфир и диэтиловый эфир. Более предпочтительным является добавление диэтилового эфира. Приемлемым является количество примерно от 10 до 20% об. от общего количества растворителя. Обнаружено, что добавление эфира улучшает выход при крупномасштабном синтезе, а также увеличивает скорость осаждения полярной соли.
Стадия (4) включает стадию сбора осажденной соли, например, путем фильтрации или центрифугирования, например, через 0,5-4 часов, например примерно через 2 часа. Затем из собранного продукта удаляют используемые растворители, предпочтительно путем испарения, например путем испарения при повышенной температуре и/или пониженном давлении (например, под вакуумом), с получением продукта в сухом виде.
Коммерчески доступный DO3A-три-трет-бутиловый эфир содержит некоторые примеси тетраалкилированного циклена (тетра-трет-бутиловый эфир 1,4,7,10-тетрааза-циклододекан-тетрауксусной кислоты) и некоторые количества ди-алкилированного циклена (ди-трет-бутиловый эфир 1,4,7,10-тетраазациклододекан-диуксусной кислоты). Процедура обработки согласно изобретению обеспечивает получение соли DO3A-три-трет-бутилового эфира высокой чистоты. Процедура обработки, описанная здесь, гарантирует отделение желаемого трехзамещенного продукта от реакционной смеси, которая может также содержать моно-, ди- и тетра-замещенные производные. Полученный продукт в соответствии со стандартными уровнями обнаружения практически не содержит диалкилированного продукта, обнаруженного в нежелательных количествах в коммерчески доступном DO3A-три-трет-бутиловом эфире. Любые примеси тетраалкилированного продукта со стадии (1) не осаждаются в виде соли. Чистоту полученного продукта можно контролировать различными аналитическими методами, такими как, например, ЯМР, для подтверждения структуры и определения чистоты продукта; жидкостная хроматография высокого разрешения для определения чистоты и газовая хроматография для определения наличия остаточных растворителей. Продукт, полученный с помощью описанного способа, например HBr соль DO3A-три-трет-бутилового эфира, имеет чистоту по меньшей мере 95%, более предпочтительно по меньшей мере 99% и наиболее предпочтительно по меньшей мере 99,9%.
Способ согласно данному изобретению обеспечивает получение защищенной соли DO3A формулы (I) с хорошим выходом, предпочтительно с выходом выше 60%, более предпочтительно выше 70%, наиболее предпочтительно выше 80% в расчете на мольное количество циклена. Получены высокие выходы DO3A-три-трет-бутилового эфира в виде HBr соли, достигающие 81,5%. Обычным результатом является выход 73%.
Другим аспектом данного изобретения являются соединения формулы I в виде солей, при этом предпочтительным соединением является соль DO3A-три-трет-бутилового эфира, предпочтительно HBr-моно-соль.
Еще одним аспектом данного изобретения являются соединения формулы I, полученные описанным способом.
Защищенный DO3A или его соль можно использовать при получении DO3A путем снятия защиты групп уксусной кислоты. Защитные группы можно удалить с помощью стандартных методов, например с помощью гидролиза, гидрогенолиза и т.д., например, обрабатывая трифторуксусной кислотой или муравьиной кислотой, с получением свободных кислот DO3A или его производные могут образовывать комплексные соединения с атомом парамагнитного металла и применяются в качестве улучшающих релаксацию агентов для магнитно-резонансной визуализации. Альтернативно, из соли DO3A-три-трет-бутилового эфира, например из HBr-соли, можно получить МР контрастные агенты, такие как имеющийся в продаже продукт ProHanceTM, используя стадию алкилирования или раскрытия эпоксидного цикла соли DO3A-три-трет-бутилового эфира в присутствии основания, или, альтернативно, путем высвобождения свободного основания DO3A-три-трет-бутилового эфира в отдельной стадии. Алкилирование включает, например, присоединение гидроксипропильной группы к реакционноспособному вторичному амину. После этого можно осуществить снятие защиты и, в завершение, образование комплекса с Gd3+ или другим парамагнитным ионом металла.
Ниже данное изобретение дополнительно проиллюстрировано посредством следующих не ограничивающих его примеров.
Примеры
Пример 1: Получение HBr-соли DO3A-три-трет-бутилового эфира.
Трет-бутилбромацетат (77,1 мл, 522 ммоль) в N,N-диметилацетамиде (ДМАА) (150 мл) добавляли по каплям к перемешиваемой суспензии 1,4,7,10-тетраазациклододекана (30 г, 174 ммоль) и ацетата натрия (NaAc) (42,9 г, 522 ммоль) в N,N-диметилацетамиде (400 мл) при 0°С в течение 25 минут. После последнего добавления реакционной суспензии дали нагреться до комнатной температуры. Реакционный сосуд плотно закрыли стеклянной пробкой и белую суспензию оставили перемешиваться в течение 5 суток. Реакционную суспензию вылили в воду (2000 мл) с образованием светло-желтого раствора.
Величину рН раствора доводили до 9 путем прибавления твердого NaHCO3. При механическом перемешивании добавляли KBr (30,0 г, 252 ммоль) и после полного растворения соли добавляли диэтиловый эфир (10 мл). Через несколько минут осаждалось белое кристаллическое вещество. Через один час этот осадок отфильтровывали и сушили под вакуумом с образованием гидробромида трет-бутилового эфира (4,7-бис-трет-бутоксикарбонилметил-1,4,7,10-тетрааза-циклододец-1-ил)-уксусной кислоты в виде белого порошка (77,3 г, 73%).
Анализ:
Рассчитано для С26Н53 BrN4O6: С, 52,25%; Н 8,94; N 9,37; О 16,06.
Найдено: С 52,2; Н 8,7; N 9,0; О 16,6.
Пример 2: Альтернативный вариант получения HBr-соли DO3A-три-трет-бутилового эфира.
Трет-бутилбромацетат (77,1 мл, 522 ммоль) в N,N-диметилацетамиде (150 мл) добавляли по каплям к перемешиваемой суспензии 1,4,7,10-тетраазациклододекана (30 г, 174 ммоль) и ацетата натрия (42,9 г, 522 моль) в N,N-диметилацетамиде (400 мл) при 0°С в течение 25 минут. После последнего прибавления реакционную суспензию оставили нагреваться до комнатной температуры. Реакционный сосуд плотно закрыли стеклянной пробкой и белую суспензию оставили при перемешивании на 5 суток.
Реакционную суспензию вылили в теплую воду (50°С, 2000 мл), содержащую растворенный KBr (30,0 г, 252 ммоль), с образованием светло-желтого раствора.
Величину рН доводили до 9 путем добавления твердого NaHCO3. Через несколько минут осаждалось белое кристаллическое вещество. Суспензии дали охладиться до комнатной температуры при медленном перемешивании, а затем осадку дали осадиться без перемешивания в течение 4 часов. Осадок отфильтровали и высушили под вакуумом с образованием гидробромида трет-бутилового эфира (4,7-бис-трет-бутоксикарбонилметил-1,4,7,10-тетрааза-циклододец-1-ил)-уксусной кислоты в виде белого порошка (77,3 г, 73%).
Результаты ЯМР: ДМСО-D6 (400 МГц); 8,92 (2Н), 3,41 (4Н), 3,35 (2Н), 2,98 (4Н), 2,84 (4Н), [2,71 (4Н) 2,67 (4Н)]. Неразрешенная АВ система, 1,42 (27Н).
1. Способ получения соединений формулы (I) где R представляет собой трет-бутил;Х представляет собой анион хлора, брома или йода;у представляет собой 1;причем способ включает стадии:(1) взаимодействия циклена и активированного эфира уксусной кислоты формулы (IV) представляющего собой алкилирующий агент,где X' представляет собой легко замещаемую группу, выбранную из группы хлора, брома, йода,в присутствии смешиваемого с водой полярного растворителя,с получением смеси;(2) доведения рН этой смеси до 9,0±0,5;(3) добавления к этой смеси KBr;(4) сбора осажденного продукта,где стадию (3) проводят до или после стадии (2).
2. Способ по п.1, в котором стадию (2) проводят перед стадией (3).
3. Способ по п.1, в котором стадию (3) проводят перед стадией (2).
4. Способ по п.1 для получения соединения формулы (I), в котором Х представляет собой бром.
5. Способ по п.1, в котором растворителем является N,N-диметилацетамид.
6. Способ по п.1, в котором стадия (2) включает регулирование рН путем добавления карбоната натрия, бикарбоната натрия, карбоната калия, бикарбоната калия, гидроксидов щелочных металлов или фосфата натрия.
7. Способ по п.1, в котором стадия (4) включает добавление неполярного растворителя к смеси стадии (3).
8. Способ по п.1, в котором стадия (4) включает сбор продукта путем фильтрации или центрифугирования с последующей сушкой этого продукта.