Способ выявления микобактерий туберкулеза генотипа beijing
Иллюстрации
Показать всеИзобретение относится к медицине, а именно к фтизиатрии. Стандартным методом определения штаммов Mycobacterium tuberculosis генотипа Beijing является сполиготипирование, которое основано на анализе структуры хромосомы М. tuberculosis в области прямых повторов, разделенных вариабельными спейсерами. Метод гибридизационного анализа полиморфизма длин рестрикционных фрагментов ДНК, содержащих инсерционный элемент IS6110 (метод IS6110-RFLP), применяемый для дифференциации штаммов микобактерий туберкулеза, в т.ч. и штаммов генотипа Beijing, не может быть использован для характеристики генотипа Beijing как единого генетического семейства из-за разнообразия получаемых профилей рестрикции. В соответствии с изобретением выявляют амплифицированные в ПЦР специфические фрагменты ДНК (участков генома между близкорасположенными копиями элемента IS6110) размером 290 пн и 470 пн для «древних» (атипичных) штаммов Beijing или размером 260 пн, 290 пн и 470 пн для «современных» (типичных) штаммов Beijing М. tuberculosis. Анализ результатов проводят путем электрофореза продуктов ПЦР в горизонтальном агарозном мини-геле. Использование способа обеспечивает быструю и надежную детекцию микобактерий туберкулеза генотипа Beijing. 6 ил.
Реферат
Изобретение относится к медицине, а именно к фтизиатрии, и может быть использовано для лабораторного определения микобактерий туберкулеза, относящихся к генотипу Beijing.
Возбудитель туберкулеза человека - Mycobacterium tuberculosis - имеет клональную структуру популяции, т.е. внутри вида М. tuberculosis выделяют отдельные генетические семейства (линии или генотипы), которые могли сформироваться в различных географических регионах. Со временем некоторые генотипы возбудителя распространились по всему миру [Sola et al., 2001]. Примером такого убиквитарного генотипа М. tuberculosis является генетическое семейство (генотип) Beijing, вероятно, возникшее в северном Китае. Штаммы генотипа Beijing были впервые выявлены у больных туберкулезом в окрестностях Пекина, что и объясняет название (Пекин - англ. Beijing) [van Soolingen et al., 1995; Kremer et al., 2004; Mokrousov et al., 2005]. В настоящее время штаммы М. tuberculosis, принадлежащие к этому семейству, выделяют в различных странах, в том числе и в России (40-60% больных туберкулезом) [Нарвская и др., 2002; Bifani et al., 2002; Drobniewski et al., 2005]. Эффективное применение современных схем лечения туберкулеза затруднено селекцией и циркуляцией гипервирулентных мультирезистентных штаммов М. tuberculosis, устойчивых к основным противотуберкулезным препаратам, рифампицину (RIF) и изониазиду (INH) [Zhang et al., 1999; Lopez et al., 2003]. Исследования, проведенные в различных регионах России, показали, что большинство таких штаммов принадлежат к генетическому семейству Beijing [Вишневский и др., 2002; Narvskaya et al., 2002; Cox et al., 2005]. Следовательно, выявление штаммов этого генотипа является важной составляющей диагностики туберкулеза и имеет существенное значение для выбора адекватного лечения.
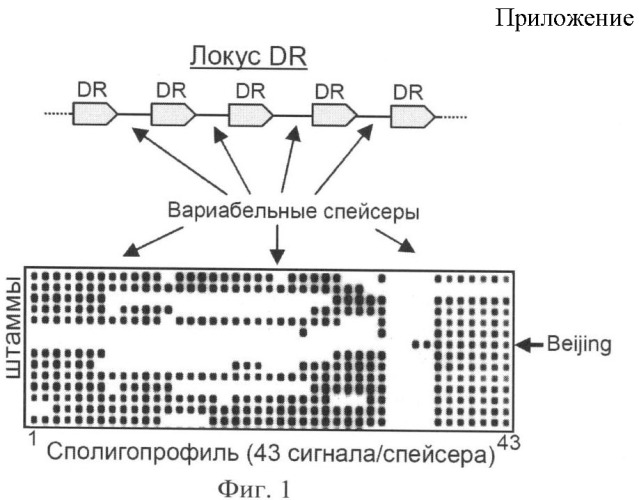
Стандартным методом определения штаммов Beijing является сполиготипирование, которое основано на анализе структуры хромосомы М. tuberculosis в области прямых повторов (DR-локус), разделенных вариабельными спейсерами [Kamerbeek et al., 1997]. Метод требует проведения полимеразной цепной реакции (ПЦР) и последующей ДНК-гибридизации с иммобилизованными на мембране зондами в специальном приборе (миниблоттере) и выявлением сигналов хемилюминесценции на светочувствительной пленке. Являясь «золотым стандартом» выявления принадлежности М. tuberculosis к генотипу Beijing, метод неприменим для использования в практических бактериологических лабораториях (Фиг.1).
Метод гибридизационного анализа полиморфизма длин рестрикционных фрагментов ДНК, содержащих инсерционный элемент IS6110 (метод IS6110-RFLP), применяется для геномной дактилоскопии и дифференциации штаммов микобактерий туберкулеза, в т.ч. и штаммов генотипа Beijing [van Embden et al., 1993]. Метод IS6110-RFLP позволяет различать штаммы, что полезно для решения задач эпидемиологии, однако разнообразие получаемых профилей IS6110-RFLP штаммов Beijing не позволяет использовать этот метод для характеристики генотипа Beijing как единого генетического семейства (Фиг.2).
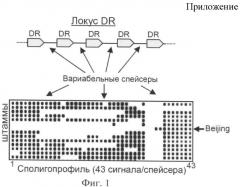
Среди штаммов семейства Beijing выделяют две подгруппы на основе наличия («современные» или типичные штаммы) или отсутствия («древние» или атипичные штаммы) инсерции IS6110 в локусе NTF (Фиг.3) [Plikaytis et al., 1994]. В российской популяции М. tuberculosis преобладают «современные» штаммы Beijing (95%), в то время как, например, в китайской и вьетнамской популяциях доля «древних» штаммов относительно выше (25%) [Mokrousov et al., 2002, 2006]. Предполагают, что две подгруппы могут различаться по механизмам развития лекарственной устойчивости [Mokrousov et al., 2006].
Недостатками указанных методов сполиготипирования и IS6110-RFLP являются трудоемкость и длительность, сложность и/или неоднозначная интерпретация результата.
В качестве прототипа предлагается метод блот-гибридизации хромосомной ДНК М. tuberculosis, обработанной рестриктазой PvuII. Фрагменты рестрикции ДНК, разделенные при электрофорезе в агарозном геле, переносят на нейлоновую мембрану и подвергают гибридизации с меченым фрагментом инсерционного элемента IS6110; результат, т.е. профили гибридизации, выявляют колориметрически или хемилюминесценцией [van Embden et al., 1993]. Метод требует использования специального оборудования для переноса ДНК по Саузерну и для гибридизации. Кроме того, метод требует выделения большого количества очищенной ДНК и длительных процедур рестрикции ДНК, разделения в агарозном геле, переноса по Саузерну и собственно гибридизации. В целом процедура занимает не менее 5-6 дней.
Задачей предлагаемого изобретения является разработка способа быстрой и надежной детекции микобактерий туберкулеза генотипа М. tuberculosis.
Поставленная задача достигается выявлением амплифицированных в ПНР специфических фрагментов ДНК (участков генома между близкорасположенными копиями элемента IS6110) размерами 290 пн и 470 пн - для «древних» штаммов Beijing или размерами 260 пн, 290 пн и 470 пн - для «современных» штаммов Beijing М. tuberculosis. Анализ результатов проводится путем электрофореза продуктов ПНР в горизонтальном агарозном мини-геле. Сущность изобретения поясняется чертежами.
Фиг.1. Сполиготипирование, профили микобактерий туберкулеза (профиль Beijing указан стрелкой).
Фиг.2. Профили IS6110-RFLP: пример разнообразия профилей штаммов генотипа Beijing.
Фиг.3. Схематическое изображение локуса NTF и возможных инсерций.
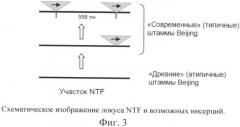
Фиг.4. Схема инвертированной 1S6110-ПЦР и позиции праймеров Ris1 и Ris2.
Фиг.5. Профили инвертированной 1S6110-ПЦР штаммов микобактерий туберкулеза.
Фиг.6. Примеры профилей инвертированной 1S6110-ПЦР штаммов микобактерий туберкулеза из Китая (а), Вьетнама (b), Болгарии (с), России (d). Bj - генотип Beijing. *, «древний» (атипичный) вариант генотипа Beijing. Стрелки показывают ПЦР-фрагменты, специфические для генотипа Beijing. М, маркер молекулярных весов «100 bp DNA ladder».
Преимущества предлагаемого способа:
- быстрота (один день от момента выделения ДНК),
- простая и однозначная интерпретация результатов,
- простое оборудование для стандартной ПЦР и агарозного гель-электрофореза,
- возможность быстрого анализа больших коллекций штаммов М. tuberculosis для оценки их принадлежности к генотипу Beijing с диагностической целью и при популяционных исследованиях,
- возможность использования грубых препаратов ДНК (клеточных лизатов) для быстрой диагностики.
Способ осуществляется следующим образом.
Выделение ДНК из культуры М. tuberculosis, выращенной на среде Левенштейна-Иенсена, проводят по van Embden et al. [1993] при выделении очищенной ДНК и по Mazars et al. [2001] при получении клеточных лизатов. В первом случае суспендируют 1 стандартную бактериологическую петлю культуры в 400 мкл буфера ТЕ х1 и инкубируют 20 мин при 85°С. Дальнейшую обработку проводят с использованием лизоцима, протеиназы К, додецилсульфата натрия и цетилтриметиламмонийбромида. Полученный лизат обрабатывают смесью фенол-хлороформ-изоамиловый спирт (25:24:1), центрифугируют, осаждают изопропанолом, промывают 70% этанолом, осадок высушивают и растворяют в 30-50 мкл ТЕ х0.5. При получении грубого препарата ДНК (клеточного лизата) 1 петлю культуры суспендируют в 100 мкл буфера ТЕ х1, кипятят 20 мин на водяной бане, центрифугируют 15 мин (12000 об/мин) и полученный супернатант используют для ПЦР.
Материал для ПЦР - чистая ДНК или клеточный лизат. Амплификацию фрагментов ДНК, расположенных между соседними копиями IS6110, проводят методом ПЦР с использованием двух праймеров: Ris1 и Ris2 (Фиг.4). Продукты ПЦР разделяют методом электрофореза в 1.5% агарозном геле. В качестве контрольной используют ДНК типичного («современного») штамма Beijing. Наличие профиля из двух или трех характерных фрагментов свидетельствует о принадлежности изучаемых ДНК к генотипу Beijing (Фиг.5).
Способ использует два инвертированных праймера Risi и Ris2, расположенных на терминальных участках элемента IS6110 и амплифицирующих участки генома между соседними элементами (Фиг.4).
Следующие праймеры были использованы для ПЦР: Risi (5'-GGCTGAGGTCTCAGATCAG) и Ris2 (5′-ACCCCATCCTTTCCAAGAAC) [Ross, Dwyer, 1993]. Очищенная ДНК (0.1-0.5 мкл) или клеточный лизат (супернатант, 4 мкл) добавляется к смеси ПЦР (конечный объем 30 мкл) содержащей 3,5 mM MgCl2, 1 U Taq ДНК полимеразы (Силекс, Москва), 200 µМ каждого из дНТФ, праймеры Ris1 и Ris2 (по 30 пмоль). ПЦР проводили в термоциклере РТС-100 (MJ Research, Inc.) в следующих условиях: 95°С, 3 мин; далее 33 цикла (для чистой ДНК) или 36 циклов (для лизатов) 94.5°С, 50 с, 56°С, 50 с, 72°С, 1 мин; заключительная элонгация 72°С, 3 мин. Продукты ПЦР (10 µ1) разделяли электрофорезом в 1,5% агарозном геле и визуализировали на УФ-трансиллюминаторе.
Оценка результатов.
При наличии в образце штамма Beijing ПЦР-продукт представляет собой набор ярких полос, представленных амплифицированными фрагментами ДНК размерами 290 пн и 490 пн и, в случае «современного» варианта Beijing, дополнительным фрагментом 260 пн. Определение длин фрагментов проводят путем сравнения с маркером молекулярных весов (например, 100bр ladder) или непосредственно путем сравнения с профилем амплифицированных фрагментов контрольного штамма генотипа Beijing (Фиг.5). Наличие неярких дополнительных полос в профилях оценивается как неспецифическое и не учитывается.
Специфичность амплификации межгенных участков, расположенных между соседними копиями IS6110, была подтверждена применением жестких условий амплификации, в т.ч. повышением температуры отжига праймеров, использованием различных концентраций MgCl2 (до 1,5 mM), а также различных вариантов ДНК-полимераз и термоциклеров. Во всех случаях специфичный и характерный профиль из двух или трех полос был получен при электрофорезе для штаммов генотипа Beijing.
Пример 1. Анализ 865 проб ДНК штаммов микобактерий туберкулеза, выделенных в 1997-2007 гг. в России (N=575), Китае (N=117), Вьетнаме (N=122), Болгарии (N=51), был проведен методами сполиготипирования (использован в качестве «золотого» стандарта идентификации генотипа Beijing) и методом инвертированной IS6110-ПЦР, предлагаемым в настоящей заявке в качестве способа быстрой детекции М. tuberculosis генотипа Beijing. Была определена принадлежность 408 штаммов М. tuberculosis к генотипу Beijing (Фиг.6). При этом результаты анализа обоими методами полностью совпали. Дополнительно 61 штамм М. tuberculosis Beijing был определен как относящийся к «древнему» варианту этого генотипа, при этом результаты анализа локуса NTF и инвертированной IS6110-ПЦР совпали. Таким образом, предлагаемый способ обеспечивает высокую чувствительность определения штаммов микобактерий туберкулеза генотипа Beijing и его «древнего»/атипичного и «современного»/типичного вариантов.
Пример 2. Анализ проб из 163 клеточных лизатов штаммов микобактерий туберкулеза. В 148 случаях были получены ПЦР-профили, из которых в 112 было определено присутствие микобактерий туберкулеза генотипа Beijing. Сравнение с последующими результатами сполиготипирования подтвердило результат инвертированной IS6110-ПЦР. Отсутствие амплификации для некоторых лизатов связано с ингибированием ПЦР и/или недостаточным количеством ДНК, поэтому эффективность метода применительно к клеточным лизатам составила 90,8%.
Источники информации
1. Вишневский Б.И., Нарвская О.В., Васильева С.Н. и др. Вирулентность микобактерий туберкулеза // Пробл. туб. - 2002. - №10. - С.33-36.
2. Нарвская О.В., Мокроусов И.В., Лимещенко Е.В. и др. Характеристика циркулирующих на Северо-Западе России штаммов Mycobacterium tuberculosis с использованием сполиготипирования // Пробл. туб. - 2002. - №4. - С.44-47.
3. Bifani P.J., Mathema В., Kurepina N.E., Kreiswirth B.N. Global dissemination of the Mycobacterium tuberculosis W-Beijing family strains // Trends Microbiol. - 2002. - Vol.10. - P.45-52.
4. Cox H.S., Kubica Т., Doshetov D. et al. The Beijing genotype and drug resistant tuberculosis in the Aral Sea region of Central Asia // Respir. Res. - 2005. - Vol.6. - P.134.
5. Drobniewski F., Balabanova Y., Nikolayevsky V. et al. Drug-resistant tuberculosis, clinical virulence, and the dominance of the Beijing strain family in Russia // JAMA. - 2005. - Vol.293. - P.2726-2731.
6. Kamerbeek J., Schouls L., Kolk A. et al. Simultaneous detection and strain differentiation of Mycobacterium tuberculosis for diagnosis and epidemiology // J. Clin. Microbiol. - 1997. - Vol.35. - P.907-914.
7. Kremer K., Glynn J.R., Lillebaek T. et al. Definition of the Beijing/W lineage of Mycobacterium tuberculosis on the basis of genetic markers // J. Clin. Microbiol. - 2004. - Vol.42. - P.4040-4049.
8. Lopez В., Aguilar D., Orozco H. A marked difference in pathogenesis and immune response induced by different Mycobacterium tuberculosis genotypes // Clin. Exp.Immunol. - 2003. - Vol.133. - P.30-37.
9. Mazars E., Lesjean S., Banuls A.L. et al. High-resolution mini-satellite-based typing as a portable approach to global analysis of Mycobacterium tuberculosis molecular epidemiology // Proc. Natl. Acad. Sci. USA. - 2001. - Vol.98. - P.1901-1906.
10. Mokrousov I., Narvskaya O., Otten T. et al. Phylogenetic reconstruction within Mycobacterium tuberculosis Beijing genotype in northwestern Russia // Res. Microbiol. - 2002. - Vol.153. - P.629-637.
11. Mokrousov I., Ly H.M., Otten T. et al. Origin and primary dispersal of the Mycobacterium tuberculosis Beijing genotype: clues from human phylogeography // Genome Res. - 2005. - Vol.15. - P. 1357-1364.
12. Mokrousov I, Jiao WW, Sun GZ et al. Evolution of drug resistance in different sub-lineages within Mycobacterium tuberculosis Beijing genotype // Antimicrob. Agents Chemother. - 2006. - Vol.50. - P.2820-2823.
13. Narvskaya O., Otten Т., Limeschenko E. et al. Nosocomial outbreak of multidrug-resistant tuberculosis caused by a strain of Mycobacterium tuberculosis W-Beijing family in St. Petersburg, Russia // Eur. J. Clin. Microbiol. Infect. Dis. - 2002. - Vol.21. - P.596-602.
14. Plikaytis B.B., Marden J.L., Crawford J. et al. Multiplex PCR assay specific for the multidrug resistant strain W of M. tuberculosis // J. Clin. Microbiol. - 1994. - Vol.32. - P.1542-1546.
15.Ross, В.С., Dwyer В. Rapid, simple method for typing isolates of Mycobacterium tuberculosis by using the polymerase chain reaction // J. Clin. Microbiol. - 1993. - Vol.31. P.329-334.
16. Sola C., Filliol I., Legrand E., Mokrousov I., Rastogi N. Mycobacterium tuberculosis phylogeny reconstruction based on combined numerical analysis with IS1081, IS6110, VNTR, and DR-based spoligotyping suggests the existence of two new phylogeographical clades // J. Mol. Evol. - 2001. - Vol.53. - P.680-689.
17. van Embden, J.D.A., Cave M.D., Crawford J.T. et al. Strain identification of Mycobacterium tuberculosis by DNA fingerprinting: recommendations for a standardized methodology // J. Clin. Microbiol. - 1993. - Vol.31. - P.406-409.
18. van Soolingen D., Qian L., de Haas E.W. et al. Predominance of a single genotype of Mycobacterium tuberculosis in countries of East Asia // J. Clin. Microbiol. - 1995. - Vol.33. - P.3234-3238.
19. Zhang M., Cong J., Yang Z. et al. Enhanced capacity of a widespread strain of Mycobacterium tuberculosis to grow in human macrophages // J. Infect. Dis. - 1999. - Vol.179. - P.1213-1217.
Способ определения микобактерий туберкулеза генотипа Beijing путем определения специфических участков генома между соседними копиями элемента IS6110 посредством ПЦР, отличающийся тем, что применяют ПЦР с использованием двух инвертированных праймеров, расположенных на концах IS6110, и при амплификации фрагментов ДНК длиной 290 пн и 490 пн или 260 пн, 290 пн и 490 пн судят о принадлежности М. tuberculosis к «древнему» (атипичному) и «современному» (типичному) вариантам генотипа Beijing соответственно.