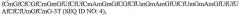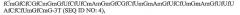Аптамерные терапевтические средства, применимые для лечения связанных с комплементом расстройств
Иллюстрации
Показать всеНастоящее изобретение относится к веществам и способам лечения, профилактики и улучшения состояния при заболевании, связанном с комплементом. Предлагаются различные терапевтически эффективные конъюгаты аптамер/ПЭГ. Аптамеры по настоящему изобретению содержат модифицированные нуклеотиды, что повышает их стабильность к ферментативному и химическому разрушению, а также к термическому и физическому разрушению. Данные конъюгаты аптамер/ПЭГ применимы в качестве средств для терапии связанных с комплементом сердечных, воспалительных и аутоиммунных расстройств, ишемического реперфузионного повреждения и/или других заболеваний или расстройств, в которые вовлечена опосредованная С5 активация комплемента. 6 н. и 14 з.п., 79 ил., 7 табл.
Реферат
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Изобретение в общем относится к области нуклеиновых кислот и более конкретно к аптамерам, способным связываться с белком C5 системы комплемента, применимым в качестве средств для терапии и диагностики связанных с комплементом сердечных, воспалительных и аутоиммунных расстройств, ишемического реперфузионного повреждения и/или других заболеваний или расстройств, в которые вовлечена опосредованная C5 активация комплемента. Кроме того, изобретение относится к веществам и способам введения аптамеров, способных связываться с белком системы комплемента C5.
УРОВЕНЬ ТЕХНИКИ
Аптамеры представляют собой молекулы нуклеиновых кислот, обладающие специфической аффинностью связывания с молекулами посредством других взаимодействий, отличных от классического спаривания согласно Уотсону-Крику.
Аптамеры подобно пептидам, созданным с использованием фагового дисплея, или моноклональным антителам («мАт») способны специфически связываться с выбранными мишенями и модулировать активность мишеней, например, посредством связывания аптамеры могут блокировать способность мишеней функционировать. Созданные способом селекции in vitro из пулов олигонуклеотидов со случайными последовательностями аптамеры были образованы более чем для 100 белков, включая факторы роста, факторы транскрипции, ферменты, иммуноглобулины и рецепторы. Типичный аптамер имеет размер 10-15 кД (30-45 нуклеотидов), связывает свою мишень с субнаномолярной аффинностью и различает близкородственные мишени (например, аптамеры обычно не должны связывать другие белки из того же самого семейства генов). В ряде структурных исследований показано, что аптамеры способны использовать такие же типы взаимодействий при связывании (например, водородные связи, электростатическую комплементарность, гидрофобные взаимодействия, стерическое исключение), которые управляют аффинностью и специфичностью комплексов антитело-антиген.
Аптамеры обладают рядом свойств, требуемых для применения в качестве терапевтических средств и диагностических средств, включая высокую специфичность и аффинность, биологическую эффективность и превосходные фармакокинетические свойства. Кроме того, они обеспечивают конкретные конкурентоспособные преимущества по сравнению с антителами и другими белковыми биологическими средствами, например указанные ниже:
1) Скорость и контроль. Аптамеры получают полностью способом in vitro, что позволяет быстро создавать начальные варианты, включая терапевтические варианты. Селекция in vitro дает возможность тщательно контролировать специфичность и аффинность аптамера и позволяет создавать варианты, включая варианты как против токсичных, так и против неиммуногенных мишеней.
2) Токсичность и иммуногенность. Аптамеры как класс имеют малопроявляемую токсичность или иммуногенность или вовсе их не имеют. При хроническом введении крысам или суркам доз, содержащих высокие уровни аптамера (10 мг/кг в сутки в течение 90 дней), не наблюдали токсичности ни при каких клинических, клеточных или биохимических измерениях. В то время как эффективность многих моноклональных антител может быть сильно ограничена иммунным ответом к самим антителам, чрезвычайно трудно вызвать образование антител к аптамерам, наиболее вероятно, потому, что аптамеры не могут быть презентированы T-клетками посредством MHC, и иммунный ответ обычно не подготовлен для того, чтобы узнавать фрагменты нуклеиновых кислот.
3) Введение. Тогда как большинство одобренных в настоящее время терапевтических антител вводят посредством внутривенной инфузии (обычно в течение 2-4 часов), аптамеры можно вводить путем подкожной инъекции (биодоступность аптамеров при подкожном введении составляет >80% в исследованиях на обезьянах (Tucker et al., J. Chromatography B. 732: 203-212, 1999)). Такое различие главным образом является следствием сравнительно низкой растворимости и, соответственно, больших объемов, необходимых в случае большинства терапевтических мАт. Благодаря хорошей растворимости (>150 мг/мл) и сравнительно низкой молекулярной массе (аптамер: 10-50 кД; антитело: 150 кД) еженедельная доза аптамера может быть доставлена посредством инъекции в объеме, составляющем менее 0,5 мкл. Кроме того, небольшой размер аптамеров позволяет им проникать в области, ограниченные конформационно, в которые не могут проникнуть антитела или фрагменты антител, что является еще одним преимуществом терапевтических или профилактических средств на основе аптамеров.
4) Масштабируемость и стоимость. Терапевтические аптамеры химически синтезируют, и, следовательно, их синтез можно легко масштабировать, чтобы удовлетворить потребность в получении. Тогда как трудности масштабного производства в настоящее время ограничивают доступность некоторых биологических средств, и капитальные затраты на крупномасштабное производство белков огромны, один крупномасштабный синтезатор олигонуклеотидов может давать более 100 кг/год и требует относительно скромного начального капиталовложения. Текущие затраты на материалы для синтеза аптамеров в масштабе, измеряемом килограммами, оценивают на уровне $500/г, что сравнимо с затратами на получение высокооптимизированных антител. Предполагают, что продолжающееся совершенствование разработки способа снизит затраты на материалы до <$100/г за пять лет.
5) Стабильность. Терапевтические аптамеры являются химически стойкими. Они в действительности приспособлены к восстановлению активности после воздействия таких факторов, как тепло и денатурирующие агенты, и могут храниться в течение длительных периодов (>1 года) при комнатной температуре в виде лиофилизированных порошков.
Система комплемента
Система комплемента состоит из группы по меньшей мере 20 плазматических и мембранных белков, которые действуют совместно в регулируемой каскадной системе, атакуя внеклеточные формы патогенов (например, бактерию). Система комплемента включает в себя два отдельных ферментативно активируемых каскада, классический и альтернативный пути (фиг.1) и неферментативный путь, известный как формирование мембраноатакующего комплекса.
Первый ферментативно активируемый каскад, известный как классический путь, содержит несколько компонентов C1, C4, C2, C3 и C5 (перечислены в порядке положения в пути). Инициация классического пути системы комплемента происходит после связывания и активации первого компонента комплемента (C1) как иммунными, так и неиммунными активаторами. C1 содержит кальцийзависимый комплекс компонентов C1q, C1r и C1s и активируется при связывании компонента C1q. C1q содержит шесть идентичных субъединиц, и каждая субъединица содержит три цепи (цепи A, B и C). Каждая цепь имеет область глобулярной головки, которая связана с коллагеноподобным хвостом. Связывание и активация C1q комплексами антиген-антитело происходит посредством области головки C1q. Многочисленные не являющиеся антителами активаторы C1q, включая белки, липиды и нуклеиновые кислоты, связывают и активируют C1q через дистальный участок на коллагеноподобной области «ствола». Затем комплекс C1qrs катализирует активацию компонентов комплемента C4 и C2 с образованием комплекса C4bC2a, который функционирует в качестве конвертазы C3.
Второй ферментативно активируемый каскад, известный как альтернативный путь, является быстрым, независимым от антител путем активации и усиления системы комплемента. Альтернативный путь содержит несколько компонентов, C3, фактор B и фактор D (перечислены в порядке положения в пути). Активация альтернативного пути происходит в том случае, когда C3b, форма, образуемая при протеолитическом расщеплении C3, связывается с активирующим поверхностным агентом, таким как бактерия. Фактор B затем связывается с C3b и расщепляется фактором D, давая активный фермент Ba. Фермент Ba затем дополнительно расщепляет C3, создавая дополнительное количество C3b, что приводит к обширному отложению комплексов C3b-Ba на активирующей поверхности.
Таким образом, и классический, и альтернативный пути комплемента продуцируют конвертазы C3, которые расщепляют фактор C3 на C3a и C3b. В этой точке обе конвертазы C3 собираются в конвертазы C5 (C4b2a3b и C3b3bBb). Затем указанные комплексы расщепляют компонент комплемента C5 на два компонента: полипептид C5a (9 кД) и полипептид C5b (170 кД). Полипептид C5a связывается с имеющим 7 трансмембранных фрагментов сопряженным с G-белком рецептором, который первоначально связывали с лейкоцитами и который, как известно в настоящее время, экспрессируется во множестве тканей, включая гепатоциты и нейроны. Молекула C5a является основным хемотаксическим компонентом системы комплемента человека и может запускать множество биологических ответов, включая хемотаксис лейкоцитов, сокращение гладкой мускулатуры, активацию внутриклеточных путей сигнальной трансдукции, адгезию нейтрофилов к эндотелию, высвобождение цитокинов и липидных медиаторов и образование оксидантов.
Более крупный фрагмент C5b связывается последовательно с более дальними компонентами каскада комплемента C6, C7, C8 и C9 с образованием мембраноатакующего комплекса C5b-9 («MAC»). MAC C5b-9 может непосредственно лизировать эритроциты и в больших количествах он является литическим для лейкоцитов и повреждающим для тканей, таких как мышцы, эпителиальные и эндотелиальные клетки. В сублитических количествах MAC может стимулировать повышающую регуляцию молекул адгезии, увеличение внутриклеточного кальция и высвобождение цитокинов. Кроме того, MAC C5b-9 может стимулировать такие клетки, как эндотелиальные клетки и тромбоциты, не вызывая лизиса клеток. Нелитические эффекты C5a и MAC C5b-9 иногда довольно сходны.
Хотя система комплемента играет важную роль в поддержании здоровья, она может вызывать или вносить вклад в заболевание. Например, система комплемента вовлечена в побочные эффекты, имеющие отношение к трансплантационной хирургии по шунтированию коронарных артерий («CABG»), многочисленным почечным, ревматологическим, неврологическим, дерматологическим, гематологическим, сосудистым/легочным, аллергическим, инфекционным и связанным с биосовместимостью/шоком заболеваниям и/или состояниям и диабетической ретинопатии. Система комплемента не обязательно является единственной причиной патологического состояния, но она может быть одним из нескольких факторов, которые вносят вклад в патогенез.
В Fitch et al., Circ. 100: 2499-506 (1999) тестировали действие одноцепочечного фрагмента антитела против C5, пекселизумаба, на пациентов, подвергающихся трансплантационной хирургии по шунтированию коронарных артерий в условиях искусственного кровообращения («CPB»). Отдельным пациентам вводили пекселизумаб в течение 10 минут, одну болюсную дозу непосредственно перед CPB, составляющую 0,5 мг/кг, 1,0 мг/кг и 2,0 мг/кг. Брали образцы крови и тестировали в отношении активности комплемента перед введением дозы, через 5 мин после введения дозы, через 5 мин при 28°C после начала повторного согревания, через 5 мин при 37°C и вплоть до 7 дней после CPB. Фармакодинамический анализ показал значимое зависимое от дозы ингибирование гемолитической активности комплемента в течение периода времени до 14 часов в дозе 2 мг/кг и образование провоспалительных побочных продуктов комплемента (sC5b-9) эффективно ингибировалось зависимым от дозы образом. Однако, как указано ранее, терапевтические антитела имеют определенные ограничения.
Соответственно, было бы полезно иметь новые ингибиторы системы комплемента для применения в качестве терапевтических и диагностических средств при лечении связанных с комплементом расстройств.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Фиг.1 является иллюстрацией, изображающей классический и альтернативные пути системы комплемента.
Фиг.2 является схематичным представлением способа отбора аптамеров in vitro (SELEXTM) из пулов олигонуклеотидов, содержащих случайные последовательности.
Фиг.3A является иллюстрацией, изображающей нуклеотидную последовательность и вторичную структуру анти-C5-аптамера (SEQ ID NO: 1), в которой подчеркнутые остатки являются либо 2'-H-пиримидиновыми остатками, либо 2'-фторпиримидиновыми остатками, заключенные в рамку остатки являются либо 2'-фторпиримидиновыми остатками, либо 2'-OMe-пиримидиновыми остатками, и остатки, указанные стрелкой (→), представляют собой остатки, которые должны содержать 2'-фтор-модификацию.
Фиг.3B является иллюстрацией, изображающей нуклеотидную последовательность и вторичную структуру анти-C5-аптамера ARC330 (SEQ ID NO: 2), в которой заключенные в кружки остатки являются 2'-H-остатками, остатки пиримидина являются 2'-фтор-замещенными, и большинство остатков пурина являются 2'-OMe-замещенными за исключением трех остатков 2'-OH-пурина, показанных контуром.
Фиг.3C является иллюстрацией, изображающей нуклеотидную последовательность и вторичную структуру анти-C5-аптамера ARC186 (SEQ ID NO: 4), в которой все 21 остаток пиримидина имеют 2'-фтор-модификации, и большинство пуриновых остатков (14 остатков) имеют 2'-OMe-модификации за исключением трех остатков 2'-OH-пурина, показанных контуром.
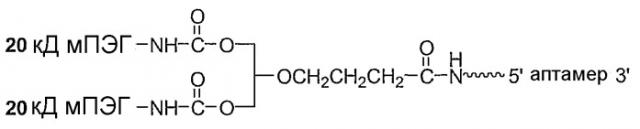
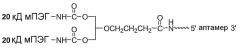
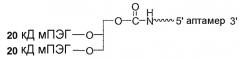
Фиг.4 является иллюстрацией разветвленного ПЭГ (1,3-бис(мПЭГ-[20 кД])-пропил-2-(4'-бутамид) с М.м. 40 кД.
Фиг.5 является иллюстрацией разветвленного ПЭГ (1,3-бис(мПЭГ-[20 кД])-пропил-2-(4'-бутамид) с М.м. 40 кД, связанного с 5'-концом аптамера.
Фиг.6 является иллюстрацией, изображающей различные способы синтеза конъюгатов высокомолекулярный ПЭГ-нуклеиновая кислота.
На фиг.7A показан график, сравнивающий зависимое от дозы ингибирование гемолиза пегилированными анти-C5-аптамерами (ARC657 (SEQ ID NO: 61), ARC658 (SEQ ID NO: 62) и ARC187 (SEQ ID NO: 5)) с ингибированием непегилированным анти-C5-аптамером (ARC186 (SEQ ID NO: 4)); на фиг.7B показана таблица значений IC50 аптамеров, используемых в анализе гемолиза, изображенном на фиг.7A; фиг.7C является графиком, сравнивающим зависимое от дозы ингибирование гемолиза пегилированными анти-C5 аптамерами ARC187 (SEQ ID NO: 5), ARC1537 (SEQ ID NO: 65), ARC1730 (SEQ ID NO: (66) и ARC1905 (SEQ ID NO: 67); на фиг.7D показана таблица значений IC50 аптамеров, используемых в анализе гемолиза, изображенном на фиг.7C.
Фиг.8 является графиком ингибирования гемолиза в процентах анти-C5-аптамером ARC658 (SEQ ID NO: 62) для комплемента сыворотки макак-крабоедов по сравнению с комплементом сыворотки человека.
Фиг.9 является графиком, изображающим связывание ARC186 (SEQ ID NO: 4) с очищенным белком C5 как при 37°C, так и при комнатной температуре (23°C) после 15-минутной инкубации.
На фиг.10 показан другой график, изображающий связывание ARC186 (SEQ ID NO: 4) с очищенным белком C5 как при 37°C, так и при комнатной температуре (23°C) после 4-часовой инкубации.
Фиг.11 является графиком, показывающим временной ход диссоциации комплекса C5•ARC186 при 23°C.
Фиг.12 является графиком, показывающим временной ход установления равновесия при образовании комплекса C5•ARC186 при 23°C.
Фиг.13 является графиком, изображающим связывание ARC186 (SEQ ID NO: 4) с белком C5 по сравнению с белковыми компонентами, расположенными выше и ниже в каскаде комплемента.
Фиг.14 является графиком, изображающим процент радиоактивного ARC186 (SEQ ID NO: 4), который связывает C5 в присутствии немеченого конкурента ARC186 (SEQ ID NO: 4), ARC657 (SEQ ID NO: 61), ARC658 (SEQ ID NO: 62) или ARC187 (SEQ ID NO: 5).
Фиг.15 является графиком, изображающим количество белка комплемента C5b, продуцируемого в образцах крови, инкубированных в течение 5 часов при 25°C и 37°C в присутствии различных концентраций аптамера ARC186 (SEQ ID NO: 4).
Фиг.16 является графиком, изображающим ингибирование комплемента в процентах при действии ARC187 (SEQ ID NO: 5) в присутствии зимозана в неразбавленной сыворотке человека, цитратной цельной крови человека или сыворотке макак-крабоедов.
Фиг.17 является графиком, показывающим, что ARC658 (SEQ ID NO: 62) полностью ингибирует активацию комплемента (C5a) в модели на основе петли из трубки, описанной в примере 1D.
Фиг.18 является графиком, изображающим константы диссоциации для пулов, полученных в 10 раунде отбора C5. Константы диссоциации (Kd) оценивали подгонкой данных к уравнению: фракция связанной РНК = амплитуда *Kd/(Kd + [C5]). «ARC520» (SEQ ID NO: 70) относится к нативному не подвергаемому отбору пулу dRmY, а «+» указывает на наличие конкурирующего вещества (0,1 мг/мл тРНК, 0,1 мг/мл ДНК спермы лосося).
Фиг.19 является графиком, изображающим кривые константы диссоциации клонов C5. Константы диссоциации (Kd) оценивали подгонкой данных к уравнению: фракция связанной РНК = амплитуда*Kd/(Kd + [C5]).
Фиг.20 является графиком, изображающим кривую IC50, который иллюстрирует ингибирующее действие на активность гемолиза различных концентраций анти-C5-аптамера клона ARC913 (SEQ ID NO: 75) по сравнению с ARC186 (SEQ ID NO: 4).
Фиг.21 является иллюстрацией, изображающей структуру ARC187 (SEQ ID NO: 5).
Фиг.22 является иллюстрацией, изображающей структуру ARC1905 (SEQ ID NO: 67).
На фиг.23 показана таблица, в которой изложен дизайн эксперимента при первом исследовании изолированного перфузируемого сердца.
Фиг.24 является графиком сравнения записи давления в отношении внутрижелудочкового давления в левом желудочке (LV) изолированного сердца, на которое воздействовали плазмой человека (A), с записью давления LVP изолированного сердца, на которое воздействовали раствором контрольного аптамера (B).
Фиг.25 является графиком сравнения записи давления в отношении внутрижелудочкового давления в левом желудочке (LV) изолированных сердец, на которые воздействовали молярно эквивалентными 10X и 50X растворами аптамера/C5 (при этом считают, что концентрация C5 в нормальной неразбавленной плазме человека составляет примерно 500 нМ).
Фиг.26 является графиком сравнения изменений частоты сердечных сокращений в ударах в минуту (уд./мин) в изолированных сердцах мышей после воздействия плазмы человека и различных растворов плазма/аптамер.
Фиг.27 является графиком сравнения изменений массы сердца в изолированных сердцах мышей до и после воздействия плазмы человека, содержащей 0-1X молярное соотношение ARC186 (SEQ ID NO: 4) (отказ сердца) или 10-50X молярное соотношение (сердца, защищенные аптамером C5).
Фиг.28 является графиком сравнения относительной продукции C5a в плазме человека, содержащей различные концентрации аптамера, после перфузии изолированных мышиных сердец. Относительные концентрации C5a отложены на графике в виде единиц поглощения (Ab), при этом более высокие значения отражают присутствие более высоких уровней C5a.
Фиг.29 является графиком сравнения относительной продукции растворимого C5b-9 в плазме человека, содержащей различные концентрации аптамера, после перфузии изолированных мышиных сердец.
Фиг.30 является графиком, показывающим влияние ARC186 (SEQ ID NO: 4) на расщепление C3 в экссудате сердца мыши.
На фиг.31 приведена таблица, показывающая результаты иммуногистохимического окрашивания в случае исследования изолированного перфузируемого мышиного сердца.
На фиг.32 приведена таблица, показывающая молярное соотношение ARC658 (SEQ ID NO: 62), необходимое в сыворотке человека или примата для защиты сердца от опосредованного C5b повреждения.
Фиг.33 является графиком, показывающим log-линейный график остаточного количества полноразмерного ARC186 в процентах как функции времени инкубации в плазме крыс и макак-крабоедов.
На фиг.34 представлена таблица, показывающая дизайн эксперимента в случае фармакокинетического исследования, проводимого на крысах Sprague-Dawley, которое описано в примере 5.
На фиг.35 представлена таблица, показывающая среднюю концентрацию в плазме ARC657 (SEQ ID NO: 61), ARC658 (SEQ ID NO: 62) или ARC187 (SEQ ID NO: 5) против времени у крыс Sprague-Dawley.
Фиг.36 является графиком, изображающим среднюю концентрацию в плазме ARC657 (SEQ ID NO: 61), ARC658 (SEQ ID NO: 62) и ARC187 (SEQ ID NO: 5) с течением времени после внутривенного введения аптамера крысам.
На фиг.37 представлена таблица, показывающая некамерный анализ концентраций в зависимости от временных данных, изображенных на фиг. 35 и 36.
На фиг.38A приведена таблица, показывающая дизайн фармакокинетического исследования ARC187 (SEQ ID NO: 5) и ARC1905 (SEQ ID NO: 67) у мышей; фиг.38B является графиком, изображающим фармакокинетический профиль ARC187 (SEQ ID NO: 5) и ARC1905 (SEQ ID NO: 67) у мышей CD-1 после однократного болюсного в/в-введения; на фиг.38C приведена таблица, показывающая некамерный анализ концентрации в зависимости от временных данных, изображенных на фиг.38B.
На фиг.39 приведена таблица, показывающая выявление перечисленных аптамеров в ткани сердца мышей после внутривенного введения.
На фиг.40 приведена таблица, показывающая дизайн эксперимента в случае исследования 1 животных, описанного в примере 5E.
На фиг.41 приведена таблица, показывающая концентрацию аптамера в плазме в зависимости от времени после внутривенного болюсного введения аптамера макакам-крабоедам.
На фиг.42 представлена таблица, в которой перечислены фармакокинетические параметры для ARC657 (SEQ ID NO: 61), ARC658 (SEQ ID NO: 62) и ARC187 (SEQ ID NO: 5, вводимых внутривенно макакам-крабоедам в исследовании 1.
Фиг. 43A и 43C являются графиками, изображающими концентрации в плазме sC5b-9 и C5a в зависимости от времени после внутривенного введения анти-C5-аптамеров ARC657 (SEQ ID NO: 61), ARC658 (SEQ ID NO: 62) или ARC187 (SEQ ID NO: 5) макакам-крабоедам; фиг. 43B и 43D являются графиками, изображающими концентрации в плазме sC5b-9 и C5a против концентрации анти-C5-аптамеров ARC657 (SEQ ID NO: 61), ARC658 (SEQ ID NO: 62) или ARC187 (SEQ ID NO: 5).
На фиг.44 представлена таблица, показывающая дизайн эксперимента исследования 2, описанного в примере 5F.
Фиг.45 является графиком, показывающим среднюю концентрацию аптамера в плазме в различных временных точках после внутривенного введения ARC658 (SEQ ID NO: 62) или ARC187 (SEQ ID NO: 5) макакам-крабоедам.
На фиг.46 представлена таблица, показывающая двухкамерный анализ концентрации в зависимости от времени после внутривенного болюсного введения аптамера макакам-крабоедам.
Фиг.47 является графиком, изображающим концентрацию C5b-9 в зависимости от концентрации ARC187 (SEQ ID NO: 5) или ARC658 (SEQ ID NO: 62) в присутствии зимозана в плазме макак-крабоедов.
Фиг.48 является графиком, изображающим концентрацию C5a в зависимости от концентрации ARC187 (SEQ ID NO: 5) или ARC658 (SEQ ID NO: 62) в присутствии зимозана в плазме макак-крабоедов.
На фиг.49 приведена таблица, в которой суммированы данные исследования ФК-ФД ARC187 (SEQ ID NO: 5) во время и после в/в болюсного плюс инфузионного введения макакам-крабоедам.
На фиг.50 приведена таблица, в которой суммированы фармакокинетические параметры ARC187 (SEQ ID NO: 5) у макак-крабоедов после в/в болюсного введения.
Фиг.51 является графиком, изображающим рассчитанные и фактически измеренные фармакокинетические профили ARC187 (SEQ ID NO: 5) во время и после в/в болюсного плюс инфузионного введения макакам-крабоедам.
Фиг.52 является графиком, показывающим, что уровни в плазме активного ARC187 (SEQ ID NO: 5) остаются постоянными во время и после в/в болюсного плюс инфузионного введения макакам-крабоедам.
На фиг.53 представлена таблица, показывающая рассчитанные потребности человека в дозах анти-C5-аптамеров при CABG-хирургии.
Фиг.54 является графиком, показывающим, что ARC187 (SEQ ID NO: 5) соответственно не влияет in vitro на коагуляцию, которую измеряли по протромбиновому времени (PT) и активированному частичному тромбопластиновому времени (APTT).
На фиг.55 приведена таблица, в которой суммированы эффекты in vitro ARC187 (SEQ ID NO: 5) на антикоагуляционную активность гепарина и прокоагуляционную активность протамина.
Фиг.56 является графиком, показывающим, что ARC187 (SEQ ID NO: 5) не влияет на обратимость антикоагулирующего действия гепарина in vivo.
Фиг.57 является графиком, показывающим, что гепарин и протамин не влияют на функционирование ARC187 (SEQ ID NO: 5), направленное против комплемента, измеряемое по ингибированию активации комплемента зимозаном.
Фиг.58 является графиком, изображающим ингибирование в процентах гемолиза эритроцитов барана в присутствии сыворотки человека как функции концентрации анти-C5-аптамеров ARC1905 (SEQ ID NO: 67) или ARC672 (SEQ ID NO: 63).
Фиг.59A является графиком, изображающим ингибирование гемолиза в процентах в присутствии сыворотки человека, макаки-крабоеда и крысы под действием ARC1905 (SEQ ID NO: 67); на фиг.59B представлена таблица, в которой суммированы средние значения IC50 для ингибирования активации комплемента в сыворотке человека, макаки-крабоеда и крысы под действием ARC1905, анти-C5-аптамера или ARC127, нерелевантного аптамера, который не связывает C5 (негативный контроль).
Фиг.60 является графиком, изображающим значения IC50 для ингибирования радиоактивно меченного ARC186 (SEQ ID NO: 4) (вертикальная ось) как функции концентрации немеченого конкурирующего вещества ARC1905 (SEQ ID NO: 67) или ARC672 (SEQ ID NO: 63) (горизонтальная ось) в анализе конкурентного связывания.
Фиг.61 является графиком, изображающим значение IC50 для ингибирования радиоактивно меченого ARC186 (SEQ ID NO: 4) (вертикальная ось) как функции концентрации немеченого конкурирующего вещества ARC1905 (SEQ ID NO: 67) (горизонтальная ось) при 37°C и 25°C в анализе конкурентного связывания.
Фиг.62 является графиком, изображающим стандартные кривые для C5a человека (hC5a) и C5a макак-крабоедов (эквивалент hC5a).
На фиг.63 представлена таблица, в которой суммированы значения IC50, IC90 и IC99 для ингибирования активации C5 в сыворотке человека и макак-крабоедов под действием ARC1905 (SEQ ID NO: 67), измеренные в анализе индуцированной зимозаном активации комплемента.
Фиг.64 является графиком, на котором изображено ингибирование в процентах образования C5a как функции концентрации ARC1905 (SEQ ID NO: 67) в сыворотке человека и макак-крабоедов, измеряемое в анализе индуцированной зимозаном активации комплемента.
Фиг.65 является графиком, изображающим влияние ARC1905 (SEQ ID NO: 67) на образование C3a в сыворотке человека или макак-крабоедов, измеряемое в анализе индуцированной зимозаном активации комплемента.
На фиг.66 представлена таблица, в которой суммированы средние значения IC50, IC90 и IC99 для ингибирования ARC1905 активации комплемента (SEQ ID NO: 67) в сыворотке человека от 5 доноров, измеренные в модели активации комплемента на основе петли из трубки.
Фиг.67 является графиком, изображающим ингибирование в процентах образования C5a и C3a как функции концентрации ARC1905, анти-C5-аптамера или ARC127, нерелевантного аптамера, который не связывает C5 (негативный контроль) в модели активации комплемента на основе петли из трубки.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к веществам и способам лечения, профилактики и улучшения состояния при заболевании, связанном с комплементом. В одном варианте предлагается аптамер, содержащий нуклеотидную последовательность, соответствующую ARC186 (SEQ ID NO: 4), конъюгированный с остатком ПЭГ. В конкретных вариантах такой конъюгат аптамер ARC186/ПЭГ имеет по существу такую же аффинность связывания по отношению к белку комплемента C5, как и аптамер, состоящий из последовательности, соответствующей SEQ ID NO: 4, но в котором отсутствует остаток ПЭГ. По существу такая же аффинность связывания в используемом в данном описании смысле означает наличие не более чем примерно от 2 до десятикратного различия, предпочтительно не более чем от 2 до пятикратного различия констант диссоциации, измеряемых в дот-блот-анализе. В некоторых вариантах константы диссоциации измеряют в конкурентном дот-блот-анализе, который описан в примере 1A ниже. В некоторых вариантах остаток полиэтиленгликоля имеет молекулярную массу, составляющую более 10 кД, в частности молекулярную массу 20 кД, более предпочтительно 30 кД и более предпочтительно 40 кД. В некоторых вариантах остаток ПЭГ конъюгируют с 5'-концом ARC186 (SEQ ID NO:4). В некоторых вариантах конъюгат аптамер/ПЭГ имеет время полужизни, предпочтительно конечное время полужизни в двухкамерной модели, которое определяют способом, описанным в примере 5E ниже, по меньшей мере 15 часов, предпочтительно по меньшей мере 24 часа, более предпочтительно по меньшей мере 48 часов у приматов. В некоторых вариантах конъюгат аптамер/ПЭГ имеет время полужизни, предпочтительно конечное время полужизни в двухкамерной модели, составляющее по меньшей мере 10, предпочтительно по меньшей мере 15 часов у крыс. В некоторых вариантах ПЭГ, конъюгированный с 5'-концом ARC186 (SEQ ID NO: 4) представляет собой ПЭГ с М.м. 40 кД. В конкретных вариантах ПЭГ с М.м. 40 кД является разветвленным ПЭГ. В некоторых вариантах разветвленный ПЭГ с М.м. 40 кД представляет собой 1,3-бис(мПЭГ-[20 кД])пропил-2-(4'-бутамид). В других вариантах разветвленный ПЭГ с М.м. 40 кД представляет собой 2,3-бис(мПЭГ-[20 кД])пропил-1-карбамоил.
В вариантах, в которых разветвленный ПЭГ 40 кД представляет собой 1,3-бис(мПЭГ-[20 кД])пропил-2-(4'-бутамид), предлагается аптамер, имеющий структуру, указанную ниже:
где
означает линкер.
Аптамер =
где fC и fU = 2'-фторнуклеотиды, а mG и mA = 2'-OMe-нуклеотиды, и все другие нуклеотиды являются 2'-OH-нуклеотидами, и 3T означает инвертированный дезокситимидин.
В вариантах, в которых разветвленный ПЭГ 40 кД представляет собой 2,3-бис(мПЭГ-[20 кД])пропил-1-карбамоил, предлагается аптамер, имеющий структуру, указанную ниже:
где
означает линкер.
Аптамер =
где fC и fU = 2'-фторнуклеотиды, а mG и mA = 2'-OMe-нуклеотиды, и все другие нуклеотиды являются 2'-OH-нуклеотидами, и 3T означает инвертированный дезокситимидин.
В некоторых вариантах данного аспекта изобретения линкер является алкильным линкером. В конкретных вариантах алкильный линкер содержит от 2 до 18 следующих друг за другом CH2-групп. В предпочтительных вариантах алкильный линкер содержит от 2 до 12 следующих друг за другом CH2-групп. В особенно предпочтительных вариантах алкильный линкер содержит от 3 до 6 следующих друг за другом CH2-групп.
В конкретном варианте предлагается аптамер ARC187 (SEQ ID NO: 5), имеющий структуру, указанную ниже:
где аптамер =
где fC и fU = 2'-фторнуклеотиды, а mG и mA = 2'-OMe-нуклеотиды, и все другие нуклеотиды являются 2'-OH-нуклеотидами, и 3T означает инвертированный дезокситимидин.
В другом варианте предлагается аптамер ARC1905 (SEQ ID NO:67), имеющий структуру, указанную ниже:
где аптамер =
где fC и fU = 2'-фторнуклеотиды, а mG и mA = 2'-OMe-нуклеотиды, и все другие нуклеотиды являются 2'-OH-нуклеотидами, и 3T означает инвертированный дезокситимидин.
В другом аспекте изобретение относится к фармацевтическим композициям. В одном варианте предлагается фармацевтическая композиция, содержащая терапевтически эффективное количество ARC187 (SEQ ID NO: 5) или ARC1905 (SEQ ID NO: 67) или их солей. Фармацевтическая композиция согласно изобретению может содержать фармацевтически приемлемый носитель или разбавитель. В данном аспекте изобретение относится к фармацевтической композиции, содержащей терапевтически эффективное количество аптамера, который ингибирует расщепление белка комплемента C5 in vivo, или его соли и фармацевтически приемлемый носитель или разбавитель. В данном аспекте изобретения предлагается фармацевтическая композиция ARC187 (SEQ ID NO: 5) или ARC1905 (SEQ ID NO: 67) для применения для лечения, профилактики или улучшения состояния при заболевании in vivo. Также в данном аспекте изобретения предлагаются ARC187 (SEQ ID NO: 5) или ARC1905 (SEQ ID NO: 67) для применения с целью получения фармацевтической композиции.
В другом аспекте согласно изобретению предлагаются способы лечения. В одном варианте способ согласно изобретению заключается в лечении, профилактике или ослаблении заболевания, опосредованного белком комплемента C5 и/или его производными C5a и C5b-9, при этом способ включает в себя введение позвоночному фармацевтической композиции, содержащий ARC187 (SEQ ID NO: 5) или ARC1905 (SEQ ID NO: 67) или из соль. В некоторых вариантах способ включает в себя введение млекопитающему фармацевтической композиции согласно изобретению. В некоторых вариантах млекопитающее является человеком.
В некоторых вариантах опосредованным белком комплемента C5, C5a и/или C5b-9 заболеванием, подвергаемым лечению, являются острые ишемические заболевания (инфаркт миокарда, инсульт, ишемическое/реперфузионное повреждение); острые воспалительные заболевания (инфекционная болезнь, сепсис, шок, острое/гиперострое отторжение трансплантата); хронические воспалительные и/или опосредованные иммунитетом заболевания (аллергия, астма, ревматоидный артрит и другие ревматологические заболевания, рассеянный склероз и другие неврологические болезни, псориаз и другие дерматологические болезни, бульбоспинальный паралич, системная красная волчанка (СКВ), подострое/хроническое отторжение трансплантата, гломерулонефрит и другие почечные болезни). В некоторых вариантах опосредованные белком комплемента C5, C5a и/или C5b-9 заболевания, подвергаемые лечению, включают активацию комплемента, связанную с диализом или ситуациями, при которых кровь пропускают по и/или через синтетическую трубку и/или чужеродный материал. В некоторых вариантах опосредованное белком комплемента C5, C5a и/или C5b-9 заболевание, подвергаемое лечению, выбрано из группы, состоящей из повреждения миокарда, связанного с CABG-хирургией, повреждения миокарда, связанного с баллонной ангиопластикой, и повреждения миокарда, связанного с рестенозом. В некоторых вариантах опосредованное белком комплемента C5, C5a и/или C5b-9 расстройство, подвергаемое лечению, выбрано из группы, состоящей из повреждения миокарда, связанного с CABG-хирургией, повреждения миокарда, связанного с баллонной ангиопластикой, повреждения миокарда, связанного с рестенозом, опосредованных белком комплемента осложнений, связанных с CABG-хирургией, опосредованных белком комплемента осложнений, связанных с чрескожным вмешательством в коронарные артерии, пароксизмальной ночной гемоглобинурии, острого отторжения трансплантата, гиперострого отторжения трансплантата, подострого отторжения трансплантата и хронического отторжения трансплантата. В некоторых вариантах опосредованным белком комплемента C5, C5a и/или C5b-9 заболеванием, подвергаемым лечению, являются осложнения, связанные с CABG-хирургией. В конкретном варианте заболеванием, подвергаемым лечению, является повреждение миокарда, связанное с CABG-хирургией.
В некоторых вариантах способ согласно изобретению заключается во введении фармацевтической композиции, содержащий ARC187 (SEQ ID NO: 5) или ARC1905 (SEQ ID NO: 67) так, чтобы достичь концентрации аптамера в плазме, которая примерно в 0,5-10 раз выше концентрации в плазме эндогенного белка комплемента C5. В некоторых вариантах фармацевтические композиции аптамера ARC187 (SEQ ID NO: 5) или ARC1905 (SEQ ID NO: 67), вводят так, чтобы достичь концентрации аптамера в плазме, которая примерно в 0,75-5 раз, 0,75-3 раза и 1,5-2 раза выше концентрации в плазме эндогенного белка комплемента C5, тогда как в других вариантах композицию аптамера вводят так, чтобы достичь концентрации, эквивалентной концентрации эндогенного белка комплемента. В некоторых вариантах фармацевтическую композицию согласно изобретению, содержащую ARC187 (SEQ ID NO: 5) или ARC1905 (SEQ ID NO: 67), вводят так, чтобы достичь концентрации аптамера в плазме, составляющей примерно 5 мкМ, примерно 4 мкМ, примерно 3 мкМ, примерно 2 мкМ, примерно 1,5 мкМ, примерно 1 мкМ или примерно 500 нМ.
Можно использовать любую комбинацию пути, продолжительности и скорости введения, которая достаточна для достижения концентраций аптамеров в плазме согласно изобретению. В некоторых вариантах фармацевтическую композицию вводят внутривенно. В некоторых вариантах фармацевтическую композицию вводят в виде болюса и/или посредством непрерывной инфузии.
В конкретных вариантах лечения, профилактики и/или ослабления осложнений, связанных с CABG-хирургией, в частности повреждения миокарда, связанного с CABG-хирургией, способ согласно изобретению включает в себя введение фармацевтической композиции перед хирургией и продолжение введения по меньшей мере 24 часа, в некоторых вариантах примерно 48 часов или в некоторых вариантах примерно 72 часа. В конкретном варианте данного аспекта изобретения концентрацию аптамера в плазме, примерно в два раза более высо