Средство для регенеративной медицины
Иллюстрации
Показать всеИзобретение относится к медицине, а именно к фармакологии и клеточным технологиям. Средство, обладающее регенеративной активностью, представляет собой гранулоцитарный колониестимулирующий фактор, иммобилизированный на водорастворимых полимерах с молекулярной массой 400-4000 Да. При этом гранулоцитарный колониестимулирующий фактор иммобилизирован на полимерах с помощью ионизирующего излучения - потока ускоренных электронов с энергией 2,5 МэВ, поглощенной дозой от 2 до 10 кГр и скоростью набора дозы 1,65 кГр/час. Средство заявленного изобретения не имеет иммуногенности, является высокоэффективным как при парентеральном, так и при пероральном введении. 10 табл.
Реферат
Изобретение относится к медицине, конкретно к фармакологии и клеточным технологиям, и может быть использовано в регенеративной медицине.
Существуют препараты гранулоцитарного колониестимулирующего фактора (Г-КСФ), обладающие гемостимулирующим, мобилизующим стволовые клетки [1, 2], гепатопротекторным [3] и церебропротекторным [4] эффектами.
Известен препарат пегилированного (иммобилизированного/конъюгированного химическим путем с полиэтиленгликолем) Г-КСФ - пегфилграстим [5]. Данное средство является наиболее близким по технической сущности и достигаемому результату и выбрано в качестве прототипа.
Недостатком препаратов Г-КСФ, в том числе пегфилграстма, является их иммуногенность, определяемая белковой природой соединения и единственно возможным - парентеральным путем введения данного средства [2, 5]. В частности, их применение может сопровождаться выраженными системными и местными аллергическими реакции различной интенсивности (вплоть до анафилактического шока) [6, 7]. Кроме того, терапия дегенеративных заболеваний с помощью имеющихся препаратов Г-КСФ является недостаточно эффективной.
Задачей, решаемой данным изобретением, является создание средства для регенеративной медицины, не имеющего иммуногенности, высокоэффективного как при парентеральном, так и при пероральном введении.
Поставленная задача достигается иммобилизацией гранулоцитарного колониестимулирующего фактора на носителях с помощью ионизирующего излучения. В качестве носителя используются биологически индифферентные вещества - водорастворимые полимеры с молекулярной массой 400-4000 Да.
Наиболее предпочтительным способом иммобилизации является воздействие на полимерный носитель и биологически активное соединение направленным потоком ускоренных электронов с энергией 2,5 МэВ, поглощенная доза от 2 до 10 кГр, скорость набора дозы 1,65 кГр/час.
В качестве водорастворимого полимера используют полиэтиленгликоль, гидроксиэтилкрахмал, поливинилпирролидон и др.
Новым в предлагаемом изобретении является создание средства для регенеративной медицины, представляющего собой гранулоцитарный колониестимулирующий фактор, иммобилизированный на полимерном носителе с молекулярной массой 400-4000 Да с помощью ионизирующего излучения, обладающего геммо-стимулирующим, мобилизующим стволовые клетки, гепатопротекторным и церебропротекторным эффектами. Техническим результатом предлагаемого изобретения является отсутствие иммуногенности, и высокая эффективность средства как при парентеральном, так и при пероральном введении.
Используемое нами оригинальное средство гранулоцитарного колониестимулирующего фактора, иммобилизированного с помощью ионизирующего излучения на низкомолекулярном носителе, было разработано и получено совместно ООО «Саентифик Фьючер Менеджмент» (г.Новосибирск) и НИИ фармакологии СО РАМН (г.Томск).
Известно, что снижение степени иммуногенности веществ может быть достигнуто путем их перорального приема. Однако средства белкового происхождения, каким является и Г-КСФ, в желудочно-кишечном тракте подвергаются расщеплению под влиянием протеолитических ферментов, что делает данный путь их введения в организм неэффективным. В связи с этим важное значение приобретает проблема создания средства для регенеративной медицины, обладающего широким спектром терапевтического действия, низким риском развития побочных эффектов и осложнений, в том числе за счет его использования перорально.
Существуют данные о повышении физической стабильности, растворимости, а также снижении иммуногенности и чувствительности к протеолитическим ферментам белков при их покрытии биологически индифферентными полимерами, конъюгации с определенными носителями (в том числе иммобилизации с помощью радиационных воздействий) [8, 9]. Тем не менее, сведений о возможности создания соединений белка, в том числе Г-КСФ, лишенных аллергизирующих (иммуногенных) свойств, а также способа создания препаратов на их основе, обладающих высокой специфической активностью, характерной для нативных белковых веществ, и одинаково эффективных при использовании парентерально и внутрь, на сегодняшний день не существуете. При этом известно, что процесс манипуляции разнородными субстанциями на молекулярном уровне, в том числе с использованием физических факторов, обладающих высокой энергией, может сопровождаться существенными изменениями стереохимической структуры исходных веществ, и в конечном итоге приводить к модификации их свойств, характер которой, однако, является непредсказуемым [10, 11]. Вместе с тем в настоящее время не существует данных о фармакологических преимуществах препаратов, полученных в результате иммобилизации биологически активных веществ с помощью ионизирующего излучения, перед соединениями, образующимися при конъюгировании тех же исходных субстанций, но химическим путем. То есть не известно существование качественных различий конечного продукта, связанных со способом его получения: технологии химического синтеза (с помощью которой получают пегфилграстим [2, 5]) и электроно-лучевой технологией иммобилизации (с помощью которой осуществляется получение предлагаемого средства). Кроме того, в мировой литературе, в принципе, нет сведений о возможности повышения биологической (фармакологической) активности белковых регуляторных молекул путем иммобилизации действующего вещества на носителях, не связанной с изменением исключительно их фармакокинетики (именно за счет изменения фармакокинетических параметров объясняется модификация свойств Г-КСФ при синтезе пегфилграстима).
Факт иммобилизации гранулоцитарного колониестимулирующего фактора на носителе с помощью ионизирующего излучения с достижением нового технического результата: создание средства, обладающего гемостимулирующим, мобилизующим стволовые клетки, гепатопротекторным и церебропротекторным действием, с низкой иммуногенностью, высокоэффективным при парентеральном и пероральном (энтеральном) приеме, для специалиста является не очевидным.
Заявляемые существенные признаки проявили в совокупности новые свойства, не вытекающие явным образом из уровня техники в данной области. Предлагаемое изобретение может быть использовано в экспериментальной биологии и медицине с выходом в практическое здравоохранение. Идентичной совокупности признаков при исследовании уровня техники по патентной и научно-медицинской литературе не обнаружено.
Исходя из вышеизложенного, следует считать заявляемое техническое решение соответствующим критериям: «Новизна», «Изобретательский уровень», «Промышленная применимость».
Эксперименты были проведены на 259 беспородных крысах обоего пола, массой 200-250 г, мышах-самцах линии CBA/CaLac в количестве 367 штук, массой 18-20 г, 54 морских свинках обоего пола массой 200-250 г. Животные получены из питомника отдела экспериментального биомедицинского моделирования НИИ фармакологии СО РАМН.
Настоящее изобретение иллюстрируется следующими примерами.
Пример 1
В 10% водный раствор полиэтиленгликоля с молекулярной массой 400 Да вносили Г-КСФ (ООО «Саентифик Фьючер Менеджмент», г.Новосибирск) до конечной концентрации 10 мг Г-КСФ в 1 мл 10% полиэтиленгликоля. Смесь перемешивали и облучали потоком ускоренных электронов в дозе 1,5 Мрад. Обработку проводили тормозным излучением, генерируемым ускорителем ИЛУ-6 с энергией электронов 2,5 МэВ, поглощенная доза от 2 кГр, скорость набора дозы 1,65 кГр/час. Получали конечный иммобилизиованный препарат в виде слегка опалесцирующего раствора. Выход готового продукта составляет 98,2%.
Пример 2
5% водный раствор гидроксиэтил-крахмала с молекулярной массой 1,5 кДа облучали потоком ускоренных электронов в дозе 1,5 Мрад. Обработку проводили тормозным излучением, генерируемым ускорителем ИЛУ-10 с энергией электронов 2,5 МэВ, поглощенная доза 10 кГр, скорость набора дозы 1,65 кГр/час. В облученный раствор вносили Г-КСФ (ООО «Саентифик Фьючер Менеджмент», г. Новосибирск) до конечной концентрации 10 мг Г-КСФ в 1 мл 5% гидроксиэтил-крахмале.
Смесь перемешивали 10 минут и получали конечный иммобилизиованный препарат в виде слегка опалесцирующего раствора. Выход готового продукта составляет 99,1%.
Пример 3
В 10,0% водный раствор поливинилпирролидона с молекулярной массой 4 кДа вносили Г-КСФ (ООО «Саентифик Фьючер Менеджмент», г.Новосибирск) до конечной концентрации 1 мг Г-КСФ в 1 мл. Затем смесь перемешивали 30 минут и облучали гамма-излучением в дозе 1,0 Мрад. Обработку проводили тормозным излучением, генерируемым ускорителем ИЛУ-10 с энергией электронов 2,5 МэВ, поглощенная доза 5 кГр, скорость набора дозы 1,65 кГр/час.
Препарат иммобилизованного Г-КСФ получали в виде прозрачного раствора. Выход готового продукта составляет 98%.
Пример 4
Проводили сравнительное изучение аллергизирующих (иммуногенных) свойств препаратов гранулоцитарного колониестимулирующего фактора, иммобилизированного на полиэтиленгликоле с помощью ионизирующей радиации (имГ-КСФ) (получен по примеру 1), и пегфилграстима («NEULASTIM», Щвейцария, Hoffmann-La Roche).
Препараты исследовались в одинаковых дозах (определяемых по содержанию Г-КСФ), которая была определена как оптимальная в отношении нормализации показателей крови у мышей с цитостатической миелосупрессией, и в 10 раз ее превышающей (содержание Г-КСФ 100 и 1000 мкг/кг соответственно). Оценка аллергизирующих свойств препарата проводилась с использованием следующих тестов: реакции общей анафилаксии, реакции специфической агломерации лейкоцитов, при внутрикожном и конъюнктивальном тестировании на морских свинках, реакции гиперчувствительности замедленного типа на мышах [12]. Обработку результатов проводили методом вариационной статистики с использованием t-критерия Стьюдента и непараметрического U-критерия Вилкоксона-Манна-Уитни.
Для сенсибилизации морских свинок препараты вводили: сначала 1 раз подкожно, затем в той же дозе 2 раза внутримышечно, через день, в область бедра. Анафилактогенные свойства препаратов Г-КСФ выявляли путем его внутрисердечного введения на 21-е сутки после последней сенсибилизирующей инъекции. Разрешающее тестирующее внутрисердечное введение препарата проводилось в дозе, равной суммарной сенсибилизирующей, т.е. 300 мкг/кг. Контролем служили несенсибилизированные морские свинки, которым препарат вводили внутрисердечно.
Учет интенсивности анафилактической реакции проводили с использованием формулы
,
где АИ - анафилактический индекс;
n - число животных, анафилактическая реакция которых заканчивалась смертельным исходом;
n1 - число животных со значительными проявлениями анафилактической реакции;
n2 - число животных со средними проявлениями реакции;
n3 - число животных со слабыми проявлениями реакции;
N - общее число животных в группе.
Для оценки кожно-сенсибилизирующих свойств препарата через 20 дней после окончания сенсибилизирующих инъекций на боковой поверхности тела морских свинок выстригали шерсть, и каждому животному внутрикожно вводили препарат имГ-КСФ, либо пегфилграстим в дозах 10 мкг/животное (50 мкг/кг) в 0,02 мл физиологического раствора (доза, не вызывающая визуальных изменений кожи у интактных морских свинок).
Реакцию кожи на введение препарата оценивали в баллах с учетом выраженности гиперемии и размеров гиперемированной области (средняя величина диаметра в миллиметрах). Были определены четыре степени гиперемии, которым соответствовали числовые индексы: сильная (+++) - 1,0; средняя (++) - 0,66; слабая (+) - 0,33; сомнительная (+/-) - 0,17. Умножение величины диаметра гиперемированной области на индекс соответствующей степени гиперемии позволило в едином показателе (баллы) выразить обе характеристики реакции.
На 20-й день после завершения цикла сенсибилизирующих инъекций проводилось конъюнктивальное тестирование. Тест заключался в закапывании в левый глаз каждого животного 0,02 мл физиологического раствора, содержащего 10 мкг препарата, в правый глаз - физиологического раствора в том же объеме. Оценка состояния конъюнктивы глаза проводилась через 4 и 24 часа после воздействия.
С целью подтверждения результатов, полученных вышеперечисленными тестами, использовалась реакция аллергодиагностики in vitro РСАЛ (реакция специфической агломерации лейкоцитов). Рабочая доза препаратов Г-КСФ для этой реакции составляла 2,5 мкг на 0,05 мл крови животного (50 мкг/мл).
На мышах сенсибилизацию проводили с использованием полного адьюванта Фрейнда (ПАФ). Препараты Г-КСФ вводили однократно подкожно в основание хвоста в 0,06 мл ПАФ, который был взят в соотношении 1:1 к объему раствора препарата. Доза препарата составляла 1000 мкг/кг. Контрольным животным вводили ПАФ в том же объеме.
Через 5 суток после инъекции опытным и контрольным мышам в подушечку одной из задних лап вводили препараты Г-КСФ в дозе 20 мкг/животное в 0,04 мл физиологического раствора (1000 мкг/кг), в другую лапу - физиологический раствор. Через 24 часа после второй инъекции с помощью инженерного микрометра типа МК измеряли толщину обеих лап. Величину реакции определяли как разницу в толщине опытной и контрольной лап, в миллиметрах.
В ходе эксперимента было установлено, что реакция морских свинок на внутрикожное введение препарата имГ-КСФ по таким визуальным показателям, как покраснение или отек, не отличалась от соответствующих показателей у животных, которым вводили дистиллированную воду, в то время как при введении пегфилграстима кожная реакция была достоверно более выражена. Конъюнкти-вальный тест и реакция аллергодиагностики in vitro не выявили признаков аллер-гизирующего действия ни у одного из препаратов Г-КСФ. В то же время при тестирующем внутрисердечном введении препаратов имГ-КСФ и пегфилграстима имело место статистически значимое увеличение анафилактического индекса в группе животных, получавших пегфилграстим, в то время как при введении имГ-КСФ АИ не отличался от такового в контрольной группе (табл.1).
Кроме того, изучение аллергизирующих (иммуногенных) свойств показало, что внутрикожные тестирующие инъекции имГ-КСФ и пегфилграстима не приводили к изменению величины реакции ГЗТ по сравнению с контрольным уровнем показателя через 4 и 24 часа после воздействия (табл.2).
Аналогичные результаты были получены при изучении имГ-КСФ, полученного при иммобилизации Г-КСФ на гидроксиэтил-крахмале и декстране.
| Таблица 1 | ||||
| Оценка анафилактогенных свойств имГ-КСФ и пегфилграстима в эксперименте на морских свинках | ||||
| Группа животных | Показатели | |||
| Реакция кожи, баллы | Конъюнктив, тест, баллы | Коэффициент РСАЛ | АИ | |
| Контроль | 0,78±0,02 | 0 | 1,5±0,2 | 0,26 |
| Пегфилграстим | 0,89±0,03∗ | 0 | 1,5±0,2 | 0,31 |
| имГ-КСФ | 0,79±0,05 | 0 | 1,5±0,2 | 0,87 |
| * - отмечена достоверность различия показателя от его значения в контроле при p<0,05 |
| Таблица 2 | ||||
| Оценка сенсибилизирующих свойств препарата имГ-КСФ в эксперименте на мышах, (Х±m) | ||||
| Условия эксперимента | Реакция ГЗТ, мм | |||
| Группа животных | Сенсибилизирующая доза, мкг/кг | Разрешающая доза, мкг/кг | 4 часа | 24 часа |
| Контроль | - | 1000 | 0,073±0,03 | 0,08±0,01 |
| Пегфилграстим | 1000 | 1000 | 0,087±0,02 | 0,09±0,01 |
| имГ-КСФ | 1000 | 1000 | 0,090±0,030 | 0,79±0,01 |
Таким образом, препарат иммобилизированного с помощью ионизирующего излучения Г-КСФ не оказывает иммуногенного эффекта, проявляющегося аллергизацией организма, в то время как пегфилграстим обладает слабо выраженными аллергизирующими свойствами
Пример 5
Проведено экспериментальное изучение иммунотоксических свойств Г-КСФ, иммобилизированного на полиэтиленгликоле с помощью ионизирующего излучения (получен по примеру 2) [12]. В качестве препарата сравнения использовался пегфилграстим («NEULASTIM», Швейцария, Hoffmann-La Roche).
Препараты исследовались на мышах при подкожном введении в дозе 100 мкг/кг, которая была определена как терапевтическая (1 ТД) и в дозе на порядок ее выше - 1000 мкг/кг (10 ТД). Экспериментальная оценка иммунотоксических свойств препаратов Г-КСФ проводилась с использованием следующих тестов: предварительная оценка иммунотоксичности при однократном введении; изучение влияния препарата на массу и клеточность центральных и периферических органов иммунитета; оценка влияния препарата на фагоцитарную активность перитонеальных макрофагов; изучение влияния препарата на число антителообразующих клеток (АОК) после иммунизации эритроцитами барана (ЭБ); исследование влияния препарата на спонтанную и индуцированную митогенами пролиферацию спленоцитов.
Обработку результатов проводили методом вариационной статистики с использованием t-критерия Стьюдента и непараметрического U-критерия Вилкоксона-Манна-Уитни.
Курсовое введение имГ-КСФ в используемых дозах не оказывало влияния на массу и клеточность центральных и периферических органов иммунитета экспериментальных мышей, на уровень антителообразующих клеток после иммунизации животных эритроцитами барана, на пролиферативный ответ лимфоцитов. В то время как пегфилграстим приводил к снижению спонтанной пролиферативной активности лимфоцитов (на 5,8% от фона) при его добавлении в культуру в дозе 5 нг/мл.
Таким образом, в результате проведенных исследований установлено, что иммобилизированный с помощью ионизирующего излучения Г-КСФ не обладает иммунотоксическими свойствами.
Пример 6
Были проведены эксперименты по изучению гемопоэзстимулирующей активности имГ-КСФ (полученного по примеру 1). В качестве сравнения служил препарат пегфилграстима («NEULASTIM», Щвейцария, Hoffmann-La Roche).
Исследования гемостимулирующих свойств проводили на мышах линии СВА на модели миелосупрессии. Для этого всем животным вводили циклофосфан (ЦФ) в дозе 170 мг/кг. Затем мыши 1-й группы получали подкожно пегфилграстим, мыши 2-й группы - пегфилграстим перорально, животным 3-й группы подкожно вводили имГ-КСФ, а 4-й - имГ-КСФ перорально. Все препараты вводили в дозе 100 мкг/кг 2 раза: на 1 день после введения цитостатика и через 5 дней. Контрольным животным вводили физиологический раствор в соответствующих режимах. На 7, 10 дни опыта с помощью стандартных и культуральных гематологических методов определяли показатели периферической крови и костного мозга, а также число КОЕ-ГМ в костном мозге [13]. Обработку результатов проводили методом вариационной статистики с использованием t-критерия Стьюдента и непараметрического U-критерия Вилкоксона-Манна-Уитни.
Проведенные эксперименты позволили установить, что пероральное введение пегфилграстима не приводило к изменениям исследуемых показателей, свидетельствующее о неэффективности использования per os препарата Г-КСФ, иммобилизированного на носителе химическим способом. В остальных случаях в периферической крови возрастало содержание палочко- и сегментоядерных нейтрофилов, а также количество КОЕ-ГМ, незрелых и зрелых нейтрофильных гранулоцитов в гемопоэтической ткани. При этом наиболее выраженными были изменения в группе животных, получавших имГ-КСФ подкожно (табл.3). В то же время достаточно существенным оказался подъем данных показателей и у животных, получавших иммобилизованный Г-КСФ перорально.
| Таблица 3 | ||||||
| Показатели грануломоноцитарного ростка кроветворения при введении циклофосфана (1), подкожном (2) и пероральном введении пегфилграстима (3), подкожном (4) и пероральном (5) введении имГ-КСФ на фоне моделирования миелосупрессии, (X±m) | ||||||
| Сроки / сутки | Палочкоядерные нейтрофилы в периферической крови, Г/л | Сегментоядерные нейтрофилы в периферической крови, Г/л | Незрелые нейтрофильные гранулоциты в костном мозге, ×106/бедро | Зрелые нейтрофильные гранулоциты в костном мозге, ×106/бедро | КОЕ-ГМ в костном мозге, на 106 миелокариоцитов | |
| фон | 0,3±0,02 | 2,44±0,23 | 1,12±0,04 | 3,64±0,21 | 5,11±0,21 | |
| 5-е | 1 | 0,0∗ | 0,9±0,09∗ | 0,56±0,03∗ | 1,02±0,08∗ | 12,68±0,8∗ |
| 2 | 0,03±0,01∗ | 1,3±0,01∗ | 0,99±0,03 | 1,69±0,02∗ | 17,9±0,9∗ | |
| # | # | # | # | # | ||
| 3 | 0,0∗ | 0,94±0,04∗ | 0,58±0,02∗ | 1,07±0,1∗ | 11,8±1,0∗ | |
| 4 | 0,06±0,01∗ | 1,98±0,02∗ | 1,34±0,01∗ | 1,72±0,07∗ | 29,7±1,2∗ | |
| #& | #& | #& | # | #& | ||
| 5 | 0,07±0,01∗ | 1,56±0,03∗ | 1,06±0,02 | 1,56±0,03∗ | 26,4±1,01∗ | |
| #& | # | # | # | #& | ||
| 10-е | 1 | 0,43±0,09 | 3,01±0,9 | 0,98±0,02 | 3,4±0,67 | 4,01+1,4 |
| 2 | 0,9±0,01∗ | 3,76±0,07∗ | 2,35±0,07∗ | 5,9±0,1∗ | 14,1±1,3∗ | |
| # | # | # | # | # | ||
| 3 | 0,37±0,1 | 2,96±0,7 | 1,1±0,03 | 3,57±0,44 | 5,2±0,7 | |
| 4 | 1,5±0,06∗ | 4,59±0,1∗ | 3,14±0,1∗ | 6,98±0,1∗ | 18,6±2,1∗ | |
| #& | #& | #& | #& | # | ||
| 5 | 1,3±0,04∗ | 3,3±0,1∗ | 2,97±0,1∗ | 6,57±0,5∗ | 16,3±1,07∗ | |
| #& | # | # | # | # | ||
| * - отмечена достоверность различия показателя от его фонового значения при p≤0,05. | ||||||
| # - отмечена достоверность различия показателя от его контрольного значения при р≤0,05. | ||||||
| & - отмечена достоверность различия показателя у мышей, получавших имГ-КСФ от его контрольного значения у животных, получавших пегфилграстим подкожно при p≤0,05. |
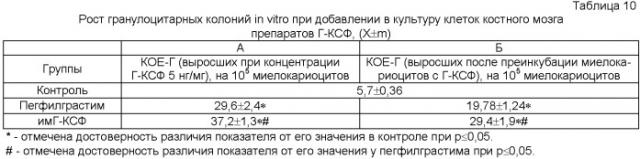
Пример 7
Изучение мобилизующих стволовые клетки свойств имГ-КСФ были проведены на интактных мышах линии СВА. Для исследований использовали препарат имГ-КСФ, полученный по примеру 2. В качестве препарата сравнения служил пегфилграстим («NEULASTIM», Щвейцария, Hoffmann-La Roche). Режим введения препаратов был отобран в предварительных экспериментах как наиболее эффективный. Мыши 1-й группы получали подкожно пегфилграстим, мыши 2-й группы - пегфилграстим перорально, животным 3-й группы подкожно вводили имГ-КСФ, а 4-й - имГ-КСФ перорально. Все препараты вводили в дозе 100 мкг/кг 1 раз в день в течение 5-и дней. На 5, 7-е сут определяли количество мезенхимальных стволовых клеток (МСК) и грануломоноцито-эритро-мегакариоцитарных (КОЕ-ГЭММ) клеток-предшественников в периферической крови [1, 13, 14].
В ходе эксперимента было установлено, что парентеральное применение (но не пероральное) пегфилграстима, а также парентеральное и пероральное введение имГ-КСФ приводили к значительному увеличению содержания стволовых клеток в периферической крови. Причем максимальных значений увеличение показателей отмечалось при парентеральном введении имГ-КСФ, а изменение числа МСК и КОЕ-ГЭММ при пероральном использовании им Г-КСФ было на уровне такового при подкожном введении пегфилграстима (табл.4).
| Таблица 4 | |||
| Содержание стволовых клеток в периферической крови мышей при подкожном (1) и пероральном введении пегфилграстима (2), подкожном (3) и пероральном (4) введении имГ-КСФ, (X±m) | |||
| Сроки / сутки | КОЕ-ГЭММ, на 105 мононуклеаров | МСК в костном мозге, на 106 мононуклеаров | |
| фон | 4,7±0,2 | 19,0±2,0 | |
| 5-е | 1 | 9,8±1,1∗ | 29,0±3,1∗ |
| 2 | 4,3±0,39 | 18,4±2,2 | |
| 17,4±2,0∗ | 39,0±3,4∗ | ||
| & | & | ||
| 4 | 10,3±0,92∗ | 36,0±3,7∗ | |
| & | |||
| 7-е | 1 | 14,3±0,9∗ | 31,0±2,4∗ |
| 2 | 5,2±0,75 | 15,0±3,1 | |
| Л | 19,7±1,7∗ | 39,0±3,3∗ | |
| & | & | ||
| 4 | 13,4±1,0∗ | 37,2±2,4∗ | |
| & | |||
| * - отмечена достоверность различия показателя от его фонового значения при р≤0,05. | |||
| & - отмечена достоверность различия показателя у мышей, получавших имГ-КСФ от его контрольного значения у животных, получавших пегфилграстим подкожно при p≤0,05. |
Пример 8
Были исследованы изменения морфофункционального состояния печени под действием иммГ-КСФ и пегфилграстима («NEULASTIM», Щвейцария, Hoffmann-La Roche) при моделировании хронического токсического гепатита.
Эксперименты были проведены на беспородных крысах массой 250-300 г. У крыс гепатит вызывали внутрижелудочным введением 50% раствора ССЦ (гепатотропный яд) на оливковом масле в дозе 2 мл/кг в течение 3-х недель 2 раза в неделю (6 раз).
По окончании моделирования хронического токсического поражения печени животные были поделены на 3 равные группы. Крысам 1-й группы в течение 5 дней подкожно вводили 100 мкг/кг пегфилграстима, растворенного в 0,5 мл растворителя. Первое введение осуществляли на следующий день после последнего введения тетрахлоруглерода. Животным 2-й группы подкожно вводили иммГ-КСФ в дозе 100 мкг/кг в течение 5 дней. Крысам 3-й группы внутрижелудочно вводили иммГ-КСФ в дозе 100 мкг/кг в течение 5 дней. Животным контрольной группы по той же схеме в эквивалентном объеме вводили физиологический раствор. Обработку результатов проводили методом вариационной статистики с использованием t-критерия Стьюдента и непараметрического U-критерия Вилкоксона-Манна-Уитни.
Для изучения состояния печени оценивали гибель крыс, проводили биохимические исследования содержания в сыворотке крови аспартат- и аланинаминотрансфераз (АсАТ, АлАТ) на 40-е сутки, а также морфологическое исследование печени на 40-е сутки опыта. Активность ферментов сыворотки крови определяли общепринятыми методами, используя полуавтоматический биохимический анализатор фирмы Cormay и стандартные наборы к нему. Кровь для исследования получали из бедренной артерии через катетер. На гистологических препаратах печени, окрашенных гематоксилином и эозином, определяли количество клеток инфильтрата с помощью окулярной сетки Автандилова, содержащей 25 тест-точек. В 20 полях зрения подсчитывали количество клеток, попадающих на тест-точки сетки. Относительную площадь инфильтрации высчитывали как отношение точек сетки, приходящихся на клетки инфильтрата, ко всем точкам сетки в 20 полях зрения. Площадь соединительной ткани определяли с помощью средств компьютерной обработки графических данных. Для этого на стандартной площади среза печени (последовательные микрофотографии 10 полей зрения, выполненные микровидеокамерой “Digital micro”, с программой передачи изображения на компьютер фирмы «Элекард», Томск) измеряли площадь структур, окрашенных пикрофуксином, и вычисляли процентное отношение к выбранной стандартной площади.
Проведенные эксперименты показали, что гибель крыс в группах животных, получавших препараты Г-КСФ, была значительно ниже, чем в контроле (35,6%). При этом при подкожном введении имГ-КСФ гибели крыс не отмечалось. Биохимические исследования сыворотки крови выявили повышение активности АлАТ, и АсАТ и ЩФ на 40-е сутки опыта после начала введения CCl4 в контрольной группе (табл.5). В то же время пегфилграстим практически не влиял на содержание ферментов в сыворотки крови. Вместе с тем как парентеральное, так и пероральное использование имГ-КСФ сопровождалось существенным падение их активности.
| Таблица 5 | |||
| Влияние препаратов на биохимические показатели крыс-самцов с хроническим CCl4-гепатитом (1) при подкожном введении пегфилграстима (2), подкожном (3) и пероральном (4) введении имГ-КСФ, на 40 сутки эксперимента, X±m | |||
| Группы | АлАТ | АсАТ | ЩФ |
| (мккат/л) | (мккат/л) | (Е/л) | |
| фон | 0,22±0,01 | 0,24±0,03 | 231,0±23,4 |
| 1 | 0,69±0,03∗ | 0,70±0,04∗ | 415,9±43,6∗ |
| 2 | 0,48±0,1∗ | 0,66±0,03∗ | 349,5±36,7∗ |
| # | |||
| 3 | 0,24±0,02 | 0,28±0,02 | 227,5±34,3 |
| #& | #& | #& | |
| 4 | 0,21±0,02 | 0,34±0,06 | 239,3±41,2 |
| #& | #& | #& | |
| * - отмечена достоверность различия показателя от его фонового значения при p≤0,05. | |||
| # - отмечена достоверность различия показателя от его контрольного значения при p≤0,05. | |||
| & - отмечена достоверность различия показателя у мышей, получавших имГ-КСФ от его контрольного значения у животных, получавших пегфилграстим подкожно при p≤0,05. |
При исследовании гистологических препаратов печени в контрольной группе крыс отмечалось выраженное нарушение долькового строения органа. На препаратах были видны поля грануляционной ткани, замещающей погибшие гепатоциты, в которых происходило новообразование сосудов и печеночных протоков. В сохранившихся гепатоцитах наблюдалась выраженная крупнокапельная жировая дистрофия. В то же время имела место значительная регенерационная гипертрофия печеночных клеток. Введение пегфилграстима, либо иммГ-КСФ при моделировании CCl4-гепатита сохраняло дольковое строение печени, а жировая дистрофия гепатоцитов была преимущественно мелкокапельная. У опытных животных отмечалась менее выраженная инфильтрация портальных трактов.
В целом относительная площадь инфильтрации была достоверно ниже, чем в контрольной группе. Кроме того, препараты Г-КСФ существенно уменьшали и площадь соединительной ткани (табл.6). При этом наиболее выраженный гепа-топротекторный эффект имел место при подкожном введении заявляемого имГ-КСФ. Вместе с тем значительной терапевтической активностью данный препарат обладал и при пероральном введении, причем таковая была сопоставима с парентеральным примением пегфилграстима.
| Таблица 6 | ||
| Влияние препаратов на биохимические показатели крыс-самцов с хроническим CCl4-гепатитом при подкожном введении пегфилграстима, подкожном и пероральном введении имГ-КСФ, на 21 и 40 сутки эксперимента, X±m | ||
| Группы | Относительная площадь инфильтрата (%) | Относительная площадь соед. ткани (%) |
| фон | 2,34±0,2 | 3,78±0,3 |
| H2O (контроль) | 27,48±4,67∗ | 16,5±0,42∗ |
| Пегфилграстим | 10,0±1,16∗# | 7,44±0,17∗# |
| Им Г-КСФ подкожно | 3,7±0,97∗#& | 3,56±0,4#& |
| Им Г-КСФ перорально | 9,4±0,67∗#& | 6,12±0,09∗#& |
| * - отмечена достоверность различия показателя от его фонового значения при p≤0,05. | ||
| # - отмечена достоверность различия показателя от его контрольного значения при p≤0,05. | ||
| & - отмечена достоверность различия показателя у мышей, получавших имГ-КСФ от его контрольного значения у животных, получавших пегфилграстим подкожно при p≤0,05. |
Таким образом, иммобилизированный с помощью ионизирующей радиации Г-КСФ обладает выраженными гепатопротекторными свойствами как при парентеральном, так и при пероральном введении. При этом механизмом его действия, очевидно, являются стимуляция и мобилизация стволовых клеток костного мозга с их дальнейшим детерминированным хомингом в печеночную ткань и диффе-ренцировкой в тканеспецифичные элементы [1, 3].
Пример 9
В эксперименте на мышах проводили исследование церебропротекторных эффектов имГ-КСФ на модели гипоксической энцефалопатии. Оценку состояния центральной нервной системы животных производили по регистрации показателей психоневрологического статуса: условно-рефлекторной деятельности и ориентировочно-исследовательскому поведению животных в открытом поле.
Энцефалопатия моделировалось с помощью термокамеры объемом 500 мл. Мыши помещались в термокамеру, крышка закрывалась, и мыши оставались там до атонального судорожного припадка или остановки дыхания, определяемой визуально, в течение 10-15 секунд. После извлечения из термокамеры и восстановления самостоятельного дыхания, через 5-10 минут, мыши вновь помещались в термокамеру также до наступления атонального состояния (генерализованного судорожного припадка или остановки дыхания). Мыши 1-й группы получали подкожно пегфилграстим («NEULASTIM», Щвейцария, Hoffmann-La Roche), мыши 2-й группы - перорально пегфилграстим («NEULASTIM», Щвейцария, Hoffmann-La Roche), животным 3-й группы подкожно вводили имГ-КСФ, а 4-й - имГ-КСФ перорально. Все препараты вводили в дозе 100 мкг/кг 1 раз в день в течение 5-и дней, начиная сразу после воздействия. Контрольным животным вводили физиологический раствор в соответствующих режимах. Через 1 сутки после моделирования энцефалопатии у животных вырабатывался условный рефлекс пассивного избегания, проверка сохранности рефлекса и ориентировочно-исследовательского поведения в открытом поле осуществлялась на 14, 21-е сут опыта. Обработку результатов проводили методом вариационной статистики с использованием t-критерия Стьюдента и непараметрического U-критерия Вилкоксона-Манна-Уитни.
В ходе эксперимента гипоксическое воздействие приводило к формированию энцефалопатии. Так, наблюдалось статистически значимое увеличение общей двигательной активности мышей в открытом поле, числа горизонтальных перемещений и повышение коэффициента асимметрии движений. В то же время отмечалось резкое падение уровня воспроизведения условного рефлекса пассивного избегания и спонтанная смертность животных на протяжении всего периода наблюдения, достигающая на 21-е сут 35,7%.
Терапевтический эффект пегфилграстима проявлялся только при его подкожном введении, в то время как препарат имГ-КСФ оказывал лечебное действие при парентеральном и пероральном назначении. Причем в обоих случаях (введения имГ-КСФ) церебропротекторный эффект был выше, чем у пегфилграстима при его подкожном применении. Более того, подкожное введение имГ-КСФ полностью отменяло появление признаков энцефалопатии (табл.7, 8).
| Таблица 7 | |||
| Условно-рефлекторная деятельность и смертность мышей линии CBA\CaLac при энцефалопатии, вызванной гипоксией гермообъема (1), при подкожном введении пегфилграстима (2), пероральном введении пегфилграстима (3), при подкожном (4) и пероральном (5) введении им Г-КСФ после пребывания животных в термокамере, в усл. ед., (X±m) | |||
| Сроки исследования, сутки | Доля погибших животных, % | Уровень воспроизведения рефлекса1 | |
| 14-е | ИК | 0 | 0,9+0,07 |
| 1 | 22,73∗ | 0,41±0,12∗ | |
| 2 | 12,3∗# | 0,7±0,08# | |
| 3 | 23,1∗ | 0,4±0,1∗ | |
| 4 | 7,4∗ | 0,87±0,04#& | |
| 5 | 14,1∗ | 0,69±0,97# | |
| 21-е | ИК | 0 | 0,8±0,13 |
| 1 | 35,7∗ | 0,1±0,1∗ | |
| 2 | 14,1∗ | 0,6±0,02# | |
| J | 34,6∗ | 0,12±0,12∗ | |
| 4 | 8,1∗ | 0,86±0,05#& | |
| 5 | 14,1∗ | 0,65±0,07# | |
| 1 - доля животных с сохраненным рефлексом | |||
| ИК - соответствующие показатели у интактных животных | |||
| * - отмечена достоверность различия показателя от его значения у интактных животных при p≤0,05. | |||
| # - отмечена достоверность различия показателя от его контрольного значения при р≤0,05. | |||
| & - отмечена достоверность различия показателя у мышей, получавших имГ-КСФ от его контрольного значения у животных, получавших пегфилграстим подкожно при р≤0,05. |
| Таблица 8 | ||||
| Динамика показателей ориентировочно-исследовательского поведения мышей линии CBA\CaLac в открытом поле при энцефалопатии, вызванной гипоксией гермообъема (1), при подкожном введении пегфилграстима (2), пероральном введении пегфилграстима (3), при подкожном (4) и пероральном (5) введении им Г-КСФ после пребывания животных в термокамере, в усл. ед., (Х±m) | ||||
| Сроки исследования, сутки | Коэффициент асимметрии | Суммарная двигательная активность | Горизонтальная двигательная активность | |
| 14-е | ИК | 0,49±0,06 | 15,4±2,45 | 8,0±1,74 |
| 1 | 0,75±0,05∗ | 36,86±8,1∗ | 26,43±4,97∗ | |
| 2 | 0,58±0,06# | 19,2±1,06# | 9,4±1,9# | |
| 0,76±0,03∗ | 34,84±2,72 | 28,71±2,11 | ||
| 4 | 0,37±0,04#& | 14,7±1,6#& | 12,4±1,5# | |
| 5 | 0,41±0,05# | 17,3±0,97# | 13,2±1,7# | |
| 21-е | ИК | 0,56±0,07 | 20,7±3,31 | 12,6±2,21 |
| 1 | 0,75±0,03∗ | 32,57±3,34∗ | 23,86±4,38∗ | |
| 2 | 0,62±0,04 | 26,59±2,3 | 17,2±1,3 | |
| 3 | 0,74±0,02∗ | 34,3±2,9∗ | 22,4±2,7∗ | |
| 4 | 0,54±0,02#& | 19,7±1,7#& | 11,7±2,4#& | |
| 5 | 0,61±0,12# | 21,8±3,87# | 15,62±2,19# | |
| * - отмечена достоверность различия показателя от его значения у интактных животных при p≤0,05. | ||||
| # - отмечена достоверность различия показателя от его контрольного значения при p≤0,05. | ||||
| &a |