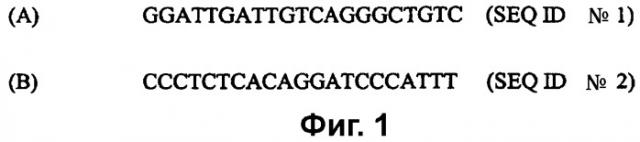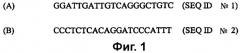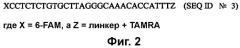Набор из двух праймеров для амплификации нуклеиновой кислоты вируса гепатита а, способ обнаружения вируса гепатита а с его использованием (варианты) и набор для обнаружения вируса гепатита а
Иллюстрации
Показать всеИзобретение относится к области биотехнологии, в частности к набору из двух праймеров для амплификации нуклеиновой кислоты вируса гепатита А, к способу обнаружения вируса гепатита А в биологическом образце, а также к набору для обнаружения вируса гепатита А в биологическом образце. Способ обнаружения вируса гепатита A (HAV) в биологическом образце, содержащем антитела, продуцируемые индивидуумом, осуществляют путем приведения твердой подложки в контакт с захватывающими нуклеиновыми кислотами, содержащими один или несколько олигонуклеотидов. После чего проводят приведение твердой подложки в контакт с биологическим образцом в условиях гибридизации. Затем осуществляют отделение твердой подложки от образца. Далее проводят амплификацию выделенных нуклеиновых кислот с применением набора из двух праймеров. После чего осуществляют определение наличия амплифицированных нуклеиновых кислот в качестве признака наличия или отсутствия HAV в образце. Способ может также включать определение наличия амплифицированной внутренней контрольной последовательности. Предложенное изобретение позволяет разработать чувствительный, надежный диагностический тест для обнаружения вируса гепатита А (HAV) в биологических образцах от потенциально зараженных индивидов. 9 н. и 34 з.п. ф-лы, 5 ил., 1 табл.
Реферат
Область техники
Настоящее изобретение в целом относится к диагностике. Конкретно изобретение относится к основанным на нуклеиновой кислоте анализам для точной диагностики инфекции гепатита A и выявления гепатита A в биологическом образце.
Предпосылки изобретения
Гепатит A представляет собой передающееся кишечным путем заболевание, вызывающее лихорадку, недомогание, потерю аппетита, тошноту, желудочно-кишечный дискомфорт и желтуху. Возбудитель гепатита A, вирус гепатита A, представляет собой маленький безоболочечный сферический вирус, принадлежащий роду Hepatovirus семейства Picornaviridae. Геном HAV состоит из одноцепочечной линейной молекулы РНК длиной 7,5 т.н., кодирующей полибелковый предшественник, перерабатываемый с образованием структурных белков, и белки с ферментативной активностью, необходимые для репликации вируса (Najarian et al., Proc. Natl. Acad. Sci. USA 82: 2627-2632 (1985)). HAV плохо растет в клеточной культуре, не является цитопатическим и дает малые выходы вируса. Хотя РНК HAV, выделенная из вирионов, является инфекционной в клеточной культуре (Locarnini et al., J. Virol. 37: 216-225 (1981) and Siegl et al., J. Gen. Virol. 57: 331-341 (1981)), непосредственное манипулирование вирусным геномом затруднено ввиду того, что он состоит из РНК.
HAV кодирует четыре капсидных белка (A, B, C и D), содержащих большинство антигенных детерминант, распознаваемых антителами инфицированных индивидов. В дополнение к капсидным белкам сообщали об антигенных детерминантах в неструктурных белках, таких как 2A и кодируемой вирусом протеазе. Другая важная антигенная детерминанта HAV описана в соединении между капсидным предшественником P1 и 2A.
Обычно HAV заражаются фекально-оральным путем, или посредством контакта человек-человек, или путем потребления зараженной пищи или воды. Однако существует вероятность переноса HAV посредством объединенных продуктов плазмы. Отсутствие липидной оболочки делает HAV очень устойчивым к физико-химической инактивации, и вирус может выдерживать традиционную тепловую обработку продуктов крови. Таким образом, HAV, а также Parvovirus B19 перенесли введением объединенных производных плазмы. Разработка чувствительных и специфичных диагностических анализов для выявления антигенов и HAV и/или антител у инфицированных индивидов, а также основанных на нуклеиновой кислоте тестов для выявления зараженных вирусом образцов для исключения их из образцов для трансфузии представляет собой важную проблему здравоохранения.
В патенте США № 5290677, выданном Robertson et al., описан захват целых вирусов HAV с применением антител. Выделяют РНК и получают кДНК. Затем кДНК амплифицируют посредством ПЦР с применением праймеров к области капсида генома HAV VP1 и VP3, а амплифицированный продукт выявляют с применением зондов из той же области генома. Выбор праймеров и зондов основан на генотипе HAV, подвергаемого выявлению.
Сущность изобретения
Настоящее изобретение основано на разработке чувствительного, надежного диагностического теста, основанного на нуклеиновой кислоте, для выявления HAV в биологических образцах от потенциально зараженных индивидов. В описанных здесь способах выделенный образец нуклеиновой кислоты применяют в качестве матрицы для амплификации консервативных геномных областей последовательности HAV с применением ПЦР, опосредованной транскрипцией амплификации (TMA), а также в 5'-нуклеазном анализе, таком как способ TaqMan™. Способы позволяют выявление HAV в зараженных вирусом образцах. В определенных осуществлениях в данном изобретении используют праймеры и зонды, полученные из области 5'-UTR генома HAV. Кроме того, способы позволяют анализ в одном контейнере, где нуклеиновые кислоты захваченных образцов можно подвергать амплификации и выявлению в одном и том же контейнере. Применяя способы по изобретению, можно идентифицировать инфицированные образцы и исключить их из образцов для трансфузии, а также из образцов для получения производных крови.
Таким образом, в одном осуществлении данное изобретение относится к способу выявления инфекции HAV в биологическом образце. Способ включает в себя:
(a) приведение твердой подложки в контакт с биологическим образцом при высоких концентрациях хаотропных солей или в гибридизационных условиях, где формируется комплекс между твердой подложкой и нуклеиновыми кислотами-мишенями;
(b) отделение твердой подложки из (a) от образца;
(c) амплификацию нуклеиновых кислот-мишеней, при наличии;
(d) выявление наличия амплифицированных нуклеиновых кислот-мишеней в качестве признака присутствия или отсутствия HAV в образце.
В другом осуществлении данное изобретение относится к способу выявления инфекции HAV в биологическом образце. Способ включает:
(a) приведение твердой подложки в контакт с биологическим образцом при высоких концентрациях хаотропных солей или в гибридизационных условиях, где формируется комплекс между твердой подложкой и нуклеиновыми кислотами-мишенями;
(b) отделение твердой подложки из (a) от образца;
(c) амплификацию цепей-мишеней с применением праймеров, полученных из 5'-UTR генома HAV, таких как праймеры, представленные последовательностями, содержащими SEQ ID №№ 1 и 2. В некоторых осуществлениях способ дополнительно включает стадию применения зонда из 5'-UTR генома HAV, такого как зонд из SEQ ID № 3, для выявления присутствия амплифицированных олигонуклеотидов-мишеней в качестве признака присутствия или отсутствия HAV в образце.
В дополнительном осуществлении изобретение относится к способу выявления инфекции HAV в биологическом образце, где способ включает:
выделение нуклеиновых кислот из биологического образца, в котором предполагают наличие HAV;
амплификацию нуклеиновых кислот с применением, по меньшей мере, двух праймеров, где (a) каждый из праймеров состоит не более чем приблизительно из 60 нуклеотидов в длину и один праймер содержит нуклеотидную последовательность из 10 последовательных нуклеотидов из SEQ ID № 1, а другой праймер содержит нуклеотидную последовательность из 10 последовательных нуклеотидов из SEQ ID № 2, или (b) праймеры обладают 90% идентичности последовательности с нуклеотидной последовательностью (a), где каждый из двух праймеров в достаточной степени комплементарен части соответственно смысловой или антисмысловой цепи выделенной нуклеиновой кислоты, чтобы гибридизоваться с ней; и
выявление наличия амплифицированных нуклеиновых кислот в качестве признака присутствия или отсутствия HAV в образце.
В определенных осуществлениях нуклеиновые кислоты выделяют из биологического образца способом, включающим:
(a) приведение твердой подложки, содержащей связанные с ней захватывающие нуклеиновые кислоты, в контакт с биологическим образцом в гибридизационных условиях, где цепи нуклеиновой кислоты-мишени гибридизуются с захватывающими нуклеиновыми кислотами;
(b) отделение твердой подложки от образца.
В дополнительных осуществлениях выделение, амплификацию и выявление проводят в одном контейнере.
В дополнительном осуществлении захватывающие нуклеиновые кислоты включают в себя один или несколько олигонуклеотидов, где каждый из олигонуклеотидов состоит не более чем приблизительно из 60 нуклеотидов в длину и включает, по меньшей мере, 10 последовательных нуклеотидов из последовательности, выбранной из группы, состоящей из SEQ ID № 4, SEQ ID № 5, SEQ ID № 6, и SEQ ID № 7.
В еще одном дополнительном осуществлении захватывающие нуклеиновые кислоты дополнительно включают гомополимерную цепь приблизительно из 15-25 нуклеотидов в длину, такую как poly(A), poly(T), poly(G), poly(C) или poly(U).
В другом осуществлении амплификация включает в себя ПЦР, опосредованную транскрипцией амплификацию (TMA) или TaqMan.
В дополнительном осуществлении способ дополнительно включает применение меченого олигонуклеотидного зонда для выявления амплифицированного продукта. Зонд представляет собой последовательность длиной не более чем 60 нуклеотидов и состоящую, по меньшей мере, из 10 последовательных нуклеотидов, содержащихся в SEQ ID № 3.
В определенных осуществлениях зонд на 5'-конце и на 3'-конце дополнительно включает в себя детектируемые метки, такие как флуоресцентная метка, выбранная из группы, состоящей из 6-карбоксифлуоресцеина (6-FAM), тетраметилродамина (TAMRA) и 2',4',5',7'-тетрахлор-4-7-дихлорфлуоресцеина (TET).
В еще одном осуществлении изобретение относится к способу выявления инфекции HAV в биологическом образце, где способ включает:
(a) приведение твердой подложки в контакт с захватывающими нуклеиновыми кислотами, содержащими один или несколько олигонуклеотидов, где один или несколько олигонуклеотидов включают последовательность, выбранную из группы, состоящей из SEQ ID № 10, SEQ ID № 11, SEQ ID № 12, SEQ ID № 13 и SEQ ID № 14, в условиях, где захватывающие нуклеиновые кислоты связываются с твердой подложкой,
(b) приведение твердой подложки из (a) в контакт с биологическим образцом в гибридизационных условиях, где цепи нуклеиновой кислоты-мишени из HAV, когда присутствуют, гибридизуются с захватывающими нуклеиновыми кислотами;
(c) отделение твердой подложки из (b) от образца;
(d) амплификацию нуклеиновых кислот с применением смыслового праймера, содержащего SEQ ID № 1, и антисмыслового праймера, содержащего SEQ ID № 2, где смысловой и антисмысловой праймеры в достаточной степени комплементарны частям соответственно смысловой или антисмысловой цепи выделенной нуклеиновой кислоты, чтобы гибридизоваться с ними;
(e) выявление наличия амплифицированных нуклеиновых кислот в качестве признака присутствия или отсутствия HAV в образце.
В определенных осуществлениях указанных выше способов твердая подложка включает в себя гранулы, такие как магнитные гранулы, и выделение, амплификацию и выявление, проводимые в одном контейнере.
В дополнительных осуществлениях изобретение относится к олигонуклеотиду, содержащему нуклеотидную последовательность, состоящую из любой из нуклеотидных последовательностей, приведенных на фиг. 1.
В дополнительных осуществлениях данное изобретение относится к отдельному олигонуклеотиду, состоящему не более чем из 60 нуклеотидов в длину, содержащему:
(a) нуклеотидную последовательность, по меньшей мере, из 10 последовательных нуклеотидов из последовательности, выбранной из группы, состоящей из SEQ ID №№ 1, 2 и 3;
(b) нуклеотидную последовательность с 90% идентичности последовательности с нуклеотидной последовательностью из (a); или
(c) комплементарные (a) и (b) последовательности.
В определенных осуществлениях олигонуклеотид представляет собой нуклеотидную последовательность, по меньшей мере, из 10 последовательных нуклеотидов из SEQ ID №№ 1, 2 или 3.
В дополнительных осуществлениях олигонуклеотид на 5'-конце и на 3'-конце дополнительно содержит детектируемую метку. В определенных осуществлениях детектируемая метка представляет собой флуоресцентную метку, выбранную из группы, состоящей из 6-карбоксифлуоресцеина (6-FAM), тетраметилродамина (TAMRA) и 2',4',5',7'-тетрахлор-4-7-дихлорфлуоресцеина (TET).
В еще одном дополнительном осуществлении изобретение относится к набору для диагностического теста, содержащему один или несколько описанных здесь праймеров и инструкции для проведения диагностического теста. В определенных осуществлениях набор для тестирования дополнительно содержит олигонуклеотидный зонд, включающий специфически гибридизующуюся с HAV последовательность из нуклеотидов длиной приблизительно от 10 до приблизительно 50 нуклеотидов, связанную с детектируемой меткой.
В дополнительном осуществлении изобретение относится к набору для выявления HAV в биологическом образце. Набор содержит захватывающие нуклеиновые кислоты, включающие в себя один или несколько олигонуклеотидов, где один или несколько олигонуклеотидов содержат последовательность, выбранную из группы, состоящей из SEQ ID № 10, SEQ ID № 11, SEQ ID № 12, SEQ ID № 13 и SEQ ID № 14; праймеры, содержащие SEQ ID №№ 1 и 2, и олигонуклеотидный зонд, содержащий SEQ ID № 3. В определенных осуществлениях набор для тестирования дополнительно содержит полимеразу и инструкции для проведения диагностических тестов.
В дополнительном осуществлении изобретение относится к набору для выявления инфекции HAV в биологическом образце, где набор включает
захватывающие нуклеиновые кислоты, включающие один или несколько олигонуклеотидов, где каждый из олигонуклеотидов состоит не более чем из 60 нуклеотидов в длину и содержит нуклеотидную последовательность, по меньшей мере, из 10 последовательных нуклеотидов последовательности, выбранной из группы, состоящей из SEQ ID № 10, SEQ ID № 11, SEQ ID № 12, SEQ ID № 13 и SEQ ID № 14;
по меньшей мере, два праймера, где (a) каждый из праймеров состоит не более чем приблизительно из 60 нуклеотидов в длину и один праймер содержит нуклеотидную последовательность из, по меньшей мере, 10 последовательных нуклеотидов из SEQ ID № 1, а другой праймер - нуклеотидную последовательность, по меньшей мере, из 10 последовательных нуклеотидов из SEQ ID № 2,
написанные инструкции для выявления инфекции HAV.
В определенных осуществлениях набор дополнительно содержит олигонуклеотидный зонд, состоящий не более чем приблизительно из 60 нуклеотидов в длину и по меньшей мере 10 последовательных нуклеотидов из SEQ ID № 3. На 5'-конце и на 3'-конце зонд дополнительно может содержать детектируемые метки. В некоторых осуществлениях детектируемая метка представляет собой флуоресцентную метку, выбранную из группы, состоящей из 6-карбоксифлуоресцеина (6-FAM), тетраметилродамина (TAMRA) и 2',4',5',7'-тетрахлор-4-7-дихлорфлуоресцеина (TET).
В определенных осуществлениях указанные выше наборы дополнительно включают полимеразу и буферы.
Данный и другие аспекты настоящего осуществления станут очевидны при ссылке на следующее ниже подробное описание и приложенные чертежи. Кроме того, здесь приведены различные ссылки на источники, в которых определенные процедуры и композиции описаны более подробно.
Краткое описание чертежей
На фиг. 1A-1B (SEQ ID №№ 1 и 2) приведены типовые праймеры для применения в амплификации выделенных нуклеиновых кислот HAV.
На фиг. 2 (SEQ ID № 3) приведен зонд для применения в выявлении присутствия амплифицированных олигонуклеотидов-мишеней, указывающих на присутствие HAV, где X представляет собой 6-FAM (флуоресцеин), а Z представляет собой линкер с TAMRA (тетраметилродамин).
На фиг. 3A-3F (SEQ ID №№ 10-15) приведены типовые захватывающие олигонуклеотиды для выделения нуклеиновых кислот HAV из биологического образца.
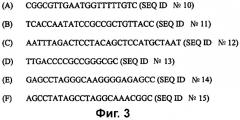
На фиг. 4A приведена последовательность-мишень HAV дикого типа (SEQ ID № 16).
На фиг. 4B (SEQ ID № 17) приведена типовая внутренняя контрольная последовательность для применения в качестве контроля для захвата и амплификации мишени. Отмеченные полужирным шрифтом основания представляют собой последовательность у дикого типа, замененную на внутреннюю контрольную последовательность.
Подробное описание изобретения
В практической части настоящего изобретения, если не указанно иначе, будут применять традиционные способы химии, биохимии, технологии рекомбинантных ДНК и вирусологии в рамках уровня технологий. Такие технологии полностью описаны в литературе. См., например, Fundamental Virology, 2nd Edition, vol. I & II (B. N. Fields and D. M. Knipe, eds.); A.L. Lehninger, Biochemistry (Worth Publishers, Inc., current addition); Sambrook, et al., Molecular Cloning: A Laboratory Manual (2nd Edition, 1989); Methods In Enzymology (S. Colowick and N. Kaplan eds., Academic Press, Inc.); Oligonucleotide Synthesis (N. Gait, ed., 1984); A Practical Guide to Molecular Cloning (1984).
Необходимо отметить, что, как применяют в данной спецификации и приложенной формуле изобретения, единичные формы включают в себя множественные объекты ссылки, если в содержании явно не указано иначе. Таким образом, например, ссылка на олигонуклеотид включает в себя смесь двух или более олигонуклеотидов и т.п.
В тексте применяют следующие сокращения аминокислот:
| Аланин: Ala (A) | Аргинин: Arg (R) |
| Аспарагин: Asn (N) | Аспарагиновая кислота: Asp (D) |
| Цистеин: Cys (C) | Глутамин: Gln (Q) |
| Глутаминовая кислота: Glu (E) | Глицин: Gly (G) |
| Гистидин: His (H) | Изолейцин: Ile (I) |
| Лейцин: Leu (L) | Лизин: Lys (K) |
| Метионин: Met (M) | Фенилаланин: Phe (F) |
| Пролин: Pro (P) | Серин: Ser (S) |
| Треонин: Thr (T) | Триптофан: Trp (W) |
| Тирозин: Tyr (Y) | Валин: Val (V) |
I. Определения
В описании настоящего изобретения применяют следующие ниже термины и подразумевается, что они определены, как указано ниже.
Термины «полипептид» и «белок» относятся к полимеру из аминокислотных остатков и не ограничены минимальной длиной продукта. Таким образом, пептиды, олигопептиды, димеры, мультимеры и т.п. включены в пределы определения. И полноразмерные белки, и их фрагменты включены в определение. Термины также включают постэкспрессионные модификации полипептида, например гликозилирование, ацетилирование, фосфорилирование и т.п. Кроме того, для целей настоящего изобретения «полипептид» относится к белку, включающему модификации, такие как делеции, добавления или замены (как правило, консервативные по природе) в природной последовательности, при условии, что белок сохраняет желательную активность. Данные модификации могут проводить намеренно так, как при сайт-специфическом мутагенезе, или они могут являться случайными, такими как вследствие мутаций продуцирующих белки хозяев или ошибок вследствие амплификации ПЦР.
При ссылке на белок под «выделенным» подразумевают то, что указанная молекула является изолированной и отдельной от целого организма, в котором данная молекула обнаружена в природе, или находится при существенном отсутствии других биологических макромолекул того же типа. По отношению к полинуклеотиду термин «выделенный» представляет собой молекулу нуклеиновой кислоты целиком или частично освобожденную от последовательностей, обычно связанных с ней в природе; или существующую в природе последовательность, но со связанными с нею гетерологичными последовательностями; или молекулу, отделенную от хромосомы.
Полинуклеотид «полученный из» или «специфичный к» указанной последовательности ссылается на полинуклеотидную последовательность, содержащую непрерывную последовательность, по меньшей мере, приблизительно из 6 нуклеотидов, предпочтительно, по меньшей мере, приблизительно из 8 нуклеотидов, более предпочтительно, по меньшей мере, приблизительно из 10-12 нуклеотидов, и даже более предпочтительно, по меньшей мере, приблизительно из 15-20 нуклеотидов, соответствующих, т.е. идентичных или комплементарных, области указанной нуклеотидной последовательности. Полученный полинуклеотид необязательно получен физически из представляющей интерес нуклеотидной последовательности, но его можно получить любым способом, включающим в качестве неограничивающих примеров химический синтез, репликацию, обратную транскрипцию или транскрипцию, основанную на информации, предоставленной последовательностью оснований в области(ях), из которых получен полинуклеотид. По существу он может представлять или смысловую, или антисмысловую ориентацию исходного полинуклеотида.
«Гомология» относится к проценту сходства между двумя полинуклеотидами или двумя полипептидными молекулами. Две последовательности нуклеиновой кислоты или две полипептидные последовательности являются «по существу гомологичными» друг другу, когда последовательности обнаруживают, по меньшей мере, приблизительно 50%, предпочтительно, по меньшей мере, приблизительно 75%, более предпочтительно, по меньшей мере, приблизительно 80-85%, предпочтительно, по меньшей мере, приблизительно 90% и наиболее предпочтительно, по меньшей мере, приблизительно 95-98% сходства последовательностей на протяжении заданной длины молекул. Как применяют здесь, «по существу гомологичные» также относится к последовательностям, демонстрирующим полную идентичность с конкретной нуклеиновой кислотой или полипептидной последовательностью.
Как правило, «идентичность» относится к точному соответствию нуклеотид-нуклеотид или аминокислота-аминокислота двух полинуклеотидов или полипептидных последовательностей соответственно. Процент идентичности можно определить прямым сравнением информации, заключенной в последовательности, между двумя молекулами посредством выравнивания последовательностей, подсчета точного количества совпадений между двумя выровненными последовательностями, деления на длину более короткой последовательности и умножения результата на 100.
Для помощи в анализе гомологии и идентичности можно применять легкодоступные компьютерные программы, такие как ALIGN, Dayhoff, M.O. in Atlas of Protein Sequence and Structure M.O. Dayhoff ed., 5 Suppl. 3:353-358, National biomedical Research Foundation, Washington, DC, применяющую к анализу пептидов алгоритм локальной гомологии Smith и Waterman Advances in Appl. Math. 2:482-489, 1981. Программы для определения гомологии нуклеотидных последовательностей доступны в Wisconsin Sequence Analysis Package, Version 8 (доступный в Genetics Computer Group, Madison, WI), например, программы BESTFIT, FASTA и GAP, также основанные на алгоритме Smith и Waterman. Данные программы легко применять с параметрами по умолчанию, рекомендованными производителем и описанными в Wisconsin Sequence Analysis Package, указанном выше. Например, процент гомологии конкретной нуклеотидной последовательности и референсной последовательности можно определить с применением алгоритма гомологии Smith и Waterman, с оценочной таблицей по умолчанию и штрафом за пропуск шести нуклеотидных положений.
Другой способ оценки процента гомологии в контексте настоящего изобретения представляет собой применение программного пакета MPSRCH, авторские права на который принадлежат University of Edinburgh, разработанного John F. Collins и Shane S. Sturrok и распространяемого IntelliGenetics, Inc. (Mountain View, CA). Для данного набора пакетов можно использовать алгоритм Smith-Waterman, где для оценочной таблицы применяют параметры по умолчанию (например, штраф за внесение делеции в размере 12, штраф за продолжение делеции в размере 1 и пропуск в размере 6). Из получаемых данных значение «совпадение» отражает «гомологию последовательности». В данной области общеизвестны другие пригодные программы для подсчета процента идентичности или сходства между последовательностями, например, другая программа выравнивания представляет собой BLAST, применяемая с параметрами по умолчанию. Например, BLASTN и BLASTP можно применять с использованием следующих параметров по умолчанию: genetic code = standard; filter = none; strand = both; cutoff = 60; expect = 10; Matrix = BLOSUM62; Descriptions = 50 sequences; sort by = HIGH SCORE; Databases = non-redundant, GenBank + EMBL + DDBJ + PDB + GenBank CDS translations + Swiss protein + Spupdate + PIR. Подробности о данных программах можно найти по следующему интернет-адресу: http://www.ncbi.nlm.gov/cgi-bin/BLAST.
Альтернативно, гомологию можно определять гибридизацией полинуклеотидов в таких условиях, когда формируются стабильные дуплексы между гомологичными областями, с последующим расщеплением специфичной к одноцепочечной нуклеиновой кислоте нуклеазой(ами) и определением размера расщепленных фрагментов. Последовательности нуклеиновых кислот, являющиеся в значительной степени гомологичными, можно идентифицировать в эксперименте гибридизации по Саузерну, например, в строгих условиях, как определено для данной конкретной системы. Определение пригодных условий гибридизации находится в пределах уровня технологий в данной области. Например, см. Sambrook et al., выше; DNA Cloning, выше; Nucleic Acid Hybridization, выше.
Как применяют здесь для описания молекулы нуклеиновой кислоты, «рекомбинантный» означает происходящий из генома, кДНК, вируса, полусинтетический или синтетический полинуклеотид, который в силу его происхождения или манипуляций с ним не связан с целым полинуклеотидом или его частью, с которыми он связан в природе. Термин «рекомбинантный», применяемый в отношении белка или полипептида, означает полипептид, полученный посредством экспрессии рекомбинантного полинуклеотида. Как правило, представляющий интерес ген клонируют, а затем экспрессируют в трансформированных организмах, как описано дополнительно ниже. Организм хозяина экспрессирует чужеродный ген с образованием белка в подходящих для экспрессии условиях.
«Регуляторный элемент» относится к полинуклеотидной последовательности, способствующей транскрипции и/или трансляции полинуклеотидной последовательности, с которой он связан. Термин включает промоторы, последовательности терминации транскрипции, вышерасположенные регуляторные домены, сигналы полиаденилирования, нетранслируемые области, включающие в себя 5'-UTR и 3'-UTR и, когда подходит, лидерные последовательности и энхансеры, которые вместе обеспечивают транскрипцию и трансляцию кодирующей последовательности в клетке-хозяине.
Как применяют здесь, «промотор» представляет собой регуляторную область, способную к связыванию с полимеразой и инициации транскрипции функционально связанной с ней расположенной ниже (в направлении 3') нуклеотидной последовательности. Для целей настоящего изобретения промоторная последовательность включает минимальное количество оснований или элементов, необходимых для инициации транскрипции представляющей интерес последовательности на определяемых выше фона уровнях. В пределах промоторной последовательности находится участок инициации транскрипции, а также домены связывания белков (консенсусные последовательности), ответственные за связывания РНК- или ДНК-полимеразы. Например, промотор может представлять собой последовательность нуклеиновой кислоты, распознающуюся ДНК-зависимой РНК-полимеразой («транскриптазой») в качестве сигнала для связывания с нуклеиновой кислотой и начала транскрипции РНК на конкретном участке. Для связывания таким транскриптазам, как правило, необходима частично двухцепочечная ДНК, содержащая промоторную последовательность и комплементарную ей последовательность; матричная часть (последовательность для транскрипции) не должна являться двухцепочечной. Отдельные ДНК-зависимые РНК-полимеразы распознают множество различных промоторных последовательностей, которые могут заметно отличаться по их эффективности в активации транскрипции. Когда РНК-полимераза связывается с промоторной последовательностью для инициации транскрипции, данная промоторная последовательность не является частью транскрибируемой последовательности. Соответственно, полученные таким образом РНК-транскрипты не включают в себя данную последовательность.
Регуляторная последовательность «направляет транскрипцию» нуклеотидной последовательности, когда РНК- или ДНК-полимераза связывается с промоторной последовательностью и транскрибирует смежную последовательность.
«ДНК-зависимая ДНК-полимерза» представляет собой фермент, синтезирующий комплементарную копию ДНК на матрице ДНК. Примерами являются ДНК-полимераза I E. coli и ДНК-полимераза бактериофага T7. Всем известным ДНК-зависимым ДНК-полимерзам для инициации синтеза необходим комплементарный праймер. В подходящих условиях ДНК-зависимая ДНК-полимерза может синтезировать комплементарную копию ДНК на матрице РНК.
«ДНК-зависимая РНК-полимераза» или «транскриптаза» представляет собой фермент, синтезирующий множество копий РНК на двухцепочечной или частично двухцепочечной молекуле ДНК с (как правило, двухцепочечной) промоторной последовательностью. Молекулы РНК («транскрипты») синтезируются в направлении от 5' к 3', начиная от расположенного ниже в непосредственной близости от промотора определенного положения. Примерами транскриптаз являются ДНК-зависимые РНК-полимеразы E. coli и бактериофагов T7, T3 и SP6.
«РНК-зависимая ДНК-полимераза» или «обратная транскриптаза» представляет собой фермент, синтезирующий комплементарную копию ДНК на матрице РНК. Все известные обратные транскриптазы также обладают способностью создавать комплементарные копии ДНК на матрице ДНК; таким образом, они являются и РНК-, и ДНК-зависимыми ДНК-полимеразами. Для инициации синтеза на матрицах РНК и ДНК необходим праймер.
«РНКаза H» представляет собой фермент, расщепляющий РНК-часть дуплекса РНК:ДНК. Данные ферменты могут являться эндонуклеазами или экзонуклеазами. Большинство обратных транскриптаз, кроме полимеразной активности, как правило, обладает активностью РНКазы H. Однако доступны другие источники РНКазы H, не связанные с полимеразной активностью. Расщепление может приводить к отделению РНК из комплекса РНК:ДНК. Альтернативно, РНКаза H может просто расщеплять РНК в различных участках, таких как участки плавления РНК, или позволять ферментам раскручивать участки РНК.
Термины «полинуклеотид», «олигонуклеотид», «нуклеиновая кислота» и «молекула нуклеиновой кислоты» здесь применяют для обозначения полимерной формы нуклеотидов любой длины как рибонуклеотидов, так и дезоксирибонуклеотидов. Данный термин относится только к первичной структуре молекулы. Таким образом, термин включает в себя трех-, двух- и одноцепочечную ДНК, а также трех-, двух- и одноцепочечную РНК. Он также включает в себя модификации, такие как метилирование и/или кэпирование, и немодифицированные формы полинуклеотида. Более подробно, термины «полинуклеотид», «олигонуклеотид», «нуклеиновая кислота» и «молекула нуклеиновой кислоты» включают в себя полидезоксирибонуклеотиды (содержащие 2-дезокси-D-рибозу), полирибонуклеотиды (содержащие D-рибозу) и полинуклеотиды другого типа, являющиеся N- или C-гликозидами пуринового или пиримидинового основания, и другие полимеры, содержащие ненуклеотидные основные цепи, например полиамид (например, пептидные нуклеиновые кислоты (PNA)) и полимеры полиморфолино (коммерчески доступные в Anti-Virals, Inc., Corvallis, Oregon, как Neugene) и другие синтетические полимеры нуклеиновой кислоты со специфической последовательностью, при условии, что полимеры содержат нуклеотидные основания в конфигурации, позволяющей спаривание и стэкинг оснований, так как это происходит в ДНК и РНК. Здесь значимого отличия в длине между «полинуклеотидом», «олигонуклеотидом», «нуклеиновой кислотой» и «молекулой нуклеиновой кислоты» нет, и данные термины можно применять взаимозаменяемо. Данные термины относятся только к первичной структуре молекулы. Таким образом, данные термины включают в себя, например, 3'-дезокси-2',5'-ДНК, олигодезоксирибонуклеотид-N3',P5'-фосфорамидаты, 2'-O-алкил-замещенную РНК, двух- и одноцепочечную ДНК, а также двух- и одноцепочечную РНК, гибриды ДНК:РНК и гибриды между PNA и ДНК или РНК, а также включают в себя известные типы модификаций, например, известные в данной области метки, метилирование, «кэпы», замену одного или нескольких встречающихся в природе нуклеотидов аналогом, межнуклеотидные модификации, например, такие как межнуклеотидные модификации незаряженными связями (например, метилфосфанаты, фосфотриэфиры, фосфорамидаты, карбаматы и т.д.), отрицательно заряженными связями (например, фосфоротиоаты, фосфородитиоаты и т.д.) и положительно заряженными связями (например, аминоалкилфосфороамидаты, аминоалкилфосфоротриэфиры), межнуклеотидные модификации, содержащие боковые группы, такие как, например, белки (включая нуклеазы, токсины, антитела, сигнальные пептиды, поли-L-лизины и т.д.), межнуклеотидные модификации интеркаляторами (например, акридин, псорален и т.д.), межнуклеотидные модификации, содержащие хелаторы (например, металлы, радиоактивные металлы, бор, окисляющиеся металлы и т.д.), межнуклеотидные модификации, содержащие алкилирующие средства, межнуклеотидные модификации с модифицированными связями (например, альфааномерные нуклеиновые кислоты и т.д.), а также немодифицированные формы полинуклеотида или олигонуклеотида. В частности, ДНК представляет собой дезоксирибонуклеиновую кислоту.
Как применяют здесь, термин «область нуклеиновой кислоты, являющаяся мишенью» или «нуклеиновая кислота-мишень» означает молекулу нуклеиновой кислоты с «последовательностью-мишенью» для амплификации. Нуклеиновая кислота-мишень может являться или одноцепочечной, или двухцепочечной и может включать в себя кроме последовательности-мишени другие последовательности, которые могут не амплифицироваться. Термин «последовательность-мишень» относится к подлежащей амплификации конкретной нуклеотидной последовательности на нуклеиновой кислоте-мишени. Последовательность-мишень может включать в себя гибридизующуюся с зондом область, содержащуюся в молекуле-мишени, с которой зонд формирует стабильный гибрид в желательных условиях. «Последовательность-мишень» также может включать в себя образующие комплекс последовательности, с которыми олигонуклеотидные праймеры образуют комплексы и удлиняются с использованием последовательности-мишени в качестве матрицы. Там, где нуклеиновая кислота-мишень исходно является одноцепочечной, термин «последовательность-мишень» также относится к последовательности, комплементарной к «последовательности-мишени», существующей в нуклеиновой кислоте-мишени. Если «нуклеиновая кислота-мишень» исходно является двухцепочечной, термин «последовательность-мишень» относится и к плюс(+), и к минус(-) цепям.
Как применяют здесь, термин «праймер» или «олигонуклеотидный праймер» относится к олигонуклеотиду, действующему для инициации синтеза комплементарной цепи нуклеиновой кислоты, когда его помещают в условия, в которых индуцируется синтез продукта удлинения праймера, т.е. в присутствии нуклеотидов и индуцирующего полимеризацию средства, такого как ДНК- или РНК-полимераза, и при подходящей температуре, pH, концентрации металлов и солей. Праймер предпочтительно является одноцепочечным для максимальной эффективности амплификации, но альтернативно может являться двухцепочечным. Если праймер является двухцепочечным, его перед применением для получения продуктов удлинения сначала обрабатывают для разделения цепей. Данную стадию денатурации, как правило, проводят нагреванием, но, альтернативно, можно проводить с применением щелочи и последующей нейтрализации. Таким образом, «праймер» комплементарен матрице и образует комплексы посредством водородных связей или гибридизуется с матрицей с получением комплекса праймер/матрица для инициации синтеза полимеразой, который в процессе синтеза ДНК удлиняется добавлением ковалентно связанных оснований, связанных на 3'-конце комплементарно матрице.
Как применяют здесь, термин «зонд» или «олигонуклеотидный зонд» относится к структуре, содержащей полинуклеотид, такой как определено выше, содержащий последовательность нуклеиновой кислоты, комплементарную последовательности нуклеиновой кислоты, находящейся на анализируемой нуклеиновой кислоте-мишени. Полинуклеотидные области зондов могут состоять из ДНК, и/или РНК, и/или синтетических аналогов нуклеотидов. Когда «олигонуклеотидный зонд» применяют в 5'-нуклеазном анализе, таком как способ TaqMan™, зонд содержит, по меньшей мере, один люминофор и, по меньшей мере, один гаситель, расщепляемый вследствие 5'-эндонуклеазной активности полимеразы, применяемой в реакции для выявления любых амплифицирующихся олигонуклеотидных последовательностей-мишеней. В данном контексте олигонуклеотидный зонд содержит достаточное количество фосфодиэфирных связей, примыкающих к 5'-концу, так что применяемый фермент с 5'→3' экзонуклеазной активностью может эффективно расщеплять связи зонда для разделения люминофоров и гасителей. Когда олигонуклеотидный зонд применяют в способе TMA, его необходимо соответственно метить, как описано ниже.
Необходимо принимать во внимание, что для формирования стабильных гибридов гибридизующимся последовательностям не требуется обладать точной комплементарностью. Во многих случаях стабильные гибриды формируются, когда приблизительно немногим менее чем 10% оснований являются неподходящими, пропуская петли из четырех или более нуклеотидов. Следовательно, как применяют здесь, термин «комплементарный» относится к олигонуклеотиду, формирующему стабильный дуплекс со своим «комплементом» в условиях анализа, как правило, когда гомология составляет 90% или более.
Термины «гибридизовать» и «гибридизация» относятся к формированию комплексов между последовательностями нуклеотидов, достаточно комплементарными, чтобы формировать комплексы посредством образования пар оснований по Уотсону-Крику. Когда праймер «гибридизуется» с мишенью (матрицей), такие комплексы (или гибриды) достаточно стабильны, чтобы выполнять затравочную