Устройство для диагностики жидких сред в процессе амплификации и/или гибридизации
Иллюстрации
Показать всеУстройство предназначено для сканирования результатов диагностики в медицине, ветеринарии, при контроле пищевых продуктов, в криминалистике. Устройство содержит оптическую приемную систему, регистрирующую и управляющую системы, первый и второй осветители, источник питания, терморегулирующий блок с управляющей системой регулирования температуры и реакционную емкость. Терморегулирующий блок дополнительно содержит металлическую подложку с нанесенным на нее светоотражающим или световозвращающим слоем, которая закреплена на лицевой поверхности терморегулирующего блока с помощью термопроводящего клеевого покрытия. Реакционная емкость установлена так, что расстояние между ее рабочей поверхностью и подложкой составляет 0,3-10 мм. Терморегулирующий блок закреплен перпендикулярно оптической оси приемной системы и вместе с элементами оптической системы закреплен на общей платформе, которая может быть установлена под разными углами от 0 до 90° к горизонтальной плоскости для обеспечения возможности заполнения реакционной емкости и проведения ПЦР как в горизонтальном, так и в вертикальном положении реакционной емкости. Терморегулирующий блок снабжен съемной крышкой для вывода ее из оптической траектории оптической системы при регистрации флюоресценции. Устройство обеспечивает проведение реакций гибридизации и ПНР в режиме реального времени. 9 з.п. ф-лы, 7 ил.
Реферат
Область техники
Изобретение относится к устройству для сканирования результатов диагностики в медицине, ветеринарии, контроле пищевых продуктов, в криминалистике и других сферах диагностики, связанной с анализом биологически активных компонентов. В частности, изобретение относится к устройствам сканирования разных типов биологических объектов в растворах, размещенных в ячейках, гибридизационных камерах биочипов или плашках.
Уровень техники
Существует множество технических решений, связанных с регистрацией оптических сигналов, полученных в процессе диагностики жидких биологических образцов. Для регистрации сигнала и идентификации объектов чаще всего используют флуоресцентные метки.
При детектировании флуоресценции в ячейках мультиплат [1, 2] или в кюветах [3] или в гибридизационных устройствах [4] формируют падающий поток ультрафиолетового излучения, используя конфокальный принцип измерения при фокусировании в одной точке или применяют лазерное излучение.
Известно устройство, предназначенное для нагрева луночного планшета. Для повышения эффективности нагрева устройство снабжено стержнями, которые осуществляют теплопередачу с верхней части планшета. Однако такая конструкция не предполагает осуществлять освещение лунок с помощью источников света и представляет собой закрытую систему [5].
Известны устройства для мониторинга проведения ПЦР или устройства для мониторинга одновременно проходящих процессов ПЦР и гибридизации в реальном времени. Известно оптическое устройство (Gambini M. et al., 2006) для мониторинга ПЦР в ячейках, установленных в блок с регулировкой температуры. Эмиссионный световой поток от каждой ячейки формируется с помощью линзы Френеля и регистрируется в ПЗС детекторе. Дополнительные оптические элементы (например, линзы Френеля) удорожают устройство.
Известно устройство для амплификации и детектирования нуклеиновых кислот в реальном времени [4]. В качестве источника света используется лазерное излучение. К недостатку устройства относится необходимость перемещения камеры, в случае если необходимо сканировать всю рабочую площадь камеры.
Известно устройство для проведения ПЦР в режиме реального времени [7], которое содержит биологический чип, установленный внутри реакционного объема. Температура чипа меняется в соответствии с заданными циклами ПЦР. В устройстве используют привод, осуществляющий перемещение образца в ХУ координатах под управлением компьютера.
Известен микроскоп [8], в котором формируют двойное прохождение пучка света через прозрачный исследуемый образец с помощью двух объективов, имеющих идентичные оптические характеристики и зеркала. Зеркало размещено с обратной стороны исследуемого объекта, размещенного на прозрачном носителе, за вторым объективом и отражает поток света, проходящий через исследуемый образец.
Однако данное решение относится к конкретному типу оптического микроскопа и не предполагает возможности его применения в устройствах, которые предназначены для проведения ПЦР и/или гибридизации, поскольку в данной оптической системе невозможно обеспечить контакт подложки, на котором размещен образец с нагревательным элементом.
Таким образом, при применении конфокального принципа измерения флуоресценции или при освещении объектов лазерным излучением, в разных ячейках микроплат или в разных точках рабочего поля биочипов необходимо применение механических узлов для перемещения биочипов или микроплат в координатах ХУ. В некоторых случаях используют механические узлы для перемещения оптической системы относительно неподвижного объекта [9]. Использование сложной и точной механики является существенным недостатком устройств с конфокальным принципом измерения сигналов флуоресценции, поскольку усложняет и удорожает конструкцию. Другим недостатком является неравномерность пучка светового потока в случае использования лазеров в качестве источников возбуждающего излучения.
Известны устройства для научно-исследовательских лабораторий [10, 11]. Устройства предназначены для параллельного проведения ПЦР в 96 ячейках плашки. Устройство содержит механизмы для сканирования плашки по координатам ХУ, устройства для автоматической смены фильтров, регуляторы температуры 96 луночных плашек, ПЗС матрицу и программное обеспечение. Сложность устройства и его высокая цена ограничивают его применение для рутинных диагностик в небольших лабораториях.
Известны оптические сканеры и микроскопы, использующие темнопольный принцип формирования изображения, в соответствии с которым поверхность биочипа или кюветы освещается под углом к оптической оси устройства либо с лицевой стороны поверхности биочипа или кюветы [4, 12], либо с обратной стороны биочипа или кюветы [13-15]. Тем не менее, в большинстве оптических схем, использующих темнопольный принцип освещения, формируется узкий световой пучок, например, с помощью лазеров или светодиодов, что также требует применения устройств перемещения биочипов или кювет в координатах ХУ [15].
Известны устройства, использующие темнопольный принцип освещения, в которых не требуется перемещения биочипов в процессе сканирования результатов диагностики, для этого используют разные технические решения для освещения рабочей зоны, с которой снимают сигнал. В патенте [13] для обеспечения более широкой зоны освещения ячейки с биологическим материалом на задней поверхности ячейки сформирована ребристая поверхность. При этом боковая поверхность ребер перпендикулярна оптической оси осветителя. В устройство дополнительно введен механизм подстройки угла освещения, который управляется от компьютера. Применение специальных видов прозрачных носителей объекта и формирование на их поверхности ребристой структуры удорожает процесс диагностики. Кроме того, введение в структуру устройства дорогостоящих механизмов поворота угла освещения, под управлением компьютера с помощью специализированного программного обеспечения, также значительно удорожает и усложняет конструкцию.
Наиболее близким к изобретению является устройство, описанное в заявке [7]. Устройство предназначено для контроля реакции гибридизации в режиме реального времени. Устройство использует терморегулируемую ячейку 9×9 мм с возможностью ее освещения под углом от 45 до 135 градусов. Ячейка установлена в терморегулятор, который управляется от отдельного устройства. К недостатку устройства относится малые размеры реакционной ячейки, а также недостаточно высокую интенсивность возбуждающего света около 15 мВ и большую неравномерность освещения, которую компенсируют с помощью от 2 до 4 лазеров, освещающих поверхность ячейки перпендикулярно к поверхности или под углом с боковой стороны.
К недостатку указанного изобретения относится недостаточно высокий уровень полезного сигнала и малое отношение сигнал-шум, которые связаны с особенностью конструкции устройства, поскольку устройство не содержит поглотителей отраженного света.
Анализ уровня техники показал, что существует необходимость в разработке простого и надежного устройства для работы с прозрачными реакционными емкостями, выполненными в виде разборных ячеек, герметичных ячеек, кювет или микроплашек или биочипов с герметичным объемом, с обеспечением процесса in-situ, при работе с гомогенными растворами в разных температурных диапазонах для проведения гибридизации и/или ПЦР.
Таким образом, задачей настоящего изобретения является создание устройства с простой оптической системой, но с большим уровнем сигнала и высоким соотношением сигнал шум при измерении флюоресценции или люминесценции в процессе проведения ПЦР и/или гибридизации в режиме реального времени.
Другой задачей является повышение эффективности съема сигналов флюоресценции или люминесценции за счет построения оптической системы, позволяющей формировать освещение максимально большого рабочего поля реакционной емкости без применения сложных механических устройств и перемещения образца в процессе съема данных.
В рассматриваемом изобретении возможность увеличения уровня детектируемого флюоресцентного сигнала осуществляется за счет установки дополнительной подложки со светоотражающей поверхностью, которая расположена на лицевой поверхности терморегулятора, на которую устанавливают заднюю поверхность реакционной емкости перпендикулярно оптической оси приемного устройства. Отражающая поверхность преобразует падающий световой поток и обеспечивает двойное прохождение светового луча через прозрачный гомогенный раствор, в котором размещен исследуемый объект, что позволяет увеличить уровень измеряемого сигнала.
Одним объектом настоящего изобретения является устройство для диагностики жидких сред в процессе амплификации и/или гибридизации, содержащее оптическую приемную систему, регистрирующую и управляющую системы, первый и второй осветители, размещенные на держателях, источник питания, терморегулирующий блок с управляющей системой регулирования температуры реакционную емкость, причем терморегулирующий блок дополнительно содержит подложку с нанесенным на нее светоотражающим слоем, которая закреплена на лицевой рабочей поверхности терморегулирующего блока, с помощью термопроводящего клеевого покрытия с возможностью замены типа светоотражающего слоя, причем подложка выполнена из металла, а светоотражающий слой выполнен из зеркального или световозвращающего покрытия и расположен на расстоянии от 0,3 мм до 10 мм от рабочей поверхности реакционной емкости, причем рабочая поверхность терморегулирующего блока перпендикулярна оптической оси оптической системы и установлена с возможностью поворота на 90 градусов вместе с оптической системой для заполнения ячеек, плашек или биочипов и для проведения ПЦР как в горизонтальном, так и в вертикальном положении. При этом терморегулирующий блок дополнительно снабжен крышкой, с возможностью вывода ее из оптической траектории оптической системы при регистрации флюоресценции.
Следующим объектом изобретения является реакционная емкость, которая выполнена в форме открытой или герметичной ячейки, или биочипа, оснащенного крышкой или планшеты оснащенной крышкой или выполнена из двух биочипов, установленных через прокладку рабочими поверхностями друг к другу, причем прокладка выполнена из герметика или гибкого слоя, снабженного двухсторонним клеевым покрытием. Возможен вариант, в котором реакционная емкость выполнена из ячейки, в которой установлен биочип.
Следующим объектом изобретения является светоотражающий слой, который размещен на подложке и выполнен в виде сплошного или дискретно распределенного слоя, рабочие зоны которого совпадают с положением кластеров на биочипах или с рабочими зонами ячеек или плашек, причем подложка выполнена из алюминия или нержавеющей стали. Зеркальный слой выполнен из напыленного слоя на полированную металлическую поверхность подложки или выполнен из полимерного слоя, снабженного с одной стороны зеркальным слоем, и с другой стороны термопроводящим клеевым покрытием. Световозвращающий слой выполнен из полимерного слоя, снабженного с одной стороны светоотражающим слоем и с другой стороны снабжен термопроводящим клеевым покрытием.
Перечень чертежей
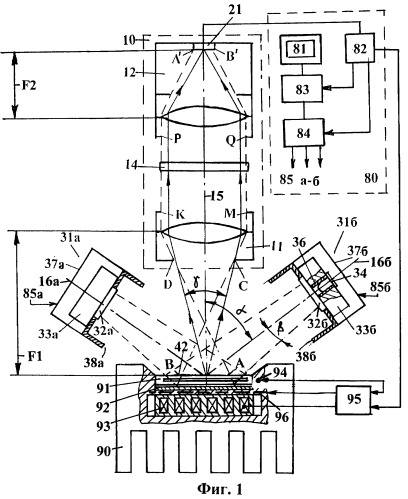
Фиг.1 - Блок-схема устройства для гибридизации и/или ПЦР, подключенного к управляющей системе.
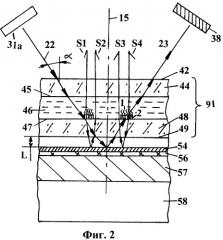
Фиг.2 - Фрагмент сечения ячейки с исследуемым образцом в комбинации с зеркальной отражающей поверхностью, размещенной на терморегулирующем блоке.
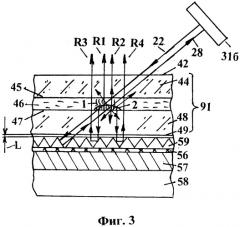
Фиг.3 - Фрагмент сечения ячейки с исследуемым образцом в комбинации со световозвращающей поверхностью, размещенной на терморегулирующем блоке,
Фиг.4 - Схема формирования коллимированного пучка света, где а) диаграмма направленности (индикатриса) излучения СИД; б) индикатриса излучения СИД, установленного в черном цилиндре; в) сечение держателя СИД.
Фиг.5 - Внешний вид элементов излучателей светового потока.
Фиг.6 - Схема конструктивного размещения узлов устройства.
Фиг.7 - Изображение кластеров, состоящих из 13 точек, при разных расстояниях от ячейки до зеркальной поверхности, где а) фотография без зеркальной поверхности; б) расстояние до зеркала 1,1 мм; в) расстояние до зеркала - 2,0 мм; г) расстояние до зеркала - 3,0 мм; д) расстояние до зеркала - 6,0 мм; е) расстояние до зеркала - 11,0 мм.
Структурная схема
Структурная блок-схема устройства приведена на фиг.1. Устройство состоит из оптической приемной системы (10), подключенной к входу регистрирующей и управляющей системы (80), первого (31а) и второго (31б) осветителей, терморегулируемого блока (90) и ячейки с исследуемым образцом (91). Первый (31а) и второй (31б) осветители, формируют световые потоки с углом конуса 2β. При этом оптические оси осветителей расположены под углом α к оптической оси (15) приемной системы (10), которая имеет угол сбора света γ. Падающий свет освещает терморегулируемую ячейку (91), в которой проходит реакция гибридизации и/или ПЦР в режиме реального времени. Терморегулируемая ячейка (91) установлена на рабочую часть терморегулирующего блока (90), который снабжен нагревательными элементами и элементом Пельтье (93). На горизонтальную часть рабочей поверхности блока (90) закреплена отражающая поверхность (93).
Оптическая система (10) состоит из первой (11) и второй (12) части, между которыми введен первый (14) светофильтр, и детектора (21). В регистрирующую и управляющую систему (80) входит компьютер (83) для сбора и обработки данных, поступающих от светочувствительного детектора (21), дисплей (81) для отображения данных, а также узел преобразования сигналов (82), вход которого подключен к выходу детектора (21), первый выход узла (82) подключен к компьютеру, а второй выход к источнику питания (84) для управления режимами работы осветителей (31), третий выход подключен к первому входу блока регулирования температуры (95), второй вход которого подключен к датчику температуры (94), причем первый выход блока (95) связан с нагревателем (96), а второй выход подключен к элементам Пельтье (93).
На фиг.2 представлен вариант, в котором приведено сечение фрагмента герметичной ячейки (91) и схема преобразования падающего света (22) при прохождении через ячейку, выполненную в виде кюветы с параллельными стенками. В ячейке размещены исследуемые образцы в виде кластеров (2) с зондами (1), на которые гибридизуются молекулы, снабженные флуоресцентными метками. Причем зеркальная отражающая поверхность расположена за задней стенкой ячейки на минимальном расстоянии L. Это расстояние может быть равно толщине защитного слоя отражающей поверхности, если ячейка располагается непосредственно на защитном слое. Это расстояние может быть равно расстоянию от задней поверхности ячейки до внешней поверхности зеркала (54), размещенного в выемке. Выемку заполняют теплопроводящим веществом в виде прозрачного геля, масла или через выемку пропускают поток воздуха или жидкости для осуществления быстрой смены температуры на поверхности ячейки. В общем случае это расстояние может лежать в диапазоне от 0,01 мм до 10,0 мм. С учетом минимальной толщины носителя, на котором могут быть иммобилизованы биомолекулы, расстояние от слоя биомолекул до отражающего слоя может лежать в пределах от 0,3 мм до 10 мм.
Согласно изобретению свет направляют под углом α (лежащим в диапазоне от (α-β) до (α+β) по отношению к оптической оси (15) к поверхности ячейки (91), в которой осуществляют реакцию амплификации или гибридизации. На фиг.2 показан световой поток (22), который излучает источник (31а). Падающий свет преломляется на нескольких границах раздела (45, 47, 49) между первой (44) и второй (48) стенками ячейки (91), жидкостью (46) и воздушной или жидкостной средой, находящейся в промежутке L. В растворе (46) осуществляется амплификация или гибридизация биомолекул, при которой увеличивается количество флуоресцентных маркеров, связанных с зондами (1), которыми снабжены кластеры (2) биомолекул. Возбужденные потоком (22) маркеры испускают поток флюоресценции S1, который фиксируется приемной оптической системой (10). Часть флуоресцентного потока, пройдя через прозрачную стенку ячейки (91) и отразившись от отражающей поверхности (54), возвращается в приемное оптическое устройство в форме потока флюоресценции S2. От отражающей поверхности (54) световой поток (22) вторично проходит через ячейку (91), вызывая следующий поток флюоресценции S3. Часть потока флюоресценции также отражается от зеркальной поверхности (54) и возвращается в оптическую систему в форме сигнала флюоресценции S4. Пучок света (23), прошедший через прозрачную ячейку (91), поглощается на поверхностях поглотителя (38), размещенного на лицевой поверхности источника света (31).
За счет двойного прохождения света через исследуемый раствор освещенность кластеров возрастает до двух раз. Общий сигнал флюоресценции, поступающий в оптическую систему (10), теоретически может быть в (1+k)2 раз больше (k - коэффициент отражения зеркала), чем в обычных схемах измерения флуоресценции в жидкостных устройствах для проведения реакции гибридизации и/или ПЦР.
Зеркальная поверхность (54) может быть выполнена в виде зеркала, непосредственно напыленного на полированную рабочую поверхность термоблока, в виде полированной металлической подложки (54), например, из алюминия или нержавеющей стали, прикрепленной к поверхности термоблока термопроводящим слоем (56). В других вариантах формирования отражающей поверхности, зеркальная поверхность может быть защищена от повреждения прозрачными слоем, выполненным из тонкого слоя L стекла или полимера.
Для проведения реакции гибридизации и/или ПЦР, в том числе ПЦР в режиме реального времени, держатель ячейки (57) дополнительно снабжен нагревателем (58) и/или элементом Пельтье для того, чтобы осуществить регулирование температуры при реакции гибридизации или амплификации. Элемент Пельтье размещен между рабочей поверхностью терморегулируемого блока и радиатором, который охлаждается с помощью вентилятора (не показан). Возможны другие варианты терморегулирующих блоков, широко известных в области устройств для гибридизации и/или ПЦР.
Конструкция держателя ячейки, биочипа, плашки может быть снабжена крышкой, которая обеспечивает более высокое качество терморегулирования, и выполнять функции пассивного или активного термостатирования, для чего крышка может быть снабжена дополнительным регулятором температуры. При наличии непрозрачной крышки съем оптического сигнала осуществляется циклически после выведения крышки из траектории оптических сигналов в автоматическом или ручном режиме.
Зеркальная поверхность (54) может быть выполнена в виде отдельного узла или наклеена на рабочую зону терморегулирующего блока. При этом расстояние между задней поверхностью ячейки (49) и лицевой поверхностью отражающего слоя (54) выбирают минимально возможным в диапазоне от 0,01 мм до 10,0 мм.
Оптическую схему установки с использованием зеркала легко представить, если вместо него поместить сзади чипа мнимые источники света, эквивалентные действительным (светящиеся кластеры и осветители), симметрично относительно поверхности зеркала. Реальные кластеры всегда изображаются на картинке резко. Так как мнимое их изображение находится за зеркалом (на удвоенном расстоянии между передней поверхностью чипа и зеркалом), оно будет расфокусировано тем больше, чем дальше находится зеркало от поверхности с иммобилизованными кластерами.
Так как мнимые источники удаляются по мере перемещения зеркала, суммарная регистрируемая яркость кластеров уменьшается, что демонстрируют данные табл.1 в примере 1. Очевидно, что зеркало следует располагать на минимально возможном расстоянии от иммобилизованных кластеров чипа.
На фиг.3 представлен фрагмент сечения ячейки (91), выполненной в виде кюветы с параллельными стенками, расположенной над световозвращающей отражающей поверхностью (59), размещенной на поверхности рабочей зоны терморегулирующего блока на расстоянии L от задней поверхности ячейки. Световозвращающее покрытие позволяет возвратить световой поток, который попадает внутрь треугольных призм, стеклянных шариков или других световозвращающих структур. Один из падающих потоков (22) света, например от второго источника (316), преломляется на внешней (42) и внутренней (45) поверхности верхней стенки (44) ячейки (91) и проходит через гомогенный раствор (46), в котором помещен исследуемый образец с зондами (1), возбуждая флуоресценцию образца. Далее поток преломляется на внутренней (47) и внешней (49) поверхности нижней стенки кюветы (91) и, пройдя через промежуток L, световой поток попадает на световозвращающую поверхность (59). За счет полного внутреннего отражения происходит преломление хода пучка света внутри световозвращающих элементов, после чего поток возвращается и падает на обратную сторону (49) нижней стенки (48) ячейки (91), и далее, пройдя слой раствора и верхнюю стенку кюветы, возвращается на гасящую поверхность (38) источника света (31).
Падающий поток (22) вызывает поток флуоресценции R1, отразившись от световозвращающей поверхности (59) отраженным потоком (28), вновь вызывает поток флуоресценции R1 образца. В свою очередь, сигнал флуоресценции от первого R1 и второго R2 потоков проникает через прозрачный носитель (48) и, отразившись от световозвращающего слоя (59), возвращается через прозрачные носители (44, 48) третьим R3 и четвертым R4 сигналами. Таким образом, общий сигнал, равный сумме потоков Rсум.=R1+R2+R3+R4, поступающий в оптическую систему (10), теоретически может быть в четыре раза больше, чем в обычных схемах сканеров флуоресценции.
Однако с учетом поглощения и рассеяния света на носителе образца и с учетом эффективности работы световозвращающей поверхности, которая снижается при увеличении угла наклона α падающего потока (22), данное техническое решение позволяет обеспечить возврат светового потока через заднюю поверхность (49) носителя (91) и повысить дополнительную освещенность объекта не в четыре раза, как в случае с зеркалом, а от двух до трех раз, в зависимости от типа световозвращающего материала и величины угла наклона α. Следует отметить, что световозвращающее покрытие существенно дешевле зеркального.
В качестве световозвращающего слоя предпочтительно использовать световозвращающие материалы, выполненные в виде панелей, листов или пленок, снабженных клеевым покрытием.
Известно применение световозвращающих элементов в изготовлении световозвращающих панелей [16] и световозвращающих элементов, выполненных в форме листа [17]. Известны гибкие световозвращающие материалы, которые содержат световозвращающую структуру с плоской лицевой поверхностью и с множеством расположенных на ее тыльной поверхности основных и дополнительных световозвращающих элементов [18].
Наиболее предпочтительно использовать в качестве световозвращающих материалов покрытия, разработанные фирмой 3М [19]. Фирма предлагает широкий спектр мультислойных световозвращающих покрытий, которые выполнены с применением сфер [20], микроструктурированных поверхностей [21-23].
Наиболее перспективны световозвращающие пленки алмазного типа. Например, пленка серии 3990 VIP фирмы 3М представляет собой материал на основе микропризм, которые обеспечивают более высокую световозвращающую способность. Пленки с нанесенным световозвращающим слоем снабжены самоклеящим составом и наклеиваются при комнатной температуре. Наиболее продолжительный срок службы достигается при наклейке на предварительно подготовленную алюминиевую поверхность экрана.
Световозвращающая поверхность материалов, основанная на использовании кубических уголковых призм, изготавливается методом литья или формовки призматических элементов на нижней поверхности очень тонкой подложки. В зависимости от типа материала, на одном квадратном сантиметре поверхности размещается от 7300 до более чем 15500 призм [19].
Реакционная емкость (91) может быть выполнена в форме открытой или герметичной ячейки, или биочипа, оснащенного крышкой, или планшета, оснащенного крышкой. Реакционная емкость может содержать жидкостной вход и выход для введения реакционной смеси. Крышка реакционной емкости снабжена, по меньшей мере, одной прокладкой для герметизации объема.
Положение реакционной емкости (91) должно быть строго перпендикулярно оптической оси (15) устройства таким образом, чтобы рабочее пространство, на котором размещен исследуемый объект, располагалось внутри поля зрения АВ регистрирующей оптической системы (10), а рабочая поверхность совмещалась с передней фокальной плоскостью первой части (11) оптической системы (10). Возможна конструкция реакционной емкости, выполненной из двух биочипов, установленных лицом друг к другу через прокладку, выполненную из герметика или гибкой ленты, снабженной двухсторонним клеевым покрытием или, из комбинации герметика и ленты.
Рабочий объем реакционной емкости или, по меньшей мере, одна внутренняя сторона емкости может быть снабжена слоем иммобилизующего материала, который выбирают из группы, состоящей из прозрачного геля, прозрачных капсул, прозрачных полых волокон, прозрачных мембран, твердых прозрачных носителей. В качестве прозрачного носителя можно использовать стекло или полимеры, например ППМА. Иммобилизирующие материалы должны обладать возможностью иммобилизации зондов или должны быть снабжены модифицирующим слоем для иммобилизации биомолекул.
Иммобилизирующий слой может занимать все рабочее поле рабочего объема или может быть выполнен в виде дискретно-распределенного слоя, в виде нескольких рабочих зон, на которых размещают кластеры с зондами. Один из вариантов может включать установку в объем реакционной емкости прозрачного твердого носителя, выполненного в виде биочипа на стеклянном или полимерном носителе.
В свою очередь, отражающий слой может быть расположен под всей рабочей поверхностью реакционной емкости или занимать или быть выполнен в виде дискретных зон, форма которых может быть выбрана из прямоугольника, квадрата, круга, треугольника, многоугольника. Положение дискретных отражающих зон должно совпадать с положением отдельных кластеров или группы кластеров с зондами на расстоянии, обеспечивающем световозвращающий принцип прохождения оптических сигналов, и с учетом типа носителя в форме биочипов, плашек, ячеек.
Устройство позиционирования и крепления носителей объектов исследования (на фиг.1 не показано) должно быть выполнено с возможностью смены разных типов носителей в форме ячейки, биочипа с реакционной емкостью или плашки.
Оптическая система
Поле зрения АВ на рабочей поверхности носителя (91) (см. фиг.1) освещается с помощью двух одинаковых, симметрично расположенных относительно оптической оси (15) устройства, источников возбуждающего излучения (31а, 31б). Конструкция держателей осветителей выполнена с возможностью ручной или автоматической смены осветителей.
В устройстве реализован принцип темнопольного освещения. Оптическая ось (16а, 16б) осветителей составляет острый угол α с оптической осью (15) устройства, при этом выполняется соотношение (α-β)>γ/2. В этом случае возбуждающее излучение (в том числе зеркально отраженное от объекта) не попадает в оптическую систему (10).
Угол α и расстояние от осветителей (31а, 31б) до исследуемого объекта можно менять в процессе юстировки устройства для улучшения равномерности освещения. На фиг.1 пунктиром показаны крайние лучи AD и ВС, собираемые регистрирующей оптикой. При поглощении возбуждающего излучения молекулы флуорохрома, связанные с объектом, флуоресцируют. Свет флуоресценции собирается первой частью (11) оптической системы (10), имеющей числовую апертуру NA=sin(γ/2). Входной люк CD ограничивает поле зрения оптической системы. На ее выходе имеет место телецентрический ход лучей, т.к. рабочая поверхность объекта совмещена с фокальной плоскостью первой части (11) оптической системы. Формирование телецентрического хода лучей необходимо для корректной работы первого интерференционного светофильтра (14). Далее свет проходит через полосовой интерференционный светофильтр (14), спектральные характеристики которого выбираются таким образом, чтобы с одной стороны пропустить максимум полезного сигнала (света флуоресценции метки), а с другой - обеспечить минимум проникновения паразитного фонового света на детектор (21).
Последнее условие обеспечивается, в основном, тремя факторами: а) минимальным проникновением возбуждающего света в канал регистрации. На этот фактор влияют угол падения пучка возбуждающего света α, угол расходимости пучка β, качество поверхностей объекта и зеркал (отсутствие паразитного рассеяния света), общее поглощение возбуждающего излучения внутри прибора, б) минимальным интегралом перекрывания спектров пропускания возбуждающего (32а, 32б) и регистрирующего (14) светофильтров, а также способностью светофильтра (14) подавлять возбуждающее излучение; в) минимальной собственной флуоресценцией материала носителя (91) объекта и светофильтра (14) в полосе пропускания светофильтра (14). Конструкция устройства позволяет менять светофильтры (14) в ручном или автоматическом режиме. Свет, прошедший через светофильтр (14), собирается второй частью (12) оптической системы, в задней фокальной плоскости которой находится фоточувствительный слой матрицы светочувствительных элементов (21), например ПЗС-матрицы. Заметим, что размер поля зрения АВ связан с размером изображения А'В', формируемого на поверхности матрицы, соотношением AB=A'B'x(F1/F2), где F1 - фокусное расстояние первой части (11) оптической системы, a F2 - фокусное расстояние второй части (12) оптической системы. Параметры оптических систем выбираются таким образом, чтобы изображение А'В' полностью заполняло матрицу (21), входное отверстие PQ второй части (12) оптической системы равнялось выходному отверстию КМ первой, а числовые апертуры были максимально большими.
Светочувствительные элементы матрицы (21) преобразуют световой сигнал в электрический. Далее этот сигнал считывается, преобразуется линейным образом, оцифровывается и передается электронным устройством (82) в компьютер (83), на дисплее (81) которого формируется изображение рабочей области объекта.
Первая 11 и вторая 12 части оптической системы (10) представляют собой высококачественные оптические системы (объективы) с высоким светопропусканием, свободные в значительной степени от геометрических и хроматических аберраций. Хроматические аберрации в меньшей степени способны влиять на точность измерений, т.к. оптика работает в квазимонохроматическом свете, выделяемом светофильтром 14. Неточность фокусировки, возникающая при смене длин волн, не сказывается на работе, т.к. глубина резкости оптической системы достаточно велика (порядка 0,5-0,7 мм).
Среди прочих характеристик объективов можно выделить: разрешающую способность, коэффициент передачи контраста, коэффициент интегрального и спектрального пропускания света, коэффициент светорассеяния, падение освещенности по полю изображения.
Большинство известных оптических систем для формирования первой части оптической системы (11) используют короткофокусные объективы с небольшим рабочим отрезком. Это приводит к сокращению пространства между первой частью (11) оптической системы и поверхностью носителя (91) объекта исследования. Сокращение пространства создает проблемы с формированием освещения рабочей зоны. В известном патенте RU 2182328 [15] в одном из вариантов устройства держатели осветителей устанавливают непосредственно на объектив. Такое решение не позволяет включать между первой частью оптической системы и поверхностью носителя образца вспомогательные элементы, например конструкции держателей ячеек или нагреватели ячеек для регистрации процессов в режиме реального времени.
В предлагаемом устройстве в качестве первой части (11) оптической системы (10) использован объектив с большим фокусным расстоянием, что позволяет расширить размеры рабочей области. Размер рабочей области объекта можно варьировать в широких пределах (например, от 10 до 90 мм) в зависимости от выбранного соотношения F1/F2. В качестве первой части (11) оптической системы целесообразно использовать проекционный или фотографический пленочный объективы, серийно выпускаемые промышленностью. Важными параметрами являются фокусное расстояние, рабочий отрезок, линейное поле зрения, числовая апертура, входной и выходной люки. Например, фокусное расстояние F1 фото- и проекционных объективов может меняться от 50 до 110 мм, апертура от 0,17 до 0,26, поле зрения от 36×24 мм до 90×60 мм, рабочий отрезок от 45 до 95 мм.
Рабочий отрезок (расстояние от первой линзы до фокальной плоскости) объектива 11 должен быть достаточно большим, чтобы не препятствовать прохождению света от осветителей. Разрешение первой оптической системы должно быть не менее 20 линий на 1 мм.
В качестве второй оптической системы целесообразно выбирать объектив, специально рассчитанный на работу со светочувствительными матрицами, например ТВ-объектив или объектив цифровой камеры. Достаточно использовать объектив с фиксированным фокусным расстоянием (монофокальный) и с ручной установкой диафрагмы. ТВ-объективы целесообразно использовать с фокусным расстоянием F2 от 25 до 12 мм, рассчитанными на матрицу 2/3" или 1/2". ТВ-объективы необходимо выбирать с высоким разрешением («мегапиксельные»), предназначенные для машинного зрения (минимум геометрических аберраций).
Используемый объектив должен быть рассчитан на работу с матрицей определенного размера. Однако он может использоваться и с матрицами меньшего размера. Например, объектив, имеющий маркировку 2/3 "может также работать с матрицами 1/2", 1/3" и т.д. В настоящее время выпускается широкая номенклатура монохромных ПЗС и КМОП-матриц с типоразмерами от 1/6" до 1,8" и более. Наиболее употребительными являются размеры 1/3" (диагональ 6 мм), 1/2" (диагональ 8 мм) и 2/3" (диагональ 11 мм). Матрицы от 1" и более дороги, а матрицы 1/4" и менее имеют малый динамический диапазон и большие шумы.
Линейное увеличение, даваемое системой, равно Г=F2/F1. Поэтому фокусное расстояние ТВ-объектива выбирают исходя из размеров рабочей зоны объекта исследования, фокусного расстояния первого объектива и размеров матрицы. Важно, чтобы входной люк PQ второго объектива примерно равнялся выходному люку КМ первого объектива и светопропускающему диаметру интерфенционного светофильтра 14 (Все три примерно одинаковы).
Интерференционный светофильтр (32а, 32б) имеет полосу пропускания от 40 до 60 нм. Светофильтры 14 - от 30 до 50 нм. Очень важно, чтобы интеграл перекрывания спектров пропускания светофильтров был минимальным, т.к. от этого напрямую зависит соотношение сигнал-шум устройства. Фильтры, которые мы используем, имеют гарантированное ослабление света вне полосы пропускания, равное 106, а фактически 108 (данные производителя Semrock Inc., США). Эмпирически установлен критерий подбора пары фильтров 14-32 как отсутствие видимого свечения светоизлучающих диодов (СИД), оцениваемое визуально в темном помещении, при наложении светофильтра 14 на светофильтр 32 при включенном на максимальную мощность осветителе.
Используемые технические решения позволяют работать с ПЗС-матрицами без охлаждения.
Осветитель
Для того чтобы реализовать возможности сканирования больших поверхностей в простых оптических системах, необходимо добиваться максимальной равномерности освещенности объекта. Эта задача не является тривиальной. Существуют ограничения в использовании лазерных источников из-за резкой неравномерности плотности излучения по сечению лазерного пучка, а также ламп, формирующих широкий спектр светового потока, из-за необходимости введения в конструкцию элементов, которые увеличивают ее габариты и стоимость. Более предпочтительными в настоящее время являются осветители на основе матриц СИД, имеющих малую стоимость и габариты.
Известно применение СИД для создания флуоресцентных сканеров или микроскопа, ориентированного на сканирование биочипов [15, 24]. С помощью СИД возможно обеспечить освещение образца и возбуждение его флуоресценции для разных схем регистрации флуоресценции. Из-за малых размеров СИД их можно размещать рядом с об