Способы, композиции и изделия, способствующие лечению рака
Иллюстрации
Показать всеГруппа изобретений относится к области медицины и может быть использовано для лечения рака предстательной железы. Осуществляют введение агониста эндотелина В IRL1620 и химиотерапевтического агента. Причем химиотерапевтический агент выбирают из доксорубицина и 5-фторурацила (5-FU). Кроме того, используют изделие, содержащее композицию с активным ингредиентом, которым является агонист эндотелина В IRL1620, а также инструкцию по введению указанной композиции. Заявленная группа изобретений позволяет увеличить кровоснабжение опухоли предстательной железы. 2 н. и 11 з.п.ф-лы, 36 ил., 2 табл.
Реферат
Ссылки на родственные заявки
По настоящей заявке испрашивается приоритет заявки на патент США № 11/461961, поданной 2 августа 2006, которая является частичным продолжением заявки на патент США № 11/360236, поданной 22 февраля 2006 (по которой испрашивается приоритет по предварительным заявкам на патент США № 60/655656; 60/655654; и 60/655643, поданным 22 февраля 2005), которая является частичным продолжением заявки на патент США № 10/691915, поданной 23 октября 2003, по которой испрашивается приоритет по предварительной заявке на патент США № 60/420960, поданной 24 октября 2002. Содержание всех указанных заявок включено в данное описание полностью в качестве ссылки.
Область техники, к которой относится изобретение
Настоящее изобретение относится к способам, композициям и изделиям, способствующим лечению рака, включая солидные опухоли, путем введения агониста эндотелина и химиотерапевтического агента.
Уровень техники
Успешное лечение раковых заболеваний, включая солидные опухоли, остается невыполненной медицинской задачей, несмотря на все большее понимание молекулярной биологии опухолевых клеток и доступность увеличивающегося числа потенциальных терапевтических агентов. Например, уровень заболевания раком молочной железы существенно вырос за последние 10 лет, при этом рак молочной железы является в США одной из ведущих причин смертности среди женщин в возрасте 40-49 лет.
Одной из проблем в лечении раковых заболеваний является то, что эффективная доза, характерная для широкого спектра потенциальных химиотерапевтических агентов, ограничена неселективностью этих агентов, сильным токсическим воздействием на нормальные ткани. В результате этого многие пациенты страдают от побочных эффектов, возникающих при химиотерапии, без ощутимых улучшений от лечения. Например, химиотерапевтический агент паклитаксел ингибирует клеточную пролиферацию и индуцирует апоптоз опухолевых клеток. Однако клинической полезности паклитаксела препятствует дозо-ограничивающая токсичность, включая гиперчувствительность, нейтропению и периферийную невропатию. Таким образом, существует потребность в разработке более специфических и менее токсичных способов лечения рака.
Целевая (направленная) доставка химиотерапевтических агентов в опухоли могла бы иметь преимущество в увеличении пользы от химиотерапевтических агентов, минимизируя при этом их системное токсическое воздействие. Такая целевая доставка также могла бы снизить необходимые дозы химиотерапевтических агентов, тем самым потенциально уменьшая недопустимые отрицательные воздействия этих агентов. Один из возможных способов достижения целевой доставки химиотерапевтических агентов заключается в использовании отличительных особенностей сосудистой сети опухоли.
Опухоли, размер которых превышает несколько миллиметров, нуждаются в постоянном снабжении питательными веществами и поэтому развивают свою собственную сосудистую сеть и кровоток. Folkman, Cancer Res, 46:467 (1986). Без постоянной подпитки из этих развивающихся кровеносных сосудов опухоли оказываются в условиях гипоксии и впоследствии погибают. Развитие новой сосудистой сети из ранее существовавших кровеносных сосудов называется "ангиогенезом".
Во время ангиогенеза кровеносные сосуды опухоли развиваются существенно отличным образом от нормальной сосудистой сети и имеют другие свойства. Однослойные эпителиальные клетки представляют собой первые, быстро сформированные кровеносные сосуды опухоли. Такие вновь сформированные кровеносные сосуды опухоли лишены слоя гладкой мускулатуры или иннервации. Опухоли также включают зрелые кровеносные сосуды, которые обладают всеми авторегуляторными функциями. Mattsson et al., Tumor Blood Circulation, CRC Press, Boca Raton, стр. 129 (1979); Reinhold, Tumor Blood Circulation, CRC Press, Boca Raton, стр. 115 (1979); Warren, Tumor Blood Circulation, CRC Press, Boca Raton, стр. 26 (1979).
Сосудистый тонус (степень расширения или сужения кровеносных сосудов) управляется эндогенными факторами хозяина, включая H+, K+, Ca2+, pO2, pCO2 и окись азота (NO), а также другими регуляторными веществами, такими как эндотелин (ET-1). Secombe et al., Landes, Austin, стр. 40 (1994); Luscher et al, The endothelium: modulator of cardiovascular function, CRC Press, Boca Raton, стр. 61 (1990). ET-1 значительно влияет на регуляцию сосудистого тонуса (Yanagisawa et al., Nature, 332:411 (1988)), и ученые показали увеличение экспрессии ET1 и ETB рецепторов в солидных опухолях, включая карциному молочной железы. Alanen et al., Histopathology, 36:161 (2000); Nelson et al., Cancer Res, 56:663 (1996); Kar et al., Biochem Biophys Res Commun 216:514 (1995); Pagotto et al., J Clin Invest, 96:2017 (1995); Yamashita et al., Cancer Res, 52:4046 (1992); Yamashita et al., Res Commun Chem Pathol Pharmacol, 74:363 (1991). Более того, стимуляция рецепторов ETB приводит к увеличению кровоснабжения опухолей путем расширения кровеносных сосудов опухоли. Настоящее изобретение использует этот факт путем применения агонистов рецепторов ETB для селективного усиления кровотока в опухоли с целью увеличения целевой доставки химиотерапевтических агентов.
Сущность изобретения
Настоящее изобретение относится к введению агонистов эндотелина и химиотерапевтического агента с тем, чтобы способствовать лечению раковых заболеваний, включая солидные опухоли. В частности, опухоли имеют характерную сосудистую сеть, включающую увеличенное количество рецепторов ETB, которые при связывании вызывают расширение кровеносных сосудов. Поскольку рецепторы ETB представляют собой сосудорасширяющие средства, агонист рецепторов ETB в сочетании с химиотерапевтическим агентом является полезным при лечении солидной опухоли, такой как опухоль, обнаруженная при раке молочной железы. Агонист рецептора ETB может более эффективно доставлять химиотерапевтические агенты в опухоли, приводя к улучшенному лечению.
Более конкретно, один из вариантов осуществления по настоящему изобретению включает способ, способствующий лечению рака, включающий введение агониста ETB и химиотерапевтического агента. В различных вариантах осуществления способов по настоящему изобретению агонист ETB и химиотерапевтический агент могут вводиться по существу одновременно или могут вводиться последовательно (химиотерапевтический агент вводится до агониста ETB или агонист ETB вводится до химиотерапевтического агента). В некоторых вариантах осуществления по настоящему изобретению при по существу одновременном введении агониста ETB и химиотерапевтического агента их можно вводить в виде одной композиции.
Другой вариант осуществления по настоящему изобретению включает композицию, содержащую химиотерапевтический агент, агонист ETB и необязательный наполнитель. Другой вариант осуществления по настоящему изобретению включает изделие, содержащее композицию, которая содержит агонист ETB, и инструкцию по введению композиции с химиотерапевтическим агентом для лечения солидной опухоли. Изделия по настоящему изобретению дополнительно могут содержать один или несколько химиотерапевтических агентов. Если изделия по настоящему изобретению включают один или несколько химиотерапевтических агентов, то агонист ETB и химиотерапевтический агент могут быть частью одной и той же композиции, могут находиться в виде отдельных композиций, либо могут быть представлены и тем, и другим способом.
Раковые заболевания, которые лечат при помощи способов, композиций или изделий по настоящему изобретению, могут включать солидные опухоли, в том числе, без ограничения, опухоли яичников, опухоли толстой кишки, саркому Капоши, опухоли молочной железы, меланому, опухоли предстательной железы, менингиому, опухоли печени, листовидные опухоли молочной железы и их комбинации.
Агонисты эндотелина B, используемые согласно способам, композициям или изделиям по настоящему изобретению, могут селективно усиливать кровоснабжение солидных опухолей, таким образом, увеличивая доставку химиотерапевтических агентов в солидную опухоль. Агонисты эндотелина B, которые могут использоваться согласно настоящему изобретению, могут включать, без ограничения, один или несколько из: ЕТ-1, ЕТ-2, ЕТ-3, BQ3020, IRL1620 (N-suc-[Glu9,Ala11,15]ЕТ-1(8-21)), сарафотоксин 56c, [Ala1,3,11,15]ЕТ-1 и их комбинации. Химиотерапевтические агенты могут включать, без ограничения, одно или несколько из следующих веществ: адриамицин, камптотецин, карбоплатин, цисплатин, даунорубицин, доксорубицин, альфа-интерферон, бета-интерферон, гамма-интерферон, интерлейкин 2, иринотекан, доцетаксел, паклитаксел, топотекан, 5-фторурацил и их комбинации. Конкретные способы, композиции или изделия по настоящему изобретению включают IRL1620, в качестве агониста ETB, с химиотерапевтическим агентом, выбранным из группы, состоящей из: паклитаксела, доксорубицина, 5-фторурацила и их комбинации.
Краткое описание чертежей
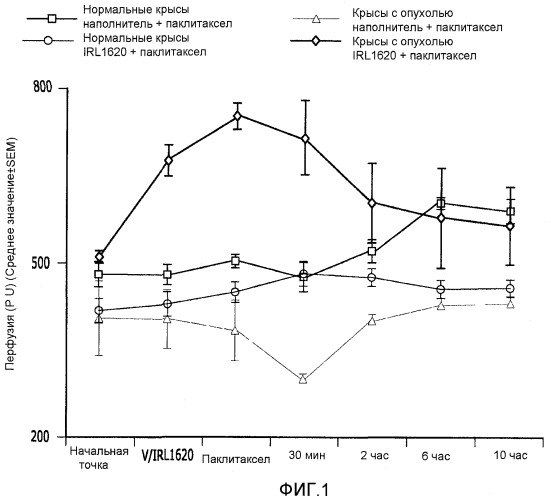
На фиг.1 показано влияние IRL1620 на паклитаксел-индуцированные изменения в перфузии опухоли;
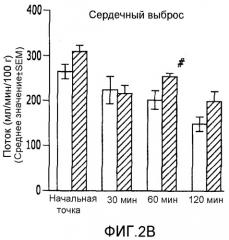
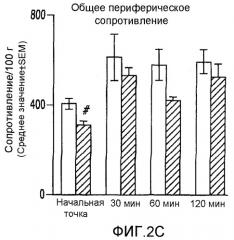
На фиг.2А-2Е показано влияние ET-1 на системную гемодинамику у не имеющих рака крыс и крыс с опухолью молочной железы;
На фиг.3А-3В показано влияние ET-1 на кровоток и региональное сосудистое сопротивление в ткани молочной железы у не имеющих рака крыс и крыс с опухолью молочной железы;
На фиг.4А-4С показано влияние ET-1 на перфузию, концентрацию подвижных клеток крови (CMBC) и скорость клеток крови в ткани молочной железы у не имеющих рака крыс и крыс с опухолью молочной железы;
На фиг.5А-5С показано влияние BQ788 на ET-1-индуцированные изменения в перфузии кровью, CMBC и скорость клеток крови в ткани молочной железы у не имеющих рака крыс и крыс с опухолью молочной железы;
На фиг.6 показано влияние наполнителя или IRL1620 на фармакокинетику паклитаксела в плазме при анализе у нормальных крыс и крыс с опухолью, как определено при помощи ВЭЖХ;
На фиг.7 и 8 показано влияние наполнителя или IRL1620 на фармакокинетику [3H]паклитаксела в плазме, как определено при помощи жидкостного сцинтилляционного счетчика;
На фиг.9А и 9В показано влияние IRL1620 на перфузию опухоли молочной железы, как измерено при помощи лазерной доплеровской флоуметрии;
На фиг.10 показано зависящее от времени влияние введения IRL1620 на концентрацию [3H]паклитаксела в опухоли и основных органах у крыс с опухолью молочной железы;
На фиг.11 показано выраженное в процентах изменение массы тела у крыс с опухолью молочной железы по сравнению с началом лечения;
На фиг.12 показано влияние введения IRL1620 на объем опухоли у крыс с опухолью молочной железы;
На фиг.13 показано влияние введения IRL1620 на прогрессирование, стазирование и регресс опухоли у крыс с опухолью молочной железы;
На фиг.14А и 14В показано влияние различных доз [физиологического раствора] или IRL1620 на перфузию опухоли предстательной железы, как измерено при помощи лазерной доплеровской флоуметрии (14A), и выраженное в процентах изменение в перфузии опухоли предстательной железы от начальной точки после введения IRL1620 (14B);
На фиг.15 показано влияние IRL1620 на концентрацию [14C]доксорубицина (DOX) в опухоли и других основных органах у крыс с опухолью предстательной железы;
На фиг.16 показана масса тела (16A); объем опухоли (16B); и вес опухоли (16C) у крыс с опухолью предстательной железы после введения IRL1620 и DOX;
На фиг.17 показана масса тела (17A); объем опухоли (17B); и вес опухоли (17C) у крыс с опухолью предстательной железы после введения IRL1620 и 5-фторурацила (5-FU);
На фиг.18А и 18В показано влияние IRL1620 на перфузию опухоли-меланомы, как измерено при помощи лазерной доплеровской флоуметрии (18A), и выраженное в процентах изменение в перфузии опухоли-меланомы от начальной точки после введения IRL1620 (18B);
На фиг.19 показано влияние IRL1620 на концентрацию [3H]паклитаксела в опухоли и других основных органах у крыс с опухолью-меланомой;
На фиг.20 показано влияние различных концентраций IRL 1620 при облучении и без облучения на объем опухоли в зависимости от времени. Для сравнения также показано влияние физиологического раствора и облучения и отсутствия лечения на объем опухоли.
Подробное описание
I. Определения
Инструкция: Как используется в настоящем описании, термин "инструкция" означает материал, сопровождающий фармацевтический продукт, который предоставляет описание того, каким образом вводить продукт, а также содержит данные по безопасному и эффективному применению, необходимые для того, чтобы врач, фармацевт и пациент могли принять обоснованное решение относительно использования этого продукта. Такая инструкция обычно называется "этикеткой" фармацевтического продукта. Инструкция может иметь разную форму, включая, без ограничения, бумажный вкладыш, CD-ROM или ссылку на вебсайт, содержащий относящуюся к фармацевтическому продукту информацию.
Пролекарство: Как используется в настоящем описании, термин "пролекарство" означает соединения, которые in vivo быстро преобразуются в применяемое в изобретении соединение, например, путем гидролиза. Подробное обсуждение пролекарств дано у Higuchi et al., Prodrugs as Novel Deliverz System, vol. 14, of the A.C.S.D. Szmposium Series, и у Roche (ed.), Bioreversible Carriers in Drug Design, American Pharmaceuticasl Association and Pergamon Press, 1987.
Лечить, лечение или способствующий лечению: Как используется в настоящем описании, термины "лечить", "лечение" и "способствующий лечению" означают профилактику, задержку прогрессирования или роста, сокращение или устранение рака, включая солидную опухоль. Также эти термины включают как медицинское терапевтическое, так и/или профилактическое введение, в зависимости от ситуации.
По существу одновременно: Как используется в настоящем описании, термин "по существу одновременно" означает, что два фармацевтических препарата (т.е., агонист ETB и химиотерапевтический агент) вводятся в одно и то же время. Согласно этому определению, "одно и то же время" следует понимать как точно одновременно, так и в течение примерно десяти минут.
Большинство химиотерапевтических агентов обладают цитостатическими свойствами, нацеленными на разрушение раковых клеток, но при этом причиняющими значимый ущерб физиологически нормальным системам тела. Следовательно, большое преимущество имела бы селективная доставка химиотерапевтических агентов в солидные опухоли, таким образом, помогая избежать таких отрицательных эффектов при лечении рака.
Ангиоархитектура кровеносных сосудов опухоли отличается от ангиоархитектуры нормальных кровеносных сосудов. Carmeliet & Jain, Nature, 407:249 (2000). Поэтому сосудистая реактивность опухолей отличается от сосудистой реактивности нормальной ткани. Например, введение доноров окиси азота, агонистов никотинамида и брадикинина модулирует кровоток в опухолях. Jordan et al., Int J Radiat Oncol Biol Phys, 48:565 (2000); Fukumura et al., Am J Pathol, 150:713 (1997); Hirst et al., Br J Radiol, 67: 795 (1994).
Эндотелин представляет собой вазоактивное вещество, которое модулирует кровоток и по сравнению с нормальной тканью молочной железы присутствует в больших концентрациях в тканях карциномы молочной железы (по существу, эндотелин может присутствовать в тканях карциномы молочной железы в количестве, равном примерно 12 пг/мг, по сравнению с количеством, равным примерно 0,12 пг/мг в нормальной ткани молочной железы). Kojima et al., Surg Oncol, 4 (6): 309 (1995); Kurbel et al., Med Hypothesis, 52 (4): 329 (1999); Patel et al., Mol Cell Endocrinol, 126 (2): 143 (1997); Yamashita et al., Cancer Res, 52 (14): 4046 (1992); Yamashita et al., Res Commun Chem Pathol Pharmacol, 74 (3): 363 (1991). Эндотелины представляют собой семейство циклических пептидов, имеющих 21 аминокислоту, содержащее у млекопитающих три изоформы ЕТ-1, ЕТ-2 и ЕТ-3. Inoue et al., Proc Natl Acad Sci США 86:2863 (1989); Yanagisawa et al., Nature, 332:411 (1988). Эндотелины оказывают воздействие, связываясь с двумя разными рецепторами клеточной поверхности ЕТА и ETB. Рецептор ETB связывает три изотипа пептида с одинаковой афинностью. Рецептор ЕТА, напротив, связывает ЕТ-1 с более высокой афинностью, чем другие изоформы. Оба рецептора принадлежат к системе G-белок-связанных рецепторов и опосредуют биологические ответы от множества стимулов, включая факторы роста, вазоактивные полипептиды, нейромедиаторы и гормоны. Masaki, J Cardiovasc Pharmacol, 35:S3 (2000); Gulati, Preface. Adv Drug Deliv Rev, 40:129 (2000); Gulati et al., Am J Physiol, 273:H827 (1997); Levin, N Engl J Med, 333:356 (1995). Нецепторы ETB, на которые направлено настоящее изобретение, находятся как на эндотелиальных клетках (EC), так и на сосудистых гладкомышечных клетках (VSMC), и по сравнению с нормальной тканью молочной железы их количество в ткани рака молочной железы увеличено (включая ткань инвазивной, а также дуктальной и лобулярной карциномы молочной железы у людей). Wulfing et al., Oncol Rep, 11:791 (2004); Wulfing et al., Clin Cancer Res, 9:4125 (2003); Alanen et al., Histopathology, 36 (2): 161 (2000). Эндотелин действует на рецепторы ETB, вызывая расширение сосудов и усиление кровотока в тканях опухоли молочной железы. ETB рецепторы, преобладающие на EC, вызывают расширение сосудов путем освобождения факторов, таких как простациклин и окись азота. de Nucci et al., Proc Natl Acad Sci USA, 85:9797 (1988). Поскольку ЕТ-1 усиливает кровоток в опухолях путем стимуляции рецепторов ETB, для селективного усиления кровоснабжения опухолей может использоваться агонист рецепторов ETB, таким образом, увеличивая целевую доставку и приводя к эффективности химиотерапевтических агентов.
Показано, что рецепторы ETB присутствуют, например, без ограничения, в раке яичников, миофибробластах, опухоли саркомы Капоши и внутриопухолевых сосудах, раке молочной железы и меланоме. Bagnato et al., Am J Pathol, 158:841 (2001); Alanen et al., Histopathology, 36 (2):161 (2000); Bagnato et al., Cancer Res, 59:720 (1999); Kikuchi et al., Biochem Biophys Res Comm, 219:734 (1996). Следовательно, введение агониста рецепторов ETB в комбинации с химиотерапевтическим агентом можно использовать с тем, чтобы способствовать лечению солидных опухолей, включая, без ограничения, рак предстательной железы, карциному толстой кишки, саркому Капоши, рак молочной железы и меланомы.
Агонисты ETB, используемые по настоящему изобретению, включают, без ограничения, ЕТ-1, ЕТ-2, ЕТ-3, BQ3020, IRL1620 (N-suc-[Glu9,Ala11,15]ЕТ-1(8-21)), сарафотоксин 56c, [Ala1,3,11,15]ЕТ-1 и их комбинации. [Ala1,3,11,15]ЕТ-1 представляет собой линейный аналог ЕТ-1, в котором дисульфидные мостики удалены заменой Ala на остатки Cys. Saeki et al., Biochem Biophys Res Commun, 179:286 (1991). BQ3020 и IRL1620 представляют собой усеченные линейные синтетические аналоги ЕТ-1 и являются наиболее широко используемыми селективными синтетическими агонистами. IRL1620 представляет собой линейный ЕТ-аналог, в основе структуры которого лежит карбокси-терминальный конец ЕТ-1, и обладает в 120000 раз более сильной селективностью к рецепторам ETB. Okada & Nishikibe, Cardiovasc Rev, 20:53 (2002); Дуглас et al., Br J Pharmacol, 114:1529 (1995). IRL1620 является в высокой степени селективным и сильнодействующим агонистом ETB, при этом отмечается, что он имеет более предпочтительную селективность к подтипу рецепторов ETB1, чем к подтипу ETB2. Brooks et al., J Cardiovasc Pharmacol, 26 Suppl 3:S322 (1995).
Химиотерапевтические агенты, используемые по настоящему изобретению, включают, например, без ограничения, алкилирующие агенты, антиметаболиты, гормоны и их антагонисты, радиоизотопы, антитела, а также натуральные продукты и их комбинации. Например, агонист ETB можно вводить с антибиотиками, такими как доксорубицин и другими аналогами антрациклина, азотными аналогами горчичного газа, такими как, без ограничения, циклофосфамид, аналогами пиримидина такими как, без ограничения, 5-фторурацил, цисплатин, гидроксимочевина и ее природные и синтетические производные и т.п. В качестве другого примера, в случае смешанных опухолей, таких как аденокарцинома молочной железы, где опухоли включают гонадотропин-зависимые и гонадотропин-независимые клетки, агонисты ETB можно вводить совместно, без ограничения, с леупролидом или гозерелином (синтетические пептидные аналоги LH-RH). Дополнительные неограничивающие примеры химиотерапевтических агентов, которые могут использоваться с настоящим изобретением, включают адриамицин, камптотецин, карбоплатин, цисплатин, даунорубицин, доксорубицин, интерферон (альфа, бета, и/или гамма), интерлейкин 2, иринотекан, доцетаксел, паклитаксел, топотекан и их терапевтически эффективные аналоги и производные.
В одном из вариантов осуществления настоящего изобретения для того, чтобы способствовать лечению солидной опухоли, агонист эндотелина используется совместно с химиотерапевтическим агентом. В этом способе агонист эндотелина, в особенности агонист ETB, увеличивает кровоток в опухоли, которая богата ETB рецепторами. Следовательно, агонист ETB обеспечивает более селективную мишень для химиотерапевтического агента и улучшает химиотерапевтический эффект этого агента.
Теоретически предполагается, хотя и не лежит в основе данного описания, что агонисты эндотелина стимулируют рецепторы ETB, расширяя кровеносные сосуды опухоли, увеличивая таким образом кровоток и суммарную доставку химиотерапевтических агентов в опухоль. Усиленная перфузия опухолей кровью, вызванная агонистами эндотелина, также улучшает оксигенацию (насыщение кислородом) ткани. Улучшенная оксигенация может усиливать терапевтическое действие химиотерапевтических агентов. Эндотелин также может обладать митогенными свойствами. Митогенное действие эндотелина может способствовать усилению действия химиотерапевтических агентов при их совместном введении. Митогенное действие агониста эндотелина может усиливать действие химиотерапевтических агентов, улучшая их проникновение в делящиеся клетки, таким образом, увеличивая их эффективность.
При лечении рака химиотерапия часто указывается в качестве вспомогательного средства при хирургическом лечении. Цель химиотерапии как вспомогательного средства заключается в уменьшении риска повторения и увеличении продолжительности жизни без болезни, когда первичная опухоль подавлена. Химиотерапия используется в качестве вспомогательного средства для лечения рака зачастую в тех случаях, когда болезнь находится на стадии метастазов. Следовательно, агонист ETB, в частности, полезен до хирургического вмешательства или после него при лечении солидной опухоли в комбинации с химиотерапией.
Модель опухоли молочной железы
Пример 1. Влияние IRL1620 и паклитаксела на перфузию опухоли молочной железы
Приведенные ниже исследования проводились с целью изучения влияния ЕТ-1 на системную гемодинамику и региональную схему у не имеющих рака крыс и крыс с опухолью молочной железы.
Одна из широко изучаемых моделей опухоли молочной железы представляет собой модель химически-индуцированного карциногенеза молочной железы у крыс. van Zwieten, The rat as animal model in breast cancer research. Martinus Nijhoff Publishers, Boston, стр. 206 (1984); Dao et al., J Natl Cancer Inst, 71:201 (1983); Russo et al., J Natl Cancer Inst, 61:1439 (1978); Huggins et al., Science, 137 (1962); Huggins et al., Proc Natl Acad Sci USA, 45:1294 (1959). Химически-индуцированный онкогенез молочной железы у крыс представляет собой модель, очень похожую на рак человека. Russo et al., Lab Invest, 62:244 (1990). В терминах структуры ткани молочная железа крысы сравнима с молочной железой женщины. Она сформирована эпителием, который покрывает трубочки и альвеолы, и стромой, соединительной тканью, поддерживающей этот орган. Эти две составляющие находятся в непрерывном взаимодействии во время эмбрионального развития и в период взрослой жизни. По этой причине в ниже описанных исследованиях в качестве модели была выбрана данная аутохтонная экспериментальная модель, поскольку она имеет наиболее сильное сходство с раком человека. Id.
Химически-индуцированный карциногенез молочной железы у крыс обычно получают путем введения 7,12-диметилбенз(a)антрацена (DMBA) или N-метилнитрозомочевины (MNU). Rogers et al., Chemically induced mammary gland tumor in rats: modulation by dietary fat. Alan R. Liss, Inc, New York 255 (1996). Опухоли, индуцированные DMBA или MNU, обладают различными морфологическими характеристиками. В частности, опухоли, индуцированные MNU, больше локализованы в молочной железе и менее вероятно подвержены метастазам. Macejova et al., Endocr Regul, 35:53 (2001). Поэтому MNU часто выбирают в качестве химического агента для специфической индукции опухолей молочной железы у крыс. Такие опухоли молочной железы могут быть доброкачественными с фиброаденомами и папилломами, или они могут быть злокачественными. van Zwieten, Martinus Nijhoff Publishers, Boston, стр. 206 (1984). Крысы имеют шесть пар молочных желез, одна пара находится в цервикальной области, две расположены в грудной области, одна - в брюшной области, и две - в паховой области. Id.; Astwood et al., Am J Anat, 61 (1937). У девственных крыс, обработанных MNU, в грудной области развивается большее количество опухолей, чем в брюшной. Russo et al., Lab Invest, 57:112 (1987).
Использовали самок крыс Sprague Dawley (Harlan Co., Madison, Wis.) весом 180-200 граммов (г). Все животные содержались по три в клетке в условиях контролируемой комнатной температуры (23±1°C), влажности (50±10%) и искусственного освещения (0600-1800 часов). Животным давали пищу и воду ad libitum. Эксперименты проводили после прохождения животными акклиматизации к окружающей среде в течение, по меньшей мере, четырех дней.
N-метилнитрозомочевина (MNU) была приобретена в компании Ash Stevens Inc. (Detroit, Michigan). IRL1620 и эндотелин-1 (ЕТ-1) были приобретены в компании American Peptide Company Inc. (Sunnyvale, Calif). ЕТ-1 растворяли в 0,1% альбумине.
MNU (50 мг/кг) или физиологический раствор (1 мл/кг) вводили самкам крыс Sprague Dawley внутрибрюшинно (i.p.). После достижения опухолями размера в диаметре примерно 2-4 см проводили эксперименты по изучению кровотока.
Во время экспериментов по изучению кровотока крыс анестезировали уретаном (1,5 г/кг, внутрибрюшинно). (Sigma Chemicals, St.Louis, Mo.), и в левую бедренную вену вводили канюлю (трубку PE 50, Clay Adams, Parsipanny, N.J) для введения лекарственного вещества.
Животные были поделены на следующие группы:
Группа I: нормальные крысы, обработанные физиологическим раствором + паклитаксел (таксол; 3 мг/кг; через 15 минут после введения физиологического раствора) (N=4);
Группа II: нормальные крысы, обработанные IRL1620 (3 нмоль/кг) + паклитаксел (3 мг/кг; через 15 минут после введения IRL1620) (N=4);
Группа III: крысы с опухолью, обработанные физиологическим раствором + паклитаксел (3 мг/кг; через 15 минут после введения физиологического раствора) (N=4); и
Группа IV: крысы с опухолью, обработанные IRL1620 (3 нмоль/кг) + паклитаксел (3 мг/кг; через 15 минут после введения IRL1620) (N=4).
Перфузию молочной железы крыс кровью измеряли при помощи лазерной доплеровской флоуметрии. См. Song et al., Int J Radiat Oncol Biol Phys, 18:903 (1990); Song et al., Int J Radiat Oncol Biol Phys, 17:1041 (1989). В этой процедуре животным выбривали участок вокруг сосков и вырезали кожу, окружающую молочные железы. Оптоволоконный зонд стандартной модели прикрепляли к артерии молочной железы и соединяли с лазерным доплеровским флоуметром Periflux PF2b 4000 (Perimed KB, Stockholm, Sweden). Постоянную времени устанавливали на 1,5 секунды, а полосу пропускания устанавливали на 4 КГц. Данные анализировали при помощи дисперсионного анализа (ANOVA) с последующим выполнением теста Дункана. Значимым считался уровень p<0,05.
В кровотоке в ткани молочной железы нормальных крыс не наблюдалось никаких изменений после введения физиологического раствора или IRL1620 и паклитаксела. Значительное отличие от начальной точки наблюдалось в кровотоке в ткани опухоли после инъекции IRL1620 (36,3%, p<0,05) и после введения паклитаксела с последующим введением IRL1620 (51,9%, p<0,05) (см. фиг.1). Таким образом, этот эксперимент показал, что IRL1620 может обеспечивать важный адъювант для лечения рака, включающего введение химиотерапевтических агентов.
Пример 2. Влияние инфузии ET-1 на системную гемодинамику и кровоток в ткани молочной железы у нормальных крыс и крыс с опухолью
Обработку MNU и физиологическим раствором проводили в виде внутрибрюшинных инъекций за три месяца до проведения исследования. Крыс регулярно пальпировали, начиная с четвертой недели после обработки. Эксперименты проводили после того, как опухоли достигали в диаметре примерно 4-8 мм.
Крыс анестезировали уретаном (1,5 г/кг, внутрибрюшинно). (Sigma Chemicals, St.Louis, Mo.). Все оперируемые области выбривали и протирали смоченным спиртом тампоном. В левую бедренную вену вводили канюлю (трубку PE 50, Clay Adams, Parsipanny, N.J) для введения лекарственного вещества. В левую бедренную артерию вводили канюлю (трубку PE 50) и использовали для взятия контрольного образца крови при помощи отсасывателя (модель 22, Harvard Apparatus, South Natick, Mass.) при изучении микросфер. В правую бедренную артерию вводили канюлю (трубку PE 50) и соединяли с датчиком давления Gould P23 ID для записи кровяного давления на полиграфе Grass P7D (Grass Instrument Co., Quincy, Mass., USA) через предусилитель 7PI. Частоту сердечных сокращений (HR) регистрировали при помощи тахографа 7P4B Grass (Grass Instrument Co., Quincy, Mass.), запускаемого сигналами кровяного давления. Обнажали правую сонную артерию и в левый желудочек выводили трубку PE 50 через общую сонную артерию. Наличие канюли в левом желудочке подтверждали регистрацией давления на тахографе Grass, используя датчик давления Statham P23 DC (Grass Instrument Co., Quincy, Mass.). При достижении канюлей левого желудочка диастолическое давление падало до нуля. Для того чтобы поддерживать pO2, pCO2, и pH фактор крови на постоянном уровне и избежать влияния респирации на кровяное давление и HR, животных держали на искусственном дыхании с постоянной скоростью путем введения эндотрахеальной трубки, соединенной с вентилятором для грызунов (Модель 683, Harvard Apparatus Inc., South Natick, Mass.).
На начальной стадии исследования крысы были поделены на две группы, каждая из которых была обработана следующим образом:
Группа I: 30-минутная инфузия ЕТ-1 (50 нг/кг/мин) крысам, обработанным физиологическим раствором (нормальные крысы) (N=6); и
Группа II: 30-минутная инфузия ЕТ-1 (50 нг/кг/мин) крысам, обработанным MNU (50 мг/кг, внутрибрюшинно; крысы с опухолью) (N=6).
Параметры системной гемодинамики и региональной циркуляции определяли в начальной точке, через 30, 60, и 120 минут после начала инфузии ЕТ-1 (50 нг/кг/мин). Поскольку инфузию ЕТ-1 проводили в течение 30 минут, 30-минутные данные показывают влияние ЕТ-1, а 60- и 120-минутные данные указывают на продолжительность влияния ЕТ-1.
Системную гемодинамику и региональное кровообращение определяли, используя процедуру, описанную в литературе. См. Gulati et al., J Lab Clin Med, 126:559 (1995); Gulati et al., Life Sci., 55:827 (1994); Sharma et al., Artif Cells Blood Substit Immobil Biotechnol, 22:593 (1994). При каждом измерении тщательно перемешанную суспензию, содержащую в 0,2 мл физиологического раствора примерно 100000 микросфер (с диаметром 15±1 мкм), меченных 46Sc (скандием), 113Sn (оловом), 141Ce (церием) или 95Nb (ниобием) (New England Nuclear Corporation, Boston, Mass., USA), вводили в левый желудочек и в течение 15 секунд промывали струей 0,3 мл физиологического раствора. Для вычисления кровотока артериальную кровь отбирали со скоростью 0,5 мл/мин через правую бедренную артерию. Кровь отбирали в течение 90 сек, начиная примерно за 5-10 сек до инъекции микросфер.
Перфузию молочной железы крыс кровью измеряли при помощи лазерной доплеровской флоуметрии. См. Song et al., Int J Radiat Oncol Biol Phys, 18:903 (1990); Song et al., Int J Radiat Oncol Biol Phys, 17:1041 (1989). У животных выбривали участки вокруг сосков. Вырезали кожу, окружающую молочные железы в виде куска примерно 6 см в ширину и примерно 4 см в длину. К поверхности этого куска прикладывали оптоволоконный зонд стандартной модели и прикрепляли к ткани при помощи двусторонней клейкой ленты. Кусок помещали на металлический держатель и закрепляли лентой с тем, чтобы предотвратить его перемещение, затем соединяли с лазерным доплеровским флоуметром Periflux PF2b 4000 (Perimed KB, Stockholm, Sweden). Постоянную времени устанавливали на 1,5 сек, а полосу пропускания устанавливали на 4 КГц. Данные анализировали при помощи дисперсионного анализа с последующим применением теста Дункана. Значимым считался уровень p<0,05.
В конце эксперимента животных умерщвляли передозировкой пентобарбитала натрия. Все ткани и органы вырезали, взвешивали и помещали в пробирки. Радиоактивность в стандартах, образцах крови и образцах ткани подсчитывали в гамма-счетчике 5000 серии Packard Minaxi Auto-Gamma (Packard Instruments Co., Downers Grove, III.) с заданными окнами, соответствующими энергиям изотопов. Вычисляли следующие параметры: (1) сердечный выброс (CO) ((инъецированная радиоактивность × скорость забора артериальной крови)/радиоактивность артериальной крови в образце), (2) систолический объем (SV) (CO/HR), (3) общее периферическое сопротивление (TPR) (среднее артериальное давление (MAP)/CO), (4) региональный кровоток ((радиоактивность в ткани × скорость отбора артериальной крови)/радиоактивность артериальной крови в образце), и (5) региональное сосудистое сопротивление (MAP/региональный кровоток). Данные вычисляли, используя компьютерные программы, описанные в литературе. Saxena et al., Comput Programs Biomed, 12:63 (1980).
У нормальных (обработанных физиологическим раствором) крыс системные гемодинамические параметры в начальной точке были следующими: MAP:111,1±4,8 мм рт.ст.; CO:268,6±17,6 мл/мин; SV:0,87±0,06 мл; TPR:419,6±24,37 мм рт.ст.мин/мл; и HR:312,5±20,2 уд./мин. У нормальных крыс через 30 мин после инфузии ЕТ-1 наблюдали значительное увеличение MAP (14,5%; p<0,05), которое снизилось через 120 минут (17,8%; p<0,05). TPR увеличилось через 120 минут (49,2%; p<0,05). CO снижался через 60 и 120 минут после инфузии Ет-1 (22,9% и 42,5%, соответственно; p<0,05). SV снижался через 60 и 120 минут (20,9% и 36%, соответственно; p<0,05). Для HR не наблюдалось никаких значимых изменений (фиг.2A-2E).
Системные гемодинамические параметры в начальной точке у крыс с опухолью (обработанных MNU) были аналогичны параметрам нормальных крыс. У крыс с опухолью наблюдалось значительное увеличение MAP через 30 минут (19,1%; p<0,05) и через 60 минут (15,3%; p<0,05) после инфузии ЕТ-1. TPR увеличился через 30 минут (73,9%; p<0,05), 60 минут (39,7%; p<0,05) и 120 минут (71,4%; p<0,05) после введения ЕТ-1. CO снижался через 30, 60 и 120 минут (29,4%, 16,7% и 36,1%, соответственно; p<0,05). SV значительно уменьшался через 30, 60 и 120 минут (31,1%, 17,9% и 32,1% соответственно; p<0,05). Для HR не наблюдалось никаких изменений (фиг.2A-2E).
После введения ЕТ-1 у нормальных крыс, обработанных физиологическим раствором, не наблюдалось никаких существенных изменений в кровотоке ткани молочной железы или изменений в сосудистом сопротивлении. У крыс с опухолью (обработанных MNU) наблюдали значимые изменения в кровотоке и региональном сосудистом сопротивлении в ткани молочной железы по сравнению с нормальными (обработанными физиологическим раствором) крысами. Значительное увеличение (153%; p<0,05) кровотока в ткани молочной железы у крыс с опухолью наблюдали через 60 минут после введения ЕТ-1 по сравнению с нормальными крысами. Сосудистое сопротивление у крыс с опухолью значительно отличалось в начальной точке (102%; p<0,05) и через 60 минут (147%; p<0,05) после введения ЕТ-1 по сравнению с нормальными крысами (фиг.3A-3B).
На фиг.4A-4C показаны изменения в перфузии, концентрации подвижных клеток крови (CMBC) и скорости эритроцитов (RBC) в ткани молочной железы у крыс с опухолью и у нормальных крыс. Перфузия ткани молочной железы нормальных крыс кровью после введения ЕТ-1 значительно не изменилась. Перфузия ткани молочной железы крыс с опухолью значительно увеличилась через 30 мин после введения ЕТ-1 (176%; p<0,05) по сравнению с нормальными крысами. У крыс с опухолью такое увеличение перфузии вернулось к начальной точке через 60 и 120 минут после введения ЕТ-1.
CMBC у крыс с опухолью значительно увеличилась (54%; p<0,05) через 60 мин после введения ЕТ-1 по сравнению с нормальными крысами. CMBC вернулась к начальной точке через 120 минут после введения ЕТ-1. Скорость RBC значительно увеличилась (252%; p<0,05) через 30 минут после введения ЕТ-1 по сравнению с нормальными крысами. У крыс с опухолью скорость RBC вернулась к начальной точке через два часа (120 мин) после введения ЕТ-1 (фиг.4A-4C).
Влияние рецепторов ETB на изменения, индуцированные инфузией ЕТ-1, в системной гемодинамике и кровотоке ткани молочной железы у нормальных крыс и крыс с опухолью оценивали при помощи другого эксперимента. BQ788 (т.е., N-цис-2,6-диметилпиперидинокарбонил-L-гамма-метиллейцил-D-1-метоксикарбонилтриптофанил-D-Nle) представляет собой специфический антагонист рецепторов ETB, который ингибирует связывание рецепторов ETB со значением IC50, равным 1,2 нм. Поэтому BQ788 использовался для определения роли ETB рецепторов в ЕТ-1-индуцированной вазодиляции в опухоли молочной железы. В этом эксперименте исследование проводилось при помощи способов, описанных в предыдущем исследовании за исключением того, что животные были разделены на следующие группы:
Группа I: 20-минутная инфузия BQ788 (American Peptide Company Inc (Sunnyvale, Calif), растворенного в физиологическом растворе с концентрацией 0,5 пмоль/кг, с последующей 30-минутной инфузией ЕТ-1 (50 нг/кг/мин) нормальным крысам, обработанным физиологическ