Способ получения нанодисперсных оксидов металлов
Иллюстрации
Показать всеИзобретение может быть использовано в производстве тугоплавких керамических матриц композиционных материалов и высокотемпературных покрытий. Раствор β-дикетонатов одного или более металлов концентрацией 1·10-3÷1 моль/л в органическом растворителе или смеси растворителей в присутствии спирта подвергают термической обработке при температуре 95÷250°С в течение 0,1÷8 часов с получением растворов алкоксо-β-дикетонатов соответствующих металлов. Затем проводят гидролиз при температуре 15÷95°С в течение 0,05÷240 часов гидролизующими растворами, представляющими собой либо воду, либо органический растворитель, или смесь растворителей, содержащих воду, либо смесь органических растворителей и воды с образованием прозрачных гелей. Далее осуществляют сушку гелей при температуре 15÷250°С при давлении 1·10-4÷1 атм до прекращения изменения массы. Термическую обработку ксерогелей с образованием нанокристаллических оксидов металлов проводят в кислородсодержащей атмосфере при температуре 350÷750°С в течение 0,5÷24 часов. Изобретение позволяет получать оксиды металлов в высокодисперсном состоянии с узким распределением частиц по размеру со средним размером частиц от 2 до 50 нм золь-гель методом. 2 ил., 1 табл.
Реферат
Изобретение относится к области синтеза оксидов металлов, в том числе сложного состава, в нанодисперсном состоянии и может быть использовано в процессах синтеза тугоплавких керамических матриц композиционных материалов и высокотемпературных покрытий, в химической промышленности, для создания авиационной и ракетной техники, получения активных катализаторов для гетерогенного катализа, материалов химической сенсорики, для синтеза сверхпроводящих и магнитных материалов, керамических пигментов, стекол, лазерных, оптических материалов. Использование предлагаемого способа позволяет синтезировать оксиды металлов как простого, так и сложного составов, в высокодисперсном состоянии с узким распределением частиц по размеру со средним размером частиц от 2 до 50 нм.
Известен синтез нанодисперсных частиц оксидов титана, циркония, гафния, церия и оксидных систем сложного состава путем получения алкоксоацетилацетоната металла при добавлении ацетилацетона в алкоксид металла, в который добавлялся суфрактант - водный раствор гидрохлорида лауриламина [Sorapong Pavasupree, Yoshikazu Suzuki, Sommai Pivsa-Art, Susumu Yoshikawa, Synthesis and Characterization of Nanoporous, Nanorods, Nanowires Metal Oxides, Science and Technology of Advanced Materials, 2005, 6, 224-229]. После смешения смесь перемешивали при комнатной температуре в течение 1 ч, затем 24 ч при 40°С и выдерживали неделю при 80°С. Затем состав сушили при 80°С 24 ч и прокаливали при 400°С в течение 4 ч. Полученные оксидные системы имели размер кристаллитов от 5 до 15 нм и достаточно развитую поверхность. В описанном методе используются алкоксиды металлов, которые при хранении могут подвергаться гидролизу и изменять свой состав и являются довольно токсичными. Кроме того, применение данного метода невозможно для получения оксидных матриц в объеме композиционного материала, т.к. при смешении компонентов образуется гетерогенная система, а пропитка ею пористой основы материала не позволяет получить гомогенное распределение оксидных частиц по объему композита.
Известен способ получения сверхпроводящих тонких пленок с использованием также алкоксидов и/или ацетилацетонатов [JP 1126208], которые смешиваются в необходимом соотношении, растворяются в органическом растворителе, а затем наносятся на подложки и нагреваются при нормальном или пониженном давлении для удаления растворителя с образованием тонких пленок ацетилацетонатных или алкоксидных комплексов, которые впоследствии окисляются кислородом воздуха при температуре 400°С и отжигаются с получением тонких оксидных пленок. Данный способ предполагает нагрев пленок комплексных частиц, которые известны своей склонностью к переходу в газовую фазу, особенно при пониженном давлении, что может привести к изменению состава пленки.
Наиболее близким по своей технической сути является способ получения оксидных систем, заключающийся в том, что синтез тонких оксидных сверхпроводящих пленок с получением оксидной системы заданного состава проводят смешением в необходимом соотношении алкоксидов, ацетилацетонатов или октилатов одного или более металлов, далее их растворяют в органическом растворителе с последующим гидролизом водой в присутствии стабилизирующих добавок гликоля и ПВА и образованием золя [JP 1219004] (прототип), после этого смесь наносят на подложку с образованием геля, затем гель сушат и подвергают термической обработке при температуре 780÷1000°С в атмосфере кислорода. Полученные пленки оксидов металлов обладали высокой дисперсностью.
Основным недостатком прототипа является то, что в данном способе синтез оксидных смешанных систем на основе полученных ксерогелей проводится при достаточно высоких температурах, что приводит к относительному укрупнению и загрязнению частиц оксидов металлов.
Вторым недостатком является то, что способ по прототипу не позволяет устанавливать заданную гидролитическую активность полученных составов и соответственно времени гелеобразования, что важно для осуществления образования частиц определенной дисперсности, а также получения оксидов металлов в объеме композиционного материала.
Также к недостаткам способа по прототипу относится то, что предлагается использование индивидуальных алкоксидов металлов, которые в процессе хранения могут подвергаться гидролизу с изменением концентрации металлов, что приводит к смещению стехиометрического состава получаемых смешанных оксидов.
Из прототипа неясно, каким образом гомолигандные ацетилацетонаты металлов подвергаются гидролизу водой.
Еще одним недостатком прототипа является то, что в результате грубого гидролиза водой для получения дисперсных систем применяются дополнительные стабилизирующие добавки.
Изобретение направлено на изыскание эффективного способа получения нанодисперсных оксидов металлов при относительно низких температурах с использованием золь-гель техники без применения дополнительных стабилизирующих добавок, который позволяет варьировать гидролитическую активность составов и соответственно времени гелеобразования, что важно для образования оксидных частиц как простого, так и сложного состава, определенной дисперсности и требуемого стехиометрического состава.
Технический результат достигается тем, что предложен способ получения нанодисперсных оксидов металлов, заключающийся в том, что раствор β-дикетонатов одного или более металлов концентрацией 1·10-3÷1 моль/л в органическом растворителе или смеси растворителей в присутствии спирта, как источника алкоксо-групп, подвергают термической обработке при температуре 95÷250°С в течение 0.1÷8 часов с получением растворов алкоксо-β-дикетонатов соответствующих металлов, затем проводят гидролиз при температуре 15÷95°С в течение 0.05÷240 часов гидролизующими растворами, представляющими собой либо воду, либо органический растворитель, или смесь растворителей, содержащих воду, либо смесь органических растворителей и воды с образованием прозрачных гелей, далее осуществляют сушку гелей при температуре 15÷250°С при давлении 1·10-4÷1 атм до прекращения изменения массы, при этом термическую обработку ксерогелей с образованием нанокристаллических оксидов металлов проводят в кислородсодержащей атмосфере при температуре 350÷750°С в течение 0.5÷24 часов.
В случае оксидных систем сложного состава мольные соотношения атомов металлов соответствуют мольным соотношениям в исходных растворах β-дикетонатов.
Среди β-дикетонатов металлов выбирают гомо- и смешанно-лигандные соединения из следующего ряда; ацетилацетонаты, пропионилацетонаты, изобутирилацетонаты, дипропионилацетонаты, диизобутирилметанаты, дипивалоилметанаты, гексафторацетилацетонаты, трифторацетилацетонаты, трифторацетилпропионилметанаты, трифторацетилизобутирилметанаты, трифторацетилметилбутилметанаты, трифторацетилпивалоилметанаты.
Выбор реагентов, их концентраций, растворителей и соотношений обусловлен необходимостью обеспечения образования гомогенных систем, в которых проходят реакции гидролиза и поликонденсации, приводящие к образованию прозрачных гелей, где атомы металлов распределены равномерно, что позволяет синтезировать при относительно низких температурах максимально дисперсные оксидные системы, в том числе оксидные системы сложного состава.
Использование концентраций β-дикетонатов металлов менее 1·10-3 моль/л препятствует гелеобразованию, а более 1 моль/л ограничивает растворимость.
В качестве спиртов, как источников алкоксогрупп, используют моно- и полиатомные разветвленные и неразветвленные спирты с углеводородной цепочкой от C1 до C12.
В качестве органических растворителей, в которых растворяют и подвергают термической обработке β-дикетонаты металлов с образованием гидролитически активных растворов алкоксо-β-дикетонатов металлов, могут быть использованы моно- и полиатомные спирты, алифатические и ароматические углеводороды, галогенпроизводные, эфиры, альдегиды, кетоны, органические кислоты и прочие, обладающие температурами кипения в интервале 95÷250°С.
Термическую обработку растворов β-дикетонатов металлов с образованием гидролитически активных растворов алкоксо-β-дикетонатов металлов требуется проводить с обратным холодильником.
Термическая обработка растворов при температуре ниже 95°С не приводит к образованию смешанных алкоксо-β-дикетонатов металлов, а выше 250°С происходит интенсивное разложение органических фрагментов.
Время термической обработки вышеупомянутых растворов менее 0.1 часа также не дает возможность заметного протекания реакции, особенно при низких значениях температур, а более 8 часов приводит к образованию гомолигандных излишне влагочувствительных, а значит и склонных к неконтролируемому гидролизу, алкоксидов металлов.
Проведение стадии гидролиза при температуре менее 15°С происходит очень медленно, а при температуре более 95°С наблюдается удаление воды из системы, а также неравномерное по объему гелеобразование.
Время гидролиза обусловлено химией и физико-химией гелеобраэования.
Использование при сушке гелей температуры менее 15°С сильно замедляет процесс, а при температуре более 250°С возможен выброс смеси из реакционного сосуда и неравномерное высушивание гелей.
Давление, применяемое при сушке гелей, более 1 атм затрудняет отгонку растворителей и продуктов гидролиза, а менее 1·10-4 атм также может привести в выбросу смеси из реакционного сосуда.
Применение при синтезе оксидов металлов температуры менее 350°С приводит к загрязнению оксидов металлов остаточным углеродом от органических фрагментов и не дает возможность кристаллизации соединений. Использование температуры выше 750°С нецелесообразно с точки зрения возможного укрупнения частиц продуктов и их загрязнения технологическими примесями.
Время прокаливания менее 0.5 часа, особенно при низких температурах, также может быть недостаточным для выжигания избыточного углерода и кристаллизации фаз, а более 24 часов нецелесообразно, как и при использовании повышенных температур.
Заданная гидролитическая активность получаемых растворов алкоксо-β-дикетонатов металлов может быть достигнута путем изменения типа OR-групп, растворителей, температуры и времени термической обработки. Контроль времени гидролиза позволяет управлять морфологией и пористостью получаемых оксидных систем.
Выбранные температурно-временные режимы сушки и термообработки обеспечивают оптимальные условия для протекания процессов синтеза оксидов одного или более металлов, в результате чего образуются оксидные системы, состав которых задается соотношением β-дикетонатов металлов.
Изобретение проиллюстрировано Фиг.1 и 2, на которых приведены микрофотографии, выполненные на просвечивающем электронном микроскопе JEM-100CX с ускоряющим напряжением 100 кВ. Дифракционная картина доказывает образование кристаллической структуры, а данные просвечивающей электронной микроскопии подтверждают получение наночастиц.
Фиг.1. Микрофотография нанодисперсного порошка состава 0.6ZrO2-0.25HfO2-0.15Y2O3, синтезированного при 450°С (пример 2).
Фиг.2. Микрофотография нанодисперсного порошка иттрийалюминиевого граната, синтезированного при 400°С (пример 4).
Ниже приведены примеры осуществления способа получения нанодисперсных оксидов металлов. Примеры иллюстрируют, но не ограничивают предложенный способ.
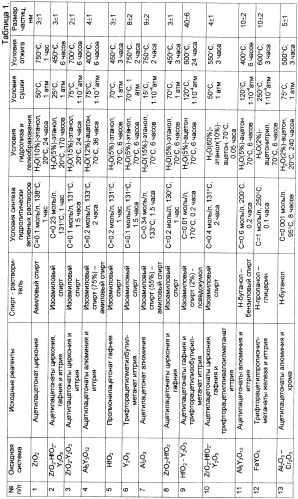
Все примеры осуществления изобретения и данные по полученным размерам частиц оксидных систем сведены в Таблицу 1 «Примеры осуществления изобретения и данные по дисперсности полученных оксидных систем».
Пример 1. В 30 мл амилового спирта растворяли 1.46 г ацетилацетоната циркония и подвергали термической обработке при температуре 138±5°С в течение 1 ч. Полученный раствор гидролизовали водно-спиртовым раствором, содержащим 10%об. воды, гелеобразование наблюдалось после 24 ч. Гель сушили при температуре 50±5°С при атмосферном давлении до прекращения потери массы, ксерогель прокаливали на воздухе при температуре 750°С в течение 1 ч. Согласно проведенному рентгенофазовому анализу образовался моноклинный диоксид циркония со средним размером кристаллитов 3±1 нм.
Пример 2. В 311 мл изоамилового спирта растворяли 18.22 г ацетилацетоната циркония, 8.96 г ацетилацетоната гафния и 7.21 г ацетилацетоната иттрия и подвергали термической обработке при температуре 131±5°С в течение 1 ч. Полученный раствор гидролизовали водой, содержащейся в этаноле (ректификате), гелеобразование наблюдали после 170 ч. Гель сушили при температуре 25±5°С при атмосферном давлении до прекращения потери массы, ксерогель прокаливали на воздухе при температуре 450°С в течение 6 ч. Элементный масс-спектральный анализ полученного оксида подтвердил, что соотношение атомов металлов в нем соответствует таковому в растворе исходных ацетилацетонатов. Согласно проведенному рентгенофазовому анализу образовался однофазный порошок с кубической сингонией с параметрами а=5,156(7) Å, V=137,1(3)Ǻ и средним размером кристаллитов 3±1 нм. По данным просвечивающей электронной микроскопии с микродифракцией (Фиг.1) средний размер частиц составил 3±1 нм.
Пример 3. В 25 мл изоамилового спирта растворяли 0.81 г ацетилацетоната циркония, 0.32 г ацетилацетоната иттрия и подвергали термической обработке при температуре 131±5°С в течение 1.5 ч. Полученный раствор гидролизовали водно-спиртовым раствором, содержащим 15%об. воды, гелеобразование наблюдали после 24 ч. Гель сушили при температуре 75±5°С при давлении 1·10-1 атм до прекращения потери массы, ксерогель прокаливали на воздухе при температуре 700°С в течение 6 ч. Элементный масс-спектральный анализ полученного оксида подтвердил, что соотношение атомов металлов в нем соответствует таковому в растворе исходных ацетилацетонатов. Согласно проведенному рентгенофазовому анализу образовался однофазный порошок с кубической сингонией, параметрами а=5,173(3) Å, V=138,43(14) Å3 и средним размером кристаллитов 2±1 нм.
Пример 4. В 33.7 мл смеси изоамилового спирта (75%) и амилового спирта растворяли 1.439 г ацетилацетоната алюминия и 0.974 г ацетилацетоната иттрия и подвергали термической обработке при температуре 133±5°С в течение 2 ч. Полученный раствор гидролизовали водно-ацетоновым раствором, содержащим 12%об. воды, при 70±5°С, гелеобразование наблюдали после 36 ч. Гель сушили при температуре 75±5°С при давлении 1·10-1 атм до прекращения потери массы, ксерогель прокаливали на воздухе при температуре 400°С в течение 6 часов. Элементный масс-спектральный анализ полученного оксида подтвердил, что соотношение атомов металлов в нем соответствует таковому в растворе исходных ацетилацетонатов. Согласно проведенному рентгенофазовому анализу образовался однофазный порошок иттрийалюминиевого граната с кубической сингонией, параметрами а=12,0227(22) Å, V=1737,8(6) Å3 и средним размером кристаллитов 3±1 нм. По данным просвечивающей электронной микроскопии (Фиг.2) средний размер частиц составляет 4±1 нм.
Примеры 5-24 осуществляются по методикам, аналогичным Примерам 1-4.
Таким образом, заявленный способ обладает следующими преимуществами:
- позволяет варьировать гидролитическую активность полученных алкоксо-β-дикетонатных растворов и соответственно времени гелеобразования, что важно для осуществления образования частиц оксидов металлов определенной дисперсности и требуемого стехиометрического состава;
- дает возможность получать оксидные материалы, в том числе, сложного состава, при относительно низких температурах, что позволяет синтезировать их в нанодисперсном состоянии без образования технологических примесей;
- образующиеся наночастицы сохраняют соотношение атомов металлов, заданное при загрузке исходных β-дикетонатов металлов;
- наночастицы оксидов металлов имеют узкое распределение частиц по размерам, средний размер которых может быть изменен при варьировании параметров процесса;
- используемые стабильные исходные реагенты - β-дикетонаты металлов - не изменяют своего состава при длительном хранении, а также могут быть дополнительно очищены путем перекристаллизации или сублимации, следствием чего является повышенная чистота образующихся нанокристаллических материалов;
- не требует введения дополнительных стабилизирующих добавок для формирования транспарентных гелей;
- может быть использован для получения равномерных тонких пленок методом золь-гель;
- может быть использован для получения оксидов металлов как простого, так и сложного состава, повышенной чистоты.
Получение нанокристаллических оксидов металлов, характеризующихся как простым, так и сложным составами, с узким распределением частиц по размеру со средним размером от 2 до 50 нм может быть использовано в процессах синтеза тугоплавких керамических матриц композиционных материалов и высокотемпературных покрытий в химической промышленности, для создания авиационной и ракетной техники, получения активных катализаторов для гетерогенного катализа, материалов химической сенсорики, для синтеза сверхпроводящих и магнитных материалов, керамических пигментов, стекол, лазерных, оптических материалов.
Способ получения нанодисперсных оксидов металлов, заключающийся в том, что раствор β-дикетонатов одного или более металлов концентрацией 1·10-3÷1 моль/л в органическом растворителе или смеси растворителей в присутствии спирта, как источника алкоксо-групп, подвергают термической обработке при температуре 95÷250°С в течение 0,1÷8 ч с получением растворов алкоксо-β-дикетонатов соответствующих металлов, затем проводят гидролиз при температуре 15÷95°С в течение 0,05÷240 ч гидролизующими растворами, представляющими собой либо воду, либо органический растворитель, или смесь растворителей, содержащих воду, либо смесь органических растворителей и воды с образованием прозрачных гелей, далее осуществляют сушку гелей при температуре 15÷250°С при давлении 1·10-4÷1 атм до прекращения изменения массы, при этом термическую обработку ксерогелей с образованием нанокристаллических оксидов металлов проводят в кислородсодержащей атмосфере при температуре 350÷750°С в течение 0,5÷24 ч.