Фармацевтические соединения
Иллюстрации
Показать всеИзобретение относится к применению 3,11b-цис-дигидротетрабеназина или его фармацевтически приемлемых солей для получения лекарственного средства для профилактики или лечения шизофрении. Изобретение также относится к соединениям для применения для профилактики или лечения психоза, к способам профилактики или лечения психоза, а также к способам предотвращения или облегчения психотического эпизода. Технический результат - применение 3,11b-цис-дигидротетрабеназина для получения лекарственного средства для профилактики или лечения шизофрении. 12 н. и 22 з.п. ф-лы, 11 табл., 4 ил.
Реферат
Данное изобретение относится к применению дигидротетрабеназина для профилактики или лечения психоза.
Предпосылки изобретения
Психоз является общим психиатрическим термином для психических состояний, при которых компоненты рационального мышления и восприятия существенно нарушены. Люди, страдающие от психоза, могут подвергаться галлюцинациям, иметь параноидальные или бредовые идеи, проявлять изменения личности и обнаруживать дезорганизованное мышление. Это обычно сопровождается отсутствием адекватной самооценки необычной или аномальной природы их поведения, трудностями социального взаимодействия и нарушениями в осуществлении элементарных действий по самообслуживанию. По существу при психотическом эпизоде утрачивается контакт с реальностью.
Психоз часто рассматривают как симптом серьезного психического заболевания. Хотя он не связан исключительно с определенным психологическим или физическим состоянием, он, в частности, сопутствует шизофрении, биполярному расстройству (маниакальной депрессии) и тяжелой клинической депрессии. Существуют также некоторые физические обстоятельства, которые могут вызвать психотическое состояние, включая электролитный дисбаланс, инфекции мочевыводящих путей у пожилых, болевые синдромы, лекарственную токсичность и отмену лекарственного средства (в особенности алкоголя, барбитуратов и, иногда, бензодиазепинов), а также инфекции или повреждение головного мозга (данные психозы в настоящее время обычно называют психическими расстройствами органического происхождения).
Психоз может являться следствием или сопутствовать повреждению мозга, а также возникать после приема лекарственных средств, особенно после передозировки лекарственных средств, при их длительном применении и во время отмены лекарственных средств.
Известно, что хронический психологический стресс также вызывает психотические состояния, хотя точные механизмы, лежащие в основе этого, неясны. Кратковременный психоз, вызванный стрессом, известен как кратковременный реактивный психоз.
Существенную окраску психотическим эпизодам придает настроение. Например, люди, переживающие психотический эпизод в контексте депрессии, могут подвергаться бредовым состояниям преследования или самообвинения или галлюцинациям, в то время как люди, переживающие психотический эпизод в контексте мании, могут вырабатывать грандиозные бредовые идеи или испытывать глубокую религиозную значительность.
Галлюцинации определяют как чувственное восприятие в отсутствие внешних стимулов. Психотические галлюцинации могут иметь место в любом из пяти чувств и принимать почти любую форму, которая может включать простые ощущения (такие как световые сигналы, цвета, вкусовые ощущения, запахи) и более осмысленные впечатления, такие как способность видеть и взаимодействовать с полностью сформированными образами животных и людей, способность слышать голоса и сложные осязательные ощущения.
Слуховые галлюцинации, в частности способность слышать голоса, являются обычными и часто наиболее заметными особенностями психоза. Голоса в галлюцинации могут говорить о человеке или с ним самим, говорящих может быть несколько, каждый со своей индивидуальностью. Слуховые галлюцинации имеют тенденцию причинять особые страдания, когда они являются унижающими, властными или поглощающими все внимание.
Психоз может включать бредовые или параноидальные идеи. Психотические бредовые идеи можно классифицировать по типам на первичные и вторичные. Первичные бредовые идеи определяют как возникающие ни с того ни с сего и не понятные в контексте нормальных психических процессов, тогда как вторичные бредовые идеи можно истолковать как возникшие под влиянием прошлого опыта или существующей ситуации.
Нарушение мышления характеризуют как глубинное нарушение сознательного мышления и классифицируют главным образом по его влиянию на устную и письменную речь. Страдающие им люди могут демонстрировать речевой напор (говорить постоянно и быстро), нарушение планов или вихрь идей (переходить с одной темы на другую, не заканчивая фразу или невпопад), разрыв мыслей, разговор в рифму или каламбурами.
Важной и плохо понимаемой особенностью психоза обычно является отсутствие адекватной самооценки необычной, странной или аномальной природы восприятия или поведения человека. Даже в случае острого психоза больные могут казаться совершенно не понимающими, что их яркие галлюцинации и невозможные бредовые идеи в любом случае являются нереалистичными. Однако адекватная самооценка может варьировать у различных индивидов и на протяжении психотического эпизода. В некоторых случаях, в частности при слуховых или зрительных галлюцинациях, пациент обладает вполне адекватной самооценкой, и это делает психотическое переживание еще более ужасающим, поскольку пациент осознает, что он или она не должны слышать голоса, однако слышат их.
Существует целый ряд возможных причин для психоза. Психоз может являться результатом исходной психической болезни, такой как биполярное расстройство (также известное как маниакальная депрессия) и шизофрения. Психоз может также возникать или усугубляться в результате сильного психического стресса, а также вследствие приема высоких доз или длительного употребления лекарственных средств, таких как амфетамины, ЛСД, PCP, кокаин или скополамин. Внезапное прекращение приема лекарственных средств, являющихся депрессантами для ЦНС, таких как алкоголь или бензодиазепины, может также служить причиной психотических эпизодов. Как видно из обширного списка болезней и состояний, при которых, как сообщают, возникает психоз (включая, например, СПИД, проказа, малярия и даже свинка), не существует единственной причины психотического эпизода.
Шизофренией называют группу психотических заболеваний, обычно характеризующихся уходом от реальности, нелогической системой мышления, бредом и галлюцинациями, и сопровождающихся, в различной степени, другими эмоциональными, поведенческими или интеллектуальными нарушениями. Шизофрения связана с дисбалансом дофамина в головном мозге и нарушениями в лобной доле, и возникает в результате генетических и других биологических факторов, а также психологических факторов.
Лекарственные средства, традиционно применяемые для лечения психозов, таких, которые связаны с шизофренией, (так называемые «типичные» нейролептические препараты) эффективно контролируют галлюцинации, бред и спутанность сознания, связанные с данными состояниями. Подобные лекарственные средства, примеры которых включают галоперидол, хлорпромазин и флуфеназин, широко применяют с середины 1950-х. Данные лекарственные средства действуют, главным образом, блокируя дофаминовые рецепторы, и являются эффективными в лечении «позитивных» симптомов психоза.
Четыре основных области головного мозга являются первичными проводящими путями для дофамина. Они включают нигростриарную, мезокортикальную, мезолимбическую и тубероинфундибулярную системы. Снижение активности дофамина в мезокортикальном нервном пути (что наблюдают у пациентов с шизофренией) приводит к неспособности вызывать возбуждение префронтальных зон головного мозга. Позитивные симптомы, такие как галлюцинации и бредовые идеи, могут возникать, когда в мезолимбическом нервном пути имеет место повышенная активность дофамина. В головном мозге существует пять подклассов дофаминовых рецепторов. Общепринятые нейролептические препараты оказывают наибольшее воздействие на рецептор D2. Так называемые «нетипичные» нейролептические средства (см. ниже) обычно обладают более слабым эффектом на рецепторы D2 и более сильно блокируют рецептор D4, который в основном встречается в лобной коре и гиппокампе.
Общепринятые («типичные») нейролептические препараты блокируют рецепторы D2 не избирательно во всех четырех областях мозга. Полученный эффект в мезолимбическом нервном пути уменьшает галлюцинации и бред. Однако сопутствующее снижение дофамина в нигростриарном нервном пути может вызывать экстрапирамидальные симптомы. Блокада дофамина может также ухудшать негативные симптомы и познавательный процесс посредством дальнейшего уменьшения количества дофамина в лобной коре. Тубероинфундибулярный нервный путь подвергается воздействию всех общепринятых нейролептических препаратов, что может вызывать нейроэндокринную и гипоталамическую дисфункцию. Дофаминовая блокада в тубероинфундибулярном нервном пути является причиной возрастания уровней пролактина.
Таким образом, применение «типичных» нейролептических препаратов связано с целым рядом нежелательных побочных эффектов.
«Нетипичные» нейролептические препараты нацелены на лимбическую область более специфично, когда блокируют дофаминовые рецепторы D2. Вследствие этого они оказывают меньшее воздействие на нигростриарный и мезокортикальный нервные пути, в результате чего снижается возможность побочных эффектов. Как отмечено ранее, они также имеют тенденцию проявлять большую аффинность к дофаминовым рецепторам D4.
Обзор профилей связывания с рецепторами «нетипичных» нейролептических лекарственных средств представлен в статье A.E. Hensiek & M.R. Trimble, J. Neurology, Neurosurgery and Psychiatry, (2002), 72:281-285.
Современные «нетипичные» нейролептические препараты - часто называемые антагонистами серотонина-дофамина (SDAs)- блокируют рецепторы как серотонина так и дофамина, тем самым излечивая как «позитивные» так и «негативные» симптомы шизофрении - см. H.Y. Meltzer, J. Clin. Psychopharmacol. (1995), Feb; 15 (1 Suppl 1):2S-3S и M. Huttunen,.J. Clin. Psychopharmacol. (1995), Feb; 15 (1 Suppl 1):4S-10S. Данные современные лекарственные средства являются эффективными в лечении более широкого набора симптомов психоза и шизофрении и обладают меньшими побочными эффектами по сравнению с традиционными нейролептическими препаратами. Например, они имеют меньшую тенденцию вызывать экстрапирамидальные побочные эффекты и увеличение уровня пролактина, по сравнению с типичными нейролептическими препаратами.
Примеры данных современных «нетипичных» нейролептических препаратов («антагонистов серотонина-дофамина») включают клопазин, рисперидон, асенапин, оланзапин и илоперидон.
Тетрабеназин (химическое название: 1,3,4,6,7,11b-гексагидро-9,10-диметокси-3-(2-метилпропил)-2Н-бензо(а)хинолизин-2-один) применяли в качестве фармацевтического лекарственного средства с конца 1950-х. Первоначально разработанный как нейролептический препарат, тетрабеназин в настоящее время применяют для симптоматического лечения гиперкинетических нарушений движения, таких как болезнь Хантингтона, гемибаллизм, сенильная хорея, тик, поздняя дискинезия и синдром Туретта, смотри, например, Jankovic et al., Am. J. Psychiatry. (1999) Aug; 156(8):1279-81 и Jankovic et al., Neurology (1997) Feb; 48(2):358-62.
Химическая структура тетрабеназина представлена ниже на Фиг.1.
Фиг.1 - Структура тетрабеназина
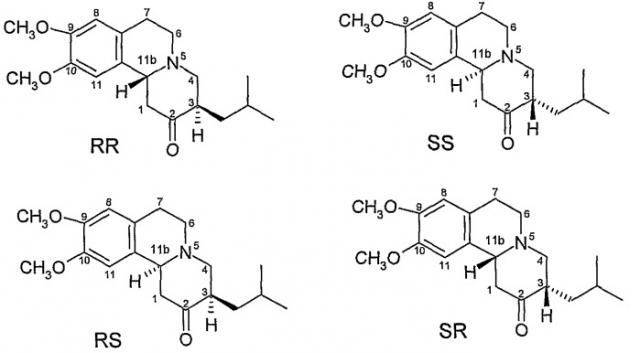
Соединение обладает хиральными центрами на 3 и 11b атомах углерода и таким образом может, теоретически, существовать, в общей сложности, в четырех изомерных формах, как показано на Фиг.2.
Фиг.2 - Возможные изомеры тетрабеназина
На Фиг.2 стереохимию каждого изомера определяли, используя номенклатуру «R и S», разработанную Cahn, Ingold and Prelog, смотри Advanced Organic Chemistry, Jerry March, 4е издание, John Wiley & Sons, New York, 1992, страницы 109-114. На Фиг.2 и в других местах данной патентной заявки обозначения «R» или «S» приводят в порядке номеров позиций атомов углерода. Так, например, RS представляет собой сокращенное написание для 3R,11bS. Аналогично, когда присутствуют три хиральных центра, как в дигидротетрабеназине, описанном ниже, обозначения «R» или «S» перечисляют в порядке атомов углерода 2,3 и 11b. Так, изомер 2S,3R,11bR в краткой форме обозначают SRR и так далее.
Коммерчески доступный тетрабеназин представляет собой рацемическую смесь RR и SS изомеров и очевидно, что RR и SS изомеры (далее индивидуально или коллективно называемые транс-тетрабеназином, поскольку атомы водорода на позициях 3 и 11b имеют взаимную трансориентацию) являются наиболее термодинамически стабильными изомерами.
Тетрабеназин обладает до некоторой степени слабой и переменной биодоступностью. Он в высокой степени метаболизируется в пресистемном метаболизме, и в моче обычно обнаруживают мало или не обнаруживают вовсе неизмененного тетрабеназина. Основным метаболитом является дигидротетрабеназин (химическое название: 2-гидрокси-3-(2-метилпропил)-1,3,4,6,7,11b-гексагидро-9,10-диметоксибензо(а)хинолизин), который образуется посредством восстановления 2-кетогруппы в тетрабеназине, и, как считают, в первую очередь отвечает за активность лекарственного средства (см. Mehvar et al., Drug Metab. Disp, 15, 250-255 (1987) и J. Pharm. Sci., 76, No. 6, 461-465 (1987).
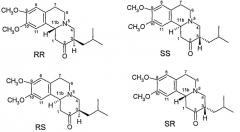
Ранее были идентифицированы и охарактеризованы четыре изомера дигидротетрабеназина, все полученные из более стабильных RR и SS изомеров исходного тетрабеназина и обладающие взаимной транс ориентацией между атомами водорода на позициях 3 и 11b (см. Kilbourn et al., Chirality, 9: 59-62 (1997) и Brossi et al., Helv. Chim. Acta., vol. XLI, No. 193, pp. 1793-1806 (1958). Четыре изомера представляют собой (+)-α-дигидротетрабеназин, (-)-α-дигидротетрабеназин, (+)-β-дигидротетрабеназин и (-)-β-дигидротетрабеназин. Считают, что структуры четырех известных изомеров дигидротетрабеназина являются такими, как представлены на Фиг.3.
Фиг.3 - Структура известных изомеров дигидротетрабеназина
Kilbourn et al.,(см. Eur. J. Pharmacol., 278:249-252 (1995) и Med. Chem. Res., 5:113-126 (1994)) исседовали специфическое связывание отдельных радиоактивно-меченых изомеров дигидротетрабеназина в мозге бодрствующей крысы. Они обнаружили, что изомер (+)-α-[11C]дигидротетрабеназин (2R,3R,llbR) скапливается в участках мозга, связанных с высокими концентрациями переносчика дофамина нейрональных мембран (DAT) и везикулярным переносчиком моноаминов (VMAT2). Однако по существу неактивный изомер (-)-α-[11C]дигидротетрабеназин был почти равномерно распределен в мозге, из чего можно предположить, что специфическое связывание с DAT и VMAT2 отсутствовало. Исследования in vivo коррелировали с исследованиями in vitro, которые свидетельствовали о том, что изомер (+)-α-[11C]дигидротетрабеназин обладает Ki для [3H]метокситетрабеназина >2000 раз большей, чем Ki для изомера (-)-α- [11C]дигидротетрабеназина.
В нашей предшествующей международной патентной заявке номер PCT/GB2005/000464 описано получение и применение фармацевтических изомеров дигидротетрабеназина, полученных из нестабильных RS и SR изомеров (далее индивидуально или коллективно называемые цис-тетрабеназином, поскольку атомы водорода на позициях 3 и 11b имеют взаимную цис-ориентацию) тетрабеназина.
Сущность изобретения
В настоящее время установлено, что цис-дигидротетрабеназины, описанные в нашей предшествующей заявке номер PCT/GB2005/000464, обладают профилями рецепторного связывания приблизительно такими же, как профили рецепторного связывания нетипичных нейролептических средств. В частности, цис-дигидротетрабеназины обладают как дофаминергическим, так и серотинергическим ингибиторным действием. Профили рецепторного связывания цис-дигидротетрабеназинов указывают на то, что их можно применять для профилактики и лечения психоза, например, психоза, возникающего вследствие, или связанного с шизофренией.
Соответственно, в первом аспекте данное изобретение относится к применению 3,11b-цис-дигидротетрабеназина для профилактики и лечения психоза.
В другом аспекте изобретение относится к применению 3,11b-цис-дигидротетрабеназина для предотвращения или облегчения психоза.
В другом аспекте изобретение относится к применению 3,11b-цис-дигидротетрабеназина для предотвращения, облегчения или снятия одного или больше симптомов шизофрении.
Изобретение также относится к:
- использованию 3,11b-цис-дигидротетрабеназина для получения лекарственного средства для профилактики или лечения психоза;
- способу профилактики или лечения психоза, включающему введение млекопитающему терапевтически эффективного количества цис-дигидротетрабеназина;
- использованию 3,11b-цис-дигидротетрабеназина для получения лекарственного средства для предотвращения или облегчения психотического эпизода;
- способу предотвращения или облегчения психотического эпизода, включающему введение млекопитающему терапевтически эффективного количества цис-дигидротетрабеназина;
- способу или использованию как определено выше, где психоз или психотический эпизод возникает вследствие, или связан с шизофренией;
- использованию 3,11b-цис-дигидротетрабеназина для получения лекарственного средства для профилактики или лечения шизофрении;
- способу профилактики или лечения шизофрении, включающему введение млекопитающему терапевтически эффективного количества цис-дигидротетрабеназина;
- использованию 3,11b-цис-дигидротетрабеназина для получения лекарственного средства для предотвращения, облегчения или снятия одного или больше симптомов шизофрении;
- способу предотвращения, облегчения или снятия одного или больше симптомов шизофрении, включающему введение млекопитающему терапевтически эффективного количества цис-дигидротетрабеназина.
Психотические эпизоды, психозы или симптомы предотвращенные, облегченные или снятые по данному изобретению могут являться любым одним или большим количеством симптомов, выбранных из следующих:
- бредовые состояния;
- галлюцинации;
- зрительные галлюцинации;
- слуховые галлюцинации;
- галлюцинации с участием осязательных ощущений, вкусовых ощущений или запахов;
- спутанность сознания;
- эмоциональные, поведенческие или интеллектуальные нарушения;
- уход от реальности;
- нелогические и/или дезорганизованные системы мышления;
- параноидальные или бредовые идеи;
- паранойя;
- бред сверхзначительности;
- бред преследования или самообвинения; и
- изменения личности.
Психотические эпизоды, психозы или симптомы предотвращенные, облегченные или снятые по данному изобретению могут являться любым одним или большим количеством, выбранным из тех, что возникают вследствие или связаны с:
- психозом, вызванным или связанным с шизофренией;
- психозом, вызванным или связанным с биполярным расстройством (маниакальной депрессией);
- психозом, вызванным или связанным с тяжелой клинической депрессией;
- психозом, вызванным нарушениями или состояниями, такими как:
- электролитный дисбаланс;
- инфекции мочевыводящих путей у пожилых;
- болевые синдромы;
- лекарственная токсичность;
- отмена лекарственного средства; и
- инфекции или повреждение головного мозга;
- психозом, вызванным хроническим психологическим стрессом (кратковременным реактивным психозом);
- психозом, вызванным или усиленным тяжелым психическим стрессом; и
- психозом, спровоцированным или возникающим вследствие, или сопутствующим болезням и состояниям, таким как СПИД, проказа, малярия и свинка.
В одном варианте осуществления симптомы или психозы возникают вследствие, или сопутствуют шизофрении, и могут являться любым одним или большим количеством симптомов, выбранных из следующих:
- бредовые состояния;
- галлюцинации;
- спутанность сознания;
- эмоциональные, поведенческие или интеллектуальные нарушения;
- уход от реальности; и
- нелогические системы мышления.
цис-Дигидротетрабеназин, применяемый по настоящему изобретению, представляет собой 3,11b,цис-дигидротетрабеназин.
3,11b-цис-Дигидротетрабеназин, применяемый по изобретению, может находиться в значительно гомогенной форме, например, при изомерной гомогенности большей, чем 90%, обычно большей, чем 95% и более предпочтительно большей, чем 98%.
Термин «изомерная гомогенность» в контексте настоящего документа обозначает присутствующее количество 3,11b-цис-дигидротетрабеназина относительно общего количества или концентрации дигидротетрабеназина во всех изомерных формах. Например, если 90% всего дигидротетрабеназина, присутствующего в композиции, представляет собой 3,11b-цис-дигидротетрабеназин, то изомерная гомогенность составляет 90%.
11b-цис-Дигидротетрабеназин, применяемый по изобретению, может находиться в форме композиции, которая в значительной степени свободна от 3,11b-транс-дигидротетрабеназина, предпочтительно содержащей меньше, чем 5% 3,11b-транс-дигидротетрабеназина, более предпочтительно меньше, чем 3% 3,11b-транс-дигидротетрабеназина, и наиболее предпочтительно меньше, чем 1% 3,11b-транс-дигидротетрабеназина.
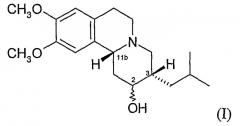
Термин «3,11b-цис-», как используют здесь, означает, что атомы водорода на позициях 3 и 11b в структуре дигидротетрабеназина имеют взаимную цис-ориентацию. Следовательно, изомеры по изобретению представляют собой соединения формулы (I) и их антиподы (зеркальные образы).
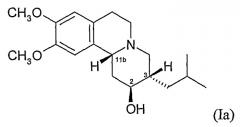
Существуют четыре возможных изомера дигидротетрабеназина, обладающих 3,11b-цис-конфигурацией, и они представляют собой 2S,3S,11bR изомер, 2R,3R,11bS изомер, 2R,3S,11bR изомер и 2S,3R,11bS изомер. Четыре изомера были выделены и охарактеризованы и, в другом аспекте, изобретение относится к применению отдельных изомеров 3,11b-цис-дигидротетрабеназина. В частности, изобретение относится к:
(a) 2S,3S,11bR изомеру 3,11b-цис-дигидротетрабеназина, обладающему формулой (Ia):
(b) 2R,3R,11bS изомеру 3,11b-цис-дигидротетрабеназина, обладающему формулой (Ib):
(c) 2R,3S,11bR изомеру 3,11b-цис-дигидротетрабеназина, обладающему формулой (Ic):
и
(d) 2S,3R,11bS изомеру 3,11b-цис-дигидротетрабеназина, обладающему формулой (Id):
Отдельные изомеры по изобретению можно характеризовать по их спектроскопическим, оптическим и хроматографическим свойствам, а также по их абсолютным стереохимическим конфигурациям, определяемым рентгеноструктурной кристаллографией.
Безотносительно какой-либо определенной абсолютной конфигурации или стереохимии, четыре новых изомера можно охарактеризовать следующим образом:
Изомер A
Оптическая активность, измеренная ORD (ДОВ) (метанол, 21°C): левовращающий
(-) ИК-спектр (твердый KBr), 1H-ЯМР спектр (CDCl3) и 13C-ЯМР спектр (CDCl3), в основном, как представлено в таблице 1.
Изомер B
Оптическая активность, измеренная ДОВ (метанол, 21°C): правовращающий(+) ИК-спектр (твердый KBr), 1H-ЯМР спектр(CDCl3) и 13C-ЯМР спектр (CDCl3), в основном, как представлено в таблице 1, и параметры рентгеноструктурной кристаллографии, как описано в примере 4.
Изомер C
Оптическая активность, измеренная ДОВ (метанол, 21°C): правовращающий (+) ИК-спектр (твердый KBr), 1H-ЯМР спектр(CDCl3) и 13C-ЯМР спектр (CDCl3), в основном, как представлено в таблице 2.
Изомер D
Оптическая активность, измеренная ДОВ (метанол, 21°C): левовращающий (-) ИК-спектр (твердый KBr), 1H-ЯМР спектр(CDCl3) и 13C-ЯМР спектр (CDCl3), в основном, как представлено в таблице 2.
Величины ДОВ для каждого изомера приведены ниже в примерах, однако следует отметить, что подобные значения приведены лишь в качестве примеров и могут варьировать в зависимости от степени гомогенности изомера и от влияния других переменных, таких как температурные флуктуации и воздействие остаточных молекул растворителя.
Каждый из энантиомеров A, B, C и D может присутствовать в основном в энантиометрически гомогенной форме или в виде смесей с другими эантиомерами по изобретению.
Термины «энантиометрическая гомогенность» и «энантиометрически гомогенный» в контексте настоящего документа обозначают присутствующее количество данного энантиомера 3,11b-транс-дигидротетрабеназина относительно общего количества или концентрации дигидротетрабеназина во всех энантиомерных или изомерных формах. Например, если 90% всего дигидротетрабеназина, имеющегося в композиции, находится в форме единственного энантиомера, то энантиомерная гомогенность составляет 90%.
В качестве примера по каждому аспекту и варианту осуществления данного изобретения каждый отдельный энантиомер, выбранный из изомеров A, B, C и D, может присутствовать при энантиомерной гомогенности по меньшей мере 55% (например, по меньшей мере 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95%, 97%, 98%, 99%, 99,5% или 100%).
Изомеры по данному изобретению могут также присутствовать в форме смесей одного или больше изомеров A, B, C и D. Подобные смеси могут быть рацемическими или не рацемическими смесями. Примеры рацемических смесей включают рацемическую смесь изомера A и изомера B, а также рацемическую смесь изомера С и изомера D.
Фармацевтически приемлемые соли
Если по контексту не требуется иного, то ссылка в данной заявке на дигидротетрабеназин и его изомеры охватывает не только свободное основание дигидротетрабеназина, но его соли и, в частности, кислотно-аддитивные соли.
Конкретные кислоты, из которых получают кислотно-аддитивные соли, включают кислоты, обладающие величиной pKa меньшей, чем 3,5 и чаще всего меньшей, чем 3. Например, кислотно-аддитивные соли можно получать из кислоты, обладающей pKa в диапазоне от +3,5 до -3,5.
Предпочтительные кислотно-аддитивные соли включают те, которые образованы с сульфокислотами, такими как метансульфокислота, этилсульфокислота, бензолсульфокислота, толуолсульфокислота, камфарсульфокислота и нафталинсульфокислота.
Конкретной кислотой, из которой можно получать кислотно-аддитивные соли, является метансульфокислота.
Кислотно-аддитивные соли можно получать способами, описанными здесь, или общепринятыми химическими способами, такими как способы, описанные в Pharmaceutical Salts: Properties, Selection, and Use, P. Heinrich Stahl (Editor), Camille G. Wermuth (Editor), ISBN: 3-90639-026-8, Hardcover, 388 страниц, август 2002. Как правило, подобные соли можно получать, проводя реакцию между соединением в форме свободного основания и соответствующим основанием или кислотой в воде или в органическом растворителе, или в смеси из них; обычно используют неводные среды, такие как эфир, этилацетат, этанол, изопропанол или ацетонитрил.
Соли обычно представляют собой фармацевтически приемлемые соли. Однако соли, которые не являются фармацевтически приемлемыми, можно также получать в качестве промежуточных форм, которые в дальнейшем можно переводить в фармацевтически приемлемые соли. Подобные фармацевтически неприемлемые солевые формы также являются частью данного изобретения.
Способы получения изомеров дигидротетрабеназина
Дигидротетрабеназин по изобретению можно получать способом, включающим реакцию соединения формулы (II):
с реактивом или реактивами, применимыми для гидратирования 2,3-двойной связи в соединении формулы (II), а затем, при необходимости, разделение и выделение нужной изомерной формы дигидротетрабеназина.
Гидратацию 2,3-двойной связи можно проводить посредством гидроборирования с применением реактива борана, такого как диборан или боранзамещенный простой эфир (например, боранзамещенный тетрагидрофуран (ТГФ) (THF) для получения промежуточного аддукта алкилборана с последующим окислением аддукта алкилборана и гидролизом в присутствии основания. Гидроборирования обычно проводят в сухом полярном непротонном растворителе, таком как эфир (например, ТГФ), обычно при не повышенной температуре, например комнатной температуре. Аддукт бораналкен обычно окисляют окислителем, таким как перекись водорода в присутствии основания, обеспечивающего источник гидроксильных ионов, такого как гидроокись аммония или гидроокись щелочного металла, например гидроокись калия или гидроокись натрия. В результате последовательности реакций гидроборирование-окисление-гидролиз способа A обычно получают изомеры дигидротетрабеназина, в которых атомы водорода на позициях 2 и 3 обладают взаимной трансориентацией.
Соединения формулы (II) можно получать восстановлением тетрабеназина для получения дигидротетрабеназина с последующей дегидратацией дигидротетрабеназина. Восстановление тетрабеназина можно проводить с использованием реактива алюмогидрида, такого как алюмогидрид лития, или реактива борогидрида, такого как борогидрид натрия, борогидрид калия, или производного борогидрида, например алкилборогидрида, такого, как три-втор-бутилборогидрид лития. Альтернативно, этап восстановления можно осуществлять, используя каталитическую гидрогенизацию, например, при помощи ренеевского никелевого или оксидно-платинового катализатора. Соответствующие условия для проведения этапа восстановления более подробно описаны ниже, или их можно найти в US 2843591 (Hoffmann- La Roche) и Brossi et al., Helv. Chim. Acta., vol. XLI, No. 193, pp l793-1806 (1958).
Поскольку тетрабеназин, применяемый в качестве исходного материала для восстановительной реакции, обычно представляет собой смесь RR и SS изомеров (то есть транс-тетрабеназин), дигидротетрабеназин, полученный на этапе восстановления, будет обладать той же самой транс конфигурацией относительно позиций 3- и 11b и будет принимать форму одного или больше из известных изомеров дигидротетрабеназина, представленных выше на Фиг.3. Таким образом, по способу A можно брать известные изомеры дигидротетрабеназина, дегидратировать их для получения алкена (II), а затем «регидратировать» алкен (II), применяя условия, которые приводят к получению нужных новых цис-изомеров дигидротетрабеназина по изобртению.
Дегидратацию дигидротетрабеназина до алкена (II) можно проводить, применяя множество стандартных условий для дегидратирования спиртов с образованием алкенов, см., например, J. March (тот же источник) страницы 389-390 и ссылки в нем. Примеры подобных условий включают использование дегидратирующих веществ на основе фосфора, таких как галоиды фосфора или галоидокиси фосфора, например, POCl3 и PCl5. В качестве альтернативы прямой дегидратации гидроксильную группу дигидротетрабеназина можно превращать в уходящую группу L, такую как галоген (например, хлор или бром), а затем переводить в условия (например, присутствие основания) для отщепления H-L. Превращение гидроксильной группы в галоид можно осуществлять, применяя способы, хорошо известные специалистам в области химии, например посредством реакции с четыреххлористым углеродом или четырехбромистым углеродом в присутствии триалкил или триарилфосфина, такого как трифенилфосфин или трибутилфосфин.
Тетрабеназин, используемый в качестве исходного материала для восстановления с целью получения дигидротетрабеназина, можно коммерчески приобрести или синтезировать способом, описанным в US 2830993 (Hoffmann-La Roche).
Другой способ (способ B) для получения дигидротетрабеназина по данному изобретению включает применение к соединению формулы (III):
условий для раскрытия кольца 2,3-эпоксидной группы в соединении формулы (III), а затем, при необходимости, разделение и выделение нужной изомерной формы дигидротетрабеназина.
Раскрытие кольца можно осуществлять известными способами для раскрытия эпоксидного кольца. Однако в настоящее время предпочтительным способом раскрытия кольца эпоксида является восстановительное раскрытие кольца, которое можно осуществить, применяя восстанавливающее вещество, такое как боран-ТГФ. Реакцию с боран-ТГФ можно проводить в полярном непротонном растворителе, таком как эфир (например, тетрагидрофуран), обычно при комнатной температуре, с последующим гидролизом полученного таким образом боранового комплекса посредством нагревания в присутствии воды и основания при температуре флегмы растворителя. Способом B обычно получают изомеры дигидротетрабеназина, в которых атомы водорода на позициях 2 и 3 обладают взаимной цис-ориентацией.
Эпоксидные соединения формулы (III) можно получать эпоксидированием алкена формулы (II), приведенной выше. Реакцию эпоксидации можно проводить, применяя условия и реактивы, хорошо известные специалистам в области химии, см., например, J. March (тот же источник), страницы 826-829 и ссылки в нем. Обычно пер-кислоту, такую как мета-хлорпербензойная кислота (МХПБК) (MCPBA), или смесь пер-кислоты и дополнительного окисляющего вещества, такого как перхлорная кислота, можно использовать для осуществления эпоксидации.
Если исходными материалами при способах A и B, приведенных выше, являются смеси энантиомеров, то полученные данными способами продукты будут обычно представлять собой пары энантиомеров, например рацемические смеси, возможно, с диастереоизомерными примесями. Нежелательные диастереоизомеры можно удалять такими методами, как хроматография (например, ВЭЖХ), а отдельные энантиомеры можно разделять разнообразными способами, известными специалистам в области химии. Например, их можно разделять посредством:
(i) хиральной хроматографии (хроматографии на хиральной подложке); или
(ii) получения соли с оптически гомогенной хиральной кислотой, разделения солей двух диастереоизомеров фракционной кристаллизацией с последующим высвобождением дигидротетрабеназина из соли; или
(iii) получения производного (такого как сложный эфир) с оптически гомогенным хиральным веществом для образования производного (например, этерифицирующим веществом), разделения полученных эпимеров (например, хроматографией) с последующим превращением производного в дигидротетрабеназин.
Один из способов разделения пар энантиомеров, полученных по каждому из способов A и B, который является особенно эффективным, состоит в том, чтобы этерифицировать гидроксильную группу дигидротетрабеназина оптически активной формой кислоты Мошера, такой как R (+) изомер, представленный ниже, или его активной формой:
Полученные сложные эфиры двух энантиомеров дигидротетрабеназина затем можно разделять хроматографией (например, ВЭЖХ), и разделенные сложные эфиры гидролизовать для получения отдельных изомеров дигидротетрабеназина, используя основание, такое как гидроокись щелочного металла (например, NaOH) в полярном растворителе, таком как метанол.
В качестве альтернативы использованию смесей эантиомеров как исходных материалов по способам A и B и последующему проведению разделения энантиомеров последовательно каждый из способов A и B можно осуществлять с исходными материалами в виде одиночного энантиомера, в результате получая продукты, в которых преобладает одиночный энантиомер. Одиночные энантиомеры алкена (II) можно получать, подвергая RR/SS тетрабеназин стереоизбирательному восстановлению с применением три-втор-бутилборогидрида лития для получения смеси SRR и RSS энантиомеров дигидротетрабеназина, разделяя энантиомеры (например, фракционной кристаллизацией), а затем дегидратируя выделенный единичный энантиомер дигидротетрабеназина для получения преимущественно или исключительно единичного энантиомера соединения формулы (II).
Способы A и B проиллюстрированы более подробно ниже на схемах 1 и 2, соответственно.
Схема 1
На схеме 1 представлено получение отдельных изомеров дигидротетрабеназина, обладающих конфигурациями 2S,3S,11bR и 2R,3R,11bS, при которых атомы водорода, закрепленные на позициях 2 и 3, находятся во взаимной трансориентации. Данная схема реакции охватывает способ А, описанный выше.
Исходным пунктом последовательности реакций на схеме 1 является коммерчески доступный тетрабеназин (IV), который представляет собой рацемическую смесь RR и SS оптических изомеров тетрабеназина. В каждом из RR и SS изомеров атомы водорода на позициях 3 и 11b находятся во взаимной трансориентации. В качестве альтернативы коммерчески доступному соединению тетрабеназин можно синтезировать способом, описанным в патенте США номер 2830993 (см. в конкретном примере 11).