Иммуногенная композиция и способ разработки вакцины, основанной на слитом белке
Иллюстрации
Показать всеИзобретение относится к области биотехнологии, вирусологии и медицины. Раскрыта композиция, направленная на элиситирование иммунного ответа против ВИЧ. Композиция содержит белок слияния ВИЧ. Раскрыто также применение такой композиции для изготовления лекарственного средства для элиситирования иммунного ответа на ВИЧ и способ элиситирования иммунного ответа с ее использованием. Изобретение может быть использовано в медицине. 3 н. и 28 з.п. ф-лы, 8 ил.
Реферат
ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
[0001] Данная заявка испрашивает приоритет по заявке США с временным номером 60/513827, дата подачи 23.10.2003.
ПРЕДПОСЫЛКИ ДАННОГО ИЗОБРЕТЕНИЯ
Область данного изобретения
[0002] Данное изобретение касается области вирусологии и иммунологии. В частности, но не исключительно, оно касается способа индуцирования иммунного ответа и субстанции, основанной на слитом белке (или белке F) для достижения индуцирования иммунного ответа.
Описание известного уровня техники
[0003] Вирус иммунодефицита человека (ВИЧ) является ретровирусом медленной или лентивирусной группы и вызывает Синдром Приобретенного Иммунного Дефицита (СПИД). Подобно многим вирусам, имеющим оболочку, для ВИЧ необходимо слияние вирусной и клеточной мембраны, что приводит к инфекции и репликации вируса. Как только ВИЧ сливается с клеткой хозяина, он переносит свой геном через вирусную и клеточную мембраны в клетку хозяина.
[0004] ВИЧ использует свою РНК как матрицу для образования вирусной ДНК в клетках-мишенях путем обратной транскрипции. Вирусная ДНК затем может объединиться с ДНК инфицированного хозяина. ВИЧ инфицирует клетки, имеющие поверхностный CD4, такие как лимфоциты и макрофаги, и разрушает CD4+ хелперные Т-лимфоциты. CD4 представляет кластер антигенной дифференцировки №4, который является частью клеток Th1 и Th2. Молекулы клеточной мембраны используются для дифференциации лейкоцитов различных эффекторных подклассов. В общем, описаны четыре типа молекул клеточных мембран, известных как кластер дифференцировки (КД). Тип I и II представляют собой трансмембранные белки (ТБ) с полярностью, противоположной плазматической мембране. ТБ типа III несколько раз пересекают плазматическую мембрану, и поэтому могут образовывать поры или каналы. ТБ типа IV являются сцепленными с гликозилфосфатидилинозитолом (ГФИ). CD4 является трансмембранным белком типа I, выраженным в различных клетках, включая хелперные/индукторные Т-клетки, моноциты, макрофаги и представляющие антиген клетки.
[0005] Этот процесс частично зависит от сшитых белков, которые являются компонентами гликопротеина gp41. Структура белка F устойчива к протеазам (Weissenhom, Nature Vol.387, p.426-430 (1997)). С помощью рентгеновской кристаллографии установили трехмерную структуру белка F.
[0006] Наружные мембранные белки ВИЧ, gp41 и gp120 связаны друг с другом нековалентной связью. На поверхности вириона ВИЧ gp120 и gp41 объединены в трехмерную единицу. Три молекулы gp120 объединены с тремя молекулами gp41.
[0007] Молекула gp120 связывается с рецептором CD4 на поверхности хелперных Т-клеток, а также макрофагов и моноцитов. Это связывание характеризуется высокой аффинностью между двумя молекулами. Высокое содержание сиаловой кислоты на поверхности вируса снижает пороговое значение энергии связывания, необходимое для преодоления отталкивающих электростатических сил. Таким образом, полагают, что мембранное слияние частицы ВИЧ с клеткой-мишенью хозяина включает следующие этапы:
1. взаимодействие вирусного связанного СурА (циклофилина А) с гепарином клетки хозяина;
2. прикрепление вируса к клетке-мишени путем взаимодействия СурА с гепарином;
3. связывание gp120 с молекулой CD4 клетки-мишени; для этого процесса необходимы корецепторные белки, известные как рецепторы хемокинов (CCR5 для Т-клеток и CXCR4 для макрофагов); затем эти вирусы начинают сливаться с клеткой, производя структурные или конформационные изменения и экспонируя другие рецепторы;
4. экспонирование слитого домена или белка F gp41 конформационными изменениями трехмерной и/или четырехмерной структуры молекулы gp120;
5. диссоциация молекулы gp120 от gp41 как результат конформационного изменения и отделение gp120;
6. сворачивание gp41 непосредственно перед проникновением в плазматическую мембрану клетки-мишени;
7. разворачивание белка F; и
8. слияние мембран вирусной частицы и клетки хозяина.
Вставка слитого пептида разрушает целостность липидов в мембране клетки-мишени хозяина. Белок F связывает вирусную и клеточную мембраны так, что при разворачивании сшивающего белка плазматическая мембрана клетки-мишени и вирусная мембрана соединяются вместе.
[0008] Вирусная мембрана ВИЧ образована из плазматической мембраны инфицированной клетки хозяина, когда вирус проникает сквозь клеточную мембрану. Таким образом, оболочка включает некоторые липидные и белковые компоненты клетки хозяина (Stoiber, 1996; Stoiber, 1997). Некоторые вирусы, имеющие оболочку, используют белки шипов для имитации молекул хозяина, для того чтобы связаться с рецепторами клетки хозяина и проникновения в другие клетки-мишени. Однако эти шипы могут также быть антигенными поверхностями для распознавания и разрушения вируса иммунной системой. ВИЧ защищается от иммунной идентификации (гуморальной и с помощью CD8) хозяином. В добавок к изменчивости конформационных изменений gp120 предусматривает другие свойства поверхности, которые маскируют его от иммунного узнавания и атаки, такие как покрытие гликопротеинами, ковалентно связанные остатки сиаловой кислоты или пространственное смыкание (Haurum, 1993). ВИЧ активирует различные иммунные ответы для своей собственной пользы.
Иммунный ответ
[0009] Таким образом, первичное действие ВИЧ заключается в уничтожении CD4 Т-клеток, которое снижает общую иммунную активность. Как описано выше, инфекция ВИЧ сосредотачивается на CD4 Т-клетках, но также поражает В-клетки, тромбоциты, эндотелиальные клетки, эпителиальные клетки, макрофаги и т.д. Поскольку CD4 Т-клетки уничтожены, ответ В-клеток становится разрегулированным. Прогрессирование ВИЧ отличает гипергаммаглобулинемия с неэффективными антителами. Кроме того, цитотоксические CD8 Т-клетки находятся в состоянии некомпетентности и не способны к распознаванию и разрушению вирусной инфекции. Это частично обуславливает трансфекцию неэффективных CD8 клеток белком tat, образованным в инфицированных CD4 клетках.
[0010] CD4 хелперные Т-клетки (Th) продуцируют цитокины и могут быть отнесены к Th1 клеткам или Th2 клеткам. Th1 клетки обеспечивают клеточно-опосредованный иммунитет, в то время как Th2 клетки индуцируют гуморальный иммунитет. Цитокины являются химическими посредниками или белковыми аттрактантами, которые регулируют иммунологический ответ. Уничтожение CD4+ хелперных клеток при ВИЧ заболевании приводит к снижению синтеза вирусных цитокинов. Дисрегуляция цитокинов угнетает активность природных клеток-киллеров и макрофагов. Кроме того, потеря интерлейкина-2 замедляет размножение клона и активацию зрелых Т-клеток.
[0011] Различные особенности вируса усиливают или ослабляют клеточно-опосредованный или гуморальный ответ. В зависимости от некоторых штаммов и фаз развития, ВИЧ можно охарактеризовать как нарушающий Th1 ответ, сопровождаемый сверхактивным, но не эффективным Th2 ответом. Полагают, что баланс между Th1 и Th2 иммунным ответом частично зависит от штамма (штаммов) ВИЧ, а частично от генетической среды инфицированного животного. Например, у носителей с непрогрессирующей инфекцией усиливается эффективный Th1 ответ на ВИЧ заболевание (Pantaleo, 1995).
[0012] Иммуногенное соединение, направленное на создание сбалансированного иммунного ответа и укрепление или усиление вида иммунного ответа, подавленного конкретным вирусом, имело бы важное значение (Hogan, 2001).
Клеточный ответ
[0013] Предполагают, что ВИЧ запускает начальный устойчивый клеточный ответ, который долго не поддерживается и, в конечном счете, не в состоянии управлять инфекцией (McMichael, 2001).
[0014] CD8 цитотоксические Т-клетки (Тк) распознают клетку, представляющую чужеродный антиген с помощью молекул МНС (главного комплекса гистовсовместимости) класса I на поверхности, и разрушают ее. CD4 хелперные клетки (Th) стимулируют макрофаги, которые поглощают вирус для того, чтобы убить его. Цитокины или интерлейкины, продуцируемые CD4 клетками, частично определяют, какими клетками в основном, Th1 или Th2, осуществляется иммунологический ответ на патоген. При некоторых инфекциях CD4 клетки продуцируют интерлейкин-4 и интерлейкин-5, которые отбираются для В-клеток. В-клетки представляют антиген, связанный с молекулами МНС класса II. При других инфекциях CD4 клетки продуцируют интерлейкин-2 (IL-2), который отбирается для цитотоксических Т-клеток. Это разделение или ограничение функций в распознавании антигенов иногда упоминается как рестрикция МНС. МНС класса I обычно представляет эндогенно-синтезируемые антигены, такие как вирусные белки, в то время как МНС класса II обычно представляет внеклеточные микроорганизмы или антигены, такие как бактериальные или вирусные белки, которые фагоцитируются антиген-представляющими клетками. Антиген-представляющие клетки затем связывают антиген с белками МНС II на их поверхности. CD4 клетка взаимодействует с этим антигеном через свой Т-клеточный рецептор и активируется. Это вносит свой вклад в неэффективность инактивированных вакцин для образования Тк цитотоксического ответа (Levinson, 2002).
[0015] Как указывалось выше, Т-клетки опосредуют клеточный ответ. Антиген-презентирующие клетки, наряду с молекулами МНС (или антигена лейкоцита человека - HLA), представляют части пептида антигена ВИЧ (или эпитопы) соответствующим Т-клеткам, вызывая Т-клеточный ответ.Тип эпитопа, представленного Т-клеткам, зависит от типа молекулы HLA (например, HLA А, В, С, DR, DQ, DP) и аминокислот в пептидах. Генетические недостатки в молекулах HLA или мутантные эпитопы могут привести к потере эпитопа и персистенции ВИЧ (McMichael, 2001). Как отмечено выше, Th клетки продуцируют цитокины для общего (т.е., Th1 и Th2) иммунного ответа, но в случае с ВИЧ он подавляется инфицированием Th клеток. ВИЧ специфические Th клетки, которые отвечают на антигены ВИЧ, в конце концов, инфицируются и разрушаются или подавляются. Это приводит к вторичному действию на Тс-клетки. Тс-клетки демонстрируют различные антивирусные воздействия (такие как продуцирование перфоринов и цитокинов), включая распознавания и разрушения чужеродных антигенов и инфицированных клеток, которых связываются молекулами МНС класса I. ВИЧ может снижать экспрессию молекул HLA класса I в инфицированных клетках, уменьшая способность Тс-клеток к распознаванию или поражению инфицированных Th клеток. Кроме того, инфекция и уничтожение Th клеток нарушают способность Тс-клеток к созреванию и ответу на мутантные вирионы (McMichael, 2001). Типично, при вирусной инфекции цитотоксические Т-клетки уничтожают или супрессируют вирус. Но ВИЧ противостоит клеточному иммунному ответу, инфицируя иммунные клетки и нарушая ответ Th клеток и Тс-клеток.
[0016] Таким образом, иммуногенное соединение, которое стимулирует активность Th 1, обеспечит благоприятный иммунный ответ на ВИЧ.
Гуморальный ответ
[0017] Гуморальное звено иммунной системы состоит из В-клеток, которые при возбуждении дифференцируются на клетки плазмы, продуцирующие антитела. Первыми появляются антитела IgM, за которыми следуют IgG в крови или IgA в секреторных тканях. Главной функцией этих антител является защита от инфекционных болезней и их токсинов. Антитела не только нейтрализуют вирусы и токсины, а также опсонизируют микроорганизмы. Опсонизация является процессом, при котором антитела облегчают поглощение и разрушение вирусов или бактерий фагоцитарными клетками. Фагоцитарные клетки включают полиморфно-ядерные нейтрофилы (ПМН) и тканевые макрофаги. ПМН включают около 60% лейкоцитов в крови неинфицированного пациента. Число ПМН и тканевых макрофагов может увеличиваться или уменьшаться при определенных инфекционных нарушениях. Например, брюшной тиф характеризуется уменьшением числа лейкоцитов (т.е., лейкопенией). ПМН и макрофаги фагоцитируют или поглощают бактерии и вирусы. ПМН, в отличие от макрофагов и дендритных клеток, не презентируют антиген хелперным Т-клеткам.
[0018] Фагоцитоз включает (1) миграцию, (2) поглощение и (3) цитолиз. Клетки ткани инфицированной области продуцируют небольшие полипептиды, известные как хемокины. Хемокины привлекают ПМН и макрофаги к участку инфекции. Затем бактерии поглощаются выпячиванием клеточной мембраны ПМН вокруг бактерий, образующим вакуоль или фагосому. Это поглощение усиливается связыванием IgG антител (опсонинов) с бактериальной поверхностью. Компонент C3b системы комплемента также усиливает опсонизацию (Hoffman, R. Hematology Basic Principles and Practice Ch. 37 (3rd ed. 2000)). Клеточные мембраны ПМН и макрофага несут рецепторы для C3b и части Fc IgG.
[0019] С поглощением приводится в действие метаболизм, известный как дыхательный взрыв. В результате в фагосомах образуются два микробоцидных агента - супероксидный радикал и перекись водорода. Эти высокореакционные соединения, часто называемые реакционными промежуточными продуктами кислорода, образуются при следующих реакциях:
O2 + е- → O2-
2O2- + 2H+ → H2O2 (Перекись водорода) + O2.
[0020] При первой реакции восстанавливается молекулярный кислород с образованием супероксидного радикала, который является слабым микробоцидом. При второй реакции, которая катализируется ферментом супероксидной дисмутазой, в фагосоме образуется перекись водорода. В общем, перекись водорода является более эффективным микробоцидом, чем супероксид. При дыхательном взрыве также образуется оксид азота (NO), другой микробоцид. NO содержит свободный радикал, который участвует в окислительном цитолизе поглощенных нейтрофилами и макрофагами вирусов и бактерий. Синтез NO в фагосоме катализируется ферментом NO синтазой, которая индуцируется процессом фагоцитоза.
[0021] Цитолиз организма в фагосоме является двухэтапным процессом, состоящим из дегрануляции, за которой следует образование гипохлоритных ионов, являющихся наиболее эффективными микробоцидными агентами. В цитоплазме нейтрофилов или макрофагов обнаружены два типа гранул. Эти гранулы соединяются с фагосомой для образования фаголизосомы. Затем содержимое гранул выпускается. Эти гранулы являются лизосомами, содержащими различные ферменты, существенно важные для цитолиза и разрушения. Идентифицировали два типа лизосомальных гранул, которые различаются по размеру. Большая лизосомальная гранула, которая составляет около 15% общего количества, содержит несколько ферментов, включая миелопероксидазу, лизоцим и другие деструктивные ферменты. Остальные 85% являются меньшими гранулами, содержащими лактоферрин и другие деструктивные ферменты, такие как протеаза, нуклеаза и липаза. Фактически цитолиз или деструкция микроорганизмов происходит путем различных механизмов, зависимых от кислорода и независимых от кислорода. Наиболее важный зависимый от кислорода механизм заключается в образовании гипохлоритного иона, что катализируется миелопероксидазой:
Cl-+H2O2→ClO+Н2О.
[0022] CD8 цитотоксические Т-клетки (Tc) распознают клетку, представляющую чужеродный антиген с помощью молекул МНС (главного комплекса гистовсовместимости) класса I на поверхности, и разрушают ее. CD4 хелперные клетки (Th) стимулируют макрофаги, которые поглощают вирусы, чтобы убить. Цитокины или интерлейкины, продуцируемые CD4 клетками, частично определяют, какими клетками в основном, Th1 или Th2, осуществляется иммунологический ответ на патоген. При некоторых инфекциях CD4 клетки продуцируют интерлейкин-4 и интерлейкин-5, которые отбираются для В-клеток. В-клетки представляют антиген, связанный с молекулами МНС класса II. При некоторых инфекциях CD4 клетки продуцируют интерлейкин-2 (IL-2), который отбирается для цитотоксических Т-клеток. Это разделение или ограничение функций в распознавании антигенов иногда определяется как рестрикция МНС. МНС класса I обычно представляет эндогенно-синтезируемые антигены, такие как вирусные белки, в то время как МНС класса II обычно представляет внеклеточные микроорганизмы или антигены, такие как бактериальные или вирусные белки, которые фагоцитируются антиген-представляющими клетками. Антиген-представляющие клетки затем связывают антиген с белками МНС II на их поверхности. CD4 клетка взаимодействует с этим антигеном через свой Т-клеточный рецептор и активируется. Это вносит свой вклад в неэффективность инактивированных вакцин для образования Тс цитотоксического ответа (Levinson, 2002).
[0023] Вариабельные области и L- и Н-цепей имеют три высоковариабельные (или гипервариабельные) аминокислотные последовательности на амино-концевой части, которая составляет антигенсвязывающий участок. В каждой гипервариабельной области этот участок образован только 5-10 аминокислотами. Взаимодействие антиген-антитело включает электростатические силы и силы Ван дер Ваальса. Кроме того, между антигеном и гипервариабельными областями антитела образуются водородные и гидрофобные связи. Специфичность или "уникальность" каждого антитела заключается в гипервариабельной области; гипервариабельная область является "отпечатком пальца" антитела.
[0024] В связывании антигена участвует амино-концевая часть каждой L-цепи. Карбоксиконцевая часть входит в Fc-фрагмент. Fc-фрагмент (образованный протеолитическим отщеплением шарнирной области молекулы антитела, отделяющей участки связывания антигена от остальной части молекулы или Fc-фрагмента) экспрессирует биологические действия постоянной области, специфическую фиксацию комплемента. Н-цепи различны для каждого из пяти иммунологических классов. Тяжелые цепи IgG, IgA, IgM, IgE и IgD обозначаются γ, α, µ, є и δ, соответственно. Класс иммуноглобулина IgG опсонизирует микроорганизмы; таким образом, этот класс Ig (иммуноглобулинов) усиливает фагоцитоз (Hoffman, Ronald, et al., Hematology Basic Principles & Practice, ch.36 & 39 (3rd ed. 2000); Levinson, Warren, Medical Microbiology & Immunology, Ch. 59 & 63 (7th ed. 2002)). На поверхности ПМН и макрофагов обнаружены рецепторы γ Н-цепи IgG. IgM непосредственно не опсонизирует микроорганизмы, потому что на поверхности фагоцита нет рецепторов для µ Н-цепи. Однако IgM активирует комплемент, и C3b белок может опсонизировать, потому что на поверхности фагоцитов имеются участки связывания для C3b (Levinson, 2002). IgG и IgM способны вызвать каскад комплемента. Фактически, одна молекула IgM может активировать комплемент. Для активации комплемента с помощью IgG необходимо две перекрестносшитые молекулы IgG (подклассов IgGI, IgG2 или IgG3; IgG4 не способен активировать комплемент). Непосредственно активировать систему комплемента также могут неиммунологические молекулы, такие как бактериальный эндотоксин.
[0025] Система комплемента состоит приблизительно из двадцати белков, которые обычно находятся в сыворотке. Выражение "комплемент" означает белки комплемента или увеличение других компонентов в иммунной системе, таких как антитела и иммуноглобулин. Каскад комплемента имеет три важных иммунных эффекта: (1) лизис микроорганизмов; (2) образование медиаторов, которые участвуют в воспалении и привлекают ПМН, и (3) опсонизация.
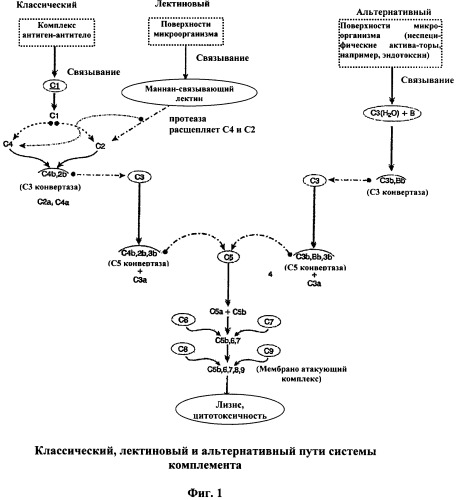
[0026] Каскад комплемента идет по одному из трех путей: (1) классическому; (2) пектиновому и (3) альтернативному (Prodinger, Wm., et al., Fundamental Immunology, Ch. 29 (1998)). Эти пути схематически показаны на Фигуре 1. Пунктирная линия показывает, что произошло протеолитическое расщепление молекулы (на конце стрелки). Линия над комплексом указывает на то, что он ферментативно активный. Хотя большой фрагмент С2 иногда попеременно по договоренности обозначается С2а или C2b, в данном описании маленькие фрагменты обозначаются "а", а все большие фрагменты "b". Следовательно, С3 конвертазой является C4b, 2b. Отмечено, что протеазы, ассоциированные с лектином, связывающим маннозу, расщепляют С4, а также С2. Каждый из этих путей ведет к образованию Мембраноатакующего Комплекса (МАК).
[0027] С антителом, прикрепленным к специфическому компоненту вируса или бактерии, МАК способен перфорировать защитную оболочку микроорганизма и позволяет плазме крови и электролитам попадать в микроорганизм, и в то же время обеспечивает выход внутренних структуральных компонентов микроорганизма.
[0028] При классическом пути комплексы антиген-антитело активизируют С1 для образования протеазы, которая расщепляет С2 и С4 для образования комплекса C4b, 2b. С1 состоит из трех белков: C1q, C1r и C1s, C1q состоит из 18 полипептидов, которые связываются с Fc-фрагментом IgG и IgM. Fc является многовалентным и может сшивать несколько молекул иммуноглобулина. C1s является проферментом, который расщепляется для образования активной протеазы. Для активации С1 как кофактор необходим кальций. Далее, для активации С1 необходимо многоточечное присоединение, по меньшей мере, двух глобулярных головок C1q к Fc-доменам IgG и/или IgM. Изменения, вызванные в C1q при связывании множественных Fc иммуноглобулинов, передаются C1r субъединицам, приводя к протеолитической аутоактивации димера C1r, который затем протеолитически активирует или расщепляет C1s. Как отмечено выше, активированный C1s имеет каталитический участок для протеолитического сплайсинга С4 и С2. Образуется ферментативный комплекс C4b, 2b. Он функционирует как С3 конвертаза, расщепляющая молекулы С3 на два фрагмента С3а и C3b. C3b формирует комплекс с C4b и C2b, образуя новый фермент (C4b, 2b, 3b), который является С5 конвертазой.
[0029] При лектиновом пути маннан-связывающий лектин (МСЛ, или маннозо-связывающий белок (МСБ)) связывается с поверхностью микробов, экспрессирующих маннан. МСБ является лектином С-типа в плазме, структура которого подобна структуре C1q, и связывается рецепторами C1q, усиливая фагоцитоз. Манноза, являющаяся альдогексозой, обнаружена на поверхности множества микроорганизмов. Первый компонент пектинового пути называют маннозо-(или маннано-)связывающим белком. С-концевой домен узнавания углевода имеет сродство к N-ацетилглюкозамину и придает способность МСБ непосредственно опсонизировать микроорганизмы, экспрессируя богатые маннозой поверхности оболочек. В крови МСБ циркулирует как стабильный комплекс с C1r-подобным проферментом и C1s-подобным проферментом (обозначаемым как МСБ-ассоциированная сериновая протеаза, или МАСП-1 и МАСП-2 соответственно). Комплекс МСБ-МАСП-1, МАСП-2 связывается с соответствующей поверхностью углевода. Это вызывает конформационное изменение в МСБ, которое приводит к аутоактивации МАСП-1 путем внутреннего расщепления пептида, преобразующей МАСП-1 в активную сериновую протеазу. Подобно C1r, активный МАСП-1 расщепляет МАСП-2, активируя его. Активный МАСП-2 проявляет способность протеолитически активировать С4 и С2 для инициации сборки ферментативного комплекса C4b, 2b (С3 конвертазы). Как и при классическом пути, это приводит к образованию С5 конвертазы.
[0030] При альтернативном пути множество чужеродных для клеточной поверхности структур, таких как бактериальные липополисахариды (эндотоксин), клеточные стенки грибов и вирусные капсулы, могут инициировать процесс, связываясь с С3(Н2О) и Фактором В. Этот комплекс расщепляется протеазой. Фактором D, с образованием C3b,Bb, который действует как С3 конвертаза для образования большего количества C3b. В отличие от последовательного ферментного каскада классического пути, альтернативный путь использует позитивную обратную связь; основной продукт активации C3b действует как кофактор для C3b, Bb, который также отвечает за свое собственное продуцирование. Таким образом, альтернативный путь непрерывно примируется для взрывной активации С3. Интенсивность активации С3 определяется стабильностью ферментативного комплекса C3b, Bb. Фактор D протеолизом расщепляет Фактор В на маленький фрагмент (Ва) и большой фрагмент (Bb). Большой фрагмент Bb объединяется либо с С3(Н2О), либо с C3b. Через каталитический участок в Bb комплекс С3(H2O), Bb может протеолитически преобразовывать С3 в С3а и C3b. Образующийся по данному механизму C3b способен связывать дополнительный Фактор В. Поэтому альтернативный путь комплемента имеет, по меньшей мере, две петли позитивной обратной связи, усиливающие продуцирование C3b. Как показано на Фигуре 1, этот путь также приводит к продуцированию С5 конвертазы.
[0031] В каждом пути С5 конвертаза (C4b, 2b, 3b или C3b, Bb, C3b) расщепляет С5 на С5а и C5b. C5b связывается с С6 и С7 для образования комплекса, который взаимодействует с С8 и С9, в конечном счете образуя МАК (C5b, 6, 7, 8, 9) (Hoffman, 2000).
[0032] Независимо от того, по какому пути активирован комплемент, комплекс C3b является центральной молекулой каскада комплемента. Иммунологически C3b выполняет три функции:
1. последовательная комбинация с другими компонентами комплемента для образования С5 конвертаз, ферментов, которые приводят к образованию МАК (C5b, 6, 7, 8, 9);
2. опсонизация микроорганизмов; фагоциты на своей клеточной поверхности имеют рецепторы для C3b;
3. связывание с их рецепторами на поверхности активированных В-клеток, которое значительно усиливает продуцирование антител (Parham, Peter, The Immune System, ch. 7 (2nd ed. 2004)).
Гуморальный ответ включает определенные регуляторы этой системы, такие как Фактор Н комплемента, который является чувствительным к эксплуатации ВИЧ. Любой микроорганизм со способностью ограничивать активность каскада комплемента теоретически мог бы защитить себя от гуморального звена иммунной системы (Stoiber, Herbert, "Role of Complement in the control of HIV dynamics and pathogenis," Vaccine 21: S2/77-S2/82 (2003)). Таким образом, каскад комплемента является "ахиллесовой пятой" гуморального звена.
Взаимодействие ВИЧ с гуморальным ответом
[0033] Ретровирусы могут активировать систему комплемента при отсутствии антител (Haurum, J., AIDS, Vol.7(10), p.1307-13 (1993)). Установлено, что активация комплемента гликопротеинами оболочки ВИЧ опосредована связыванием МСБ с углеводами в белках природной оболочки, продуцируемых в клетках, инфицированных вирусом, а также в гликозилированных рекомбинантных белках оболочки (Haurum, 1993; Speth, С, Immunology Reviews, Vol.157, p.49-67 (1997)). Активация классического пути и пектинового пути комплемента ретровирусной оболочкой может инициироваться связыванием МСБ с углеводной стороной цепи гликопротеинов оболочки. Показано, что трансмембранный белок ВИЧ-1, gp41, связан с gp120 нековалентной связью. Комплементный компонент C1q также связывается с gp41. Во внешней клеточной части (эктодомене) gp41 три участка (аа 526-538, аа 601-613 и аа 625-655) связаны с gp120 и с C1q. Таким образом, C1q и gp120 структурально и функционально гомологичны. Взаимодействие между gp41 и C1q зависит от кальция, в отличие от ассоциации gp41 и gp120, которая не зависит от кальция.
[0034] Когда ВИЧ запускает классический и лектиновый пути способом, не зависимым от антитела, это повышает ВИЧ-инфицирование комплементных рецептор-позитивных клеток. Связывание C1q с gp41 может облегчить инфицирование различными путями. C1q связывается непосредственно с ВИЧ инфицированными клетками, которые также поражены ВИЧ-1. C1q сохраняет свою способность связываться с рецептором C1q, также известным как коллектиновый рецептор. Кроме того, gp41 непосредственно взаимодействует с C1q, закрепленным на плазматической мембране макрофагов. В обоих случаях, ВИЧ имеет возможность для C1q-опосредованного СВ4-независимого контакта с клетками.
[0035] Гомология gp120 и C1q повышает возможность непосредственного взаимодействия gp120 с рецептором C1q, и, тем самым, облегчает поглощение ВИЧ макрофагами СD4-независимым способом (Stoiber, Heribert, European Journal of Immunology, Vol 24, p.294-300 (1994)). Антитела к gp120 способны перекрестно реагировать с C1q и могут, по меньшей мере, частично отвечать за очень низкую концентрацию C1q у пациентов, инфицированных ВИЧ-1. C1q является одним из факторов, ответственным за клиренс нерастворимых иммунных комплексов, и его отсутствие могло бы внести свой вклад в очень высокие концентрации нерастворимых иммунных комплексов, отмеченных у индивидуумов, инфицированных ВИЧ (Procaccia, S., AIDS Vol 5, p.1441 (1991)). Гипокомплементемия, которая характеризует заболевание ВИЧ, коррелирует с ВИЧ-ассоциированными инфекциями, вызванными условно-патогенными микроорганизмами и связанными с вирусом злокачественными новообразованиями.
[0036] Регуляторы активности комплемента можно обнаружить прикрепленными к плазматическим мембранам. Остальные свободно циркулируют в плазме и лимфе человека. Охарактеризованы многие регуляторы активности комплемента (РАК), и фактически каждый этап во всех трех путях зависит от положительного и отрицательного контролей. Три ферментных комплекса (С3 конвертазы, С5 конвертазы, МАК) являются центральными в каскаде комплемента и зависят от многочисленных ингибиторов или катализаторов.
[0037] Несколько белков, которые управляют путями активации комплемента, циркулируют в плазме как свободно растворимые молекулы и могут или управлять С3 активацией в жидкой фазе, или ингибировать формирование МАК на клеточных поверхностях. Показано, что этой функции способствуют регуляторы комплемента, такие как Фактор Н и белок, подобный Фактору Н, с низкой молекулярной массой. Фактор Н взаимодействует с gp120, усиливая формирование синцития и индуцированную растворимым CD4 (sCD4) диссоциацию капсульного гликопротеинового (env) комплекса. Фактор Н связывает активированный gp120 только после того, как он связывается с CD4, предполагают, что участок связывания скрыт в env комплексе и оголяется только после взаимодействия gp120 с CD4 (Pinter, С, AIDS Research in Human Retrovimses, Vol.11, (1995)). Молекула gp120 связывается с рецептором CD4 на хелперных Т-клетках. Затем вирус сливается с Т-клеткой. Домен слияния расположен на gp41. При слиянии "слущивается" фрагмент gp120. Эктодомен gp41 оголяется после "слущивания" gp120. Участки связывания C1q и Фактора Н на gp41 становятся открытыми.
[0038] ВИЧ активирует системы комплемента человека даже при отсутствии специфических антител (Stoiber, Heribert, Journal Ann. Rev. Immunology, Vol 15, page 649-674 (1997)). Это приведет к инактивации вируса, если комплементу не препятствовать. Если бы комплемент был свободным, это привело бы к образованию МАК, запускающего лизис вируса. Однако ВИЧ избегает лизис вируса, включая в свою структуру различные молекулы хозяина (например, ФУД (фактор ускорения диссоциации)/CD55), которые регулируют комплемент. ВИЧ включает эти молекулы из инфицированной клетки в вирусную мембрану после активной репликации в результате проникновения в клетку или присоединением к структурам gp41 и gp120 (Stoiber, H.J. Ann. Rev. Immunology, Vol.15, 649-674 (1997)). Это взаимодействие с компонентами комплемента облегчает ВИЧ использование в своих целях компонентов комплемента для усиления инфекционности, фоликулярной локализации и расширения своего диапазона клеток-мишеней. В то же время ВИЧ защищается от гуморального звена.
[0039] Белки, такие как Фактор Н и CR1, обладают кофакторной активностью и ускоряют диссоциацию по отношению к С3 конвертазам (Stoiber, Н, J. Ann. Rev. Immunology, Vol.15, 649-674 (1997)). Целостность C3b существенна для достижения каскадом комплемента клеточного лизиса. C3b быстро расщепляется сериновой протеазой (комплемент Фактор 1-CF1) после взаимодействия с соответствующими рецепторами комплемента. Белки, содействующие этой реакции, обладают кофакторной активностью по отношению к CF1. Некоторые белки снижают активацию комплемента, ингибируя сборку и/или способствуя диссоциации ферментов, образующих C3b и C4b (конвертаз). Эту активность называют ускорением диссоциации, она характерна для молекулы белка CD55 (ФУД).
[0040] Сыворотка, лишенная Фактора Н, будет лизировать ВИЧ и инфицированные, а не здоровые клетки (Stoiber, H.J. Exp.Med., 183: 307-310 (1996)). Показано, что в присутствии Фактора Н лизис ВИЧ происходит, если связывание Фактора Н ингибировалось моноклональным антителом, направленным на участок связывания Фактора Н в gp41. Но до сих пор неизвестно, как применить эти расширяющиеся сведения взаимосвязи ВИЧ и Фактора Н к человеческой системе комплемента.
Известный уровень техники
[0041] Вопреки напряженным усилиям, не создана лечебная вакцина к ВИЧ. Изобретатели направляют свои усилия на различные этапы жизненного цикла ВИЧ. До настоящего времени исследователи не получили композицию, которая способствовала бы эффективному иммунному ответу на иммуносупрессивный ретровирус ВИЧ-1. Большинство вакцин ВИЧ используют части гликопротеинов оболочки (gp160, gp120 и gp41) при попытке индуцировать образование нейтрализующих антител против шипов оболочки вируса (Johnston, et al., 2001). Некоторые добивались успеха в создании высоких титров нейтрализующих антител. Идея этого подхода заключается в том, что антитела, которые связываются с этими гликопротеинами, нейтрализовали бы вирус и предотвратили бы инфекцию. Затем функционирующая иммунная система могла бы активировать систему комплемента, которая каскадно лизировала бы и разрушала вирус. Однако ослабление гуморального ответа, описанного выше, ограничивает эффективность этих вакцин. Множество лекарственных препаратов или композиций (AZT, dd1, ddC, d4T и 3ТС) ингибирует обратную транскрипцию. Аналоги 2',3'-дидеоксинуклеозида могут быть эффективными против определенных штаммов, но являются чувствительными к изменчивости генома ВИЧ (Deeks, Steven, The Medical Management of Aids, Ch. 6 (6th ed. 1999)). Эти лекарственные препараты также имеют проблемы с токсичностью, стоимостью, сложностями получения, взаимодействия с другими лекарственными препаратами, а также устойчивостью патогена к лекарственному препарату.
[0042] Нацеливание инвариантных белков имеет премущество избегания продуктов генетической мутабильности. Некоторые изобретатели стремились разработать композиции, которые мешают процессу вирусного слияния с клеточной мембраной, или "ингибиторы проникновения". Однако большинство попыток сосредоточены на рецепторе CD4 или корецепторе CCR5. Некоторые попытки, такие как патент США №6060065 Barney и др., раскрывает использование пептида для блокирования слияния вириона США; иммунный ответ не был раскрыт. Аналогично, в патенте США №6747126 Eckert и др., предусматривают пептиды для нарушения процесса процесса слияния. Однако сохраняется потребность в иммуногенных композициях и способах, которые направлены на стимулирование отдельных элементов клеточного и гуморального иммунных ответов для процесса слияния.
КРАТКОЕ ОПИСАНИЕ ДАННОГО ИЗОБРЕТЕНИЯ
[0043] Как описано выше, для ВИЧ необходимо слияние вирусной и клеточной мембраны, что приводит к инфекции и вирусной репликации. Кроме того, ВИЧ ослабляет иммунный ответ регуляторами разрушения или связывания комплемента. Следовательно, данное изобретение заключается в иммуногенной композиции, основанной на субъединице слияния или белке F, и в способе получения и применения данной композиции. В данном изобретенипи рассмотрены три категории вариантов осуществления: белок или фрагменты белка, информационная РНК или ДНК/РНК. Композиции ДНК/РНК могут быть или оголенными, или рекомбинантными. Данное изобретение также рассматривает применение с различными иммунными стимуляторами.
Краткое описание графических материалов
[0044] На Фигуре 1 показана схема путей каскада комплемента человека.
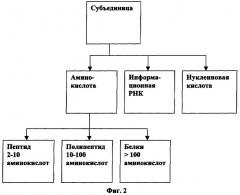
[0045] На Фигуре 2 изображены категории вариантов осуществления данной иммуногенной композиции с белком слияния.
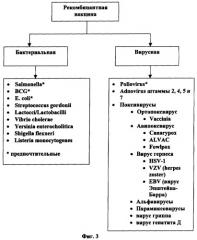
[0046] Фигура 3 является графиком типичных носителей, приемлемых для рекомбинантной ДНК.
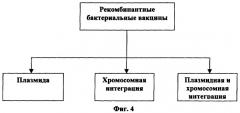
[0047] На Фигуре 4 показан сплайсинг генетического материала, кодирующего белок слияния в рекомбинантных бактериальных композициях или вакцинах.
[0048] На Фигуре 5 показана схема сплайсинга генетического материала, кодирующего белок слияния в рекомбинантных вирусных композициях или вакцинах.
[0049] На фигуре 6 представлен список иммунных стимуляторов для применения с оголенной ДНК.
[0050] На Фигуре 7 описаны традиционные способы введения ДНК.
[0051] Фигура 8 представляет схематический рисунок, на котором показаны структуры цепей С3 и CVF и их взаимосвязь.
Описание данного изобретения
А. Введение
[0052] Данное изобретение является иммуногенной композицией, основанной на субъединице белка слияния ВИЧ. Можно использовать зрелую и незрелую белка. Кроме того, кодирование генетической последовательности белка слияния можно также использовать для получения рекомбинантного бактериального или вирусного варианта осуществления или варианта осуществления экспрессированной информационной РНК.
[0053] В дополнение к описанным выше иммунным функциям, еще одной функцией является создание антигенной "памяти". Более позднее воздействие того же антигена могло бы затем вызвать более эффективный ранний ответ. Эта память создается антиген специфическими лимфоцитами. Таким образом, лимфоциты памяти, наряду с другими клетками и факторами, обеспечивают непосредственную защиту в периферийной ткани и обеспечивают вторичные иммунные ответы во вторичных лимфоидных органах. При активировании лимфоциты распространяются, что р