Аналоги адренокортикотропного гормона и относящиеся к ним методы
Иллюстрации
Показать всеИзобретение относится к области биотехнологии, в частности к генетической инженерии, и может быть использовано в медико-биологической промышленности. Предложен аналог адренокортикотропного гормона (АСТН), состоящий из 24 аминокислотных остатков и представляющий собой укороченный с С-конца природный пептид человека (hACTH 1-24), в котором последовательность Lys15-Lys16-Arg17-Arg18-Pro19 заменена последовательностью Lys15-Arg16-Ala17-Ala18-Trp19. Новая мутантная форма АСТН обладает такими свойствами, как (1) снижение секреции кортикостероида мембраной надпочечника в присутствии аналога АСТН в сравнении с немодифицированным АСТН; (2) снижение секреции кортикостероида мембраной надпочечника в присутствии эндогенного АСТН и (3) повышенная аффинность по связыванию с MC-2R при сниженной активации рецептора MC-2R в сравнении с вариантом связывания немодифицированного АСТН. Совокупность свойств, характеризующих аналог АСТН по изобретению, позволяет использовать его как непосредственно, так и в составе фармкомпозиции, для лечения АСТН-ассоциированных состояний, в частности при болезни Кушинга. 4 н. и 7 з.п. ф-лы, 5 ил., 5 табл.
Реферат
Информации о поддержке правительства США
Тема исследования, отраженная в настоящей заявке, была финансирована исследовательским грантом Национального Института Здоровья (National Institutes of Health) (номер гранта NIH: DK50870) и грантом Национального Фонда Науки (National Science Foundation) (номер гранта NSF IBN-0132210). Соответственно, правительство имеет определенные права на настоящее изобретение.
Перекрестные ссылки на родственные заявки
Настоящая заявка заявляет приоритет предварительной заявки на патент США, номер No. 60/622436, «Композиции и способы лечения преждевременных родов, синдрома Кушинга и родственных расстройств» (Composition and Methods for the Treatment of Premature Labor, Cushing's Syndrome and Related Disordes»), поданной 27 октября 2004 года, полное содержание которой включено в настоящее описание в качестве ссылки.
Область техники, к которой относится изобретение
Настоящее изобретение относится к соединениям-аналогам АСТН, а также к относящимся к ним фармацевтическим композициям и способам лечения.
Уровень техники
Кортикотропин, также известный как адренокортикотропный гормон (АСТН), представляет собой главный гормон, секретируемый гипофизом, и который, как считается, является медиатором в процессах создания множества жизненно важных ростовых стероидов, контролирующих рост и физиологические процессы. АСТН стимулирует кору надпочечника. Более конкретно, он стимулирует секрецию глюкокортикоидов, таких как кортизол, у человека (или кортикостерон у грызунов) и оказывает незначительное регулирующее воздействие на секрецию альдостерона, другого важного стероидного гормона коры надпочечника. АСТН связывается с рецептором адренокортикотропного гормона MC-2R, экспрессируемым в надпочечнике.
АСТН секретируется из передней доли гипофиза в ответ на кортикотропин-рилизинг гормон (CRH) гипотоламуса. В гипофизе АСТН продуцируется из крупной молекулы-предшественника опиомеланокортина (POMC), который расщепляется под действием специфических пептидаз. Эффекты АСТН на синтез стероидов могут включать повышение уровня холестеролэстеразы, транспорт холестерина в митохондриальную мембрану и через нее, связывание холестерина с P450SСС и, в этой связи, повышение продукции прегненолона (см., Nussey, S. and S. Whitehead, Endocrinology: An Integrated Approach, BIOS Scientific Publishers Ltd. (2001)). Последующая активность может включать индукцию стероидогенных ферментов и структурные изменения, которые характеризуются гиперваскуляризацией, клеточной гипертрофией и гиперплазией. Этот феномен особенно важен в тех случаях, когда избыток АСТН может нежелательно секретироваться в течение длительных периодов времени.
Стероидный глюкокортикоид продуцируется фасциально-ретикулярными клетками надпочечника в надпочечнике, который секретируется в ответ на повышение уровня в плазме адренокортикотропного гормона (АСТН). Глюкокортикоиды вовлекаются в метаболизм углеводов, белков и жиров и, как было показано, обладают противовоспалительными свойствами, и в стрессовых условиях подвергаются гиперсекреции. При избытке, как было показано, глюкокортикоиды повреждают гиппокамп, участок лимбической системы головного мозга, который важен для осуществления познавательных функций, таких как обучение и память (см., например, Sapolsky, R. M., Ann. N. Y. Acad. Sci. 746:294 (1994); и McEwen, B S., Ann. N. Y. Acad. Sci. 746:134 (1994)). Кроме того, было показано, что нейротоксичность глюкокортикоидов и их повреждающий потенциал в отношении нервных клеток является решающим фактором в развитии и старении нервных клеток, а также неврологических заболеваний, связанных с повреждением гиппокампа (см., например, deKloet, E. R., et al., Ann. N. Y. Acad. Sci. 746: 8 (1994)).
Кортикостероиды представляют собой стероидные гормоны, характеризующиеся структурным родством с холестерином. Указанные гормоны синтезируются в коре надпочечника и включают глюкокортикоиды (например, кортикостероиды), минералокортикоиды (например, альдостерон), а также слабые андрогены и эстрогены. Функции надпочечника, как и щитовидной железы, находятся под контролем гипоталамуса (HPT) и гипофиза (PIT). Когда уровни кортикостероидов (природного глюкокортикоида) падают ниже определенной точки, гипоталамус высвобождает CRH (кортикотропин-рилизинг гормон), который стимулирует высвобождение адренокортикотропного гормона (АСТН) из гипофиза. АСТН представляет собой тропный гормон, который стимулирует синтез и секрецию кортикостероидов (он оказывает минимальный эффект на синтез/секрецию альдостерона) и на рост надпочечника.
В настоящее время имеется потребность в соединениях, которые могли бы связываться с рецепторами АСТН и при этом оказывать сниженную активацию секреции кортикостероидов, например, для лечения АСТН-родственных состояний, включающих: синдром Кушинга, сниженный иммунитет, возникающий в результате гиперсекреции кортикостероида, и некоторых относящихся к надпочечнику состояний, которые вызывают преждевременные роды.
Синдром Кушинга представляет собой расстройство, возникающее в результате повышенной секреции кортикостероида надпочечником. Гиперфункция коры надпочечников может быть АСТН-зависимой или может быть независимой от регуляции АСТН, например, в случае продукции кортикостероида адренокортикальной аденомой или карциномой. Наиболее частой причиной синдрома Кушинга является избыточное образование АСТН гипофизом. В типичном случае повышенный уровень АСТН в кровотоке создается аденомой гипофиза (болезнь Кушинга), но иногда имеет другую этиологию. Синдром Кушинга, возникающий в результате образования АСТН в сайте, отличном от гипофиза, носит название эктопический синдром Кушинга. Примеры эктопических сайтов включают тимому, медуллярную карциному щитовидной железы, феохромоцитому, опухоли островковых клеток поджелудочной железы и овсяно-клеточную карциному легкого. Однако в подавляющем большинстве случаев этиология синдрома Кушинга у людей связана с аденомой гипофиза. Симптомы синдрома Кушинга включают повышение веса, центральное ожирение, гиперсекрецию стероидов, повышенную экскрецию кортизола с мочой, лунообразное лицо, слабость, усталость, боли в спине, головную боль, импотенцию, изменение ментального статуса, атрофию мышц и повышенную жажду и мочевыделение в сравнении с млекопитающими, не имеющими этого заболевания. Диагностика и лечение синдрома Кушинга все еще остаются проблемой для медицины (см., Oldfields, E. W., et. al., N. Engl. J. Med., 352: 897-905 (1991); Findling, J. W., et al., «Diagnosis and differential diagnosis of Cushing's syndrome», Endocrinol. Metab. Clin. North. Am., 30: 729-47 (2001); Orth, D. N., «Cushing's syndrome», N. Engl. J. Med., 332: 791-803 (1995)). В настоящее время отсутствует медицинские доступные стратегии лечения синдрома Кушинга. В специализированных центрах проводят хирургическую резекцию микроаденом гипофиза, секретирующих АСТН, что позволяет достичь общего уровня излечивания примерно в 70-80%, но в случае макроаденом уровень излечивания составляет лишь примерно 30%, а необходимая при этом обширная хирургическая резекция создает значительный риск для окружающей нормальной ткани гипофиза, приводящий к частичному или полному гипопитуитаризму примерно в 80% случаев (Simmons, N. E., et al., «Serum Cortisol response to transphenoidal surgery for Cushing's disease», J. Neurosurg., 95:1-8 (2001); Mampalam, T. J. et al., «Transsphenoidal microsurgery for Cushing's disease: A report of 216 cases», Ann. Intern. Med., 109: 487-93 (1988); и Trainer, P. J. et al., «Transsphenoidal resection in Cushing's disease: undetectable serum cortisol as the definition of successful treatment», Clin. Endocrinol., 38: 73-8 (1993)). Таким образом, имеется потребность в лечении синдрома Кушинга, когда источником АСТН является диссеминированная опухоль гипофиза или эктопический источник, которое было бы эффективным и не создавало риска для пациента.
Соединения, которые связываются с рецепторами АСТН, при сопутствующей сниженной активации секреции кортизола, могут также использоваться при воздействии по оси гипоталамус-гипофиз-надпочечник для инициации преждевременных родов. Преждевременные роды происходят примерно в 7-10% случаев и вносят определенный вклад в существенный процент перинатальной заболеваемости и смертности (McCormick, M. C., «The contribution of low birth weight to infant mortality and childhood morbidity», N Engl J Med., 312: 82-90 (1985)). Профилактика спонтанных абортов и преждевременных родов, а также пролонгированный период беременности у людей желательны по многим причинам. Беременность особенно желательно продлить для того, чтобы (i) повысить вероятность рождения живого ребенка, (ii) снизить частоту осложнений для здоровья, сопровождающих преждевременное рождение ребенка, и (iii) снизить период времени, в течение которого недоношенный ребенок, даже если он здоров, должен в связи с его размерами и жизнеспособностью получать особый интенсивный уход. Все указанные факторы: (i) рождение живого ребенка, (ii) здоровый ребенок и (iii) ребенок, который может вовремя покинуть больницу на попечение родителей, способствуют счастью и процветанию родителей и родственников. Эти факторы также имеют социальное значение, поскольку преждевременные роды несут большую социально-экономическую нагрузку, связанную с уходом за детьми, которые родились в результате очень ранних родов.
Сельское хозяйство и аквакультура становятся рентабельными, когда культивируемые организмы выращиваются с высокой плотностью популяции. Однако у млекопитающих, птиц и рыб такая плотность зачастую приводит к образованию стрессовых гормонов надпочечника с их вредными последствиями, включая ослабление иммунной функции и сниженный рост. Было бы также желательно иметь способ снижения уровней гормонов стресса надпочечника в таких и других состояниях, вызванных длительным стрессом и приводящих к нежелательным изменениям здоровья, например к сниженной иммунной функции и чувствительности к заболеваниям.
Различные композиции и способы могут использоваться для снижения уровня АСТН, например, через посредство определенных рецепторов для аргинин-вазопрессина (AVP). В патенте США No. 6 380 155, зарегистрированном 3 мая 2000 года, описывается использование некоторых композиций с антагонистом рецептора вазопрессина для регуляции высвобождения АСТН. Композиции для лечения АСТН-ассоциированных состояний, которые регулируют уровни АСТН, являются желательными, такие как композиции, которые могут связываться с рецепторами АСТН MC-2R, при снижении или устранении АСТН-индуцированной продукции кортикостероидов, с тем чтобы ослаблять нежелательные состояния, ассоциированные с повышенными уровнями АСТН.
КРАТКОЕ ОПИСАНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Предлагаются различные модифицированные пептиды на основе адренокортикотропного гормона (АСТН) («аналоги АСТН»), которые снижают или устраняют АСТН-индуцированную секрецию кортикостероида в сравнении с немодифицированным АСТН. Предпочтительно, аналоги АСТН также снижают секрецию кортикостероида из мембраны надпочечника в присутствии немодифицированного АСТН.
Соединения-аналоги АСТН предпочтительно включают по меньшей мере аминокислоты 1-24 из немодифицированного АСТН, при наличии замещения одной или нескольких аминокислот. Соединения-аналоги АСТН могут включать одно или несколько замещений аминокислот или усечений аминокислот в сравнении с немодифицированной последовательностью аминокислот человеческого АСТН. Немодифицированный человеческий АСТН представляет собой полипептид, включающий 39 остатков аминокислот в следующей последовательности: N-Ser1-Tyr-Ser-Met-Glu5-His-Phe-Arg-Trp-Gly10-Lys-Pro-Val-Gly-Lys15-Lys-Arg-Arg-Pro-Val20-Lys-Val-Tyr-Pro-Asn25-Gly-Ala-Glu-Asp-Glu30-Ser-Ala-Glu-Ala-Phe35-Pro-Leu-Glu-Phe39-Ac (SEQ ID NO: 1), где N и Ac обозначают амино и карбокси концы молекулы соответственно. Аналоги АСТН могут также включать соединения, которые содержат пептид, имеющий одно или несколько замещений или модификаций в последовательности: N-Ser1-Tyr-Ser-Met-Glu5-His-Phe-Arg-Trp-Gly10-Lys-Pro-Val-Gly-Lys15-Lys-Arg-Arg-Pro-Val20-Lys-Val-Tyr-Pro-Ac (SEQ ID NO: 2), где N и Ac обозначают амино- и карбокси концы молекулы соответственно. Предпочтительные соединения-аналоги АСТН включают по меньшей мере остатки аминокислот 1-19 из hACTH или mACTH, более предпочтительно аминокислотные остатки 1-24 из hACTH или mACTH, при наличии замещения одной или нескольких аминокислот.
Соединения-аналоги АСТН включают соединения, содержащие последовательность АСТН SEQ ID NO: 1 или SEQ ID NO: 2, при наличии одной или нескольких структурных модификаций, которые приводят к достижению одной или более из числа указанных предпочтительных биологических функций аналогов АСТН: (1) снижение секреции кортикостероида мембраной надпочечника в присутствии аналога АСТН в сравнении с немодифицированным АСТН, (2) снижение секреции кортикостероида мембраной надпочечника в присутствии эндогенного АСТН и (3) повышенная аффинность по связыванию MC-2R при сниженной активации рецептора MC-2R в сравнении с немодифицированным АСТН. Примеры предпочтительных замещений аминокислот в АСТН, которые приводят к получению соединений-аналогов АСТН, включают одно или несколько из следующих замещений: (1) замещение одного или нескольких аминокислотных остатков в положениях 1-13, которые сохраняют аминокислоты в положениях 6-9 и/или усиливают или сохраняют связывание с MC-2R, (2) замещение одного или нескольких аминокислотных остатков в положениях 15-18, которое предотвращает или антагонизирует энзиматическое расщепление в этих позициях, (3) замещение одного или нескольких аминокислотных остатков в положениях 15-18, так что аналог АСТН не будет включать соседствующие аминокислотные остатки с основными боковыми цепями в положениях 15-18, (4) замещение или усечение одного или нескольких аминокислотных остатков в положениях 20-24, которое продлевает период полувыведения из сыворотки аналога АСТН, (5) замещение одного или нескольких аминокислотных остатков в положениях 20-36, которое приводит к образованию аналога АСТН, обладающего способностью снижать секрецию кортикостероида мембраной надпочечника в присутствии аналога АСТН, в сравнении с немодифицированным АСТН пептидом, (6) замещение или предпочтительно усечение одного или нескольких аминокислотных остатков в положениях 25-39, которое приводит к образованию соединений-аналогов АСТН, обладающих желательными свойствами по высвобождению, или (7) усечение аминокислотных остатков 25-39, в результате которого аминокислотный остаток в положении 24 образует карбокси конец молекулы.
Соединения-аналоги АСТН предпочтительно связываются с рецепторами АСТН, такими как рецептор меланокортина 2 (MC-2R) в мембране надпочечника. Предпочтительно, соединения-аналоги АСТН не активируют или слабо активируют клетки, экспрессирующие MC-2R, и ингибируют или снижают действие немодифицированных эндогенных АСТН.
В первом варианте осуществления настоящего изобретения различные соединения-аналоги АСТН могут включать одно или несколько замещений аминокислот или их усечение в сравнении с немодифицированной аминокислотной последовательностью человеческого АСТН. Например, композиция, включающая выделенный аналог пептида АСТН, может включать пептид SEQ ID NO: 2, при наличии по меньшей мере одного из следующих замещений аминокислот:
а) замещение остатка Pro в положении 19 в SEQ ID NO: 2 аминокислотой Trp; или
b) замещение одной или нескольких аминокислот остатками, выбранными из аминокислотных остатков 16-18 в SEQ ID NO: 2, так что аминокислотные остатки 16, 17 и 18 в аналоге АСТН не включают два соседствующих остатка аминокислот, выбранных из группы, состоящей из: Lys и Arg; и один или нескольких аминокислотных остатков, замещенных в положениях 16, 17 или 18 в SEQ ID NO: 2, выбирают из группы, состоящей из: Lys, Arg, Gln, Gly, Ala, Val, Leu, Ile и аналога аминокислоты, содержащей алкильную боковую цепь (такого как Nle). Необязательно аналог пептида АСТН может включать по меньшей мере один Ala, Gly или другую аминокислоту с алкильной боковой цепью (например, Val, Leu, Ile аминокислотный аналог, включающий алкильную боковую цепь, такой как Nle) и по меньшей мере один остаток Arg, замещенный по любым двум положениям аминокислот в положениях 15, 16, 17 или 18 в SEQ ID NO: 2. Аналог АСТН может необязательно состоять по существу из последовательности SEQ ID NO: 2, включающей следующие замещения аминокислот: остаток Pro в положении 19 в SEQ ID NO: 2 замещается аминокислотой Trp; аминокислота в положении 15 в SEQ ID NO: 2 выбирается из группы, состоящей из Lys, Ala и Gln; и аналог пептида АСТН может включать одно или несколько замещений аминокислот, выбранных из аминокислотных остатков 16-18 в SEQ ID NO: 2, так что аминокислотные остатки 16, 17 и 18 в аналоге АСТН не включают двух соседствующих аминокислотных остатков, выбранных из группы, состоящей из Lys и Arg. Предпочтительно, аналог пептида АСТН включает аминокислотную последовательность SEQ ID NO: 4 по аминокислотным остаткам 6, 7, 8 и 9. Аналог пептида АСТН может также включать аминокислотную последовательность SEQ ID NO: 12 по аминокислотным остаткам 15-19.
Первый вариант осуществления изобретения также включает аналоги АСТН, содержащие пептид SEQ ID NO: 1 с наличием по меньшей мере одного аминокислотного замещения, такого как замещение аминокислотного остатка в положении 9, 26, 30 или 36 в SEQ ID NO: 1. Аналог пептида АСТН может также включать пептид SEQ ID NO: 1 с наличием по меньшей мере одного из следующих замещений аминокислот:
а) замещение остатка Pro в положении 19 в SEQ ID NO: 1 аминокислотой Trp; или
b) замещение одной или нескольких аминокислот остатками, выбранными из аминокислотных остатков 16-18 в SEQ ID NO: 1, так что аминокислотные остатки 16, 17 и 18 в аналоге АСТН не включают двух соседствующих аминокислотных остатков, выбранных из группы, состоящей из: Lys и Arg; и один или несколько аминокислотных остатков, замещенных в положениях 16, 17 или 18 SEQ ID NO: 2, выбирают из группы, состоящей из: Lys, Arg, Gln, Gly, Ala, Val, Leu, Ile и Nle (или другого аминокислотного аналога с алкильной боковой цепью).
Другие предпочтительные аналоги пептидов АСТН включают модификации пептидов SEQ ID NO: 1 или SEQ ID NO: 2, так что аналог пептида АСТН включает аминокислотную последовательность SEQ ID NO: 6 по аминокислотным остаткам 15-19. Аналоги пептидов АСТН также включают усечения по одному или нескольким пептидам, аналог АСТН также включат усечение по аминокислотным остаткам 25-39 в SEQ ID NO: 1. Аналоги пептидов АСТН с SEQ ID NO: 20 являются особенно предпочтительными.
В некоторых вариантах осуществления настоящего изобретения введение аналога пептида АСТН снижает АСТН-индуцированную продукцию кортикостерона мембраной надпочечника в тесте индукции кортикостероида в сыворотке in vitro по меньшей мере на 10% и предпочтительно до 100%, в сравнении с пептидом SEQ ID NO: 2. Например, во втором варианте аналоги АСТН представляют собой модифицированные пептиды АСТН, которые функционируют по снижению секреции кортикостероида мембраной надпочечника в присутствии аналога АСТН в сравнении с немодифицированным АСТН.
В некоторых вариантах осуществления настоящего изобретения введение аналога пептида АСТН в тесте на ингибирование кортикостероидов в сыворотке in vivo снижает АСТН-индуцированную секрецию кортикостероида по меньшей мере на 10%. В третьем варианте аналоги АСТН представляют собой модифицированные пептиды АСТН, которые функционируют по снижению секреции кортикостероида мембраной надпочечника в присутствии эндогенного АСТН.
В некоторых вариантах осуществления настоящего изобретения предлагаются композиции, которые включают выделенный аналог пептида АСТН по SEQ ID NO: 2 с наличием по меньшей мере одного аминокислотного замещения, где указанный аналог пептида АСТН связывается с SEQ ID NO: 2 из мембраны надпочечников и вытесняет его. Связывание пептида может быть выявлено и измерено в тесте на конкурентное связывание с мембраной надпочечника в бессывороточной среде in vitro. Например, в четвертом варианте аналоги пептидов АСТН представляют собой модифицированные пептиды АСТН, которые функционируют по связыванию с рецепторами АСТН надпочечника, таким как рецептор MC-2R, предпочтительно с повышенной аффинностью по связыванию с MC-2R и со сниженной способностью к активации рецептора MC-2R в сравнении с немодифицированным АСТН. Предпочтительно, аналог пептида АСТН может связываться с пептидом SEQ ID NO: 2 из мембраны надпочечника и вытеснять его, где связывание пептида измеряют в тесте на конкурентное связывание в бессывороточной среде с мембраной надпочечника in vitro. Наиболее предпочтительно, аналог пептида АСТН связывается с MC-2R из мембраны надпочечника по меньшей мере с увеличенной в два раза аффинностью, чем пептид SEQ ID NO: 2.
В некоторых вариантах осуществления настоящего изобретения аналог пептида АСТН снижает АСТН-индуцированную продукцию кортикостерона мембраной надпочечника в тесте на ингибирование функции надпочечника в бессывороточной среде in vitro. Например, в пятом варианте осуществления изобретения соединения-аналоги АСТН могут снижать индукцию кортикостероида немодифицированным АСТН в эксплантатах ткани in vitro. Аналоги АСТН включают пептиды, которые снижают АСТН-индуцированную продукцию кортикостерона мембраной надпочечника в тесте на ингибирование надпочечника в бессывороточной среде in vitro.
В шестом варианте осуществления настоящего изобретения предлагаются аналоги АСТН с увеличенным периодом полувыведения из организма. Аналоги АСТН с увеличенным периодом полувыведения из организма могут быть идентифицированы как имеющие первую активностью, измеряемую по концентрации сывороточного кортикостероида, выявляемого in vivo, которая выше, чем вторая активность, измеряемая по бессывороточной концентрации кортикостероида, выявляемого по активности in vitro, где активность in vivo измеряют в рамках теста на ингибирование секреции кортикостероида надпочечником в сыворотке, в соответствии с примером 2, а активность in vitro определяют в тесте на ингибирование секреции кортикостероида мембраной надпочечника в бессывороточной среде in vitro, в соответствии с примером 4.
В седьмом варианте осуществления настоящего изобретения предлагаются способы скрининга аналогов АСТН, которые полезны по блокированию избытка АСТН, при поддержании тонуса надпочечника. Различные аналоги АСТН могут быть получены и введены пациенту для оценки индукции кортизона in vivo.
В восьмом варианте настоящее изобретение относится к фармацевтическим композициям, включающим аналоги АСТН и их введение субъекту по способу, соответствующему лечению симптомов, связанных с АСТН-ассоциированным состоянием. Приведенные в настоящем описании аналоги АСТН могут включаться в состав фармацевтических композиций для лечения АСТН-ассоциированных состояний, таких как сверхэкспрессия АСТН у людей или животных. Рассматриваются также способы получения аналогов АСТН и основанных на них фармацевтических композиций, содержащих аналоги АСТН. Например, в одном аспекте предлагаются способы скрининга класса аналогов АСТН для соединений, используемых при блокировании избытка АСТН с поддержанием тонуса надпочечника.
Соединения-аналоги АСТН могут использоваться для лечения заболеваний, опосредованных уровнями АСТН, таких как состояния, отзывчивые на модуляцию рецепторов АСТН (таких как MC-2R). Описываются также соединения, используемые для регуляции секреции кортикостероида или уровня кортикостероида. Соединения-аналоги АСТН могут вводиться для лечения состояний, связанных с регуляцией уровня АСТН, например для снижения эффектов высоких уровней АСТН у пациентов, при поддержании функции надпочечника в состоянии тонуса. Композиции с аналогом АСТН используются, например, при лечении АСТН-ассоциированных состояний, таких как синдром Кушинга, ослабленный иммунитет, возникающий в результате гиперсекреции кортикостероида, инициация преждевременных родов (например, по оси гипоталамус-гипофиз-надпочечник) и родственные состояния. В одном аспекте получают различные аналоги АСТН и вводят пациенту для оценки индукции кортизона in vivo. В другом аспекте предлагаются способы лечения животных, такие как способы снижения гормонов стресса для улучшения состояния здоровья сельскохозяйственных и применяемых в аквакультуре видов, выращиваемых с высокой плотностью популяций.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
На прилагаемых чертежах указано следующее.
На фиг.1 показан график, демонстрирующий уровни кортикостерона, измеряемые in vivo после инъекции различных соединений-аналогов АСТН, в сравнении с уровнем кортикостерона, измеряемым после введения немодифицированного АСТН.
На фиг.2 показан график, сравнивающий уровни кортикостерона in vivo, индуцированные введением немодифицированного АСТН, аналога АСТН в сочетании с немодифицированным АСТН, аналога АСТН с последующим отдельным введением немодифицированного АСТН и одного аналога АСТН.
На фиг.3 показан график, сравнивающий результаты конкурентного теста на связывание с рецепторами АСТН надпочечника для немодифицированного АСТН и соединения-аналога АСТН.
На фиг.4 показан график, сравнивающий уровни кортикостерона in vitro, индуцированные введением в изолированные мембрану надпочечника немодифицированного АСТН, аналога АСТН в сочетании с немодифицированным АСТН и одного аналога АСТН.
На фиг.5 показан график, сравнивающий активности in vivo и in vitro различных соединений-агонистов АСТН по индукции кортикостерона, в сравнении с активностью немодифицированного АСТН, принятого за стандарт (то есть 100%).
ПОДРОБНОЕ ОПИСАНИЕ
Если особо не указано иное, все технические и научные термины, применяемые в описании, имеют общепринятые значения, известные специалистам в данной области, к которой относится настоящее изобретение. В случае несовпадения, настоящий документ, включая приведенные определения, будет определяющим. Предпочтительные способы и материалы описаны ниже, хотя способы и материалы, аналогичные или эквивалентные приведенным в настоящем описании, могут использоваться в практике осуществления настоящего изобретения или при проведении тестов в соответствии с настоящим изобретением. Все публикации, патентные заявки, патенты и другие ссылки, процитированные в описании, включены в него полностью в качестве ссылок. Материалы, методы и примеры, приведенные в описании, являются лишь иллюстративными и не носят ограничивающий характер.
В контексте настоящего описания термин «немодифицированный адренокортикотропный гормон» («немодифицированный АСТН») обозначает пептидный гормон, продуцируемый передней долей гипофиза, который стимулирует кору надпочечника по секреции глюкокортикоидных гормонов, которые помогают клеткам синтезировать глюкозу в процессе глюконеогенеза, катаболизировать белки, мобилизовать свободные жирные кислоты и ингибировать воспаление при аллергических ответах. Одним таким гормоном является кортикостероид, которые регулирует метаболизм углеводов, жиров и белков.
Термин «кортикостероид» в контексте настоящего описания включает человеческий кортикостероид кортизон и кортикостероид грызунов - кортикостерон.
Термин «примерно», используемый применительно к количеству, включает вариации в приведенных количествах, которые эквивалентны цитируемому количеству, например количеству, которое несущественно отличается от приведенного количества для указанной цели или функции.
Номенклатура «P(x-y)» в контексте настоящего описания, где P обозначает наименование полипептида и х и у обозначают целые числа, относится к аминокислотной последовательности, состоящей из последовательности аминокислот от положения (х) до положения (у) полипептида, называемого «Р». Например, «hACTH(1-24)» относится к полипептиду из 24 последовательных аминокислот, состоящих из остатков 1-24 от амино конца человеческого пептида АСТН. Термин «mACTH» относится к мышиному АСТН. В частности, hACTH(1-24) и mACTH(1-24) представляют собой идентичные пептидные последовательности.
Номенклатура «aXb», где a и b представляют собой однобуквенные сокращения, принятые для аминокислот, и Х обозначает число, относится к замещению аминокислоты «a» в положении «Х» в немодифицированном пептиде АСТН аминокислотой «b». Например, выражение «(V26F, E30K)mACTH» относится к молекуле мышиного АСТН, состоящей из 39 аминокислот, которая была модифицирована путем замещения аминокислотой Phe аминокислоты Val в 26 положении на амино конце молекулы и замещения аминокислотой Lys аминокислоты Glu в положении 30 на амино конце молекулы. Аналогично, номенклатура «αβχX-Yδεφ», где α, β, χ, δ, ε и φ обозначают однобуквенные сокращения для аминокислот и X и Y обозначают числа, относится к замещению последовательных аминокислот «αβχ» в положениях X-Y аминокислотами «δεφ».
Соединения-аналоги АСТН включают соединения, содержащие последовательности АСТН, при наличии в них одной или нескольких структурных модификаций, которые обеспечивают одну или несколько указанных ниже предпочтительных биологических функций аналога АСТН: (1) снижение секреции кортикостероида мембраной надпочечника в присутствии аналога АСТН в сравнении с немодифицированным АСТН, (2) снижение секреции кортикостероида мембраной надпочечника в присутствии эндогенного АСТН, (3) повышенную аффинность по связыванию MC-2R при сниженной активации рецептора MC-2R в сравнении с немодифицированным АСТН. Считается, что соединения-аналоги АСТН действуют посредством связывания с рецептором меланокортина 2 (MC-2R), при слабой активации клеток, экспрессирующих MC-2R, и блокировании действия эндогенного АСТН на рецептор MC-2R.
Примеры предпочтительных замещений аминокислот в АСТН, которые приводят к образованию соединений-аналогов АСТН, обладающих одной или несколькими желательными функциями, включают: (1) замещение одного или нескольких аминокислотных остатков в положениях 1-13, которые сохраняют аминокислоты в положениях 6-9 и/или усиливают или сохраняют связывание с MC-2R, (2) замещение одного или нескольких аминокислотных остатков в положениях 15-18, которое предотвращает или антагонизирует энзиматическое расщепление по этим положениям, (3) замещение одного или нескольких аминокислотных остатков в положениях 15-18, для которых не характерно соседствующее положение двухосновных аминокислот, (4) замещение или усечение одного или нескольких аминокислотных остатков в положениях 20-24, которое приводит к увеличению периода полувыведения из сыворотки аналога АСТН, (5) замещение или предпочтительно усечение одного или нескольких аминокислотных остатков в положениях 25-39, которое обеспечивает получение соединений-аналогов АСТН с желательными свойствами по высвобождению или (6) усечение аминокислотных остатков 25-39, в результате которого аминокислотный остаток в положении 24 образует карбокси конец молекулы.
СОЕДИНЕНИЯ-АНАЛОГИ АСТН
В первом варианте осуществления настоящего изобретения различные соединения-аналоги АСТН могут включать замещения или усечение одной или нескольких аминокислот в сравнении с немодифицированной аминокислотной последовательностью человеческого АСТН. Немодифицированный человеческий АСТН представляет собой пептид, который включает 39 аминокислотных остатков в следующей последовательности: N-Ser1-Tyr-Ser-Met-Glu5-His-Phe-Arg-Trp-Gly10-Lys-Pro-Val-Gly-Lys15-Lys-Arg-Arg-Pro-Val20-Lys-Val-Tyr-Pro-Asn25-Gly-Ala-Glu-Asp-Glu30-Ser-Ala-Glu-Ala-Phe35-Pro-Leu-Glu-Phe39-Ac (SEQ ID NO. 1) («hACTH»), где N и Ac обозначают амино и карбокси концы молекулы соответственно. АСТН(1-24) консервируется, так что АСТН(1-24) найден у большинства хордовых, включая человеческие АСТН(1-24), и имеет следующую пептидную последовательность: N-Ser1-Tyr-Ser-Met-Glu5-His-Phe-Arg-Trp-Gly10-Lys-Pro-Val-Gly-Lys15-Lys-Arg-Arg-Pro-Val20-Lys-Val-Tyr-Pro-Ac (SEQ ID NO: 2) (а также идентичен на участке 1-24 мышиному АСТН («mACTH(1-24)»), где N и Ac обозначают амино- и карбокси концы молекулы соответственно.
Соединения-аналоги АСТН могут включать по меньшей мере аминокислотные остатки 1-19, более предпочтительно аминокислотные остатки 1-24 из hACTH (SEQ ID NO: 1), при наличии замещения одной или нескольких аминокислот. Предпочтительные соединения-аналоги АСТН включают SEQ ID NO: 2, модифицированную за счет замещения одной или нескольких аминокислот. Соединения-аналоги АСТН включают такие соединения, которые включают последовательности АСТН, при наличии одной или нескольких структурных модификаций, которые обеспечивают наличие одной или нескольких указанных ниже предпочтительных биологических функций аналога АСТН: (1) снижение секреции кортикостероида мембраной надпочечника в присутствии аналога АСТН в сравнении с немодифицированным АСТН, (2) снижение секреции кортикостероида мембраной надпочечника в присутствии эндогенного АСТН и (3) повышенную аффинность по связыванию с MC-2R при сниженной активации рецептора MC-2R в сравнении с немодифицированным АСТН.
Особенно предпочтительные соединения-аналоги АСТН содержат замещение одной или нескольких приведенных ниже аминокислот в сравнении с немодифицированной последовательностью человеческого АСТН: (1) замещение одного или нескольких аминокислотных остатков в положениях 1-13, которые сохраняют аминокислоты в положениях 6-9, (2) замещение одного или нескольких аминокислотных остатков в положениях 15-18, которое предотвращает или антагонизирует ферментативное расщепление по этим положениям, (3) замещение одного или нескольких аминокислотных остатков в положениях 15-18, для которых не характерно соседствующее положение двуосновных аминокислот, (4) замещение или усечение одного или нескольких аминокислотных остатков в положениях 20-24, которое приводит к увеличению периода полувыведения из сыворотки аналога АСТН и (5) замещение или предпочтительно усечение одного или нескольких аминокислотных остатков в положениях 25-39, которое обеспечивает создание соединений-аналогов АСТН с увеличенным периодом полувыведения из сыворотки в сравнении с немодифицированным АСТН или в сравнении с другими соединениями-аналогами АСТН.
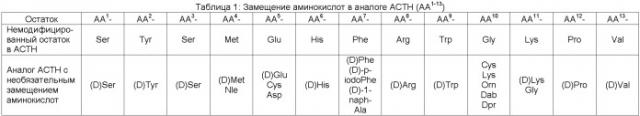
Аналог АСТН предпочтительно включает полипептид, описываемый приведенной ниже формулой (I):
(I) N-(AA1-13)-(AA14)-(AA15-18)-(AA19)-Ac,
где N- и Aс- указывают амино конец и карбокси конец полипептида соответственно, (AA1-13)- указывает первую серию из тринадцати последовательных аминокислот или аминокислотных аналогов, (AA14)- указывает аминокислотный остаток, присоединенный к карбокси концу первой серии, (AA15-18)- указывает вторую серию из четырех последовательных аминокислот, присоединенных к карбокси концу (AA14)-, (AA19)- обозначает аминокислотный остаток, присоединенный к карбокси концу второй серии.
Аналог АСТН формулы (I) предпочтительно также включает часть более крупной молекулы, присоединенную к карбокси концу (AA19)-Ас части. Аналог АСТН может также включать дополнительные аминокислоты, присоединенные к карбокси концу (Ас) молекулы формулы (I). Наиболее предпочтительно, аналоги АСТН включают в целом пять дополнительных аминокислот, присоединенных к Ас части молекулы формулы (I), и содержат в совокупности по меньшей мере 24 аминокислоты в составе аналога АСТН.
Аналоги АСТН могут включать аминокислотные последовательности немодифицированного АСТН, соответствующие формуле (I), предпочтительно включающие одно или несколько аминокислотных замещений. Дополнительные аминокислоты или аналоги аминокислот предпочтительно присоединяются к карбокси концу (AA19)- остатка молекулы формулы (I).
(AA1-13)- часть молекулы формулы (I) обозначает последовательность из тринадцати аминокислот формулы (II):
(II) -AA1-AA2-AA3-AA4-AA5-AA6-AA7-AA8-AA9-AA10-AA11-AA12-AA13-,
которая представляет собой немодифицированную аминокислотную последовательность АСТН, описанную во втором ряду таблицы 1, при необязательном включении в нее одного или нескольких аминокислотных замещений, приведенных в третьем ряду в таблице 1. (AA1-13)- часть немодифицированного человеческого АСТН имеет последовательность Ser-Тyr-Ser-Met-Glu-His-Phe-Arg-Trp-Gly-Lys-Pro-Val (SEQ ID NO. 3). Предпочтительно -AA6-AA7-AA8-AA9- часть молекулы формулы (II) имеет немодифицированную аминокислотную последовательность His-Phe-Arg-Trp (SEQ ID NO: 4), при необязательном наличии замещения одним или несколькими (D) аминокислотными аналогами.
В таблице 1 обозначение (D) относится к (D) энантиомеру указанных аминокислот: Nle относится к аминокислотному аналогу норлейцина или к другой аминокислоте с алкильной боковой цепью; Orn относится к орнитину или другой модифицированной аминокисло