Устройство и способ определения инъекционной точки для целевой доставки лекарственного средства
Иллюстрации
Показать всеГруппа изобретений относится к медицине. Устройство для определения инъекционной точки в области сосуда, через который осуществляют инъекцию лекарственного средства в целевую области организма пациента, содержит: идентификационное средство для идентификации топологии сосудов сосудистого дерева, питающих целевую область; средство определения потока для определения процентного содержания лекарственного средства, доставляемого к цели после инъекции в различные потенциальные инъекционные точки в сосудистом дереве; средство выборки для селекции как оптимальной инъекционной точки потенциальной инъекционной точки, приводящей к более высокому процентному содержанию лекарственного средства, доставленного к цели. Другой вариант устройства дополнительно предполагает наличие дисплейного средства для отображения сосудистого дерева и представления оптимальной инъекционной точки. Способ включает: предварительную идентификацию топологии сосудов сосудистого дерева, питающих целевую область; определение процентного содержания лекарственного средства, доставленного к целевой области после инъекции в различные потенциальные инъекционные точки сосудистого дерева; селекцию как оптимальной инъекционной точки, точки, приводящей к более высокому процентному содержанию лекарственного средства, доставленного к цели. Данная группа изобретений позволит количественно определить и визуализировать как эффективность лечения опухоли, так и негативное действие на здоровые ткани поблизости. 3 н. и 10 з.п.ф-лы, 6 ил.
Реферат
Настоящее изобретение относится к устройству и соответствующему способу определения инъекционной точки для целевой доставки лекарственного средства в организм пациента путем инъекции лекарственного средства в сосуд, питающий целевую область, включающую цель. Далее настоящее изобретение относится к компьютерной программе реализации указанного способа на компьютере.
Химоэмболизация представляет собой эффективной способ лечения нерезектабельных опухолей с помощью минимально-инвазивного средства. Под контролем рентгеновских лучей наконечник катетера направляют в артерии, которые питают опухоль. Затем химоэмболизирующий материал инъекцируют через катетер в опухоль. В результате химиотерапия непосредственно доставляется в опухоль и поток крови к опухоли блокируется.
Для того чтобы определить местонахождение главных питающих артерий опухоли, контрастное вещество инъекцируют в кандидатные сосуды и получают серии DSA (числовая субтракционная ангиография) изображений. При последующей визуальной инспекции распространения контрастного вещества в сосудистом дереве катетер направляют в оптимальную инъекционную точку. Так как данный подход является субъективным и основан только на методе проб и ошибок, некоторые рентгенографические наблюдения необходимы до тех пор, пока представляемая оптимальная инъекционная точка не будет достигнута.
Если место целевой доставки лекарственного средства не будет тщательно выбрано, эмбол может разместиться в неправильном месте и лишить нормальную ткань ее кровоснабжения, что приведет к гибели здоровых клеток. Следовательно, это является критическим для инъекции химоэмболизирущего материала в артерии, питающие преимущественно опухоль, в то же время с сохранением большей части здоровой ткани.
До настоящего времени отсутствует функциональная поддержка планирования вмешательств, основанная на транскатетерной доставке лекарственного средства. Кроме того, обычная визуальная инспекция распространения контрастного вещества позволяет лицу, осуществляющему вмешательство, в основном, определять имеющееся местоположение доставки контрастного вещества. Следовательно, управление движением катетера для исправления инъекционной точки лекарственного средства превращается в процедуру проб и ошибок.
US 5919135 раскрывает способ определения дозы лекарственного средства и избежания того, что лекарственное средство снова покинет опухоль или что лекарственное средство распространится по венозной системе. Предлагается применение места на участке изображения опухоли как инъекционной точки. Однако не применяется (объективного) измерения для определения данной инъекционной точки и не предлагается лучшая инъекционная точка для врачей. Паттерны потока используют для определения количества лекарственного средства, которое должно было быть инъекцировано и для контроля диффузии таких лекарственных средств в венозную систему. Но не описано, как используются паттерны потока. Измерение кровотока выполняют путем инфузии, но характеристики потока не применяют для определения инъекционных точек.
Задачей настоящего изобретения является предоставление устройства и способа, которые предоставляют лицу, осуществляющему вмешательство, объективное и количественное определение потенциальных инъекционных точек лекарственного средства вместо полагания на его субъективное впечатление на основе визуальной инспекции DSA серий. Дальнейшей задачей является то, что возможно с помощью устройства и способа по изобретению количественно определить и визуализировать как эффективность лечения опухоли, так и негативное действие на здоровые ткани поблизости.
Задачи, достигнутые согласно настоящему изобретению с помощью устройства по п.1, включают:
идентификационное средство для идентификации топологии сосудов сосудистого дерева, питающих указанную целевую область;
средство определения потока для определения процентного содержания лекарственного средства, доставляемого к указанной цели после инъекции в различные потенциальные инъекционные точки в указанном сосудистом дереве;
средство выборки для селекции как оптимальной инъекционной точки потенциальной инъекционной точки, приводящей к более высокому процентному содержанию лекарственного средства, доставленного к указанной цели.
Соответствующий способ определен в п.13. Компьютерная программа, включает закодированное программное средство для выполнения компьютером стадий указанного способа, где указанная компьютерная программа, выполняемая на компьютере, определена в п.14. Предпочтительные варианты осуществления по настоящему изобретению определены в зависимых пунктах.
В соответствии с настоящим изобретением предлагается объективная оценка потенциальных инъекционных точек лекарственного средства, которая возможна всего лишь при единственной инъекции контрастного вещества. В результате информацию об оптимальной инъекционной точке или в предпочтительном варианте осуществления путеводную карту оптимальной инъекционной точки для целевой доставки лекарственного средства получают незамедлительно. Вследствие планомерного направления потребление токсичного контрастного вещества и продолжительности обработки рентгеновскими лучами вещества и пациентов минимизируется и повышается удобство в использовании.
Изобретение основано на идее определения всех потенциальных инъекционных точек лекарственного средства, то есть сегментов сосудистого дерева с объективным и количественным измерением для того, чтобы обеспечить поддержку решения по целевой доставке лекарственного средства и для обеспечения планомерного направления для оптимального места. Для этой цели процентное содержание инъецированного лекарственного средства, например химоэмболизирующего материала, доставляемого к цели, например в опухоль, определяют для различных потенциальных инъекционных точек. Путем использования определенного процентного содержания оптимальную инъекционную точку выбирают как инъекционную точку, имеющую наивысшее процентное содержание, то есть, если лекарственное средство инъецируют в оптимальную инъекционную точку, эффективность доставки лекарственного средства к цели максимизируется и здоровая ткань повреждается в минимальном размере.
Кроме того, в предпочтительном варианте осуществления дополнительно определяют количество лекарственного средства, действующего на здоровую ткань. Эта информация может быть получена отдельно от процентного содержания лекарственного средства, доставленного к цели, но также может быть прямо получена из процентного содержания лекарственного средства, доставленного к цели. При определении количества лекарственного средства, действующего на здоровую ткань, принимают в расчет, что повреждение, вызываемое лекарственным средством в здоровой ткани, зависит от типа ткани или органа и, конечно, от типа лекарственного средства. Следовательно, также оценивают риск для здоровья, связанный с потенциальными инъекционными точками. Даже если только незначительное процентное содержание контрастного вещества неправильно введено в несоответствующую область ткани, это может вызвать разрушительное повреждение жизненно важных органов.
В предпочтительном варианте осуществления объемные скорости потока в конечных сегментах сосудистого дерева измеряют для того, чтобы определить количество лекарственного средства, введенного в целевую область, питаемую сосудистым деревом, или артерию, питающую указанное сосудистое дерево. Далее путем обратной проекции объемных скоростей потока в потенциальные инъекционные точки лекарственного средства может быть определена пропорция лекарственного средства, которая должна быть введена в цель.
В соответствии с дальнейшим вариантом осуществления объемные скорости потока взвешивают с помощью весовых факторов, указывающих, какого размера лекарственные повреждения ткани расположены на конце соответствующего конечного сегмента сосудистого дерева. Низкий весовой фактор указывает, что лекарственное средство непосредственно не влияет на ткань, тогда как весовой фактор, близкий к 1, указывает, что лекарственное средство разрушает клетки. Следовательно, весовые факторы зависят от лекарственного средства, применяемого в процедуре, и ткани, на которую воздействует лекарственное средство. Биологическое воздействие определенного лекарственного средства на определенную ткань показано ниже в таблицах. Весовой фактор для ткани с наивысшим воздействием равен единице. Другие вычислены соответствующим образом.
Предпочтительно объемные скорости потока для каждого конечного сегмента сосудистого дерева взвешивают с помощью соответствующего весового фактора ткани, которая питается этой отдельной артерией. Затем определяют путь от конечного сегмента до инъекционной точки. Взвешенную скорость потока оценивают для каждой ветви этого пути. Тем самым устанавливают различие между концевым сегментом, питающим опухоль или здоровую ткань. Эта информация является обратнораспространяемой, то есть с таким же успехом оценивает каждую вышележащую ветвь.
В соответствии с дальнейшим предпочтительным вариантом осуществления по изобретению саму цель, например опухоль или полную целевую область, то есть область, окружающую цель, включая саму цель и окружающие ткани, сегментируют. В последнем случае все сегменты целевой области, питаемые конечным сегментом сосудистого дерева, определяют для каждого конечного сегмента. Например, для печени число и принципиальное местоположение таких различных сегментов хорошо известно.
Цель предпочтительно идентифицируют путем взаимодействия с пользователем, например, путем щелчка мышкой на опухоль. Однако, в общем, автоматическая идентификация цели, например, путем анализа структуры ткани также осуществима. Но так как идентификации цели является очень легкой для врача и щелчок мышкой или перетаскивание вокруг большей области является легкой процедурой, ручная селекция является предпочтительной.
В результате получают определение местоположения оптимальной инъекционной точки. Это местоположение может быть отображено на визуальном изображении сосудистого дерева. Далее могут быть отображены процентное содержание лекарственного средства, доставляемого в различные сегменты указанного сосудистого дерева, или соответствующие результаты оценочного критерия.
Хотя единственная инъекция контрастного вещества должна быть достаточной, возможно также несколько инъекций. Если контрастное вещество инъецируется в нескольких местах, эффективность, полученная в результате всех инъекций, может объединяться. В результате также отображается информация о всех ветвях, которые не были видимы в результате одной отдельной инъекции контрастного вещества. Дополнительно, информация становится более надежной, так как заданная эффективность для отдельных ветвей состоит из нескольких наблюдений. Результаты, полученные для инъекционных точек, наиболее близких к отдельной ветви, являются более надежными, чем другие и, таким образом должны больше влиять на оценку потенциальных инъекционных точек.
Это может быть сделано путем автоматического определения меры неопределенности для каждого видеоденситометрического измерения. Эта мера может быть затем использована для взвешивания различных наблюдений, куда относят более надежные результаты более сильных весовых факторов.
В соответствии с дополнительным предпочтительным вариантом выполнения изобретения средство определения потока дополнительно включает взвешивающее средство для взвешивания указанных объемных скоростей потока посредством факторов неопределенности, указывающих, какой является неопределенность измеряемой объемной скорости потока.
Теперь изобретение будет объяснено более детально со ссылкой на чертежи, на которых:
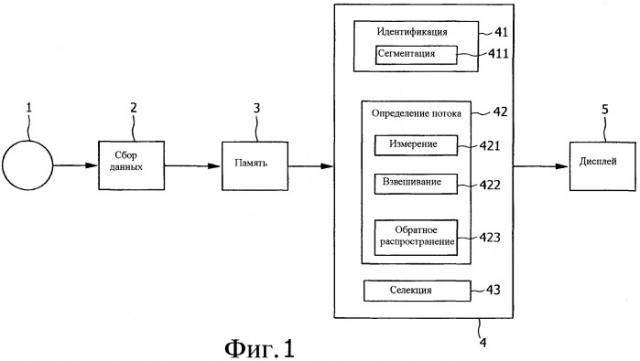
Фиг.1 показывает функциональную схему устройства по изобретению;
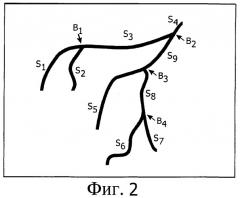
Фиг.2 показывает иллюстрацию топологии сегментированного сосудистого дерева;
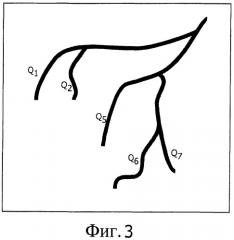
Фиг.3 показывает иллюстрацию измерения объемных скоростей потока в концевых сегментах сосудистого дерева;
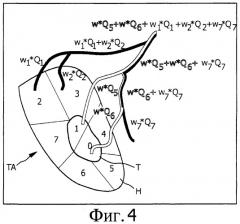
Фиг.4 показывает обратное распространение взвешенных объемных скоростей потока к потенциальным инъекционным точкам лекарственного средства;
Фиг.5 показывает эффективность инъекции лекарственного средства в соответствующие сосудистые сегменты;
Фиг.6 показывает путеводную карту оптимального места целевой доставки лекарственного средства.
Вариант осуществления устройства по настоящему изобретению для основанного на рентгеновском излучении определения потенциальных мест для целевой доставки лекарственного средства схематически показан на функциональной схеме Фиг.1. Перед тем как может быть определена оптимальная инъекционная точка для инъекции лекарственного средства в организм пациента 1 данные изображения пациента 1 должны быть получены с помощью средства получения данных изображения 2, такого как рентгеновское устройство для 3D ротационной ангиографии (3DRA) или других медицинских диагностических средств изображения, подобных СТ (КТ, компьютерная томография), MR (магнитно-резонансная томография) или ультразвуковому устройству. Полученные данные изображения обычно хранят в памяти 3. Конечно, последующая обработка данных устройством для обработки данных 4 может быть проведена непосредственно после получения данных или хранения данных, но она может быть также сделана в любое время впоследствии.
Для того чтобы оценить воздействие химоэмболизации во время динамического получения данных, показывающих транспортировку контрастного вещества в сосудистое дерево, анализируют распределение контрастного вещества в сосудистом дереве в целевой области. Для этой цели топологию сосудистого дерева анализируют сначала с помощью идентификационного блока 41. В частности, определение сосудистых конечных точек и разветвлений является важным для последующей обработки. Также может быть идентифицирована указанная цель, например опухоль. В предпочтительном варианте осуществления дополнительно сегментируют здоровую ткань на сегменты, питаемые одной и той же артерией. Такая сегментированная сосудистая топология, которая может быть получена из полученных данных изображения, показана на Фиг.2, в которой указаны ряд разветвлений B1-B4 и ряд сегментов S1-S9. Алгоритм анализа топологии сосудистого дерева для планарного получения данных, подобных рентгенографическим, например, описан у С.Kirbas и F. К. Н. Quek "A Review of Vessel Extraction Techniques and Algoritms", Vision Interfaces and Systems Laboratory (VISLab), Department of Computer Science and Engineering, Wright State University, Dayton, Ohio, November 2002. Другой алгоритм описан у Н. Schmitt с сотр. "An X-ray-based method for the determination of the contrast agent propagation in 3-D vessel structures", IEEE Transactions on Medical Imaging, Vol.21, No.3, March 2002.
Предпочтительно сосудистое дерево сегментируют путем трехмерной сегментации в сегментационном блоке 411. Затем полученное 3D сосудистое дерево делят на сегменты путем увеличения участков. Начиная от зародышевой точки все связанные воксели детектируют. Затем проверяют, все ли воксели этой генерации являются связанными. Если дело обстоит именно так, все воксели принадлежат к одному и тому же сегменту. В случае разветвления сосудистого дерева генерация дробится на два или более связанных компонентов. Воксели метят как новые сосудистые сегменты. На следующей стадии детектируют соседние воксели текущей генерации. Процедуру заканчивают, когда все воксели являются мечеными или оставшиеся воксели не могут быть охвачены с помощью зародышевой точки.
В другом варианте осуществления сначала рассчитывают скелет бинарного сосудистого дерева. Разветвления представляют собой воксели с более чем двумя соседями. В дальнейших подходах, которые также могут быть использованы вместо этого, применяют информацию, предоставляемую динамическими характеристиками контрастного вещества для увеличения дополнительно робастности в планарном сборе данных. Далее следует отметить, что сегментирование и анализ топологии сосудистого дерева также могут быть сделаны предварительно с помощью другого средства и также могут быть использованы в памяти 3.
Так как определенный сегмент органа, в основном, питается единственной артерией, количество химоэмболизирующего материала, транспортируемого через питающую артерию, прямо связано с воздействием химоэмболизации в этой отдельной области. Так как анатомия органа хорошо известна заранее, анатомическое секционирование, предпочтительно в комбинации с ручной повторной регулировкой для индивидуального пациента, выполняют в идентификационном блоке 41. Для того чтобы провести различение между желательным и нежелательным распределением химоэмболизирующего материала, сегменты разделяют на здоровую ткань и опухолевую/целевую область. Так как опухоль сама по себе не видна в рентгенографических проекциях, диагностическое изображение, например, CT/MR применяют для сопоставления с информацией по топологии для определения местоположения целевой области.
В дальнейшем процентное содержание лекарственного средства, доставляемого к цели, определяют в блоке определения потока 42. Сначала объемные скорости потока в конечных сегментах S1, S2, S5, S6 и S7 сосудистого дерева измеряют с помощью измерительного блока 421. Объемная скорость потока Qi конечного сосудистого сегмента указывает, сколько химоэмболизирующего материала поступило в ассоциированный сегмент. Однако биологическое воздействие локальной доставки лекарственного средства зависит не только от количества лекарственного средства, но также от типа ткани. Следовательно, объемная скорость потока предпочтительно взвешенная во взвешивающем блоке 422 с помощью фактора wi, указывает, насколько восприимчивой является ткань. Для измерения объемных скоростей потока в 2D могут быть применены хорошо известные алгоритмы, как описано у S.D.Shpilfougel, R.A.Close, D.J.Valentine и G.R.Duckwiler "X-ray videodensitometric methods for blood flow and velocity measurement: A critical review of literature", Med. Phys. 27(9), p.2008-2023, 2000. Последнее время предпочтительные подходы в 3D являются доступными и могут быть также использованы, как описано в европейской заявке на патент ЕР 05100798.7 (номер в реестре Филипса NL 050108, «Система определения сосудистой геометрии и характеристик потока») в комбинации с хорошо известными видеоденситометрическими способами измерения кровотока, например, по болюсному времени прибытия. Фиг.3 показывает иллюстрацию измерения объемных скоростей потока в конечных сегментах сосудистого дерева, как получено посредством измерительного блока 421.
Обзор хорошо известных видеоденситометрических способов измерения кровотока представлен у S.D.Shpilfougel, R.А.Close, D.J.Valentine и G.R.Duckwiler "X-ray videodensitometric methods for blood flow and velocity measurement: A critical review of literature", Med. Phys. 27(9), p.2008-2023, 2000. Важными алгоритмами являются, например, алгоритмы болюсного времени прибытия, которые определяют время, за которое репрезентативный признак контрастного вещества болюса достигает положения l. По данным двух таких наблюдений получают разность Δt, обозначающую, что болюс переместился на расстояние Δl между двумя фиксированными ROI и, впоследствии, применяют для расчета скорости кровотока и объемной скорости соответственно. Конечно, репрезентативный признак также может быть получен из эмпирически подобранной модели кривой временной интенсивности вместо применения самой кривой временной интенсивности. Вместо алгоритмов болюсного времени прибытия также могут быть использованы алгоритмы слежения за контуром болюса. В данном описании положение болюса в DSA изображении определяют в момент времени. При использовании двух таких наблюдений расстояние ΔZ, на которое болюс был перемещен между двумя фиксированными моментами времени, может быть получено и снова может быть использовано для расчета скорости.
Полный отличающийся подход представляет собой интегральный поверхностный способ. В данном описании объемная скорость потока резервуара с единственным впуском представляет собой разность между содержанием резервуара в двух различных временных событиях, поделенную на временную разность. Объемную скорость потока в данный момент получают, когда данная временная разность сводится к минимуму. Более того, известны подходы, в которых используют уравнение неразрывности для оптического потока. Конечно, этот список алгоритмов измерения объемного потока является неполным, и другие известные алгоритмы также могут быть применены.
Затем взвешенные объемные скорости потока проецируют обратно в точку инъекции контрастного вещества в блок обратного распространения 423. В результате (показано на Фиг.4) взвешенное количество химоэмболизирующего материала вводят в опухоль Т (то есть цель) и поражение здоровой ткани Н целевой области ТА теперь известно для каждого сегмента сосудистого дерева. Здоровая ткань может быть разделена на различные сегменты, каждый питаемый определенной питающей артерией. Результат сегментации также изображен на Фиг.4, где каждый сегмент обозначен специфическим номером.
Пропорция химоэмболизирующего материала, вводимого в опухоль, показывает эффективность η целевой доставки лекарственного средства в определенное место. Следовательно, эффективность рассчитывают в средстве определения потока 42, например, путем деления суммы взвешенных объемных скоростей потока питающих опухоль артерий на общую сумму взвешенных объемных скоростей потока
С другой стороны
является индикатором повреждения, вызванного химоэмболизацией в здоровой ткани. Если µ близко к 0 и η близко к 1, соответственно, большинство химоэмболизирующего материала будет попадать в опухоль и соответствующий сосудистый сегмент является приемлемым в качестве инъекционной точки лекарственного средства.
Альтернативно, эффективность может быть измерена по-другому. Например, положительные весовые факторы соответствуют опухоли, тогда как отрицательные весовые факторы соответствуют здоровой ткани. Затем взвешенные скорости потока точно также были суммированы в процедуре обратного проецирования. Тогда высокий и положительный результат для отдельной ветви показывает хорошую инъекционную точку, тогда как отрицательные результаты маркируют неприемлемые инъекционные точки.
Так как все сегменты сосудистого дерева являются потенциальными инъекционными точками лекарственного средства, эффективность целевой доставки лекарственного средства теперь рассчитывают для каждого сегмента, применяя уравнение (1). Для примера результат представлен на Фиг.5. Оптимальное место L целевой доставки лекарственного средства выбирают с помощью блока выборки 43 как сегмент с наивысшей эффективностью η. Наконец, для того чтобы поддержать лицо, осуществляющее вмешательство в продвижении катетера, путеводная карта к оптимальной инъекционной точке лекарственного средства может быть опционально выведена на дисплей 5, как показано на Фиг.6. Но, в общем, для визуализации на дисплее эффективности каждой сосудистой ветви достаточно. Конечно, верификация эффективности целевой доставки лекарственного средства в оптимальную инъекционную точку может быть сделана вдобавок путем СА сбора данных и инъекции контрастного материала в обнаруженную оптимальную инъекционную точку.
Главной областью применения предлагаемого изобретения для потенциальных инъекционных точек лекарственного средства является поддержка планирования целевой доставки лекарственного средства во время лечения рака. Так как, в частности, применение химоэмболизации опухолей печени возрастает, предложенные функциональные возможности представляют собой важное расширение диапазона применения известных инструментов. Новое определение потенциальных инъекционных точек для химоэмболизирующего материала может быть добавлено к пакетам программ для плановой перфузии и потока, и увеличивает важности ангиограмм для вмешательств.
Основная идея изобретения состоит в представлении лицу, осуществляющему вмешательство, объективного и количественного определения всех потенциальных инъекционных точек лекарственного средства при всего лишь единственной инъекции контрастного вещества, по крайней мере, если потенциальные инъекционные точки лекарственного средства в сосудистом дереве расположены ниже инъекционных точек от инъекционной точки первой инъекции. Для этой цели процентное содержание инъекцируемого химоэмболизирующего материала, доставляемого в опухоль, и количество лекарственного средства, действующего на здоровую ткань, определяют для каждой потенциальной инъекционной точки. В примере осуществления количество химоэмболизирующего материала, введенного в опухоль, определяют путем измерений объемной скорости кровотока в комбинации с обратным распространением взвешенных скоростей потока в 3D.
Так как предоставляется более сильное фокусирование доставки лекарственного средства, количество ошибочно доставляемого материала уменьшается. В некоторых прежде неизлечимых случаях заболевания целевая доставка лекарственного средства может, поэтому, стать применимой, потому что здоровая ткань повреждается в меньшем размере. В любом случае исход вмешательства улучшается.
Кроме того, как подход предлагаются также карты определения потенциальных инъекционных точек в 3D сосудистом дереве, планомерное наведение на оптимальное местоположение для артериальной доставки лекарственного средства.
Несмотря на то, что единственной инъекции контрастного вещества должно быть достаточно, также возможны несколько инъекций. Если контрастное вещество инъецируют в различные места, эффективность результатов всех инъекций может быть объединена. В результате также представляется информация о ветвях, которые являются невидимыми при одной отдельной инъекции контрастного вещества. Кроме того, информация становится более надежной, так как данная эффективность для отдельных ветвей состоит из нескольких наблюдений. Результаты, которые получены для инъекционных точек, близких к отдельной ветви, являются более надежными, чем другие, и должны поэтому сильнее влиять на определение потенциальных инъекционных точек.
Это может быть сделано путем автоматического определения меры неопределенности для каждого видеоденситометрического измерения. Эта мера может быть затем использована для взвешивания различных наблюдений, куда относят более надежные результаты более сильных весовых факторов. Эта стадия взвешивания может, например, также быть выполнена посредством взвешивающего блока 422 в добавление или альтернативно к вышеописанному взвешиванию.
1. Устройство для определения инъекционной точки в области сосуда, через который осуществляют инъекцию лекарственного средства в целевую область организма пациента, содержащее: идентификационное средство (41) для идентификации топологии сосудов сосудистого дерева, питающих указанную целевую область; средство определения потока (42) для определения процентного содержания лекарственного средства, доставляемого к указанной цели после инъекции в различные потенциальные инъекционные точки в указанном сосудистом дереве; средство выборки (43) для селекции как оптимальной инъекционной точки потенциальной инъекционной точки, приводящей к более высокому процентному содержанию лекарственного средства, доставленного к указанной цели.
2. Устройство по п.1, в котором указанное средство определения потока (42) включает измерительное средство (421) для измерения объемных скоростей потока конечных сегментов сосудистого дерева, в частности, после инъекции контрастного вещества в питающий сосуд указанного сосудистого дерева, указанные объемные скорости потока показывают, сколько лекарственного средства поступило в целевую область через указанные конечные сегменты и могут применяться для определения процентного содержания доставленного лекарственного средства для различных потенциальных инъекционных точек.
3. Устройство по п.2, в котором указанное средство определения потока (42) дополнительно включает взвешивающее средство (422) для взвешивания указанных объемных скоростей потока с помощью весовых факторов, указывающих, какой участок лекарственных повреждений ткани локализован на конце соответствующего конечного сегмента сосудистого дерева.
4. Устройство по п.2 или 3, в котором указанное средство определения потока дополнительно включает средство обратного распространения (423) для обратной проекции указанных объемных скоростей потока, соответственно, в различные потенциальные инъекционные точки в указанном сосудистом дереве.
5. Устройство по п.2 или 3, в котором указанное средство определения потока (42) адаптировано для определения указанного процентного содержания доставленного лекарственного средства путем определения критерия, применяемого для оценки потенциальных инъекционных точек, указанный критерий определяют путем деления суммы объемных скоростей потока или суммы взвешенных объемных скоростей потока, соответственно, целевых питающих сосудов на полную сумму объемных скоростей потока или взвешенных объемных скоростей потока, соответственно.
6. Устройство по п.1, в котором указанное идентификационное средство (41) адаптировано для различения здоровой ткани в целевой области и для отделения первых конечных сегментов указанного сосудистого дерева, питающего здоровую ткань, от вторых конечных сегментов указанного сосудистого дерева, питающего целевую область.
7. Устройство по п.6, в котором средство определения потока (42) адаптировано для определения процентного содержания лекарственного средства, доставленного к указанной цели и в окружающие здоровые ткани в целевой области после инъекции в различные потенциальные инъекционные точки указанного сосудистого дерева, и средство выборки (43) адаптировано для селекции как оптимальной инъекционной точки потенциальной инъекционной точки, приводящей к более высокому процентному содержанию лекарственного средства, доставленного к указанной цели и более низкому повреждению здоровой ткани.
8. Устройство по п.1, в котором указанное идентификационное средство (41) включает средство сегментации (411) для сегментации указанной цели или для сегментации указанной целевой области на сегменты со здоровой тканью, причем указанные сегменты питаются различными конечными сегментами указанного сосудистого дерева.
9. Устройство по п.1, в котором указанное идентификационное средство (41) адаптировано для идентификации и разделения указанной целевой области на сегменты, питаемые питающей артерией указанного сосудистого дерева.
10. Устройство по п.1, в котором указанное средство определения потока (42) дополнительно включает взвешивающее средство (422) для взвешивания указанных объемных скоростей потока посредством факторов неопределенности, указывающих какой является неопределенность измеряемой объемной скорости потока.
11. Устройство для определения инъекционной точки в области сосуда, через который осуществляют инъекцию лекарственного средства в целевую область организма пациента, содержащее: идентификационное средство (41) для идентификации топологии сосудов сосудистого дерева, питающих указанную целевую область; средство определения потока (42) для определения процентного содержания лекарственного средства, доставляемого к указанной цели после инъекции в различные потенциальные инъекционные точки в указанном сосудистом дереве; средство выборки (43) для селекции как оптимальной инъекционной точки потенциальной инъекционной точки, приводящей к более высокому процентному содержанию лекарственного средства, доставленного к указанной цели, дисплейное средство (5) для отображения сосудистого дерева и представления оптимальной инъекционной точки.
12. Устройство по п.11, в котором указанное дисплейное средство (5) дополнительно адаптировано для отображения в указанном сосудистом дереве процентного содержания лекарственного средства, доставленного в различные сегменты указанного сосудистого дерева, или соответствующих результатов оценочного критерия.
13. Способ определения инъекционной точки в области сосуда, через который осуществляют инъекцию лекарственного средства в целевую область организма пациента, включающий: предварительную идентификацию топологии сосудов сосудистого дерева, питающих указанную целевую область; определение процентного содержания лекарственного средства, доставленного к указанной целевой области после инъекции в различные потенциальные инъекционные точки в области различных сосудов указанного сосудистого дерева; селекцию как оптимальной инъекционной точки, точки, приводящей к более высокому процентному содержанию лекарственного средства, доставленного к указанной цели.