Рекомбинантный белок collbd-cbd, рекомбинантная плазмида pос-collbd, штамм escherichia coli - продуцент рекомбинантного белка collbd-cbd, способ получения рекомбинантного белка collbd-cbd
Иллюстрации
Показать всеИзобретение относится к биотехнологии, генной инженерии и медицине. Описан рекомбинантный белок Collbd-CBD, состоящий из коллагенсвязывающего домена Collbd (SPARC(w)), из внеклеточного кальцийзависимого белка SPARC (ВМ-40 или остеонектина) человека и спейсерной последовательности GGS. Предложен способ его получения, включающий выращивание штамма Е.coli M15 [pREP4, pOC-Collbd]. Представлены соответствующий штамм и плазмида. Изобретение позволяет обеспечить высокий уровень продукции рекомбинантного белка Collbd-CBD и одновременно простую и эффективную схему очистки этого белка с иммобилизацией его на коллагенсодержащем сорбенте, входящем в состав нового поколения изделий и материалов медицинского назначения - имплантатов и покрытий. 4 н.п. ф-лы, 1 ил.
Реферат
Изобретение относится к генной инженерии, биотехнологии, микробиологии, а также медицине. Рекомбинантные химерные белки, способные эффективно связываться с коллагеном и обладающие различной биологической активностью, могут быть использованы для разработки нового поколения изделий и материалов медицинского назначения - имплантатов, покрытий и пр. Кроме того коллагенсвязывающие домены могут использоваться в качестве аффинных доменов для одностадийной очистки химерных белков.
В настоящее время в медицине широко применяются высокоочищенные препараты различных рекомбинантных белков: факторов роста, адгезии и др. Производство материалов и покрытий с биологически активными факторами - весьма сложный и дорогостоящий процесс. Иммобилизация этих белков, основанная, как правило, на химической пришивке, многостадийна, трудоемка и дорогостояща. Важной проблемой остается разработка методов очистки конечных продуктов от высокотоксичных для организма липополисахаридов, балластных белков, ДНК и РНК штаммов-продуцентов, а также получение функционально активных биологических компонентов.
Повышение уровня экспрессии и стабильности чужеродных белков в бактериальной системе и разработка простых и эффективных схем тестирования и очистки белков могут быть достигнуты с помощью ряда генно-инженерных подходов. Одним из них является технология создания слитных (химерных) белков, в основе которой лежит метод, основанный на соединении в одной рамке трансляции двух генов (гена белка-носителя и гена исследуемого продукта), приводящая к синтезу в бактериальной системе химерного белка [Terpe K. Overview of tag protein fusions: from molecular and biochemical fundamentals to commercial systems // Appi Microbiol Biotechnol. - 2003. Vol.60. - P.523-33]. Тенденция к минимизации белка-носителя способствовала развитию технологии аффинных доменов, основанной на специфическом молекулярном узнавании. Небольшие по молекулярному весу аффинные домены различной химической природы проявляют свою специфичность при использовании молекулярных взаимодействий различного типа [Terpe К. Overview of tag protein fusions: from molecular and biochemical fundamentals to commercial systems // Appi Microbiol Biotechnol. - 2003. Vol.60. - P.523-33].
Ранее была разработана технология, заключающаяся в принципиально новом подходе к очистке рекомбинантных белков путем аффинной иммобилизации на целлюлозосодержащих сорбентах. Метод основан на способности целлюлозосвязывающих доменов (cellulose binding domain, CBD) - автономных белковых модулей - самопроизвольно взаимодействовать с полимерными целлюлозосодержащими сорбентами с высокой константой связывания [RU № 2278160 от 20 июня 2006 г., RU № 2270249 от 20 февраля 2006]. Использование CBD в качестве белка-носителя позволяет сделать процесс иммобилизации и очистки рекомбинантных белков, содержащих в своем составе CBD, одностадийным и практически безынструментальным.
Однако еще более перспективным представляется использование в качестве аффинных доменов коллагенсвязывающих пептидов. Коллаген является одним из основных компонентов внеклеточного матрикса. Помимо этого он играет ключевую роль в столь разнообразных процессах, как морфогенез, заживление ран, воспалительные реакции, образование опухолевых метастазов, гемостаз и тромбоз. Следует отметить его низкую токсичность и антигенность, а также высокую механическую прочность. Указанные свойства коллагена выглядят крайне перспективными для его использования в качестве сорбента для очистки химерных белков, а также компонента биосовместимых материалов и покрытий.
Исходя из структуры все стороны трех цепей молекулы коллагена, выходящие на поверхность, доступны для различных межмолекулярных взаимодействий. К лигандам, связывающимся с коллагеном, относятся поверхностные рецепторы клеток, такие как α1β1 и α2β1 интегрины и NG2 протеогликаны; несколько ростовых факторов; малые матричные протеогликаны и другие матричные белки, такие как нидоген, ВМ-40 и фактор фон Виллебранда. Большинство связываний происходит с интактной структурой тройной спирали [Т.Sasaki, E.Hohenester, W.Gohring, and R.Timpl. The EMBO Journal. 1998. 17(6): 1625-1634]. Коллаген в поврежденных тканях может быть потенциальной мишенью ростовых факторов, индуцирующих репарацию тканей. Кроме того, коллагеновые материалы могут быть полезны в качестве потенциальных переносчиков ростовых факторов при помещении их на металлический имплантат или поврежденную ткань.
В основу заявленной группы изобретений положена задача создания штамма E.coli, обеспечивающего высокий уровень продукции рекомбинантного белка Collbd-CBD, и, одновременно, простую и эффективную схему очистки этого белка, с иммобилизацией его на коллагенсодержащем сорбенте, входящем в состав нового поколения изделий и материалов медицинского назначения - имплантатов и композиционных покрытий.
Упомянутая задача решена за счет синтеза рекомбинантного белка Collbd-CBD в клетках Е.coli, в частности, за счет введения в состав рекомбинантного белка целлюлозосвязывающего домена (CBD) из эндоглюканазы Anaerocellum thermophilum, a также за счет введения между функциональными доменами спейсерной последовательности из 19 аминокислотных остатков для сохранения функции активации клеточного роста слитыми белками, связанными с коллагеновым матриксом. Помимо этого упомянутая задача решена за счет возможности одностадийной высокоэффективной очистки рекомбинантного белка Collbd-CBD, содержащего коллагенсвязывающий домен и иммобилизации его на коллагенсодержащем нанокомпозитном покрытии. Также упомянутая задача решена за счет использования для генно-инженерного конструирования плазмидного вектора рОС, кодирующего целлюлозосвязывающий домен (CBD) и глицин-сериновый спейсер [Н.Е.Шарапова, А.П.Котнова, З.М.Галушкина, Н.Н.Полетаева, Н.В.Лаврова, Е.И.Аксенова, А.С.Семихин, А.С.Карягина, В.Г.Лунин. Получение и характеристика коллагенсвязывающих доменов из фактора фон Виллебранда человека. // Молекулярная генетика, микробиология и вирусология. - 2009. - №4. - С.31-35], который позволяет обеспечить высокий уровень экспрессии получаемого химерного белка Collbd-CBD. Использование технологии создания химерных белков в данном случае является необходимьм условием для получения целевого белка, поскольку сам Collbd очень мал (содержит всего 20 аминокислотных остатков) и может подвергаться протеолизу в клетках-продуцентах.
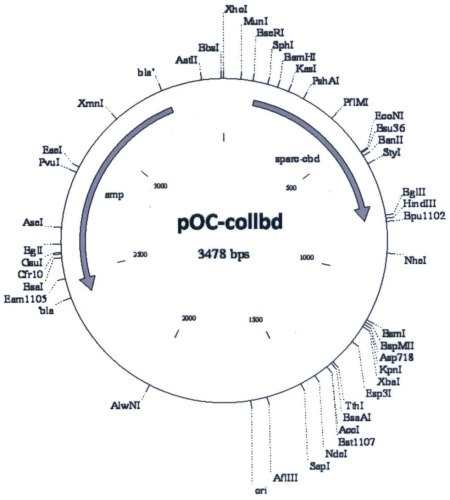
Сущность изобретения состоит в том, что рекомбинантная плазмида pOC-Collbd размером 3478 п.н. обеспечивает экспрессию рекомбинантного белка Collbd-CBD, состоящего из коллагенсвязывающего домена Collbd из внеклеточного кальцийзависимого белка Collbd человека, спейсера из остатков глицина и серина и целлюлозосвязывающего домена (CBD) из эндоглюканазы Anaerocellum thermophilum, и содержит:
- искусственный бактериальный оперон химерных белков, включающий: промоторную область раннего промотора бактериофага Т5 (7-87 п.н.), обеспечивающую эффективную транскрипцию контролируемой мРНК; рекомбинантный ген, обеспечивающий экспрессию целевого химерного белка (коллагенсвязывающий домен Collbd - спейсер - целлюлозосвязывающий домен CBD) (117-794 п.н.); нетранслируемую область терминации транскрипции бактериального оперона, обеспечивающую эффективное окончание транскрипции (834-928 п.н.);
- бактериальный оперон bla (3263-2413 п.н. комплементарной цепи), кодирующий белок бета-лактамазу, являющуюся селективным маркером для отбора клонов-трансформантов Е.coli методом контр-селекции;
- бактериальный участок инициации репликации типа ColEl, обеспечивающий репликацию плазмиды в штаммах Е. coli (1879 п.н.).
Штамм Escherichia coli M15 [pREP4, pOC-Collbd] получен трансформацией штамма Escherichia coli M15/pREP4 плазмидой pOC-Collbd. Полученный штамм является продуцентом рекомбинантного белка Collbd-CBD, состоящего из коллагенсвязывающего домена Collbd из внеклеточного кальций зависимого белка Collbd человека, спейсера из остатков глицина и серина и целлюлозосвязывающего домена (CBD).
Рекомбинантный белок Collbd-CBD, состоящий из коллагенсвязывающего домена Collbd из внеклеточного кальцийзависимого белка Collbd человека, спейсера из остатков глицина и серина и целлюлозосвязывающего домена (CBD), обладает способностью самопроизвольно связываться с коллагенсодержащим сорбентом, а также с разными видами целлюлоз, благодаря наличию в составе белка CBD.
Способ получения рекомбинантного белка Collbd-CBD включает выращивание клеток штамма Escherichia coli M15 [pREP4, pOC-Collbd], индукцию синтеза белка Collbd-CBD, разрушение клеток, получение супернатанта, содержащего белок, иммобилизацию белка путем добавления к супернатанту суспензии целлюлозосодержащего сорбента, инкубирование, отмывание сорбента со связавшимся белком, последующую элюцию белка с сорбента.
Техническим результатом заявленного изобретения является обеспечение высокого уровня продукции рекомбинантного белка Collbd-CBD и одновременно обеспечение простой и эффективной схемы очистки этого белка, с иммобилизацией его на коллагенсодержащем сорбенте, входящем в состав нового поколения изделий и материалов медицинского назначения - имплантатов и покрытий.
Таким образом, технический результат достигается за счет того, что создана рекомбинантная плазмида pOC-Collbd, кодирующая бифункциональный рекомбинантный белок Collbd-CBD, с одной стороны, содержащий аминокислотную последовательность коллагенсвязывающего домена Collbd, а с другой - обладающий способностью самостоятельно связываться с целлюлозосодержащим сорбентом, благодаря наличию CBD. При конструировании этой плазмиды коллагенсвязывающий домен Collbd получен синтетическим способом из четырех олигонуклеотидов, в которые были заложены сайты для эндонуклеаз рестрикции NcoI и BamHI. Благодаря этим сайтам можно получать химерные белки, у которых коллагенсвязывающий домен будет на N-конце.
Также указанный технический результат достигается тем, что штамм Escherichia coli M15 [pREP4, pOC-Collbd] является продуцентом рекомбинантного белка Collbd-CBD. При этом отсутствие в клетках Е. coli белков, способных связываться с коллагеном, служит гарантией того, что рекомбинантный белок Collbd-CBD является единственным белком штамма Escherichia coli M15 [pREP4, pOC-Collbd], прочно связывающимся с используемым сорбентом, что обеспечивает возможность одностадийного получения высокоочищенного препарата указанного рекомбинантного белка, иммобилизованного на коллагенсодержащем сорбенте.
Штамм Е.coli M15 [pREP4], содержащий плазмиду pOC-Collbd, - продуцент рекомбинантного белка Collbd-CBD - характеризуется следующими признаками.
Культурально-морфологические признаки. Клетки прямые, палочковидные, неподвижные, грамотрицательные. При рассеве на чашке с 1,5% LB-агаром рост в виде отдельных колоний, иногда в R-форме с неровными краями. Хорошо растет на плотных и жидких питательных средах (LB-бульон, LB-агар, МПА, МПБ).
Физиолого-биохимические признаки. Клетки растут в пределах +4-42°С при оптимуме рН 6,8-7,5. Штаммы разлагают глюкозу, маннит с образованием кислоты, не разлагают сахарозу, арабинозу, галактозу, сбраживают мальтозу, ксилозу, сорбит, рамнозу. Существенным при использовании данных штаммов является их чувствительность к налидиксовой кислоте (25 мг/мл), стрептомицину (20 мг/мл) и рифампицину (25 мг/мл). Проявляют устойчивость к ампициллину (до 100 мкг/мл), обусловленную наличием плазмиды pOC-Collbd, и к канамицину (до 25 мкг/мл), обусловленную наличием плазмиды pREP4.
Указанный технический результат достигается также тем, что рекомбинантный белок Collbd-CBD, включающий в себя аминокислотную последовательность CBD, определяющую способность данного белка связываться с целлюлозосвязывающим сорбентом, позволяет проводить в одну стадию концентрирование, очистку и иммобилизацию белка Collbd-CBD на целлюлозном сорбенте.
Достигается указанный технический результат также тем, что способ очистки, концентрирования и получения иммобилизованного рекомбинантного белка Collbd-CBD заключается в обработке супернатанта гидролизата клеток штамма Е.coli M15 [pREP4, pOC-Collbd] целлюлозосодержащим сорбентом с последующей отмывкой сорбента с иммобилизованным рекомбинантным белком, последующей элюцией белка Collbd-CBD с сорбента и диализом.
Также указанный технический результат достигается тем, что рекомбинантный белок Collbd-CBD, содержащий аминокислотную последовательность коллаген-связывающего домена Collbd, способен взаимодействовать с коллагенсодержащим сорбентом (желатином).
Изобретение проиллюстрировано чертежом.
На чертеже представлена схема плазмиды pOC-Collbd.
В списке последовательностей: нуклеотидная последовательность плазмиды pOC-Collbd - последовательность №1, аминокислотная последовательность белка коллагенсвязывающего домена Collbd - последовательность №2, аминокислотная последовательность глицин-серинового спейсера - последовательность №3, аминокислотная последовательность целлюлозосвязывающего домена CBD-последовательность №4.
Все стандартные генно-инженерные и микробиологические манипуляции, а также амплификацию и секвенирование ДНК проводили по известным методикам (Маниатис Т., Фрич Э., Сэмбрук Дж., Молекулярное клонирование, М., Мир, 1984; Клонирование ДНК. Методы. Под ред. Д.Гловера, Пер. с англ., Москва, Мир, 1988; Saiki R.K., Gelfand D.H., Stoffel S., Sharf S.J., Higuchi R., Horn G.T., Mullis K.B., Eriich H.A. Science, 1988. V.239, №4839, p.487-491; Sanger F., Nicklen S., Coulson A.R. Proc. Nat. Acad. Sci. USA, 1977, V.74, p.5463-5467).
Ниже приведены примеры, иллюстрирующие изобретение.
Примеры.
Пример 1. Получение плазмиды pOC-Collbd.
а) Химический синтез олигодезоксирибонуклеотидов.
Олигодезоксирибонуклеотиды были синтезированы твердофазным фосфорамидитным методом с помощью синтезатора АСМ 100-2 (Новосибирск) и очищены методом электрофореза в 12%-ном ПААГ.
б) Получение гена Collbd с последующим его клонированием.
Коллагенсвязывающий домен из внеклеточного кальцийсвязывающего белка Collbd (BM-40 или остеонектина) человека был синтезирован с использованием 4 комплементарных олигонуклеотидов следующего состава (5'-3'):
Dir1: CATGCTGGACTCTGAACTGACCGAATTCCC
Dir2:GCTGCGCATGCGTGACTGGCTGAAAAACCCGGGTGGTTCTG
Rev1: GATCCAGAACCACCCGGGTTTTTCAGCCAGTCACGCA
Rev2:TGCGCAGCGGGAATTCGGTCAGTTCAGAGTCCAG
Олигонуклеотиды были спланированы таким образом, что при сборке они образуют двухцепочечный фрагмент ДНК, содержащий липкие концы, соответствующие сайтам гидролиза рестриктаз NcoI и BamHI. При синтезе олигонуклеотиды были фосфорилированы по 5'-концу.
Для сборки двухцепочечного фрагмента ДНК смесь олигонуклетидов (по 20 пкМ) прогревали при 95°С (10 мин) и в течение 4 часов охлаждали до 25°С. Полученную смесь объединяли с фрагментом плазмиды рОС (3407 п.н.), гидролизованной эндонуклеазами рестрикции NcoI и BamHI при 37°С в буферном растворе, содержащем 66 мМ Трис-ацетат (рН 7,9 при 37°С), 20 мМ ацетат магния, 132 мМ ацетат калия в течение 1,5 часов. Лигирование проводили с помощью ДНК-лигазы фага Т4 в буфере, содержащем 40 мМ Трис-HCl (рН 7,8 при 25°С), 10 мМ хлористого магния, 10 мМ ДТТ и 5 мМ АТФ. Лигированную смесь ДНК использовали для трансформации клеток Е.coli штамма M15 [pREP4] методом электропорации. Трансформированные клетки отбирали на агаризованной среде LB с антибиотиками канамицином (25 мкг/мл) и ампициллином (100 мкг/мл). Из отобранных рекомбинантных клонов выделяли плазмидную ДНК методом щелочного лизиса. Отобранные клоны секвенировали и подтвердили наличие вставки, соответствующей коллагенсвязывающему домену из внеклеточного кальцийсвязывающего белка SPARC (ВМ-40 или остеонектина) человека.
Пример 2. Получение штамма Е.coli - продуцента рекомбинантного белка Collbd-CBD, состоящего из коллагенсвязывающего домена Collbd, глицин-серинового спейсера и целлюлозосвязывающего домена CBD.
Для получения штамма Е.coli - продуцента рекомбинантного белка Collbd-CBD, клетки штамма Е. coli M15 [pREP4] (Nals, Strs, rifs, lac-, ara-, gal-, mtl-, F-, recA+, uvr+) трансформировали плазмидой pOC-Collbd. Трансформированные клетки выращивали в 500 мл среды LB при 37°С до оптической плотности, соответствующей 1 ед. поглощения при длине волны 600 нм, индуцировали 150 мкл 0,1 М раствора изопропил-бета-D-тиогалактопиранозида и выращивали в течение 8 часов.
Для контроля продукции рекомбинантного белка Collbd-CBD клетками штамма Е.coli M15 [pREP4, pOC-Collbd] применяли метод электрофореза в ПААГе в присутствии додецилсульфата натрия. Разделение белков проводили в 12%-ном ПААГе в стандартной системе буферов (электродный буфер: 25 мМ Трис-HCl, 192 мМ глицина, 0,1% додецилсульфата натрия, рН 8,3; буфер для геля: 375 мМ Трис-HCl, рН 8,8). По окончании электрофореза гели окрашивали 0,15% раствором Кумасси G250 в 25% изопропаноле и 10% уксусной кислоте и отмывали в 10% уксусной кислоте. При сравнении спектра белков у штаммов Е.coli M15 [pREP4] и Е.coli M15 [pREP4, pOC-Collbd] обнаруживали появление дополнительной белковой полосы с молекулярной массой 25 кДа, что соответствует молекулярной массе рекомбинантного белка Collbd-CBD. Уровень синтеза белка Collbd-CBD определяли, сравнивая интенсивность окрашивания полосы рекомбинантного белка с полосой соответствующего белка - стандарта молекулярной массы. Согласно полученным данным, клетки штамма Е.coli M15 [pREP4, pOC-Collbd] синтезируют около 20% Collbd-CBD от общего белка клеток.
Пример 3. Способ выделения препарата белка Collbd-CBD в целлюлозосодержащем сорбенте.
Клетки Е.coli M15 [pREP4], трансформированные плазмидой pOC-Collbd, выращивали в 3,5 мл среды LB с ампициллином и канамицином при 37°С до оптической плотности, соответствующей 1 ед. поглощения при длине волны 600 нм, добавляли 3 мкл 0,1 М раствора изопропил-бета-D-тиогалактопиранозида и выращивали в течение 4 ч. Культуру разводили до оптической плотности 0,7 при 530 нм, отбирали 400 мкл суспензии, осаждали клетки центрифугированием при 5000 об/мин в течение 10 мин. Клетки ресуспендировали в 500 мкл фосфатно-цитратного буфера (ФЦБ, 50 мМ, рН 6,0), разрушали ультразвуком, клеточный дебрис удаляли центрифугированием при 16000 об/мин в течение 10 мин.
К 100 мкл 50% суспензии микрокристаллической целлюлозы добавляли 2 мл буферного раствора, содержащего 30 мМ Трис, рН 8,0, и 0,15 М хлорида натрия, а также лизат клеток в 7 М растворе гуанидинхлорида. Инкубировали при +4°С в течение 2 ч, затем оставляли на 16 ч при той же температуре. Центрифугировали полученную суспензию в течение 5 мин при 5000 об/мин. Осадок сорбента со связавшимся белком трижды отмывали буферным раствором, содержащим 30 мМ Трис, рН 8,0, и 0,15 М хлорида натрия.
Элюцию белка проводили буферным раствором, содержащим 7 М гуанидина гидрохлорида в объемном отношении 1:1 к полученному осадку сорбента с иммобилизованным белком в течение 10 мин при комнатной температуре. Анализ результатов связывания и элюции белка Collbd-CBD проводили методом электрофореза по Лэммли в 12% ПААГ в денатурирующих условиях.
По результатам электрофореза в ПААГ в присутствии ДСП концентрация белка Collbd-CBD составляла 15 мг на 1 мл сорбента.
Пример 4. Связывание рекомбинантного белка Collbd-CBD с коллагенсодержащим сорбентом.
К 100 мкл 50% суспензии желатин-сефарозы добавляли 2 мл буферного раствора, содержащего 30 мМ Трис рН 8,0 и 0,15 М хлорида натрия, а также 200 мкл раствора элюированного белка в 7 М растворе гуанидинхлорида. Инкубировали при перемешивании во льду в течение 18 ч. Центрифугировали полученную суспензию в течение 5 минут при 5000 об/мин. Осадок сорбента со связавшимся белком трижды отмывали буферным раствором, содержащим 30 мМ Трис рН 8,0 и 0,15 М хлорида натрия.
Элюцию белка проводили буферным раствором, содержащим 6 М мочевины, 30 мМ Трис рН 8,0 и 10 мМ ЭДТА. Анализ результатов связывания и элюции белка Collbd-CBD с коллагенсодержащим сорбентом доменов проводили методом электрофореза по Лэммли в 12% ПААГ в денатурирующих условиях.
По результатам электрофореза в ПААГ в присутствии ДСН показано практически 100% связывание рекомбинантного белка Collbd-CBD с желатин-сефарозой.
1. Рекомбинантный белок Collbd-CBD, состоящий из коллагенсвязывающего домена Collbd из внеклеточного кальцийзависимого белка SPARC человека с последовательностью SEQ ID NO: 2, спейсера из остатков глицина и серина с последовательностью SEQ ID NO: 3 и костного морфогенетического белка CBD с последовательностью SEQ ID NO: 4, обладающий биологическими свойствами белка CBD и способностью самопроизвольно связываться с коллагенсодержащим сорбентом.
2. Рекомбинантная плазмида pOC-Collbd с последовательностью SEQ ID NO: 1, обеспечивающая экспрессию рекомбинантного белка CollbdD-CBD по п.1, содержащаяискусственный бактериальный оперон химерных белков, включающий промоторную область раннего промотора бактериофага Т5, обеспечивающий эффективную транскрипцию контролируемой мРНК;рекомбинантный ген, обеспечивающий экспрессию целевого химерного белка по п.1;нетранслируемую область терминации транскрипции бактериального оперона, обеспечивающую эффективное окончание транскрипции;бактериальный оперон bla, кодирующий белок бета-лактамазу, являющуюся селективным маркером для отбора клонов-трансформантов Е.coli методом контрселекции;бактериальный участок инициации репликации типа ColEl, обеспечивающий репликацию плазмиды в штаммах Е.coli.
3. Штамм Escherichia coli M15 [pREP4, pCollbd-BMP-2], полученный трансформацией штамма Escherichia coli M15/pREP4 плазмидой pCollbd-BMP-2 по n.2, - продуцент рекомбинантного белка Collbd-BMP-2 по п.1.
4. Способ получения рекомбинантного белка Collbd-CBD по п.1, включающий выращивание клеток штамма Escherichia coli M15 [pREP4, pOC-Collbd], индукцию синтеза белка Collbd-CBD по п.1, разрушение клеток, получение супернатанта, содержащего белок, иммобилизацию белка путем добавления к супернатанту суспензии коллагенсодержащего сорбента, инкубирование, отмывание сорбента со связавшимся белком, последующую элюцию белка с сорбента и диализ.