Рекомбинантный белок collbd-bmp-2, рекомбинантная плазмида pcollbd-bmp-2, штамм escherichia coli-продуцент рекомбинантного белка collbd-bmp-2, способ получения рекомбинантного белка collbd-bmp-2
Иллюстрации
Показать всеИзобретение относится к биотехнологии, генной инженерии и медицине. Описан рекомбинантный белок Collbd-BMP-2, состоящий из коллагенсвязывающего домена Collbd (SPARC(w)), из внеклеточного кальций-зависимого белка SPARC (ВМ-40 или остеонектина) человека и спейсерной последовательности GGS. Предложен способ его получения, включающий выращивание штамма Е.coli M15 [pREP4, pCollbd-BMP-2]. Представлены соответствующий штамм и плазмида. Изобретение позволяет обеспечить высокий уровень продукции рекомбинантного белка Collbd-BMP-2 и одновременно простую и эффективную схему очистки этого белка с иммобилизацией его на коллагенсодержащем сорбенте, входящем в состав нового поколения изделий и материалов медицинского назначения - имплантатов и покрытий. 4 н.п. ф-лы, 1 ил.
Реферат
Изобретение относится к биотехнологии, генной инженерии и медицине и может быть использовано для получения рекомбинантного белка, иммобилизованного на коллагенсодержащем носителе, входящем в состав нового поколения изделий и материалов медицинского назначения - имплантатов, покрытий и др.
Хорошо известно, что процесс формирования костной ткани зависит от активности клеток, участвующих в остеогенезе, и от влияния ростовых факторов, так называемых остеоиндуктивных белков. Около 40 лет назад Marshall R. Urist показал, что внеклеточный костный матрикс содержит субстанцию, стимулирующую формирование костной ткани (Urist MR. Bone: formation by autoinduction. Science 1965; 150: 893-9.) Позже были выделены костные морфогенетические белки (bone morphogenetic proteins, BMPs) (Reddi АН. Bone morphogenetic proteins: from basic science to clinical applications. J. Bone Joint Surg. Am. 2001; 83-A (Suppl.1): S1-S6), ставшие объектом интенсивного изучения. Было показано, что BMP принадлежат к суперсемейству трансформирующих ростовых факторов β (transforming growth factor β, TGFβ) и играют важную роль в эмбриональном развитии, в частности в процессах формирования мозга и костной ткани. Представители этой группы белков обладают значительным структурным сходством: полипептидная цепь содержит около 110 аминокислотных остатков и характеризуется консервативными особенностями, в частности, содержит семь остатков цистеина, присутствующих у всех членов семейства.
На сегодняшний день идентифицировано более 20 типов BMP человека. Выяснено, что среди них наибольшим остеогенным потенциалом обладают белки BMP-2, BMP-7, ВМР-6 и BMP-9 (Cheng H, Jiang W, Phillips FM et al. Osteogenic activity of the fourteen types of human bone morphogenetic proteins (BMPs). J. Bone Joint Surg. Am. 2003; 85-A: 1544-52).
В последние годы разработаны технологии получения рекомбинантных ВМР-2 и ВМР-7, что позволяет использовать данные ростовые факторы в клинической практике для расширения зоны и скорости костной репарации при проведении трансплантации.
Введение биологически активных компонентов с помощью добавления их растворимых форм или пропитки ими материалов обеспечивает лишь кратковременный эффект. Это связано с их быстрым удалением из поврежденного участка, даже при введении ростовых факторов в материал покрытия. Более длительный эффект вызывает иммобилизация биологически активных компонентов непосредственно в раневом покрытии. Таким образом, весьма перспективным подходом для развития методов реконструктивной хирургии является создание материалов и покрытий, несущих на поверхности иммобилизованные специфические факторы роста, и изучение их влияния на приживаемость имплантата.
Однако процессы иммобилизации этих белков, основанные, как правило, на химической пришивке, многостадийны, трудоемки, дорогостоящи и небезопасны с точки зрения обеспечения экологической безопасности производства. Важной проблемой остается разработка методов очистки конечных продуктов от липополисахаридов, балластных белков, ДНК и РНК штаммов-продуцентов; получение функционально активных биологических компонентов.
Аналогов препаратов ВМР-2, иммобилизованного на коллагенсодержащем носителе за счет аффинного взаимодействия, в доступных источниках информации не обнаружено.
Задачей, решаемой заявленной группой изобретений, является создание штамма Е.coli, обеспечивающего высокий уровень продукции рекомбинантного белка Collbd-ВМР-2, и одновременно простой и эффективной схемы очистки этого белка с иммобилизацией его на коллагенсодержащем сорбенте, входящем в состав нового поколения изделий и материалов медицинского назначения - имплантатов и покрытий.
Упомянутая задача решается за счет синтеза рекомбинантного белка Collbd-BMP-2, в частности за счет введения в состав рекомбинантного белка коллагенсвязывающего домена Collbd (SPARC(w)) из внеклеточного кальций-зависимого белка SPARC (ВМ-40 или остеонектина) человека, а также за счет введения между функциональными доменами спейсерной последовательности GGS для сохранения функции активации клеточного роста слитыми белками, связанными с коллагеновьм матриксом. Помимо этого, упомянутая задача решается за счет возможности одностадийной высокоэффективной очистки рекомбинантного белка Collbd-BMP-2, содержащего коллагенсвязывающий домен, и иммобилизации его на коллагенсодержащем нанокомпозитном покрытии.
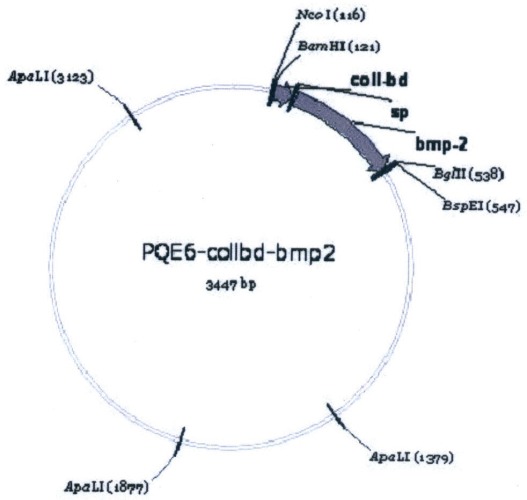
Сущность изобретения заключается в том, что рекомбинантная плазмида pCollbd-ВМР-2 размером 3447 п.н. обеспечивает экспрессию рекомбинантного белка Collbd-BMP-2, состоящего из коллагенсвязывающего домена Collbd из внеклеточного кальций-зависимого белка SPARC человека, спейсера из остатков глицина и серина и костного морфогенетического белка ВМР-2, и содержит:
- искусственный бактериальный оперон химерных белков, включающий: промоторную область раннего промотора бактериофага Т5 (7-87 п.н.), обеспечивающую эффективную транскрипцию контролируемой мРНК; рекомбинантный ген, обеспечивающий экспрессию целевого химерного белка (коллагенсвязывающий домен Collbd - спейсер - костный морфогенетический белок BMP-2) (117-545 п.н.); нетранслируемую область терминации транскрипции бактериального оперона, обеспечивающую эффективное окончание транскрипции (585-679 п.н.);
- бактериальный оперон bla (3232-2382 п.н. комплементарной цепи), кодирующий белок бета-лактамазу, являющуюся селективным маркером для отбора клонов-трансформантов Е.coli методом контрселекции;
- бактериальный участок инициации репликации типа ColE1, обеспечивающий репликацию плазмиды в штаммах Е.coli (1630 п.н.).
Штамм Escherichia coli M15 [pREP4, pCollbd-BMP-2] получен трансформацией штамма Escherichia coli M15/pREP4 плазмидой pCollbd-BMP-2. Полученный штамм является продуцентом рекомбинантного белка Collbd-BMP-2, состоящего из коллагенсвязывающего домена Collbd из внеклеточного кальций-зависимого белка SPARC человека, спейсера из остатков глицина и серина и костного морфогенетического белка BMP-2.
Рекомбинантный белок Collbd-BMP-2, состоящий из коллагенсвязывающего домена Collbd из внеклеточного кальций-зависимого белка SPARC человека, спейсера из остатков глицина и серина и костного морфогенетического белка BMP-2, обладает биологическими свойствами белка BMP-2 и способностью самопроизвольно связываться с коллагенсодержащим сорбентом.
Способ получения рекомбинантного белка Collbd-BMP-2 включает выращивание клеток штамма Escherichia coli M15 [pREP4, pCollbd-BMP-2], индукцию синтеза белка Collbd-BMP-2, разрушение клеток, получение супернатанта, содержащего белок, иммобилизацию белка путем добавления к супернатанту суспензии коллагенсодержащего сорбента, инкубирование, отмывание сорбента со связавшимся белком, последующую элюцию белка с сорбента и диализ.
Техническим результатом заявленного изобретения является обеспечение высокого уровня продукции рекомбинантного белка Collbd-BMP-2 и одновременно обеспечение простой и эффективной схемы очистки этого белка, с иммобилизацией его на коллагенсодержащем сорбенте, входящем в состав нового поколения изделий и материалов медицинского назначения - имплантатов и покрытий.
Таким образом, технический результат достигается за счет того, что создана рекомбинантная плазмида pCollbd-BMP-2, кодирующая бифункциональный рекомбинантный белок Collbd-BMP-2, с одной стороны содержащий аминокислотную последовательность ВМР-2, а с другой - обладающий способностью самостоятельно связываться с коллагенсодержащим сорбентом, благодаря наличию коллагенсвязывающего домена Collbd из внеклеточного кальций-зависимого белка SPARC человека.
Также указанный технический результат достигается с помощью создания штамма Escherichia coli M15 [pREP4, pCollbd-BMP-2], являющегося продуцентом рекомбинантного белка Collbd-BMP-2. При этом отсутствие в клетках Е.coli белков, способных связываться с коллагеном, служит гарантией того, что рекомбинантный белок Collbd-BMP-2 является единственным белком штамма Escherichia coli M15 [pREP4, pCollbd-BMP-2], прочно связывающимся с используемым сорбентом, что обеспечивает возможность одностадийного получения высокоочищенного препарата указанного рекомбинантного белка, иммобилизованного на коллагенсодержащем сорбенте.
Штамм Е.coli M15 [pREP4], содержащий плазмиду pCollbd-BMP-2, - продуцент рекомбинантного белка Collbd-BMP-2 - характеризуется следующими признаками.
Культурально-морфологические признаки. Клетки прямые, палочковидные, неподвижные, грамотрицательные. При рассеве на чашке с 1,5% LB-агаром рост в виде отдельных колоний, иногда в R-форме с неровными краями. Хорошо растет на плотных и жидких питательных средах (LB-бульон, LB-агар, МПА, МПБ).
Физиолого-биохимические признаки. Клетки растут в пределах +4-42°С при оптимуме рН 6,8-7,5. Штаммы разлагают глюкозу, маннит с образованием кислоты, не разлагают сахарозу, арабинозу, галактозу, сбраживают мальтозу, ксилозу, сорбит, рамнозу. Существенным при использовании данных штаммов является их чувствительность к налидиксовой кислоте (25 мг/мл), стрептомицину (20 мг/мл) и рифампицину (25 мг/мл). Проявляют устойчивость к ампициллину (до 100 мкг/мл), обусловленную наличием плазмиды pCollbd-BMP-2, и к канамицину (до 25 мкг/мл), обусловленную наличием плазмиды pREP4.
Указанный технический результат достигается также тем, что рекомбинантный белок pCollbd-BMP-2, включающий в себя аминокислотную последовательность, определяющую способность данного белка связываться с коллагенсодержащим сорбентом, позволяет проводить в одну стадию концентрирование, очистку и иммобилизацию белка Collbd-BMP-2 на коллагенсодержащем сорбенте.
Достигается указанный технический результат также тем, что способ очистки, концентрирования и получения иммобилизованного рекомбинантного белка Collbd-BMP-2 заключается в обработке супернатанта гидролизата клеток штамма Е.coli M15 [pREP4, pCollbd-BMP-2] коллагенсодержащим сорбентом с последующей отмывкой сорбента с иммобилизованным рекомбинантным белком.
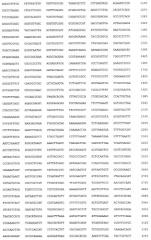
Изобретение проиллюстрировано графическими материалами, на которых изображены: на чертеже - схема плазмиды pCollbd-BMP-2, нуклеотидная последовательность плазмиды pCollbd-BMP-2 - последовательность №1, аминокислотная последовательность белка коллагенсвязывающего домена Collbd - последовательность №2, аминокислотная последовательность глицин-серинового спейсера - последовательность №3, аминокислотная последовательность костного морфогенетического белка BMP-2 - последовательность №4.
Все стандартные генно-инженерные и микробиологические манипуляции, а также амплификацию и секвенирование ДНК проводили по известным методикам (Маниатис Т., Фрич Э., Сэмбрук Дж. Молекулярное клонирование, М.: Мир, 1984; Клонирование ДНК. Методы. Под ред. Д. Гловера, пер. с англ., Москва: Мир, 1988; Saiki R.K., Gelfand D.H., Stoffel S., Sharf S.J., Higuchi R., Horn G.T, Mullis K.B, Eriich H.A. Science, 1988. V.239, №4839, p.487-491; Sanger F., Nicklen S., Coulson A.R. Proc. Nat. Acad. Sci. USA, 1977, V.74, p.5463-5467).
Ниже приведены примеры, иллюстрирующие изобретение.
Примеры.
Пример 1. Получение плазмиды pQE6-BMP-2.
а) Химический синтез олигодезоксирибонуклеотидов.
Олигодезоксирибонуклеотиды были синтезированы твердофазным фосфорамидитным методом с помощью синтезатора АСМ 100-2 (Новосибирск) и очищены методом электрофореза в 12%-ном ПААГ.
б) Получение гена ВМР-2 с последующим его клонированием.
Копию гена BMP-2 получали методом полимеразной цепной реакции, сопряженной с обратной транскрипцией (ОТ-ПЦР). Для этого проводили выделение тотальной РНК человека из скелетной мышцы человека. кДНК получали путем обработки 100 ng полиаденилированной РНК скелетной мышцы человека с помощью ImProm-II обратной транскриптазы Promega, согласно протоколу производителя.
Для последующей ПЦР были выбраны праймеры, соответствующие началу и концу гена BMP-2. В прямой праймер был введен сайт BamHI, а в обратный - сайты Bg1II, Kpn2I и стоп-кодон.
Dir 5'GGATCCAGATCCCAAGCCAAACACAAACAGCGGAAACGCCT3'
Rev: 5'TCCGGACTAAGATCTACACCCACAACCCTCCACAACCATGTCCTG3'
2 мкл полученной в результате обратной транскрипции смеси вносили в реакционную смесь для ПЦР, которая содержала 10 пкМ каждого праймера (Dir и Rev), 67 мМ трис-HCl (рН 8,8 при 25°С), 15 мМ сульфата аммония, 2,5 мМ хлористого магния, 0,01% Твин-20, смесь дезоксинуклеотидтрифосфатов (дАТФ, дЦТФ, дТТФ, дГТФ по 2,5 мМ) и 1 ед. полимеразы Native Pfu Polymerase (Stratagene). Реакцию амплификации проводили в объеме 25 мкл под вазелиновьм маслом: 1 цикл 95°С - 3 мин; 35 циклов: 95°С - 15 сек, 72°С - 1 мин.
Продукт амплификации размером 357 п.н. обрабатывали хлороформом, переосаждали этиловым спиртом и растворяли в воде. Для клонирования данного продукта полученную ДНК ВМР-2, а также ДНК плазмиды pQE6 («Qiagen», США) гидролизовали рестрикционными эндонуклеазами BamHI и Kpn21 при 37°С в буфере, содержащем 66 мМ Трис-ацетата (рН 7,9 при 37°С), 20 мМ ацетата магния, 132 мМ ацетата калия и 0,2 мг/мл BSA в течение 1,5 ч.
Выделенные из геля рестрикционные фрагменты: фрагмент ДНК, соответствующий гену BMP-2, размером 354 п.н. и фрагмент плазмиды pQE6 размером 3024 п.н., лигировали с помощью ДНК-лигазы бактериофага Т4. Эту конструкцию использовали для трансформации клеток Е.coli M15 [pREP4] методом электропорации. Трансформированные клетки отбирали на агаризованной среде LB с антибиотиками - ампициллином и канамицином. Плазмидную ДНК рВМР-2 выделяли методом щелочного лизиса, анализировали с помощью рестриктаз BamHI и BspEI, а также рестриктаз, находящихся внутри клонируемых фрагментов, и отбирали клоны, плазмидная ДНК которых рВМР-2 размером 3447 п.н. содержит последовательность гена BMP-2.
Первичную структуру полученной плазмиды подтверждали секвенированием.
г) Получение фрагмента гена SPARC, содержащего последовательность коллагенсвязывающего домена, с последующим его клонированием в плазмидную конструкцию рВМР-2.
Коллагенсвязывающий домен Collbd из внеклеточного белка SPARC (ВМ-40 или остеонектин) человека был синтезирован с использованием 4 олигонуклеотидов следующего состава:
Dirl: CATGGGATCCCTGGACTCTGAACTGACCGAATTCCCGCTGCGCATGCGT
Dir2: GACTGGCTGAAAAACCCGGGTGGTTCTA
Rev1: GATCTAGAACCACCCGGGTTTTTCAGCCAGTCACGCATG
Rev2: CGCAGCGGGAATTCGGTCAGTTCAGAGTCCAGGGATCC.
Олигонуклеотиды были спланированы таким образом, что при гибридизации они образуют двуцепочечный фрагмент ДНК, содержащий липкие концы, соответствующие сайтам гидролиза рестриктаз NcoI и BglII. При синтезе олигонуклеотиды были фосфорилированы по 5 - концу.
Для получения двухцепочечного фрагмента ДНК смесь олигонуклетидов (по 20 пкМ), прогревали при 95°С (10 мин) и в течение 4 часов охлаждали до 25°С. Полученную смесь объединяли с фрагментом плазмиды рВМР-2 (3376 п.н.), гидролизованной эндонуклеазами рестрикции NcoI и BamHI при 37°С в буфере, содержащем 66 мМ Трис-ацетат (рН 7,9 при 37°С), 20 мМ ацетат магния, 132 мМ ацетат калия в течение 1,5 часов. Лигирование проводили с помощью ДНК-лигазы фага Т4 в буфере, содержащем 40 мМ Трис-HCl (рН 7,8 при 25°С), 10 мМ хлористого магния, 10 мМ ДТТ и 5 мМ АТФ. Лигированную смесь ДНК использовали для трансформации клеток Е.coli M15 [pREP4] методом электропорации. Трансформированные клетки отбирали на агаризованной среде LB с антибиотиками канамицином (25 мкг/мл) и ампициллином (100 мкг/мл). Из отобранных рекомбинантных клонов выделяли плазмидную ДНК pCollbd-BMP-2 методом щелочного лизиса. Отобранные клоны секвенировали и подтвердили наличие вставки, соответствующей коллагенсвязывающему домену Collbd из внеклеточного белка SPARC (ВМ-40 или остеонектина) человека.
Пример 2. Получение штамма Е.coli - продуцента рекомбинантного белка Collbd-ВМР-2, состоящего из ВМР-2, спейсера, коллагенсвязывающего домена Collbd.
Для получения штамма Е.coli - продуцента рекомбинантного белка Collbd-BMP-2 - клетки штамма Е.coli M15 [pREP4] (Nals, Strs, rifs, lac-, ara-, gal-, mtl-, F-, recA+, uvr+) трансформировали плазмидой pCollbd-BMP-2. Трансформированные клетки выращивали в 500 мл среды LB при 37°С до оптической плотности, соответствующей 1 ед. поглощения при длине волны 600 нм, индуцировали 150 мкл 0,1 М раствора изопропил-бета-D-тиогалактопиранозида и выращивали в течение 4 часов.
Для контроля продукции рекомбинантного белка Collbd-BMP-2 клетками штамма Е.coli M15 [pREP4, pCollbd-BMP-2] применяли метод электрофореза в ПААГ в присутствии додецилсульфата натрия. Разделение белков проводили в 12%-ном полиакриламидном геле в стандартной системе буферов (электродный буфер: 25 мМ Трис-HCl, 192 мМ глицина, 0,1% додецилсульфата натрия, рН 8,3; буфер для геля: 375 мМ Трис-HCl, рН 8,8). По окончании электрофореза гели окрашивали 0,15% раствором Кумасси G250 в 25% изопропаноле и 10% уксусной кислоте и отмывали в 10% уксусной кислоте. При сравнении спектра белков у штаммов Е.coli M15 [pREP4] и Е.coli M15 [pREP4, pCollbd-BMP-2] обнаруживали появление дополнительной белковой полосы с молекулярной массой 16 кДа, что соответствует молекулярной массе рекомбинантного белка Collbd-BMP-2. Уровень синтеза белка Collbd-BMP-2 определяли, сравнивая интенсивность окрашивания полосы рекомбинантного белка с полосой соответствующего белка - стандарта молекулярной массы. Согласно полученным данным клетки штамма Е.coli M15 [pREP4, pCollbd-BMP-2] синтезируют около 12% Collbd-BMP-2 от общего белка клеток.
Пример 3. Способ получения препарата белка Collbd-BMP-2, иммобилизированного на коллагенсодержащем сорбенте.
Клетки Е.coli M15 [pREP4], трансформированные плазмидой pCollbd-BMP-2, выращивали в 3,5 мл среды LB с ампициллином и канамицином при 37°С до оптической плотности, соответствующей 1 ед. поглощения при длине волны 600 нм., добавляли 3 мкл 0,1 М раствора изопропил-бета-Б-тиогалактопиранозида и выращивали в течение 4 ч. Культуру разводили до оптической плотности 0,7 при 530 нм, отбирали 400 мкл суспензии, осаждали клетки центрифугированием при 5000 об/мин в течение 10 мин. Клетки ресуспендировали в 500 мкл фосфатно-цитратного буфера (ФЦБ, 50 мМ, рН 6.0), разрушали ультразвуком, клеточный дебрис удаляли центрифугированием при 16000 об/мин в течение 10 мин.
К 100 мкл 50% суспензии желатин-сефарозы добавляли 2 мл буферного раствора, содержащего 30 мМ Трис, рН 8,0, и 0,15 М хлорида натрия, а также лизат клеток в 7 М растворе гуанидинхлорида. Инкубировали при +4°С в течение 2 ч, затем оставляли на 16 ч при той же температуре. Центрифугировали полученную суспензию в течение 5 мин при 5000 об/мин. Осадок сорбента со связавшимся белком трижды отмывали буферным раствором, содержащим 30 мМ Трис, рН 8,0, и 0,15 М хлорида натрия.
Элюцию белка проводили буферным раствором, содержащим 6 М мочевины, 30 мМ Трис, рН 8,0, и 10 мМ ЭДТА. Анализ результатов связывания и элюции рекомбинантного белка Collbd-BMP-2 проводили методом электрофореза по Лэммли в 12% ПААГ в денатурирующих условиях.
По результатам электрофореза в ПААГ в присутствии ДСН концентрация белка Collbd-BMP-2 составляла 10 мг на 1 мл сорбента.
1. Рекомбинантный белок Collbd-BMP-2, состоящий из коллагенсвязывающего домена Collbd из внеклеточного кальций зависимого белка SPARC человека с последовательностью SEQ ID NO: 2, спейсера из остатков глицина и серина с последовательностью SEQ ID NO: 3 и костного морфогенетического белка ВМР-2 с последовательностью SEQ ID NO: 4, обладающий биологическими свойствами белка BMP-2 и способностью самопроизвольно связываться с коллагенсодержащим сорбентом.
2. Рекомбинантная плазмида pCollbd-BMP-2 с последовательностью SEQ ID NO: 1, обеспечивающая экспрессию рекомбинантного белка Collbd-BMP-2 по п.1, содержащаяискусственный бактериальный оперон химерных белков, включающий промоторную область раннего промотора бактериофага Т5, обеспечивающий эффективную транскрипцию контролируемой мРНК;рекомбинантный ген, обеспечивающий экспрессию целевого химерного белка по п.1;нетранслируемую область терминации транскрипции бактериального оперона, обеспечивающую эффективное окончание транскрипции;бактериальный оперон bla, кодирующий белок бета-лактамазу, являющуюся селективным маркером для отбора клонов-трансформантов Е.coli методом контрселекции;бактериальный участок инициации репликации типа ColEl, обеспечивающий репликацию плазмиды в штаммах Е.coli.
3. Штамм Escherichia coli M15 [pREP4, pCollbd-BMP-2], полученный трансформацией штамма Escherichia coli M15/pREP4 плазмидой pCollbd-BMP-2 по n.2, - продуцент рекомбинантного белка Collbd-BMP-2 по п.1.
4. Способ получения рекомбинантного белка Collbd-BMP-2 по п.1, включающий выращивание клеток штамма Escherichia coli M15 [pREP4, pCollbd-BMP-2], индукцию синтеза белка Collbd-BMP-2 по п.1, разрушение клеток, получение супернатанта, содержащего белок, иммобилизацию белка путем добавления к супернатанту суспензии коллагенсодержащего сорбента, инкубирование, отмывание сорбента со связавшимся белком, последующую элюцию белка с сорбента и диализ.