3,11b-цис-дигидротетрабеназин для лечения пролиферативного заболевания или воспаления
Иллюстрации
Показать всеПредложено применение 3,11b-цис-дигидротетрабеназина (ранее известный для лечения гиперкинезов) или его фармацевтически приемлемой соли для производства лекарственного средства для профилактики или лечения воспалительного заболевания и соответствующий способ профилактики (лечения). Показано, что все стереоизомеры 3,11b-цис-дигидротетрабеназина связываются с сигма-1- и сигма-2-рецепторами, модулируют продукцию цитокинов моноцитами человека, в высоких концентрациях подавляют пролиферацию Т-клеток (Т-клетки являются регуляторами воспаления при широком ряде заболеваний). В частности, изомер D снижал продукцию IL-2, IL-4, IL-5, IL-10, IL-12, TNF-α. 2 н. и 11 з.п. ф-лы, 6 ил., 14 табл.
Реферат
Данное изобретение относится к применению дигидротетрабеназина для профилактики или лечения воспалительных заболеваний и злокачественных опухолей.
Уровень техники
Рак является общим термином, данным группе заболеваний, характеризующихся аномальным или неконтролируемым ростом клеток. В норме клетки растут и делятся с образованием новых клеток, только когда организм нуждается в них. Когда клетки стареют и погибают, их место занимают новые клетки. Мутации генов в клетке могут иногда нарушить этот процесс таким образом, что новые клетки появляются, когда организм не нуждается в них, и старые клетки не погибают, когда должна иметь место их гибель. Дополнительные клетки образуют массу ткани, называемую ростом, новообразованием или опухолью. Опухоли могут быть доброкачественными (не раковыми) или злокачественными (раковыми). Доброкачественные опухоли не проникают в другие области организма, и они редко представляют угрозу для жизни, в то время как злокачественные опухоли могут распространяться (метастазировать) и угрожать жизни. Злокачественные опухоли происходят от одной клетки и, следовательно, их можно классифицировать, основываясь на типе клетки, от которой они берут свое начало, и по локализации клетки. Так, аденомы происходят от железистой ткани, карциномы происходят от эпителиальных клеток, лейкемии получают развитие от стволовых клеток костного мозга, лимфомы происходят от лимфатической ткани, меланомы начинают свое развитие в меланоцитах, саркомы - в соединительной ткани костей или мышц, и тератомы развиваются из зародышевых клеток.
Существуют различные способы лечения злокачественных опухолей, и чаще всего это хирургическая операция, химиотерапия и лучевая терапия. Как правило, выбор лечения зависит от локализации и категории опухоли и стадии заболевания. Если опухоль является локализованной, то часто хирургическая операция является предпочтительным видом лечения. Примеры общих хирургических вмешательств включают простатэктомию для рака простаты и мастэктомию для рака молочной железы. Целью операций является либо удаление только опухоли, либо всего органа. Поскольку одна раковая клетка может развиться до опухоли значительных размеров, то удаление только опухоли сопряжено с большей вероятностью возникновения рецидива. Химиотерапия включает лечение рака лекарственными препаратами, которые могут нарушить или остановить рост раковых клеток. Альтернативные механизмы, используемые в химиотерапии злокачественных опухолей, включают антиангиогенные препараты, действие которых проявляется в нарушении кровеносных сосудов, поставляющих кровь в опухоли, и иммунотерапевтические средства, которые стимулируют проявление иммунного ответа у хозяина против опухолевой ткани. Нормальные клетки растут и погибают контролируемым путем. В случае злокачественных опухолей клетки в организме, которые являются аномальными, сохраняют деление и образование всего большего количества клеток без контроля. Механизм одной группы противоопухолевых лекарственных средств заключается в индукции гибели делящихся клеток или остановки их роста или размножения. Также при этом могут быть затронуты здоровые клетки, особенно которые быстро делятся, и это может привести к проявлению побочных эффектов. Лучевая терапия основана на применении ионизирующей радиации для того, чтобы вызвать гибель клеток и элиминацию опухолей. Лучевая терапия приводит к повреждению или разрушению клеток в области, которая подвергается воздействию («ткани-мишени»), посредством повреждения их генетического материала, делая невозможным для данных клеток продолжать рост и деление. Несмотря на то, что радиация повреждает как раковые, так и нормальные клетки, большая часть нормальных клеток может восстановиться от действия облучения и правильно функционировать. Целью лучевой терапии является повреждение как можно большего количества раковых клеток, одновременно ограничивая вредное действие в отношении смежной здоровой ткани. Лучевую терапию можно использовать для лечения почти всех типов солидных опухолей, включая злокачественные опухоли мозга, молочной железы, рак шейки матки, злокачественные опухоли гортани, поджелудочной железы, простаты, рак кожи, позвоночника, злокачественные опухоли желудка, матки или саркомы мягких тканей. Облучение также можно использовать для лечения лейкемии и лимфомы (злокачественные заболевания соответственно кроветворных клеток и лимфатической системы).
Сообщалось, что лиганды сигма (δ)-рецепторов обладают способностью подавлять рост опухолевых клеток (Berthois et al., British Journal of Cancer (2003), 88, 438-446). Bourrie et al. (Current Opinion in Investigational Drugs (2004), 5(11): 1158-63) сообщили, что два подтипа сигма-рецепторов и два связанных с ними белка также экспрессируются на опухолевых клетках.
Сигма-рецепторы являются клеточными поверхностными рецепторами, которые рассматривают в качестве подтипа опиатных рецепторов, но в настоящее время показано после характеристики рецепторов и открытия специфических лигандов для рецепторов, что они отличаются от опиатных рецепторов (см. Bourrie et al. (2004)).
Сигма-рецепторы можно разделить на подтипы сигма-1 (σ-1) и сигма-2 (σ-2). Клонирован σ-1-рецептор, который, как полагают, содержит 223 аминокислоты (Hanner et al., Proc. Natl. Acad. Sci. USA (1996), 93: 8072-8077), и было установлено, что у него отсутствует гомология первичной последовательности по отношению к любой другой группе рецепторов. Однако он обладает 30,3% идентичностью к последовательности стерол-С8-С7-изомеразы грибов, и также было установлено, что он близок к другому белку с неизвестной функцией, SRBP2 (SR-31747-связывающий белок 2), который имеет высокую гомологию с данным ферментом. Рецептор σ-2 пока еще не клонирован.
Wang et al., Breast Cancer Research & Treatment (2004), 87(3): 205-14, исследовали экспрессию сигма-1-рецептора в злокачественной опухоли молочной железы человека и обнаружили наличие сверхэкспрессии мРНК сигма-1-рецептора в 64% злокачественных опухолей молочной железы по сравнению с нормальной тканью, на основе этих данных авторы пришли к заключению, что некоторые нормальные и большинство злокачественных эпителиальных клеток молочной железы и клеточные линии обычно могут экспрессировать сигма-1-рецептор. Они также обнаружили, что галоперидол, неспецифический лиганд сигма-1, в высоких концентрациях подавлял рост данных клеток и усиливал действие химиотерапии в условиях in vitro.
Berthois et al. (2003) описали результаты исследований, в которых оценивалось влияние сигма-рецептора лиганда SR31747A на пролиферацию человеческих эпителиальных клеток злокачественной опухоли молочной железы и злокачественной опухоли простаты. Они сообщили, что в условиях in vitro SR31747A в наномолярных концентрациях существенно подавлял пролиферацию клеток в обеих гормон-зависимых и гормоннезависимых злокачественных клеточных линиях. Они также установили, что развитие опухолей в значительной мере подавлялось у мышей, которые подвергались обработке SR31747A.
Spruce et al., Cancer Research (2004), 64: 4875-4886, сообщили, что антагонист σ-1 рецептора с небольшой молекулой подавляет рост возникающих и развившихся гормон-чувствительных и гормон-нечувствительных ксенотрансплантатов карциномы молочной железы, ортотопических опухолей простаты и ксенотрансплантатов карциномы легких без р53 у мышей с нарушением иммунной реактивности при отсутствии побочных эффектов. Они обнаружили, что антагонисты σ-1 индуцировали апоптоз (запрограммированную гибель клеток) опухолевых клеток, но не большинства нормальных типов клеток. Spruce et al. пришли к заключению, что применение антагонистов σ-1 может представлять собой предполагаемый способ индукции элиминации опухолей, не затрагивая при этом нормальные ткани.
Другие сообщения о применении лигандов σ-1-рецепторов для подавления пролиферации раковых клеток можно найти в источниках, цитированных Spruce et al. (2004), см., например, Brent et al., Eur. J. Pharmacol., (1995), 278: 151-60 и Crawford et al., Cancer Research (2002), 62: 313-22.
Следовательно, четко установлено, что лиганды сигма-рецепторов могут подавлять пролиферацию раковых клеточных линий и могут индуцировать апоптоз раковых клеток, и на основе данного факта предполагается, что лиганды сигма-рецепторов, такие как антагонисты сигма-1, будут полезными для лечения злокачественных опухолей.
Также сообщалось, что лиганды сигма-рецепторов обладают противовоспалительной активностью. Например, Bourrie et al., Eur. J. Pharmacol. (2002), 456(1-3): 123-31 сообщают, что соединение SSR125329A (химическое название [(Z)-3-(4-адамантан-2-ил-3,5-дихлорфенил)аллил]циклогексилэтиламин), полученное Sanofi-Synthelabo Recherche, представляет собой лиганд сигма-рецептора с высокой аффинностью, обладающий высокой противовоспалительной активностью. Bourrie et al. пришли к заключению, что результаты их исследований являются вескими доказательствами того, что лиганды сигма-рецепторов могут представлять новый эффективный подход для лечения ревматоидного артрита.
Другой антагонист сигма-рецептора Sanofi (SR31747) в настоящее время находится на стадии клинических испытаний, проводимых с целью лечения ревматоидного артрита.
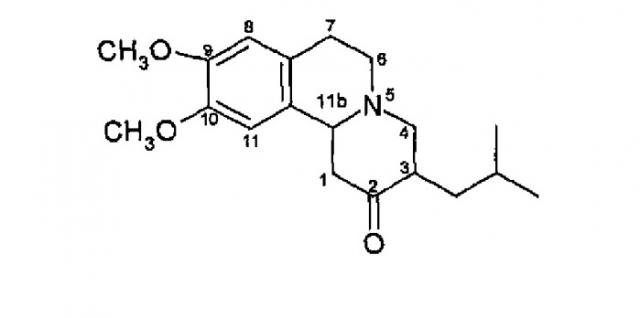
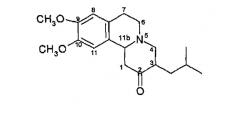
Тетрабеназин (химическое название: 1,3,4,6,7,11b-гексагидро-9,10-диметокси-3-(2-метилпропил)-2Н-бензо(а)хинолизин-2-он) применяют в качестве фармацевтического препарата с конца 50-х годов прошлого века. Разработанный первоначально в качестве антипсихотического средства в настоящее время тетрабеназин применяют для симптоматического лечения гиперкинетических двигательных нарушений, таких как болезнь Гентингтона, гемибаллизмус, старческая хорея, тик, поздняя дискинезия и синдром Туретта, см., например, Jankovic et al., Am. J. Psychiatry (1999) Aug., 156(8): 1279-81 и Jankovic et al., Neurology (1997) Feb., 48(2): 358-62.
Химическая структура тетрабеназина приведена на фиг.1 ниже.
Фиг.1 - Структура тетрабеназина
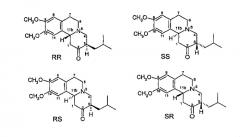
Соединение имеет хиральные центры в 3 и 11b атомах углерода и, следовательно, теоретически может находиться в виде четырех изомеров, как показано на фиг.2.
Фиг.2 - Возможные изомеры тетрабеназина
На фиг.2 стереохимия каждого изомера определяется с использованием номенклатуры «R и S», разработанной Cahn, Ingold и Prelog, см. Advanced Organic Chemistry by Jerry March, 4th Edition, John Wiley & Sons, New York, 1992, pages 109-114. На фиг.2 и в других местах данной заявки на патент обозначения «R» или «S» даны в порядке номеров положений атомов углерода. Так, например, RS представляет стенографическое обозначение 3R,11bS. Аналогично, когда присутствует три хиральных центра, как это имеет место в дигидротетрабеназине, представленном ниже, то обозначения «R» или «S» приводятся в порядке атомов углерода 2, 3 и 11b. Так, изомер 2S,3R,11bR относится к стенографическому обозначению SRR и так далее.
Промышленно доступный тетрабеназин представляет рацемическую смесь R- и SS-изомеров, и оказалось, что RR- и SS-изомеры (ниже относится по отдельности или в общем к транс-тетрабеназину, поскольку атомы водорода в положениях 3 и 11b имеют относительную транс-ориентацию) являются наиболее термодинамически стабильными изомерами.
Тетрабеназин обладает несколько слабой и колеблющейся биодоступностью. Он подвергается интенсивному метаболизму и в моче, как правило, обнаруживается незначительное количество неизмененного тетрабеназина или он вовсе отсутствует. Основным метаболитом является дигидротетрабеназин (химическое название: 2-гидрокси-3-(2-метилпропил)-1,3,4,6,7,11b-гексагидро-9,10-диметоксибензо(а)хинолизин), который образуется при восстановлении 2-кетогруппы в тетрабеназине, и полагают, что он является ответственным за проявление активности лекарственного препарата (см. Mehvar et al., Drug Metab. Disp., 15, 250-255 (1987) и J. Pharm. Sci., 76, № 6, 461-465 (1987)).
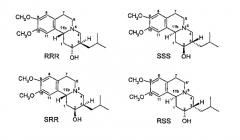
Раннее были идентифицировано и охарактеризовано четыре изомера дигидротетрабеназина, все они были получены из более стабильных RR- и SS-изомеров исходного тетрабеназина, и они имеют относительную транс-ориентацию между атомами водорода в положениях 3 и 11b (см. Kilbourn et al., Chirality, 9: 59-62 (1997) и Brossi et al., Helv. Chim. Acta, vol. XLI, No 193, pp. 1793-1806 (1958)). Четырьмя изомерами являются (+)-α-дигидротетрабеназин, (-)-α-дигидротетрабеназин, (+)-β-дигидротетрабеназин и (-)-β-дигидротетрабеназин. Структуры четырех известных изомеров дигидротетрабеназина представляют собой следующее:
Фиг.3 - Структуры известных изомеров дигидротетрабеназина
Kilbourn et al. (см. Eur. J. Pharmacol., 278: 249-252 (1995) и Med. Chem. Res., 5: 113-126 (1994)) исследовали специфическое связывание отдельных меченных радиоактивной меткой изомеров дигидротетрабеназина в мозге здоровой крысы. Они обнаружили, что (+)-α-[11C]дигидротетрабеназин, (2R,3R,11bR)-изомер, накапливается в областях мозга, ассоциированных с более высокими концентрациями нейронного мембранного переносчика дофамина (DAT) и везикулярного переносчика моноамина (VMAT2). Однако по существу неактивный изомер (-)-α-[11C]дигидротетрабеназин был практически однородно распределен в ткани мозга, на основании чего можно предположить, что в данном случае отсутствует специфическое связывание с DAT и VMAT2. Результаты исследований в условиях in vivo коррелировали с данными опытов in vitro, которые показали, что изомер (+)-α-[11C]дигидротетрабеназин имеет более высокое значение Ki для [3H]метокситетрабеназина более чем в 2000 раз выше по сравнению с Ki для изомера (-)-α-[11C]дигидротетрабеназина.
В более ранней международной заявке на патент настоящих заявителей № PCT/GB2005/000464 раскрывается получение и применение фармацевтических изомеров дигидротетрабеназина, полученных из RS- и SR-изомеров (ниже относится по отдельности или в общем к цис-тетрабеназину, поскольку атомы водорода в положениях 3 и 11b имеют относительную цис-ориентацию) тетрабеназина. В PCT/GB2005/000464 приводятся экспериментальные данные, показывающие, что изомеры цис-дигидротетрабеназина связываются с сигма-1- и сигма-2-рецепторами, но не раскрывают какие-либо терапевтические применения за счет использования способности к связыванию с сигма-рецепторами.
Сущность изобретения
Настоящее изобретение относится к применению цис-дигидротетрабеназина, описанного в более ранней заявке настоящих заявителей № PCT/GB2005/000464, для лечения воспалительных заболеваний и злокачественных опухолей.
Следовательно, в первом аспекте изобретение относится к 3,11b-цис-дигидротетрабеназину для применения в профилактике или лечении пролиферативного заболевания или воспалительного заболевания.
В одном варианте осуществления пролиферативное заболевание представляет собой рак.
Следовательно, изобретение относится к 3,11b-цис-дигидротетрабеназину для применения в профилактике или лечении пролиферативного заболевания, такого как рак.
Также изобретение относится к
• применению 3,11b-цис-дигидротетрабеназина для производства лекарственного средства для лечения пролиферативного заболевания, такого как рак;
• применению цис-дигидротетрабеназина для производства лекарственного средства для профилактики или лечения заболевания, или состояния (например, рака), возникающего в результате аномального роста клеток;
• способу лечения заболевания или состояния (например, рака), вызванного или возникающего в результате аномального роста клеток у млекопитающего, где способ включает введение млекопитающему терапевтически эффективного количества цис-дигидротетрабеназина;
• способу лечения заболевания или состояния (например, рака), вызванного или возникающего в результате аномального роста клеток у млекопитающего, где способ включает введение млекопитающему цис-дигидротетрабеназина в количестве, эффективном для подавления аномального роста клеток;
• способу ослабления или снижения частоты развития заболевания или состояния (например, рака), вызванного или возникающего в результате аномального роста клеток у млекопитающего, где способ включает введение млекопитающему цис-дигидротетрабеназина в количестве, эффективном для подавления аномального роста клеток.
Предусматривается, что соединения по изобретению будут пригодными для лечения или профилактики одного или более злокачественных заболеваний, выбранных из
аденом;
карцином;
лейкемий;
лимфом;
меланом;
сарком и
тератом.
Конкретные примеры злокачественных заболеваний, развитие которых можно подавлять или которые можно лечить, включают, но не ограничиваются этим, карциному, например карциному мочевого пузыря, молочной железы, ободочной кишки (например, колоректальные карциномы, такие как аденокарцинома ободочной кишки и аденома ободочной кишки), почек, эпидермальную карциному, карциному печени, легких, например аденокарциному, мелкоклеточную карциному легких и немелкоклеточную карциному легких, карциному пищевода, желчного пузыря, яичников, поджелудочной железы, например экзокринную карциному поджелудочной железы, карциному желудка, рак шейки матки, карциному щитовидной железы, простаты или рак кожи, например плоскоклеточную карциному; гематопоэтическую опухоль лимфоидного происхождения, например лейкемию, острую лимфоцитарную лейкемию, В-клеточную лимфому, Т-клеточную лимфому, лимфому Ходжкина, не-ходжкинскую лимфому, волосистоклеточную лимфому или лимфому Беркитта; гематопоэтическую опухоль миелоидного происхождения, например острые и хронические миелогенные лейкемии, миелодиспластический синдром или промиелоцитарную лейкемию; фолликулярную карциному щитовидной железы; опухоль мезенхимного происхождения, например фибросаркому или габдомиосаркому; опухоль центральной или периферической нервной системы, например астроцитому, нейробластому, глиому или шванному; меланому; семиному; тератокарциному; остеосаркому; пигментную ксенодерому; кератоакантому; фолликулярную карциному щитовидной железы или саркому Капоши.
Конкретнее, злокачественные опухоли, которые можно лечить или подавлять их рост при применении цис-дигидротетрабеназина, представляют собой злокачественные опухоли, которые являются чувствительными к лигандам сигма-рецепторов, например антагонистам σ-1.
Дополнительными примерами злокачественных опухолей, которые можно лечить или подавлять их рост при применении цис-дигидротетрабеназина, являются такие злокачественные опухоли, в которых имеет место гиперэкспрессия сигма-рецепторов.
В конкретном варианте осуществления карцинома представляет карциному молочной железы.
В другом конкретном варианте осуществления карцинома представляет опухоль простаты, например ортотопическую опухоль простаты.
В конкретном варианте осуществления злокачественная опухоль представляет злокачественную опухоль легких.
В другом общем варианте осуществления изобретение относится к 3,11b-цис-дигидротетрабеназину для применения при лечении воспалительного заболевания.
Также изобретение относится к
• применению 3,11b-цис-дигидротетрабеназина для производства лекарственного средства для профилактики или лечения воспалительного заболевания;
• способу профилактики или лечения воспалительного заболевания или состояния у пациента (например, млекопитающего, такого как человек), где способ включает введение млекопитающему терапевтически эффективного количества 3,11b-цис-дигидротетрабеназина.
Примеры воспалительных заболеваний или состояний включают, но не ограничиваются этим, ревматоидный артрит, остеоартрит, травматический артрит, подагрический артрит, артрит при коревой краснухе, псориатический артрит и другие виды артритов; острые или хронические воспалительные заболевания, такие как воспалительная реакция, индуцированная эндотоксином, или воспалительное заболевание кишечника; синдром Рейтера, подагру, ревматоидный спондилит, хроническое воспалительное заболевание легких, болезнь Крона и язвенный колит.
Конкретными воспалительными заболеваниями и состояниями являются таковые, которые чувствительны к лигандам сигма-рецепторов, например антагонистам сигма.
Одно конкретное воспалительное заболевание представляет собой ревматоидный артрит.
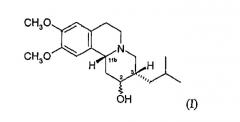
Цис-дигидротетрабеназин, используемый в настоящем изобретении, является 3,11b-цис-дигидротетрабеназином.
3,11b-Цис-дигидротетрабеназин, используемый в изобретении, может находиться в основном в чистой форме, например с изомерной чистотой выше 90%, как правило, выше 95% и наиболее предпочтительно выше 98%.
Термин «изомерная чистота» в настоящем контексте относится к присутствующему количеству 3,11b-цис-дигидротетрабеназина относительно общего количества или концентрации дигидротетрабеназина во всех изомерных формах. Например, если в композиции 90% от общего имеющегося содержания дигидротетрабеназина представляет 3,11b-цис-дигидротетрабеназин, то изомерная чистота составляет 90%.
11b-Цис-дигидротетрабеназин, используемый в изобретении, может находиться в форме композиции, которая в основном не содержит 3,11b-транс-дигидротетрабеназин, предпочтительно содержит менее чем 5% 3,11b-транс-дигидротетрабеназина, более предпочтительно менее чем 3% 3,11b-транс-дигидротетрабеназина и наиболее предпочтительно менее чем 1% 3,11b-транс-дигидротетрабеназина.
Термин «3,11b-цис», в том смысле, в котором он используется в описании, означает, что атомы водорода в положениях 3 и 11b формулы дигидротетрабеназина находятся в относительной цис-ориентации. Следовательно, изомеры по изобретению представляют собой соединения формулы (I) и их антиподы (зеркальные отражения).
Имеется четыре возможных изомера дигидротетрабеназина, имеющих 3,11b-цис-конфигурацию, и они представляют собой 2S,3S,11bR-изомер, 2R,3R,11bS-изомер, 2R,3S,11bR-изомер и 2S,3R,11bS-изомер. Четыре изомера были выделены и охарактеризованы, и в другом аспекте изобретение относится к отдельным изомерам 3,11b-цис-дигидротетрабеназина. В частности, изобретение относится к
(а) 2S,3S,11bR-изомеру 3,11b-цис-дигидротетрабеназина с формулой (Ia):
(b) 2R,3R,11bS-изомеру 3,11b-цис-дигидротетрабеназина с формулой (Ib):
(с) 2R,3S,11bR-изомеру 3,11b-цис-дигидротетрабеназина с формулой (Iс):
и
(d) 2S,3R,11bS-изомеру 3,11b-цис-дигидротетрабеназина с формулой (Id):
Отдельные изомеры по изобретению можно охарактеризовать по их спектроскопическим, оптическим и хроматографическим свойствам и также по их абсолютным стереохимическим конфигурациям, которые определяют рентгеновской кристаллографией.
Без учета любой конкретной абсолютной конфигурации или стереохимии четыре новых изомера могут быть охарактеризованы следующим образом:
Изомер А
Оптическая активность, определенная ORD (оптическая вращательная дисперсия) (метанол, 21°С): левовращающий (-); ИК-спектр (твердый КBr), 1Н-ЯМР-спектр (CDCl3) и 13С-ЯМР-спектр (CDCl3), в основном, как представлено в таблице 1.
Изомер В
Оптическая активность, определенная ORD (метанол, 21°С): правовращающий (+); ИК-спектр (твердый КBr), 1Н-ЯМР-спектр (CDCl3) и 13С-ЯМР-спектр (CDCl3), в основном, как представлено в таблице 1, и свойства в рентгеновской кристаллографии, как описано в примере 4.
Изомер С
Оптическая активность, определенная ORD (метанол, 21°С): правовращающий (+); ИК-спектр (твердый КBr), 1Н-ЯМР-спектр (CDCl3) и 13С-ЯМР-спектр (CDCl3), в основном, как представлено в таблице 2.
Изомер D
Оптическая активность, определенная ORD (метанол, 21°С): левовращающий (-); ИК-спектр (твердый КBr), 1Н-ЯМР-спектр (CDCl3) и 13С-ЯМР-спектр (CDCl3), в основном, как представлено в таблице 2.
Значения, полученные ORD, для каждого изомера приведены в примерах ниже, но следует отметить, что эти значения приводятся в качестве примера и могут варьировать в зависимости от степени чистоты изомера и влияния других переменных величин, таких как колебания температуры и влияние остаточных молекул растворителя.
Каждый из энантиомеров A, B, C и D может находиться в основном в энантиомерно чистой форме или в виде смесей с другими энантиомерами по изобретению.
Термины «энантиомерная чистота» и «энантиомерно чистый» в настоящем контексте относятся к присутствующему количеству данного энантиомера 3,11b-цис-дигидротетрабеназина по отношению к общему количеству или концентрации всех энантиомеров и изомеров дигидротетрабеназина. Например, если в композиции 90% от общего присутствующего количества дигидротетрабеназина находится в виде одного изомера, то энантиомерная чистота составляет 90%.
В качестве примера в каждом аспекте и варианте осуществления изобретения каждый отдельный энантиомер, выбранный из изомеров A, B, C и D, может иметь энантиомерную чистоту, равную, по меньшей мере, 55% (например, по меньшей мере, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95%, 97%, 98%, 99%, 99,5% или 100%).
Изомеры по изобретению также могут находиться в виде смесей одного или более изомеров A, B, C и D. Такие смеси могут представлять собой рацемические смеси или нерацемические смеси. Примеры рацемических смесей включают рацемическую смесь изомера А и изомера В и рацемическую смесь изомера С и изомера D.
Фармацевтически приемлемые соли
Если в контексте не требуется иначе, то в данной заявке обращение к дигидротетрабеназину и его изомерам относится не только к свободному основанию дигидротетрабеназина, но также его солям и, в частности, аддитивным солям кислоты.
Конкретные кислоты, из которых получают аддитивные соли кислоты, включают кислоты, имеющие значение рК ниже 3,5 и, как правило, ниже 3. Например, аддитивные соли кислоты можно получить из кислоты, имеющей значение рК в пределах от +3,5 до -3,5.
Предпочтительные аддитивные соли кислоты включают таковые, полученные из сульфоновых кислот, таких как метансульфоновая кислота, этансульфоновая кислота, бензолсульфоновая кислота, толуолсульфоновая кислота, камфорсульфоновая кислота и нафталинсульфоновая кислота.
Одной конкретной кислотой, из которой можно получить аддитивные соли кислоты, является метансульфоновая кислота.
Аддитивные соли кислоты можно получить способами, описанными в описании, или обычными химическими способами, такими, как описаны в Pharmaсeuticals Salts: Properties, Selection and Use, P. Heinrich Stahl (Editor), Camille G. Wermuth (Editor), ISBN: 3-90639-026-8, Hardcover, 388 pages, August 2002. Как правило, такие соли можно получить взаимодействием свободного основания соединения с соответствующим основанием или кислотой в воде или органическом растворителе, или смеси этих двух компонентов; обычно используются неводные среды, такие как диэтиловый эфир, этилацетат, этанол, изопропанол или ацетонитрил.
Как правило, соли являются фармацевтически приемлемыми солями. Однако также можно получить соли, которые не являются фармацевтически приемлемыми солями, в качестве промежуточных продуктов, которые затем можно превратить в фармацевтически приемлемые соли. Такие не фармацевтически приемлемые соли также формируют часть изобретения.
Способы получения изомеров дигидротетрабеназина
Дигидротетрабеназин можно получить способом, включающим взаимодействие соединения формулы (II):
с реагентом или реагентами, подходящими для гидратации по 2,3-двойной связи в соединении формулы (II) и затем, когда это требуется, отделение и выделение желаемого изомера дигидротетрабеназина.
Гидратацию по 2,3-двойной связи можно провести гидроборированием с использованием боранового реагента, такого как диборан, или комплекса боран-простой эфир (например, комплекса боран-тетрагидрофуран (ТГФ)) c получением промежуточного аддукта алкилборана с последующим окислением аддукта алкилборана и гидролизом в присутствии основания. Как правило, гидроборирование проводят в сухом неполярном растворителе, таком как простой эфир (например, ТГФ), обычно при невысокой температуре, например при комнатной температуре. Как правило, аддукт алкенборан окисляют окислителем, таким как перекись водорода в присутствии основания, обеспечивающего источник гидроксидных ионов, такого как гидроксид аммония или гидроксид щелочного металла, например гидроксид калия или гидроксид натрия. Обычно последовательность реакций гидроборирование-окисление-гидролиз в способе А обеспечивает изомеры дигидротетрабеназина, в которых атомы водорода в положениях 2 и 3 имеют относительную трансориентацию.
Соединения формулы (II) можно получить восстановлением тетрабеназина с получением дигидротетрабеназина с последующей дегидратацией дигидротетрабеназина. Восстановление тетрабеназина можно провести с использованием гидрида алюминия, такого алюмогидрид лития, или боргидрида, такого как боргидрид натрия, боргидрид калия, или производного боргидрида, например алкилборгидрида, такого как три-вторичный бутилборгидрид лития. Альтернативно стадию восстановления можно проводить с использованием каталитического гидрирования, например, с использованием катализатора никеля Ренея или оксида платины. Подходящие условия проведения стадии восстановления более подробно описаны, и их можно найти в патенте США 2843591 (Hoffmann-La Roche) и Brossi et al., Helv. Chim. Acta, vol. XLI, № 193, pp. 1793-1806 (1958).
За счет того, что тетрабеназин, используемый в качестве исходного вещества для реакции восстановления, как правило, представляет смесь RR- и SS-изомеров (т.е. транс-тетрабеназин), то дигидротетрабеназин, образовавшийся на стадии восстановления, будет иметь ту же транс-конфигурацию в отношении положений 3 и 11b и будет принимать форму одного или более известных изомеров дигидротетрабеназина, представленных на фиг.3, выше. Таким образом, способ А включает приобретение известных изомеров дигидротетрабеназина, их дегидратацию с получением алкена (II) и затем «регидратацию» алкена (II) с использованием условий, которые обеспечивают новые изомеры цис-дигидротетрабеназина по изобретению.
Дегидратацию дигидротетрабеназина в алкен (II) можно провести с использованием различных обычных условий для дегидратации спиртов с получением алкенов, например, см. J. March (в том же источнике), страницы 389-390 и цитированные там источники. Примеры таких условий включают применение дегидратирующих реагентов на основе фосфора, таких как галогениды фосфора или оксигалогениды фосфора, например POCl3 и PCl5. В качестве альтернативного способа прямой дегидратации гидроксильную группу дигидротетрабеназина можно превратить в уходящую группу L, такую как атом галогена (например, атом хлора или брома) и затем подвергнуть воздействию условий (например, в присутствии основания) для удаления H-L. Превращение гидроксильной группы в галогенид можно провести с использованием способов, хорошо известных специалистам в области химии, например, взаимодействием с тетрахлоридом углерода или тетрабромидом углерода в присутствии триалкил- или триарилфосфина, такого как трифенилфосфин или трибутилфосфин.
Тетрабеназин, используемый в качестве исходного вещества для восстановления с получением дигидротетрабеназина, можно получить из промышленных источников или можно синтезировать способом, описанным в патенте США 2830993 (Hoffmann-La Roche).
Другой способ (способ В) получения дигидротетрабеназина по изобретению включает воздействие на соединение формулы (III):
условий для раскрытия цикла 2,3-эпоксидной группы в соединении формулы (III) и затем, когда это требуется, отделение и выделение желаемого изомера дигидротетрабеназина.
Раскрытие цикла можно провести, следуя известным способам раскрытия эпоксидных групп. Однако в настоящее время предпочтительным способом раскрытия цикла эпоксида является восстановительное раскрытие цикла, которое достигается с использованием восстанавливающего реагента, такого как комплекс боран-ТГФ. Реакцию с комплексом боран-ТГФ можно провести в полярном, непротонном растворителе, таком как простой эфир (например, тетрагидрофуран), как правило, при температуре окружающей среды, где затем полученный таким образом борановый комплекс гидролизуют при нагревании в присутствии воды и основания при температуре кипения растворителя. Как правило, с помощью способа В получают изомеры дигидротетрабеназина, в которых атомы водорода в положениях 2 и 3 имеют относительную цис-ориентацию.
Эпоксидные соединения формулы (III) можно получить эпоксидированием алкена формулы (II), представленной выше. Реакцию эпоксидирования можно провести с использованием условий и реагентов, хорошо известных специалистам в области химии, см., например, J. March (в том же источнике), страницы 826-829 и цитированные там источники. Как правило, для эпоксидирования, можно использовать перкислоту, такую как мета-хлорпербензойная кислота (МСРВА), или смесь перкислоты и дополнительного окислителя, такого как перхлорная кислота.
В том случае, если исходные вещества для способов А и В, приведенных выше, являются смесями энантиомеров, то тогда продукты способов, как правило, будут представлять пары энантиомеров, возможно, вместе с примесями диастереоизомеров. Нежелательные диастереоизомеры можно удалить способами, такими как хроматография (например, ВЭЖХ), и отдельные энантиомеры можно разделить различными методами, известными специалистам в области химии. Например, их можно разделить посредством
(i) хиральной хроматографии (хроматографии на хиральной основе); или
(ii) получения соли оптически чистой хиральной кислоты, разделения солей двух диастереоизомеров фракционированной кристаллизацией и затем выделения дигидротетрабеназина из соли; или
(iii) получения производного (такого как сложный эфир) с помощью оптически чистого хирального дериватизирующего реагента (например, этерифицирующего реагента), разделения полученных эпимеров (например, хроматографией) и затем превращения производного в дигидротетрабеназин.
Один способ разделения пар энантиомеров, полученных каждым из способов А и В, и которые, как было установлено, являются особенно эффективными, представляет собой этерификацию гидроксильной группы дигидротетрабеназина с помощью оптически активной формы кислоты Мошера, такой как R(+)-изомер, представленный ниже, или ее активной формы:
Затем полученные эфиры двух энантиомеров дигидротетрабеназина можно разделить хроматографией (например, ВЭЖХ) и разделенные эфиры гидролизовать с получением отдельных изомеров дигидротетрабеназина с использованием основания, такого как гидроксид щелочного металла (например, NaOH), в полярном растворителе, таком как метанол.
В качестве альтернативы использованию смесей энантиомеров в качестве исходных веществ в способах А и В и затем проведению разделения энантиомеров каждый из способов А и В можно провести на исходных веществах, представляющих отдельные энантиомеры, что дает продукты с преобладанием одного энантиомера. Отдельные энантиомеры алкена (II) можно получить, подвергнув RR/SS-тетрабеназин стереоселективному восстановлению с использованием три-вторичного бутилборгидрид лития с получением смеси SRR- и RSS-энантиомеров дигидротетрабеназина, разделением энантиомеров (например, фракционированной кристаллизацией) и затем дегидратацией выделенного отдельного энантиомера дигидротетрабеназина с получением преимущественно или исключительно одного энантиомера соединения формулы (II).
Способы А и В более подробно приведены ниже, соответственно, на схемах реакций 1 и 2.
Схема реакций 1
На схеме 1 показано получение отдельных изомеров дигидротетрабеназина с 2S,3S,11bR- и 2R,3R,11bS-конфигурациями, в которых атомы водорода в положениях 2 и 3 расположены в относительной транс-конфигурации. Данная схема реакций 1 включает способ А, представленный выше.
Исходной точкой для последовательности реакций на схеме 1 является промышленно доступный тетрабеназин (IV), который представляет рацемическую смесь оптических RR- и SS-изомеров тетрабеназина. В каждом из RR- и SS-изомеров атомы водорода в положениях 3 и 11b располагаются в относительной транс-конфигурации. В качестве альтернативы исполь