Применение 3,11b-цис-дигидротетрабеназина для лечения симптомов болезни гентингтона
Иллюстрации
Показать всеПредложено применение 3,11b-цис-дигидротетрабеназина (в частности, в (+)-изомерной форме формулы 1а) для приостановки или замедления развития одного или более симптомов болезни Гентингтона у пациента, ассоциированных с непроизвольными движениями, такими как хорея, тремор и подергивания, а также ухудшение походки, либо для профилактического лечения пациента-носителя мутантной формы гена, ответственного за развитие болезни Гентингтона, либо для профилактики болезни у такого пациента в возрасте от 15 до 50 лет (варианты), и соответствующие способы лечения и профилактики (варианты). Показано, что соединение не демонстрирует дозо-зависимый седативный эффект при лечении. 6 н. и 12 з.п. ф-лы, 10 табл.
Реферат
Настоящее изобретение относится к применению дигидротетрабеназина для лечения симптомов болезни Гентингтона.
Болезнь Гентингтона (БГ), ранее называемая хореей Гентингтона, представляет собой наследственное нейродегенеративное заболевание, которое в настоящее время является неизлечимым. Причиной данного заболевания является экспансия числа тринуклеотидных CAG-повторов в гене IT15, локализованном в хромосомном регионе 4р16.3, что приводит к синтезу аберрантной формы белка, называемого гентингтин. Это, в свою очередь, ведет к каскаду процессов, приводящему к гибели нейронов в полосатом теле головного мозга, возможно, за счет агрегации аберрантной формы гентингтина внутри нейронов многих типов.
Ген, ответственный за развитие болезни Гентингтона (ген HD), включает в себя сегмент ДНК, содержащий последовательность повторяющихся кодонов CAG, кодирующих аминокислоту глутамин. Было показано, что индивиды, у которых число этих повторов составляет не более тридцати, не заболевают БГ. В то же время, индивиды, у которых число CAG-повторов в этом гене составляет более сорока, с высокой вероятностью могут заболеть БГ.
Болезнь Гентингтона характеризуется аутосомно-доминантным наследованием, таким образом, каждый ребенок больного БГ с 50% вероятностью заболеет этим заболеванием. Симптомы болезни Гентингтона обычно проявляются в возрасте от 30 до 50 лет, после чего болезнь постепенно прогрессирует на протяжении последующих 10-25 лет. Отличительные черты и симптомы этого заболевания включают в себя изменения личности, депрессию, перемены настроения, неустойчивую походку, хорею, непроизвольные подергивания мышц, тремор, деменцию, невнятную речь, нарушения умственной деятельности, затруднение глотания и общий вид больного, характерный для интоксикации.
С момента проявления первых симптомов продолжительность заболевания составляет от десяти до тридцати лет. Обычно течение БГ можно приблизительно разделить на три стадии: раннюю, промежуточную и позднюю.
На ранней стадии БГ пациенты еще способны выполнять большинство обычных действий. Они по-прежнему могут работать, а также могут сохранять способность к вождению транспортных средств. На этой стадии у пациентов могут появиться незначительные неконтролируемые движения, неповоротливость и спотыкание при ходьбе, снижение концентрации внимания, кратковременное нарушение памяти, а также перемены настроения; при этом неконтролируемые движения проявляются в умеренной степени, речь является по-прежнему внятной, а деменция, если и присутствует, то в весьма умеренной степени.
На промежуточной стадии пациенты постепенно теряют способность самостоятельно выполнять привычные действия и обычно нуждаются в посторонней помощи для их выполнения. На этой стадии могут появиться падения, снижение массы тела и затруднение глотания; при этом деменция становится более заметной для постороннего наблюдателя. Также, неконтролируемые движения становятся более выраженными.
На поздней стадии состояние пациентов ухудшается до такой степени, что они становятся практически полностью зависимыми от посторонней помощи и многие из них нуждаются в постоянном уходе в лечебных учреждениях. На этой стадии пациенты более не могут ходить и говорить; хотя выраженность неконтролируемых движений может снижаться, мускулатура становится более ригидной. Пациенты на этой стадии часто не могут проглатывать пищу. Большинство пациентов теряет адекватную ориентацию в пространстве и собственной личности. Причиной смерти обычно являются различные «естественные» причины, характерные для всех сильно ослабленных/истощенных пациентов вне зависимости от основного заболевания, такие как тяжелая недостаточность питательных веществ или пневмония.
В соответствии с информацией Национального Института Неврологических Нарушений и Инсультов США (NINDS), являющегося частью Национального Института Здравоохранения США (NIH), на сегодняшний момент не существует способов вылечить или приостановить развитие болезни Гентингтона.
Был предпринят ряд попыток разработать способ лечения БГ; так, Karpuj с коллегами предложили в качестве лекарства для лечения БГ цистамин (Nature Medicine, February 2002, vol. 8, №2, стр. 143-149). По-видимому, цистамин инактивирует фермент трансглутаминазу, которая способствует формированию агрегатов гентингтина и таким образом, предположительно, играет роль в патогенезе этого заболевания. Так или иначе, насколько известно авторам, на сегодняшний момент не существует доступных способов лечения или остановки развития болезни Гентингтона.
Идентификация гена, ответственного за развитие болезни Гентингтона (см. сообщение Коллаборативной Группы по Болезни Гентингтона, Cell, vol. 72, March 26, 1993, стр. 971), позволила разработать диагностические тест-системы на присутствие соответствующей мутантной формы. Диагностические системы на основе полимеразной цепной реакции (ПЦР), при помощи которых можно определять число CAG-повторов в гене IT-15, в настоящее время широко распространены и доступны; с их помощью можно предсказать, заболеет ли обследуемый болезнью Гентингтона или нет; см., например, обзор M. Hayden с соавторами, Am. J. Hum. Genet. 55: 606-617 (1994); работу S. Hersch «The Neurogenetics Genie: Testing for the Huntington's disease mutation», Neurol. 1994; 44: 1369-1373; а также работу R.R. Brinkman с соавторами (1997) «The likelihood of being affected with Huntington disease by a particular age, for a specific CAG size», Am. J. Hum. Genet. 60: 1202-1210.
Тетрабеназин (химическое название - 1,3,4,6,7,11b-гексагидро-9,10-диметокси-3-(2-метилпропил)-2Н-бензо(а)хинолизин-2-он) используется в качестве лекарственного препарата с конца 1950-х годов. Будучи первоначально разработанным в качестве нейролептика, в настоящее время тетрабеназин используется для симптоматического лечения различных гиперкинезов, таких как хорея Гентингтона, гемибаллизм, сенильная хорея, тик, поздняя дискинезия на фоне длительного приема нейролептиков и синдром Туретта - см., например, работы Jankovic с соавторами: Am. J. Psychiatry. (1999) Aug; 156 (8): 1279-81, а также Neurology (1997) Feb; 48 (2): 358-62.
Первичное фармакологическое действие тетрабеназина заключается в снижении транспорта моноаминов (например, допамина, серотонина и норпинефрина) в центральную нервную систему за счет блокировки изоформы 2 человеческого везикулярного моноаминового транспортера (hVMAT2). Помимо этого лекарственное средство также блокирует постсинаптические допаминовые рецепторы.
Тетрабеназин представляет собой эффективный и безопасный лекарственный препарат для лечения различных гиперкинезов, причем, в отличие от обычных нейролептиков, тетрабеназин не вызывает поздней дискинезии. Тем не менее, тетрабеназин демонстрирует ряд дозозависимых побочных эффектов, таких как депрессия, Паркинсонизм, нервозность или ощущение тревоги, бессонница и, в редких случаях, злокачественный нейролептический синдром.
Центральные эффекты тетрабеназина в значительной степени напоминают таковые для резерпина, однако, в отличие от резерпина, тетрабеназин не оказывает влияния на активность VMAT1-транспортера. Это обуславливает меньшую, нежели у резерпина, периферическую активность тетрабеназина, что, в свою очередь, обуславливает отсутствие у последнего побочных эффектов, связанных с блокировкой VMAT1, таких как гипотензия.
Химическая структура тетрабеназина соответствует формуле, приведенной на фиг.1.
Фиг.1 - структура тетрабеназина
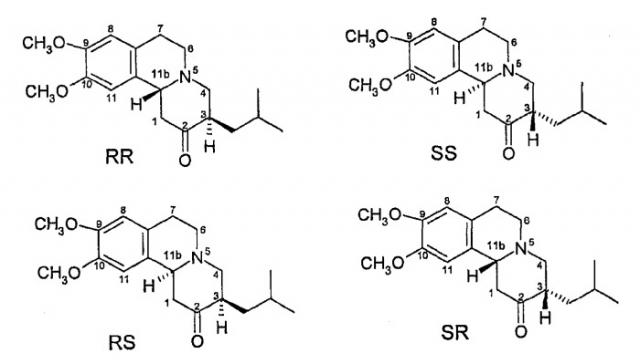
Это соединение имеет два хиральных центра (атомы углерода 3 и 11b) и, таким образом, теоретически может существовать в виде четырех изомерных форм, приведенных на фиг.2.
Фиг.2 - возможные изомеры тетрабеназина
На фиг.2 названия стереохимических изомеров даны в соответствии с “R”- и “S”-номенклатурой Кана-Ингольда-Прелога, см. учебник Jerry March «Advanced Organic Chemistry», 4th Edition, John Wiley & Sons, New York, 1992, стр. 109-114. На фиг.2 и далее порядок указания стереоконфигурации асимметрических центров (R или S) соответствует порядку, в котором идут номера соответствующих атомов углерода. Таким образом, например, RS-изомер соответствует конфигурации 3R,11bS. Аналогично, в случае наличия в структуре соединения трех хиральных центров, как в описанном ниже дигидротетрабеназине, порядок указания стереоконфигурации асимметрических центров (R или S) также соответствует порядку, в котором идут номера соответствующих асимметрических центров - 2, 3 и 11b. Таким образом, изомер 2S,3R,11bR сокращается до SRR и т.д.
Коммерчески доступный тетрабеназин представляет собой рацемическую смесь RR и SS-изомеров; по-видимому, эти RR- и SS-изомеры (здесь и далее называемые (вместе и по отдельности) транс-тетрабеназинами, поскольку в этих изомерах атомы водорода при хиральных центрах 3 и 11b расположены в транс-ориентации по отношению друг к другу) являются наиболее термодинамически стабильными.
Тетрабеназин характеризуется плохой и варьирующейся биодоступностью. Он подвергается экстенсивному пресистемному метаболизму и практически не детектируется в моче в неизменном виде. Основным метаболитом является дигидротетрабеназин (химическое название - 2-гидрокси-3-(2-метилпропил)-1,3,4,6,7,11b-гексагидро-9,10-диметоксибензо(а)хинолизин, образующийся в ходе восстановления 2-кетогруппы тетрабеназина; считается, что именно этот метаболит в первую очередь обуславливает биологическую активность тетрабеназина (см. Mehvar с соавторами, Drug Metab.Disp., 15, 250-255 (1987) и J. Pharm. ScI., 76, №.6, 461-465 (1987)), а также Roberts с соавторами, Eur. J. Clin. Pharmacol., 29: 703-708 (1986).
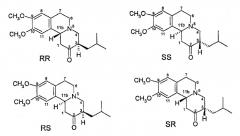
Были идентифицированы и охарактеризованы четыре изомера дигидротетрабеназина, причем все они были получены из наиболее стабильных RR- и SS-изомеров исходного тетрабеназина; атомы водорода при хиральных центрах 3 и 11b расположены в транс-ориентации по отношению друг к другу во всех полученных изомерах (см. Kilbourn с соавторами, Chirality, 9: 59-62 (1997), а также Brossi с соавт., Helv. Chim. Acta., vol. XLI, № 193, стр. 1793-1806 (1958). Полученные четыре изомера представляют собой (+)-α-дигидротетрабеназин, (-)-α-дигидротетрабеназин, (+)-β-дигидротетрабеназин, (-)-β-дигидротетрабеназин. Структуры этих известных четырех изомеров дигидротетрабеназина приведены на фиг.3.
Фиг.3 - структуры известных изомеров дигидротетрабеназина
Kilbourn с соавторами (см. Eur. J. Pharmacol, 278: 249-252 (1995), а также Med. Chem. Res., 5: 113-126 (1994)) исследовали специфичность связывания радиоактивно меченных индивидуальных изомеров дигидротетрабеназина в головном мозге бодрствующих крыс. Авторы показали, что изомер (+)-α-[11C]дигидротетрабеназин (2R,3R,11bR) накапливается в участках мозга с наибольшим содержанием нейронального мембранного допаминового транспортера (DAT) и везикулярного моноаминового транспортера (VMAT2). В то же время, практически неактивный изомер (-)-α-[11C]дигидротетрабеназин распределялся равномерно во всех отделах мозгах, что указывает на отсутствие специфического связывания этого изомера с DAT и VMAT2. Вышеописанные исследования in vivo кореллируют с данными, полученными in vitro, показывающими, что в опытах по конкуренции с [3H]метокситетрабеназином, (+)-α-[11C]дигидротетрабеназин демонстрирует значения Ki, более чем в 2000 раз превышающие Ki для изомера (-)-α-[11C]дигидротетрабеназина.
В международной патентной заявке PCT/GB2005/000464 (номер публикации - WO 2005/077946) раскрыто получение и использование фармацевтических изомеров дигидротетрабеназина, полученных из нестабильных RS- и SR-изомеров тетрабеназина (здесь и далее называемых (вместе и по отдельности) цис-тетрабеназинами, поскольку в этих изомерах атомы водорода при хиральных центрах 3 и 11b расположены в цис-ориентации по отношению друг к другу).
Было показано, что описанный в предыдущей заявке авторов № PCT/GB2005/000464 цис-дигидротетрабеназин способен приостанавливать или замедлять развитие по меньшей мере некоторых симптомов болезни Гентингтона. В частности, было продемонстрировано, что такие симптомы, как ухудшение походки и непроизвольные движения (тремор и неконтролируемые мышечные сокращения), ассоциированные с болезнью Гентингтона, могут быть устранены, либо их развитие может быть в значительной степени замедлено путем введения цис-дигидротетрабеназинов согласно настоящему изобретению.
В соответствии с этим, в первом аспекте, настоящее изобретение относится к 3,11b-цис-дигидротетрабеназину, предназначенному для устранения или замедления развития одного или более симптомов болезни Гентингтона; в частности, подобные симптомы могут быть выбраны из группы симптомов, обусловленных непроизвольными движениями, таких как хорея, тремор и подергивания, а также ухудшение походки.
В другом аспекте настоящее изобретение относится к применению 3,11b-цис-дигидротетрабеназина для приготовления лекарственной формы, предназначенной для устранения или замедления развития одного или более симптомов болезни Гентингтона; в частности, подобные симптомы могут быть выбраны из группы симптомов, обусловленных непроизвольными движениями, таких как хорея, тремор и подергивания, а также ухудшение походки.
В еще одном аспекте настоящее изобретение относится к способу устранения или замедления развития одного или более симптомов болезни Гентингтона у пациента, нуждающегося в подобном лечении, включающему в себя введение терапевтически эффективного количества 3,11b-цис-дигидротетрабеназина; в частности, вышеуказанные симптомы могут быть выбраны из группы симптомов, обусловленных непроизвольными движениями, таких как хорея, тремор и подергивания, а также ухудшение походки.
В настоящее время существуют диагностические тесты, способные определять наличие мутантного гена, ответственного за развитие болезни Гентингтона. В том случае, если индивид является носителем мутантной формы этого гена, он неизбежно заболеет болезнью Гентингтона; таким образом, предотвращение, остановка или замедление развития симптомов болезни Гентингтона в период жизни подобного индивида, когда развитие БГ наиболее вероятно, является актуальной задачей.
В соответствии с вышесказанным, в еще одном своем аспекте, настоящее изобретение относится к способу профилактического лечения пациента, являющегося носителем мутантного гена, ответственного за развитие болезни Гентингтона; данный способ включает в себя введение пациенту цис-дигидротетрабеназина (в соответствии с тем, как определено выше) в терапевтически эффективном количестве для предотвращения или замедления субклинической прогрессии болезни Гентингтона.
Под субклинической прогрессией имеется в виду досимптоматическое с клинической точки зрения развитие заболевания, когда болезнь может быть диагностирована только биохимическими и визуализационными методами, такими как компьютерная (КТ) или магнитно-резонансная (МРТ) томография.
Например, цис-дигидротетрабеназин может быть использован для профилактического приема индивидами в возрасте от 15 до 50 лет, например в возрасте от 20 до 50 лет, или от 25 до 50 лет, или от 30 до 50 лет, являющимися носителями мутантной формы гена HD, однако еще не развившие симптомы болезни Гентингтона.
Под мутантной формой гена, ответственного за развитие болезни Гентингтона (а также под синонимичными терминами), подразумевается форма гена IT-15, в которой число CAG-повторов составляет по меньшей мере 35, в более типичных случаях - по меньшей мере 40, например по меньшей мере 45 или 50. В некоторых случаях число CAG-повторов может быть очень большим (например, 70 и более), при этом индивиды, являющиеся носителями мутантного гена IT-15 со столь большим числом CAG-повторов, часто заболевают ювенильной формой болезни Гентингтона.
Таким образом, еще в одном аспекте настоящего изобретения цис-дигидротетрабеназин может быть использован для профилактики индивидам в возрасте менее 30 лет, например в возрасте от 10 до 29 лет, в более типичных случаях - от 15 до 29 лет или от 20 до 29 лет, которые прошли тестирование на наличие мутантной формы гена IT-15 и у которых число CAG-повторов в этом гене составляет более 60, в частности по меньшей мере 65 и предпочтительно 70 и более.
Используемый в контексте настоящего изобретения цис-дигидротетрабеназин представляет собой 3,11b-цис-дигидротетрабеназин.
В контексте настоящего изобретения 3,11b-цис-дигидротетрабеназин может использоваться практически в стереоизомерно чистом виде, например изомерная чистота может составлять более 90%, в типичных случаях более 95%, и предпочтительно более 98%.
Под «изомерной чистотой» в контексте настоящего изобретения подразумевается отношение количества 3,11b-цис-дигидротетрабеназина в изомерной смеси к общему количеству или концентрации всех остальных изомерных форм дигидротетрабеназина в смеси. Если в композиции присутствует 90% дигидротетрабеназина, являющегося 3,11b-цис-дигидротетрабеназином, тогда изомерная чистота составляет 90%.
3,11b-цис-дигидротетрабеназин в контексте настоящего изобретения может быть использован в виде композиции, в которой практически не содержится 3,11b-транс-дигидротетрабеназина; количество 3,11b-транс-дигидротетрабеназина в подобной композиции составляет менее 5%, более предпочтительно - менее 3%, и наиболее предпочтительно - менее 1%.
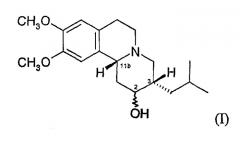
В настоящем тексте термин «3,11b-цис-» означает, что атомы водорода при асимметрических центрах в положениях 3 и 11b структуры дигидротетрабеназина находятся в цис-ориентации по отношению друг к другу. Таким образом, изомеры, обсуждаемые в настоящей заявке, представляют собой соединения общей формулы (I) и их антиподы (зеркальные отображения).
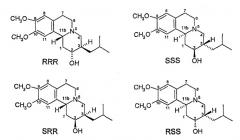
Всего существует четыре возможных изомера дигидротетрабеназина, имеющих 3,11b-цис-конфигурацию, которые представляют собой изомер 2S,3S,11bR, изомер 2R,3R,11bS, изомер 2R,3S,11bR и изомер 2S,3R,11bS. Все четыре изомеры были выделены и охарактеризованы, и еще в одном аспекте настоящее изобретение относится к индивидуальным изомерам 3,11b-цис-дигидротетрабеназина. В частности, настоящее изобретение относится к следующим изомерам 3,11b-цис-дигидротетрабеназина:
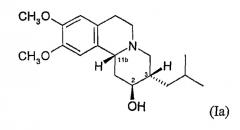
(а) 2S,3S,11bR-изомер 3,11b-цис-дигидротетрабеназина согласно формуле (Ia):
(b) 2R,3R,11bS-изомер 3,11b-цис-дигидротетрабеназина согласно формуле (Ib):
(c) 2R,3S,11bR-изомер 3,11b-цис-дигидротетрабеназина согласно формуле (Ic):
(d) 2S,3R,11bS-изомер 3,11b-цис-дигидротетрабеназина согласно формуле (Id):
Индивидуальные изомеры согласно настоящему изобретению могут быть охарактеризованы по их спектроскопическим, оптическим и хроматографическим свойствам, а также по их абсолютным стереохимическим конфигурациям, определяемым рентгеноструктурным анализом.
Предпочтительными являются правовращающие (+)-изомеры.
В особенности предпочтительным является изомер (Ia), т.е. 2S,3S,11bR-изомер 3,11b-цис-дигидротетрабеназина.
Без имплицирования каких-либо частных абсолютных конфигураций или стереохимических свойств четыре новых изомера могут быть охарактеризованы следующим образом:
Изомер А
Оптическая активность по данным дисперсии оптического вращения (метанол, 21°С): левовращающий (-).
Данные ИК-спектроскопии (таблетка KBr), а также спектроскопии ЯМР (CDCl3) на ядрах 1H и 13С приведены в таблице 1.
Изомер B
Оптическая активность по данным дисперсии оптического вращения (метанол, 21°С): правовращающий (+). Данные ИК-спектроскопии (таблетка KBr), а также спектроскопии ЯМР (CDCl3) на ядрах 1H и 13С приведены в таблице 1, данные рентгеноструктурного анализа приведены в примере 4.
Изомер C
Оптическая активность по данным дисперсии оптического вращения (метанол, 21°С): правовращающий (+).
Данные ИК-спектроскопии (таблетка KBr), а также спектроскопии ЯМР (CDCl3) на ядрах 1H и 13С приведены в таблице 2.
Изомер D
Оптическая активность по данным дисперсии оптического вращения (метанол, 21°С): левовращающий (-).
Данные ИК-спектроскопии (таблетка KBr), а также спектроскопии ЯМР (CDCl3) на ядрах 1H и 13С приведены в таблице 2.
Значения показателя дисперсии оптического вращения для каждого из изомеров приведены ниже в разделе «Примеры», однако следует отметить, что подобные значения могут в значительной степени варьироваться в зависимости от степени очистки изомера, а также других параметров, таких как флуктуации температуры, а также эффекты остаточных молекул растворителя.
Каждый из энантиомеров А, B, C и D может существовать в виде энантиомерно чистого изомера, либо в виде смеси с другими энантиомерами согласно настоящему изобретению.
Термины «энантиомерно чистый» и «энантиомерная чистота» в контексте настоящего изобретения относятся к количеству данного энантиомера 3,11b-цис-дигидротетрабеназина и общего количества или концентрации всех других энантиомерных и изомерных форм дигидротетрабеназина, присутствующих в смеси. Например, если 90% содержащегося в композиции дигидротетрабеназина составляет единственный энантиомер, энантиомерная чистота составляет 90%.
Например, в каждом из аспектов и воплощений настоящего изобретения энантиомерная чистота каждого индивидуального энантиомера, выбранного из группы, состоящей из изомера А, изомера В, изомера С и изомера D, может составлять по меньшей мере 55% (например, по меньшей мере 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95%, 97%, 98%, 99%, 99,5% или 100%).
Изомеры согласно настоящему изобретению также могут находиться в составе смесей одного или более изомеров А, В, С и D. Подобные смеси могут быть рацемическими или нерацемическими. Примерами рацемических смесей могут служить рацемическая смесь изомеров А и B, а также рацемическая смесь изомеров С и D.
Фармацевтически приемлемые соли
В объеме настоящего изобретения упоминание изомеров дигидротетрабеназина также относится к солям дигидротетрабеназина (если контекст не указывает на обратное), в частности - к кислотно-аддитивным солям.
Кислоты, при помощи которых можно получить кислотно-аддитивные соли, включают в себя кислоты со значениями pKa менее 3,5, в более типичном случае - менее 3. Например, кислотно-аддитивные соли могут быть получены путем кислот, имеющих значение pKa, находящееся в диапазоне от +3,5 до -3,5.
Предпочтительные кислотно-аддитивные соли включают в себя соли, образованные с сульфоновой кислотой, такой как метансульфоновая кислота, этансульфоновая кислота, бензолсульфоновая кислота, толуолсульфоновая кислота, камфорсульфоновая кислота и нафталинсульфоновая кислота.
Одним из примеров кислоты, которая может быть использована для получения солей присоединения, является метансульфоновая кислота.
Кислотно-аддитивные соли могут быть получены при помощи способов, описанных в настоящей заявке, либо при помощи химических методов, описанных в книге «Pharmaceutical Salts: Properties, Selection, and Use» под редакцией P. Heinrich Stahl и Camille G. Wermuth, ISBN: 3-90639-026-8, Hardcover, 388 страниц, август 2002. Обычно, подобные соли могут быть получены путем взаимодействия свободной основной формы соединения с подходящим основанием или кислотой в воде или органическом растворителе, либо в их смесях; обычно используются неводные растворители, такие как эфир, этилацетат, этанол, изопропанол или ацетонитрил.
В типичном случае, подобные соли должны быть фармацевтическим приемлемыми солями. Соли, не являющиеся фармацевтически приемлемыми, могут быть использованы в качестве промежуточных продуктов для получения фармацевтически приемлемых солей. Подобные соли, не являющиеся фармацевтически приемлемыми, также входят в объем настоящего изобретения.
Способы получения изомеров дигидротетрабеназина
Дигидротетрабеназин согласно настоящему изобретению может быть получен способом, включающим взаимодействие соединения формулы (II):
с реагентом или реагентами, пригодными для гидратирования 2-3 двойной связи, и, при необходимости - с последующим разделением и выделением желаемого изомера дигидротетрабеназина.
Гидратирование двойной связи между атомами углерода 2 и 3 может быть проведено путем гидроборирования боран-содержащим реагентом, таким как диборан или боран-эфир (например, боран-тетрагидрофуран (ТГФ)), с получением алкилборанового интермедиата и последующим окислением полученного аддукта и финальным гидролизом в присутствии основания. Обычно гидроборирование проводится в безводных полярных апротонных растворителях, таких как простые эфиры (например, ТГФ), без использования повышенных температур, например при комнатной температуре. Боран-алкеновые аддукты обычно окисляют окисляющим агентом, таким как пероксид водорода, в присутствии основания, служащего источником гидроксид-ионов, такого как гидроксид аммония или гидроксид щелочного металла, например гидроксид натрия или калия. Цепочка реакций гидроборирования-окисления-гидролиза согласно процессу А обычно приводит к получению изомеров дигидротетрабеназина, в которых атомы водорода в положении 2- и 3- транс-ориентированы по отношению друг к другу.
Соединения общей формулы (II) могут быть получены путем восстановления тетрабеназина до дигидротетрабеназина с последующей дегидратацией дигидротетрабеназина. Восстановление тетрабеназина может быть проведено при помощи алюмогидридных реагентов, например алюмогидрида лития, либо при помощи боргидридных реагентов (таких как боргидриды натрия или калия) или их борорганических аналогов, например алкилборгидридов, таких как три(втор-бутил)боргидрид лития. При другом подходе восстановление может быть проведено при помощи каталитического гидрогенирования, например, на никеле Ренея или оксиде платины. Подходящие условия подобных реакций восстановления описаны более подробно в патенте США № 2843591 (Hoffmann-La Roche), а также в работе Brossi с соавторами, Helv. Chim. Acta., vol. XLI, № 193, стр. 1793-1806 (1958).
Поскольку тетрабеназин, используемый в качестве исходного вещества в реакции восстановления, в типичном случае представляет собой смесь RR- и SS-изомеров (т.е. транс-тетрабеназин), получаемый в ходе восстановления дигидротетрабеназин имеет ту же самую транс-конфигурацию атомов водорода в положениях 3 и 11b, и его структура будет соответствовать одной или более известным формам изомеров дигидротетрабеназина, приведенным на фиг.3 (см. выше). Таким образом, процесс А подразумевает дегидратацию известных изомеров дигидротетрабеназина до алкена (II) с последующей «регидратацией» последнего в условиях, обеспечивающих получение новых изомеров цис-дигидротетрабеназина согласно настоящему изобретению.
Дегидратация дигидротетрабеназина до алкена (II) может быть проведена при помощи многих стандартных способов дегидратации спиртов до алкенов, см., например, учебник J. March (см.выше), стр. 389-390 и ссылки. Например, такие условия включают использование фосфорсодержащих дегидратирующих агентов, таких как галогениды и оксигалогениды фосфора, например POCl3 и PCl5. В качестве альтернативы прямой дегидратации, гидроксильная группа дигидротетрабеназина может быть модифицирована в уходящую группу L, такую как галогенидная группа (например, хлорид- или бромид-группа), с последующим элиминированием (например, в присутствии основания) соответствующего галогеноводорода H-L. Превращение гидроксильной группы в галогенидную может быть проведена с использованием одного из способов, хорошо известных опытному химику-специалисту, например взаимодействием с тетрахлорметаном или тетрабромметаном в присутствии триалкил- или триарилфосфина, такого как трифенилфосфин или трибутилфосфин.
Тетрабеназин, используемый в качестве исходного вещества для восстановления с целью получения дигидротетрабеназина, является коммерчески доступным, а также может быть синтезирован при помощи способа, описанного в патенте США № 2830993 (Hoffmann-La Roche).
Другим способом (процесс B) получения дигидротетрабеназина согласно настоящему изобретению является способ, включающий стадию раскрытия 2,3-эпоксидного цикла в соединении формулы (III), в соответствующих условиях, и при необходимости - с последующим разделением и выделением желаемого изомера дигидротетрабеназина.
Раскрытие эпоксидного цикла может быть проведено в соответствии с известными способами раскрытия эпоксидных циклов. В настоящее время предпочтительным способом раскрытия эпоксидного цикла является введение эпоксида в реакцию с восстанавливающим агентом, таким как комплекс боран-ТГФ. Реакция с аддуктом боран-ТГФ может быть проведена в полярных апротонных растворителях, таких как простые эфиры (например, тетрагидрофуран), обычно при комнатной температуре, с последующим гидролизом полученного боранового комплекса кипячением в присутствии основания. Процесс B обычно приводит к получению изомеров дигидротетрабеназина, в котором атомы водорода в положении 2- и 3- находятся в цис-ориентации по отношению друг к другу.
Эпоксиды общей формулы (III) могут быть получены эпоксидированием алкена формулы (II) (см. выше). Эпоксидирование может быть проведено при помощи способов, известных опытному химику-специалисту, см., например, учебник J. March (см.выше), стр. 826-829 и ссылки. В типичном случае, для проведения реакции эпоксидирования могут быть использованы перкислоты, такие как мета-хлорпербензойная кислота (MCPBA), либо смеси перкислоты и окислителя, такого как хлорная кислота.
В случае, если в качестве исходного вещества в процессах А и B используются смеси энантиомеров, то конечными продуктами обычно бывают пары энантиомеров, например рацемические смеси; также возможно присутствие диастереомерных примесей. Нежелательные диастереомеры могут быть удалены из смеси различными способами, такими как хроматография (например, ВЭЖХ), а индивидуальные энантиомеры могут быть разделены при помощи ряда способов, известных опытному химику-специалисту. Например, индивидуальные энантиомеры могут быть получены путем:
(i) хиральной хроматографии (хроматография на хиральной неподвижной фазе);
(ii) образования соли с оптически чистой хиральной кислотой, разделением солей двух диастереомеров фракционной кристаллизацией и последующим отделением дигидротетрабеназина; или
(iii) образования производного, например, сложного эфира, с оптически чистым модифицирующим агентом, например агентом эстерификации, разделения полученных эпимеров (например, путем хроматографии) с последующим превращением производного в дигидротетрабеназин.
Один в особенности эффективный способ разделения энантиомерных пар, полученных в ходе любого из процессов А и B, включает в себя этерификацию гидроксильной группы дигидротетрабеназина оптически активной кислотой Мошера, таким как нижеприведенный R(+)-изомер, либо его активной формой:
Полученную смесь сложных эфиров двух энантиомеров дигидробеназина далее можно разделить хроматографией (например, ВЭЖХ) и индивидуальные эфиры гидролизовать до индивидуальных изомеров дигидробеназина при помощи основания, такого как гидроксид щелочного металла (например, NaOH) в полярном растворителе, таком как метанол.
Альтернативно, вместо использования энантиомерных смесей в качестве исходных веществ в процессах А и В с последующим разделением индивидуальных энантиомеров процессы А и В могут быть проведены с использованием индивидуальных энантиомеров в качестве исходных веществ, что приводит к получению продуктов, в которых доминирует один энантиомер. Индивидуальные энантиомеры алкена (II) могут быть получены путем стереоселективного восстановления RR/SS-тетрабеназина три(втор-бутил)боргидридом лития до смеси SRR- и RSS-энантиомеров дигидротетрабеназина, последующего разделения индивидуальных энантиомеров (например, фракционной кристаллизацией) и затем дегидратации нужного индивидуального энантиомера дигидротетрабеназина с получением в значительной степени либо абсолютно стереоизомерно чистого энантиомера соединения (II).
Процессы А и В проиллюстрированы более подробно на схемах 1 и 2 соответственно.
Схема 1
Схема 1 иллюстрирует процесс получения индивидуальных изомеров дигидротетрабеназина с конфигурацией хиральных центров 2S,3S,11bR и 2R,3R,11bS, в которых атомы водорода при углеродных атомах в положениях 2 и 3 находятся в транс-конфигурации по отношению друг к другу. Эта реакционная схема включает в себя вышеописанный процесс А.
Исходным веществом в цепочке реакций согласно схеме 1 является коммерчески доступный тетрабеназин (IV), представляющий собой рацемическую смесь RR- и SS-оптических изомеров тетрабеназина. В каждом из этих RR- и SS-изомеров атомы водорода в положениях 3 и 11b находятся в транс-конфигурации по отношению друг к другу. В качестве альтернативы использованию коммерчески доступного тетрабеназина, последний может быть синтезирован в соответствии со способом, описанным в патенте США № 2830993 (см. пример 11).
Рацемическую смесь RR- и SS-изомеров тетрабеназина восстанавливают боргидридным восстанавливающим агентом три(втор-бутил)боргидридом лития (так называемый «L-селектрид»), в результате чего получают смесь известных 2S,3R,11bR- и 2R,3S,11bS-изомеров дигидротетрабеназина (V); для простоты на схеме 1 показан лишь 2S,3R,11bR-изомер. За счет использования более «объемного» L-селектрида вместо боргидрида натрия, в ходе реакции восстановления создается стерическое затруднение образования RRR- и SSS-изомеров, в результате чего выход этих нежелательных продуктов минимизируется или подавляется.
Изомеры дигидротетрабеназина (V) далее вводят в реакцию с дегидратирующим агентом, таким как пентахлорид фосфора, в апротонном растворителе, таком как ди- или трихлорметан (хлористый метилен или хлороформ, соответственно, предпочтительно хлористый метилен (дихлорметан)), в результате чего получают ненасыщенное соединение (II) в виде пары энантиомеров, из которых на схеме показан только R-энантиомер. Реакцию дегидратации обычно проводят при температуре ниже комнатной, например около 0-5°С.
Ненасыщенное соединение (II) далее подвергают стереоселективной регидратации, при этом получают дигидротетрабеназин (VI) и его энантиомер (не показано), в которых атомы водорода в положениях 3 и 11b находятся в цис-конфигурации по отношению друг к другу, в то время как атомы водорода в положениях 2 и 3 находятся в транс-конфигурации по отношению друг к другу. Стереоселективную регидратацию проводят при помощи гидроборирования комплексом боран-ТГФ в тетрагидрофуране (ТГФ), в результате чего получают промежуточный борановый комплекс (не показано), который далее окисляется пероксидом водорода в присутствии основания, такого как гидроксид натрия.
Далее может быть проведен первоначальный этап очистки (например, при помощи ВЭЖХ), в результате которого получают продукт (V) реакции регидратации в виде смеси 2S,3S,11bS- и 2R,3R,11bS-изомеров, из которых на схеме показан только 2S,3S,11bR-изомер. Для разделения изомеров смесь обрабатывают R(+)-реактивом Мошера в присутствии оксалилхлорида и диметиламинопиридина (DMAP) в дихлорметане, в результате чего получают пару диастереомерных эфиров (VII) (показан только один диастереомер из пары), которые далее могут быть разделены при помощи ВЭЖХ. Индивидуальные эфиры могут быть далее подвергнуты гидролизу в присутствии гидроксида щелочного металла, такого как гидроксид натрия, в результате чего может быть получен индивидуальный изомер (VI).
В одном из вариантов реакционной цепочки согласно схеме 1, после восстановления RR/SS-тетрабеназина, полученную смесь энантиомеров дигидротетрабеназина (V) можно разделить на индивидуальные энантиомеры. Разделение может быть выполнено путем конверсии в смесь солей хиральной кислоты, такой как (+)- или (-)-камфорсульфоновая кислота, последующего разделения полученных диастереомеров фракционной кр